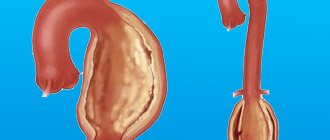
Она ветвится как дерево, вначале — на крупные ветви (стволы), затем на более мелкие ветви и веточки, и условно делится на несколько частей или отделов:
- 1. Восходящий отдел аорты — это участок от аортального клапана до плече-головного ствола.
- 2. Дуга аорты представляет собой короткий отдел, от которого отходят все сосуды, питающие руки и голову (плече-головные артерии). Они анатомически образуют дугу, соединяющую восходящий и нисходящий отделы аорты.
- 3. Нисходящий (грудной) отдел аорты начинается от устья левой подключичной артерии и продолжается до диафрагмы.
- 4. Ниже диафрагмы и до раздвоения аорты (бифуркации) располагается брюшной отдел аорты.
Деление аорты на отделы очень важно для оценки риска и выбора оптимальной тактики лечения у пациентов с аневризмами аорты.
Аневризмой аорты называют участок её локального расширения.
Причины расширения аорты
Врожденные системные заболевания соединительной ткани: синдром Марфана, Элерса – Данлоса, вызванные генетическими изменениями, при которых стенка аорты имеет неправильное строение, способны стать причиной развития аневризмы.
Приобретенные заболевания, вызывающие аневризматическое изменение стенки аорты: чаще всего это — атеросклероз. Около 80% всех осложненных аневризм аорты — аневризмы, вызванные атеросклеротическим процессом, который приводит к ослаблению стенки сосуда, и невозможности выдерживать нормальное кровеносное давление, а как следствие — к расширению её.
Реже аневризма аорты развивается при воспалительных заболеваниях, вызванных внешними агентами (сифилис, грибковая инфекция, туберкулез) или при аутоиммунных заболеваниях (неспецифический аортоартериит).
Основные заболевания дуги аорты
Особенности строения и функций дуги аорты, высокое давление и турбулентный ток крови способствуют частому формированию нарушений. Наиболее распространенные патологии и характерные изменения представлены в таблице:
| Болезнь | Краткое описание |
| Неспецифический аортоартериит (синдром Такаясу) | Васкулит – воспалительное заболевание аутоиммунного происхождения. Приводит к поражению сосуда, разрастанию в соединительной ткани и перекрытию просвета |
| «Шейная дуга» | Врожденное удлинение дуги аорты |
| Атеросклероз | Появление на стенке сосуда липидных бляшек, склонных к дестабилизации и разрыву. Основные причины:
Склероз приводит к аортальному стенозу, расслоению и аневризме аорты |
| Коарктация | Врожденный порок, проявляющийся в виде сегментарного сужения аорты. Чаще находится в области перехода дуги в нисходящую часть. Требует хирургического лечения |
| Гипоплазия | Недоразвитие тканей сосуда в утробе матери. Необходимо хирургическое вмешательство |
| Аневризма | Локальное расширение участка сосуда из-за слабости стенки. Требует планового оперативного лечения из-за риска внезапного разрыва и массивного внутреннего кровотечения |
| Правая дуга | Нарушение формирования органов в эмбриональном периоде: дуга аорты поворачивается не влево, а вправо, перекидывается через правый бронх. В большинстве случаев лечения не требует |
| Кальциноз | Скопление солей кальция и уплотнение стенки артерии. Сосуд становится менее эластичным, хрупким, что часто приводит к разрывам |
| Двойная дуга | Врожденный порок, который характеризуется раздвоением аорты:
Отделы соединены между собой. Патология требует оперативного вмешательства |
| Расслоение | Разрыв аорты в месте аневризмы. Прогноз зависит от степени повреждения. Высокий процент летальности |
Симптомы аневризмы аорты
К сожалению, диагноз аневризмы аорты не всегда может быть установлен в «холодный период» (до развития осложнений), так как это заболевание обычно протекает бессимптомно. Чаще всего её обнаруживают случайно при выполнении флюорографии, ультразвуковых или томографических исследований, выполненных в связи с другими заболеваниями. Лечение аневризмы восходящего отдела аорты до развития осложнений гораздо безопаснее для пациента, поэтому в ранней диагностике аневризмы аорты важное значение придается плановой диспансеризации.
Стоит отметить, что каждый сотый пациент, умерший внезапно — умирает от расслоения аорты.
Жалобы обычно появляются, когда аневризма начинает расслаиваться или, увеличиваясь, сдавливает окружающие органы и ткани. Появляется боль или нарушение функций тех органов, которые располагаются в области аневризмы. Вначале это не носит яркого характера и, поэтому, не настораживает ни пациента, ни врача.
Однако, боль усиливается при развитии этих смертельно опасных осложнений аневризмы аорты — это одна из самых сильных болей, которую может испытывать человек. Она локализуется в груди, если аневризма располагается в восходящем, нисходящем отделах или в её дуге, или в животе, если она образовалась в брюшном отделе. Характерна резкая слабость, бледность, нередко человек теряет сознание.
Нарушение кровоснабжения органов, находящихся в зоне разрыва аневризмы или расслоения аорты (головной или спинной мозг, почки, кишечник, верхние или нижние конечности) — приводит к потере функции этих органов, а большой объем кровопотери при разрыве аорты — представляет собой наиболее серьезную опасность. Для спасения жизни счет идет на минуты. Если раннее хирургическое лечение недоступно, то смертность при расслоении аорты в первый день составляет 1 % в час (один человек из ста умирает каждый час). В течение первых суток от расслоения аорты погибает 33% пациентов, 50% больных в течение 48 часов и 75% — в течение двух недель. Только раннее хирургическое вмешательство дает возможность спасти значительную часть больных .
Аорта и ее ветви
Аорта (aorta) является самым крупным артериальным сосудом в теле человека. В аорте выделяют три отдела: восходящую часть, дугу
и
нисходящую часть.
В нисходящей части различают
грудную часть
(pars thoracica) и
брюшную часть
(pars abdominalis) аорты.
Восходящая часть аорты (pars ascendens aortae), длиной около 6 см, имеет в начальном отделе расширение в виде луковицы (bulbus aortae), покрыта перикардом. Позади грудины она направляется вверх и вправо и на уровне хряща II ребра переходит в дугу аорты. От восходящей части (в области луковицы) отходят правая и левая венечные артерии.
Дуга аорты (arcus aortae), обращенная выпуклостью вверх, загибается назад и влево и на уровне III-IV грудного позвонка переходит в нисходящую часть аорты. От выпуклой поверхности дуги аорты отходят три крупных сосуда: плечеголовной ствол
(truncus brachiocephalicus),
левая общая сонная артерия
(a. carotis communis sinistra) и
левая подключичная артерия
(a. subclavia sinistra).
Нисходящая часть аорты (pars descendens aortae; см. рис. 181) — это наиболее длинный отдел аорты, проходит от уровня IV грудного позвонка до IV поясничного, где делится на правую и левую общие подвздошные артерии (бифуркация аорты). В нисходящей части аорты различают грудную и брюшную части.
Аорта расположена слева от средней линии тела и своими ветвями кровоснабжает все органы и ткани тела. Часть ее, длиной около 6 см, непосредственно выходящая из сердца и поднимающаяся вверх, называется восходящей частью аорты. Она начинается расширением — луковицей — аорты, внутри которой имеются три синуса аорты, располагающиеся между внутренней поверхностью стенки аорты и заслонками ее клапана. От луковицы аорты отходят правая и левая венечные артерии. Изгибаясь влево, дуга аорты лежит над расходящимися здесь легочными артериями, перекидывается через начало левого главного бронха и переходит в нисходящую часть аорты. От вогнутой стороны дуги аорты начинаются ветви к трахее, бронхам и к вилочковой железе, от выпуклой стороны дуги отходят три крупных сосуда: справа лежит плече-головной ствол, слева — левые общая сонная и левая подключичная артерии.
Плече-головной ствол длиной около 3 см отходит от дуги аорты, направляется вверх, назад и вправо, впереди трахеи. На уровне правого грудино-ключичного сустава он делится на правые общую сонную и подключичную артерии. Левая общая сонная и левая подключичная артерии отходят непосредственно от дуги аорты левее плече-головного ствола.
Общая сонная артерия (правая и левая) идет вверх рядом с трахеей и пищеводом. На уровне верхнего края щитовидного хряща она делится на наружную сонную артерию, разветвляющуюся вне полости черепа, и внутреннюю сонную артерию, проходящую внутрь черепа и направляющуюся к мозгу.
Наружная сонная артерия направляется вверх, проходит через ткань околоушной железы и в ее толще позади шейки мыщелкового отростка нижней челюсти разделяется на свои конечные ветви: верхнечелюстную и поверхностную височную артерии. На своем пути артерия отдает боковые ветви и снабжает кровью наружные части головы и шеи, полости рта и носа, щитовидную железу, гортань, язык, небо, миндалины, грудино-ключично-сосцевидную и затылочные мышцы, поднижне-челюстную, подъязычную и околоушную слюнные железы, кожу, кости и мышцы головы (мимические и жевательные), зубы верхней и нижней челюстей, твердую мозговую оболочку , наружное и среднее ухо.
Внутренняя сонная артерия направляется вверх к основанию черепа, не отдавая ветвей, входит в полость черепа через канал сонной артерии в височной кости, поднимается по сонной борозде клиновидной кости, лежит в пещеристой пазухе и, пройдя через твердую и паутинную оболочки, делится на ряд конечных ветвей. Артерия кровоснабжает мозг и орган зрения.
Подключичная артерия слева отходит непосредственно от дуги аорты, справа — от плече-головного ствола, огибает купол плевры, проходит между ключицей и 1-м ребром, ложится в одноименную борозду 1-го ребра, направляясь к подмышечной впадине. Подключичная артерия и ее ветви кровоснабжают шейный отдел спинного мозга с
оболочками, ствол головного мозга, затылочные и частично височные доли полушарий большого мозга, глубокие и отчасти поверхностные мышцы шеи, шейные позвонки, межреберные мышцы первого и второго промежутков, часть мышц затылка, спины и лопатки, диафрагму, кожу груди и верхней части живота, прямую мышцу живота, молочную железу, гортань, трахею, пищевод, щитовидную и вилочковую железы.
На основании мозга благодаря соединению передних мозговых артерий с передней соединительной артерией, а также задних соединительных и задних мозговых артерий образуется круговой артериальный анастомоз — артериальный (Виллизиев) круг большого мозга. Подключичная артерия в подмышечной области переходит в подмышечную артерию, которая лежит в подмышечной ямке медиально от плечевого сустава и плечевой кости рядом с одноименной веной, и окружается стволами плечевого сплетения. Артерия кровоснабжает мышцы плечевого пояса, кожу и мышцы боковой грудной стенки, плечевой и ключично-акромиальной суставы, содержимое подмышечной ямки.
Плечевая артерия является продолжением подмышечной, она проходит в медиальной борозде двуглавой мышцы плеча и в локтевой ямке делится на лучевую и локтевую артерии. Плечевая артерия кровоснабжает кожу и мышцы плеча, плечевую кость и локтевой сустав.
Лучевая артерия располагается на предплечье латерально в лучевой борозде, параллельно лучевой кости. В нижнем отделе вблизи ее шиловидного отростка артерия легко прощупывается, будучи прикрытой лишь кожей и фасцией. Лучевая артерия проходит на кисть под сухожилиями длинных мышц большого пальца, огибает с тыльной стороны первую пястную кость. Она кровоснабжает кожу и мышцы предплечья и кисти, лучевую кость, локтевой и лучезапястный суставы.
Локтевая артерия располагается на предплечье медиально в локтевой борозде параллельно локтевой кости, проходит на ладонную поверхность кисти. Она кровоснабжает кожу и мышцы предплечья и кисти, локтевую кость, локтевой и лучезапястный суставы. Локтевая и лучевая артерии образуют на кисти две артериальные сети запястья: тыльную и ладонную, питающие связки и суставы запястья, второй, третий, четвертый межкостные промежутки и пальцы, и две артериальные ладонные дуги — глубокую и поверхностную. Поверхностная ладонная дуга образуется, в основном, за счет локтевой артерии и поверхностной ладонной ветви лучевой артерии. От поверхностной дуги вниз отходят четыре общие ладонные пальцевые артерии, идущие к П-Ш-IV-V пальцам. Каждая из I, II, III артерий кровоснабжают обращенные друг к другу стороны II—V пальцев, IV — кровоснабжают локтевую сторону V пальца.
Глубокая ладонная дуга расположена несколько проксимальнее поверхностной. Она залегает под сухожилиями сгибателей на уровне оснований пястных костей. В образовании глубокой ладонной дуги основная роль принадлежит лучевой артерии, которая соединяется с глубокой^ ладонной ветвью локтевой артерии. От глубокой дуги отходят три ладонные пястные артерии, которые направляются во второй, третий и четвертый межкостные промежутки. Эти артерии соединяются с общими ладонными пальцевыми артериями. Благодаря наличию ана-стомозирующих между собой дуг и сетей при многочисленных и сложных движениях кисти и пальцев кровоснабжение ее не страдает.
Нисходящая часть аорты делится на две части: грудную и брюшную.
Грудная часть аорты расположена на позвоночнике асимметрично, слева от срединной линии и снабжает кровью внутренние органы, находящиеся в грудной полости, и ее стенки. От грудной аорты, отходят 10 пар задних межреберных артерий, верхние диафрагмальные и внутренностные ветви (бронхиальные, пищеводные, перикардиальные, медиа-стинальные). Из грудной полости аорта переходит в брюшную через аортальное отверстие диафрагмы. Книзу аорта постепенно смещается медиально, особенно в брюшной полости, и у места своего деления на две общие подвздошные артерии на уровне IV поясничного позвонка (бифуркация аорты) располагается по средней линии и продолжается в виде тонкой срединной крестцовой артерии, которая соответствует хвостовой артерии млекопитающих. Брюшная часть аорты кровоснабжает брюшные внутренности и стенки живота.
От грудной части аорты отходят висцеральные и париетальные ветви, которые кровоснабжают органы, лежащие в грудной полости и стенки грудной полости.
От брюшной части аорты отходят как парные, так и непарные сосуды. Среди них выделяют внутренние и пристеночные. К первым относятся три очень крупные непарные артерии: чревный ствол, верхняя и нижняя брыжеечные артерии. Парные ветви представлены средними надпочечниковыми, почечными и яичковыми (у женщин яичниковыми артериями). Пристеночные ветви: нижние диафрагмальные, поясничные и ниже срединная крестцовая артерия.
Чревный ствол отходит тотчас под диафрагмой на уровне ХП грудного позвонка и сразу же делится на три ветви, которые кровоснабжают брюшную часть пищевода, желудок, двенадцатиперстную кишку, поджелудочную железу, печень с желчным пузырем, селезенку, малый и большой сальники.
Верхняя брыжеечная артерия отходит непосредственно от брюшной части аорты и направляется в корень брыжейки тонкой кишки. От нее отходит большое число ветвей, которые кровоснабжают поджелудочную железу, тонкую кишку, правую часть ободочной кишки, включая правую часть поперечной ободочной кишки.
Нижняя брыжеечная артерия начинается от левой полуокружности брюшной части аорты, направляется забрюшинно вниз и влево и отдает ряд ветвей, которые кровоснабжают левую часть поперечной ободочной, нисходящую, сигмовидную ободочные, верхний и средний отделы прямой кишки. Ветви верхней брыжеечной артерии анастомозируют с ветвями чревного ствола и нижней брыжеечной артерии, благодаря чему все три крупных сосуда брюшной полости соединяются между собой.
Общая подвздошная артерия— это самая крупная артерия человека (за исключением аорты). Пройдя некоторое расстояние под острым углом друг к другу, каждая из них делится на две артерии: внутреннюю подвздошную и наружную подвздошную.
Внутренняя подвздошная артерия начинается от общей подвздошной артерии на уровне крестцово-подвздошного сочленения, располагается забрюшинно, направляется в малый таз, прилегая к его латеральной стенке. Внутренняя подвздошная артерия питает тазовую кость, крестец и всю массу мышц малого, большого таза, ягодичной области и отчасти приводящие мускулы бедра, а также внутренности, расположенные в малом тазу: прямую кишку, мочевой пузырь; у мужчин — семенные пузырьки, семявыносящий проток, предстательную железу; у женщин — матку и влагалище, наружные половые органы и промежность.
Наружная подвздошная артерия начинается на уровне крестцово-подвздошного сочленения от общей подвздошной артерии, идет забрюшин-но вниз и вперед, проходит под паховой связкой и переходит в бедренную артерию. Наружная подвздошная артерия кровоснабжает мышцы бедра, у мужчин мошонку, у женщин лобок и большие половые губы.
Бедренная артерия является непосредственным продолжением наружной подвздошной артерии. Она проходит в бедренном треугольнике, между мышцами бедра, входит в подколенную ямку, где продолжается в подколенную артерию. Бедренная артерия кровоснабжает бедренную кость, кожу и мышцы бедра, кожу передней брюшной стенки, наружные половые органы, тазобедренный сустав.
Подколенная артерия является продолжением бедренной. Она лежит в одноименной ямке, переходит на голень, где сразу же делится на переднюю и заднюю большеберцовые артерии. Артерия кровоснабжает кожу и близлежащие мышцы бедра и задней поверхности голени, коленный сустав.
Задняя большеберцовая артерия направляется вниз, в области голеностопного сустава проходит на подошву позади медиальной лодыжки под удерживателем мышц-сгибателей, после чего делится на свои конечные ветви: медиальную и латеральную подошвенные артерии. Наиболее крупная ветвь задней большеберцовой — малоберцовая артерия. Задняя большеберцовая артерия кровоснабжает кожу задней поверхности голени, кости, мышцы голени, коленный и голеностопный суставы, мышцы стопы.
Передняя большеберцовая артерия спускается вниз по передней поверхности межкостной перепонки голени. Артерия кровоснабжает кожу и мышцы передней поверхности голени и тыла стопы, коленный и голеностопный суставы, на стопе переходит в тыльную артерию стопы. Обе большеберцовые артерии образуют на стопе подошвенную артериальную дугу, которая лежит на уровне оснований плюсневых костей. От дуги отходят артерии, питающие кожу и мышцы стопы и пальцев.
Диагностика аневризмы аорты
В диагностике аневризм аорты наибольшее значение имеют так называемые визуализационные методики (УЗИ, МРТ, КТ, АГ). В восходящем отделе аорты , её дуге и в брюшном отделе можно обнаружить аневризму ультразвуковыми методами (УЗИ). Для диагностики аневризмы нисходящего (грудного) отдела аорты необходимы рентгеновские методы (рентгенография, компьютерная томография). Для установления окончательного диагноза и выбора метода лечения выполняются контрастные методы исследования. В настоящее время оптимальным методом диагностики, дающим наиболее полную информацию о локализации, протяженности, диаметре аневризмы и ее отношении к близлежащим органам является мультиспиральная компьютерная томография — аортография.
Строение аорты и ее ветвей
Аорта — самый большой непарный артериальный сосуд большого круга кровообращения. Аорту подразделяют на три отдела: восходящую часть аорты, дугу аорты и нисходящую часть аорты, которая в свою очередь делится на грудную и брюшную части.
Восходящая часть аорты выходит из левого желудочка позади левого края грудины на уровне третьего межреберья; в начальном отделе она имеет расширение — луковицу аорты(25-30 мм в поперечнике) .
В месте расположения клапана аорты на внутренней стороне аорты имеется три синуса. Каждый из них находится между соответствующей полулунной заслонкой и стенкой аорты. От начала восходящей части аорты отходят правая и левая венечные артерии. Восходящая часть аорты лежит позади и отчасти справа от легочного ствола, поднимается вверх и на уровне соединения 2 правого реберного хряща с грудиной переходит в дугу аорты (здесь ее поперечник уменьшается до 21-22 мм).
Дуга аорты поворачивает влево и назад от задней поверхности 2 реберного хряща к левой стороне тела 4 грудного позвонка, где переходит в нисходящую часть аорты.
В этом месте имеется небольшое сужение — перешеек. К передней полуокружности аорты с правой и левой ее сторон подходят края соответствующих плевральных мешков. К выпуклой стороне дуги аорты и к начальным участкам отходящих от нее крупных сосудов (плечеголовной ствол, левые общая сонная и подключичная артерии) прилежит спереди левая плечеголовная вена, а под дугой аорты начинается правая легочная артерия, внизу и чуть левее — бифуркация легочного ствола.
Сзади дуги аорты находится бифуркация трахеи. Между нагнутой полуокружностью дуги аорты и легочным стволом или началом левой легочной артерии имеется артериальная связка. В этом месте от дуги аорты отходят тонкие артерии к трахее и бронхам.
От выпуклой полуокружности дуги аорты начинаются три крупные артерии: плечеголовной ствол, левая общая сонная и левая подключичная артерии.
Нисходящая часть аорты — это наиболее длинный отдел аорты, проходящий от уровня 4 грудного позвонка до 4 поясничного, где она делится на правую и левую общие подвздошные артерии; это место называется бифуркацией аорты.
Нисходящую часть аорты в свою очередь подразделяют на грудную и брюшную части.
Грудная часть аорты находится в грудной полости в заднем средостении. Верхний участок ее расположен впереди и слева от пищевода. Затем на уровне 8-9 грудных позвонков аорта огибает пищевод слева и уходит на его заднюю поверхность. Справа от грудной части аорты располагаются непарная вена и грудной проток, слева к ней прилежит париетальная плевра, у места перехода ее в задний отдел левой медиастинальной плевры.
В грудной полости грудная часть аорты отдает парные париетальные ветви; задние межреберные артерии, а также висцеральные ветви к органам заднего средостения.
Брюшная часть аорты, являясь продолжением грудной части аорты, начинается на уровне 12 грудного позвонка, проходит через аортальное отверстие диафрагмы и продолжается до уровня середины тела 4 поясничного позвонка. Брюшная часть аорты располагается на передней поверхности тел поясничных позвонков, левее срединной линии; лежит забрюшинно .
Справа от брюшной части аорты находятся нижняя полая вена, кпереди -поджелудочная железа, горизонтальная (нижняя) часть двенадцатиперстной кишки и корень брыжейки тонкой кишки. Брюшная часть аорты отдает парные париетальные ветви к диафрагме и к стенкам брюшной полости, а сама непосредственно продолжается в тонкую срединную крестцовую артерию.
Висцеральными ветвями брюшной части аорты являются чревный ствол, верхняя и нижняя брыжеечные артерии (непарные ветви) и парные — почечные, средние надпочечниковые и яичниковые артерии.
Правая и левая венечные артерии (см. выше);
Методы лечения аневризмы аорты
Основной метод лечения аневризмы любого отдела аорты — это хирургический. Смысл метода заключается в замене расширенного участка аорты с целью предотвращения его дальнейшего растяжения и разрыва. Для замены аорты используются два способа — эндоваскулярный (внутрисосудистый) метод с использованием специального внутрисосудистого протеза (стент-графта), и открытая операция -протезирование аорты.
Для каждого метода имеются свои показания, и каждому из них присущи свои преимущества и недостатки.
Преимущества хирургического метода заключаются в его универсальности, то есть возможности исправления всех нарушений, связанных с аневризмой аорты, вне зависимости от отдела и характера поражения. Например, при аневризме восходящего отдела аорты и поражении аортального клапана проводят протезирование аорты, аортального клапана в сочетании с коронарным шунтированием.
Для проведения операции на восходящем отделе аорты и ее дуге необходимо применение искусственного кровообращения, системной гипотермии и зачастую — полной остановки кровообращения.
Показания к оперативному лечению
- поперечный размер аневризмы,
- темп роста аневризмы;
- формирование осложнений данного заболевания.
Для каждого отдела аорты существует пограничный предел поперечного размера аорты, после достижения которого риск разрыва аорты статистически достоверно увеличивается. Так, для восходящего и брюшного отдела аорты опасным в плане разрыва является поперечный диаметр аневризмы 5 см, для грудного отдела аорты — 6 см. Если диаметр аневризмы увеличивается более чем на 6 мм за 6 мес, то это тоже является показанием к операции. Угрожающими в плане разрыва и расслоения аорты являются также мешковидная форма аневризмы и расширения аорты меньше того диаметра, который является показанием для операции, но сопровождающиеся болями в месте расширения и нарушениями функций предлежащих органов. Расслоения и свершившиеся разрывы аневризм являются абсолютными показаниями к экстренной операции.
Острое травматическое повреждение аорты: визуализация и тактика ведения
Острое травматическое повреждение аорты (ОТПА) в большинстве случаев является летальным — при таком повреждении около 80 % пострадавших погибает еще до прибытия в стационар. Среди причин смертей в результате ДТП ОТПА по частоте уступает только черепно-мозговой травме. С улучшением вариантов визуализации, развитием хирургических методов лечения и чрескожных вмешательств смертность среди пациентов с ОТПА снизилась с 50 до 5 %. ОТПА встречается примерно в 2 % случаев тупой травмы грудной клетки, приблизительно 70 % из них — у жертв ДТП.
Точный патогенез ОТПА не совсем понятен, но предлагаемые механизмы заключаются в резком повышении внутрисосудистого давления (по типу эффекта гидравлического удара) и разрыве аорты, зажатой между телом позвонка и смещенной к позвоночнику грудиной (рис. 1). .
Рисунок 1 | Механизмы повреждения аорты у пациентов с тупой травмой грудной клетки
Методом выбора для диагностики ОТПА является КТ-ангиография, заменяющая обычную ангиографию. Она позволяет оценить нарушения интимы и косвенные признаки повреждения аорты, такие как периаортальная гематома. В экстренных условиях выполнять КТ с ЭКГ-синхронизацией для визуализации аорты нецелесообразно из-за длительной настройки, необходимости дополнительной подготовки и продолжительной задержки дыхания пациентами. С появлением новых КТ-сканеров с двумя источниками излучения и сверхбыстрой скоростью захвата стало возможно получение практически «неподвижных» изображений без двигательных артефактов, наблюдаемых в сердце и корне аорты при традиционной компьютерной томографии. С этими изображениями радиологическая оценка ОТПА может применяться для определения тактики ведения больного и прогноза.
Далее мы расскажем об актуальных аспектах визуализации, радиологической классификации, диагностике и тактике ведения больных с ОТПА, а также о последних достижениях, которые значительно влияют на точность визуализации у пациентов с этой травмой.
Благодаря своим диагностическим возможностям и доступности метода КТ-ангиография является исследованием выбора для диагностики ОТПА. Наиболее часто повреждаются перешеек аорты, восходящая аорта и аортальное отверстие диафрагмы, поэтому у пациентов с тупой травмой следует проводить КТ-сканирование грудной клетки и верхней части живота в артериальную фазу. Чаще всего КТ-ангиография выполняется как часть общей компьютерной томографии при обследовании пациентов с политравмой.
Появление КТ-сканеров с двумя источниками излучения и сканеров с 64 или более срезами произвело революцию в применении КТ при визуализации сердца и сосудов. Эти сканеры имеют пространственное разрешение в диапазоне от 0,25 до 0,47 мм, причем большинство новых сканеров предоставляют разрешение 0,33 мм. Также у таких сканеров очень быстрое вращение гентри, что приводит к более высокой скорости получения изображений — неподвижные изображения даже восходящей аорты могут быть получены без ЭКГ-синхронизации (рис. 2). Кроме того, артефакты движения от дыхания пациента минимальны, что дает необходимое диагностическое качество изображения.
Рисунок 2
Не синхронизированное с помощью ЭКГ КТ-изображение в аксиальном срезе на уровне синусов Вальсальвы (пространства между полулунными заслонками и стенкой аорты), полученное с помощью нового КТ-сканера с двумя источниками излучения (А) МСКТ на 64-срезовом сканере у того же пациента. Обратите внимание на отсутствие артефактов пульсации (указаны стрелками) в новом сканере с двумя источниками даже без ЭКГ-синхронизации.
Основанием для визуализации грудной клетки и верхней части живота в артериальную фазу является то, что большинство сосудистых повреждений анатомически происходит именно в этих областях, если только у пациента нет дополнительных факторов риска, таких как перелом таза, а значит возможного повреждения сосудов таза. Кроме того, визуализация грудной клетки только в артериальной фазе не препятствует обнаружению каких-либо серьезных патологий легких.
Низкодозированная отсроченная фаза сканирования живота и таза выполняется, если подтверждено повреждение в портальную венозную фазу исследования или есть подозрение на повреждение почек или мочевого пузыря. Начальная бесконтрастная фаза полезна для диагностики интрамуральной гематомы, однако она не выполняется как часть протокола при травме. Протокол КТ грудной клетки и живота для пациентов с тупой травмой приведен в Таблице 1.
Таблица 1 | Протокол КТ-обследования при тупой травме груди, живота и таза
В каждом случае сагиттальные и фронтальные трехмерные модели формируются через изображения в аксиальной плоскости. Другие трехмерные методы, включая проекции максимальной интенсивности (MIP — maximum intensity projection) и объемные изображения (VR — volume rendering), создаются на отдельной рабочей станции. Изогнутые реконструкции аорты создаются только в случаях, когда впоследствии при операции планируется размещение стента. Это трехмерное моделирование данных всегда считывается в сочетании с необработанными данными, что значительно помогает при планировании оперативных вмешательств.
МРТ почти никогда не используется для выявления повреждений у пациентов с тупой травмой. Тем не менее МР-ангиография также используется для диагностики травм: в основном к этому методу прибегают после установки эндоваскулярного стента или если почечная недостаточность исключает проведение КТ-ангиографии. Протокол МРТ для визуализации аорты выделен в Таблице 2. Если КТ- и МР-ангиография не могут быть выполнены из-за почечной недостаточности (СКФ < 30), пациентам лучше всего проводить КТ без контрастирования для интервального изменения диаметра аорты.
Таблица 2 | Протокол МР-ангиографии аорты
Хотя определяющим методом в большинстве случаев является КТ-ангиография, первоначальная оценка травмы часто начинается с рентгенографии органов грудной клетки. Данные, подозрительные для ОТПА при этом методе исследования, включают в себя:
- расширение средостения 8 см на уровне дуги аорты (или верхнее средостение, измеряющее приблизительно как 25 % ширины грудной клетки);
- неровность контура дуги аорты;
- невозможность определения аортопульмонального окна;
- затемнение границы легкого с аортой;
- отклонение трахеи или назогастральной трубки вправо;
- опущение левого главного бронха;
- расширенная левая паратрахеальная полоса.
КТ-ангиография обладает очень высокой чувствительностью (приблизительно 98 %) и почти 100 % специфичностью для диагностики. Признаки ОТПА на КТ-ангиографии могут быть разделены на прямые и косвенные.
Косвенные признаки ОТПА включают средостенную или периаортальную гематому, ретрокруральную гематому или небольшой калибр аорты дистальнее места повреждения. Местоположение средостенной гематомы имеет решающее значение, поскольку если между аортой и гематомой есть четко выраженный слой жировой ткани, следует рассмотреть альтернативные источники кровотечения (из вены, межреберной артерии или кости) (рис. 3). Периаортальная гематома без каких-либо явных признаков повреждения аорты может быть связана со скрытым повреждением интимы. Обычная ангиография может не давать достаточной диагностической визуализации у пациентов со скрытым повреждением интимы, поэтому дополнительно лучше использовать внутрисосудистое ультразвуковое исследование или трансэзофагеальную эхокардиографию. .
Рисунок 3
36-летний мужчина с медиастинальной гематомой и гемотораксом. Сагиттальное (А) и фронтальное изображение (В, С) КТ-ангиографии. Определяется четко выраженный слой жировой ткани между нисходящей аортой и гематомой (указана стрелками). Это предполагает, что аорта не является источником гематомы. Источником продолжающегося кровотечения служит межреберная артерия (стрелка на изображении С)
Прямые признаки ОТПА включают активную контрастную экстравазацию, разрыв (или травматическую псевдоаневризму), интрамуральный тромб, смещение аорты и аномалию контура аорты (включая внезапное изменение калибра, также известное как псевдокоарктация). При высоком риске наличия механизма повреждения, как при автотравме, оценка других возникающих при этом состояний также имеет решающее значение. Обычно ОТПА сопутствуют тяжелые травмы головы, повреждения легких и сердца, разрыв диафрагмы, внутрибрюшное кровотечение, переломы костей таза и длинных трубчатых костей.
Термин «минимальное повреждение аорты» (MПА) представляет собой развивающуюся концепцию, которая была введена в 1999 году в «Системе КТ оценки травм аорты Центра Пресли» (Таблица 3) для описания травм, которые носят незначительный характер.
Malhotra с соавт. первыми описали это повреждение и определили его как небольшой (< 1 см) посттравматический клапан интимы с минимальной периаортальной гематомой или без нее. Большинство из этих травм не могут быть диагностированы другими методами визуализации перед рутинным использованием КТ-ангиографии. Первоначально МПА обнаруживали примерно у 10 % пациентов с ОТПА, но более поздние исследования показали, что оно наблюдается примерно в 25–35 % случаев ОТПА. Увеличение частоты обнаружения МПА может быть связано с рядом факторов, таких как повышение доступности КТ-ангиографии, улучшение технологии КТ и повышение безопасности транспортных средств. Нисходящая аорта является наиболее распространенной локализацией MПА, на втором месте по частоте — перешеек аорты. Хотя общепринятым критерием МПА служит минимальная или отсутствующая средостенная гематома, не существует стандартного признака, который определял бы MПА. Варианты определения минимального или незначительного повреждения аорты в различных исследованиях даны в Таблице 3.
Таблица 3 | Определение группы пациентов с незначительными/минимальными повреждениями аорты в различных исследованиях
Использование различных признаков минимального или незначительного повреждения аорты вводит в заблуждение радиологов и хирургов, поскольку это может повлиять на тактические решения. Среди ключевых признаков в большинстве исследований рассматривался «маленький» интимный лоскут, внутрипросветный тромб или интрамуральная гематома без каких-либо аномалий внешнего контура и с минимальной периаортальной гематомой или без таковой в качестве MПА (рис. 4, 5). В большинстве исследований лоскут интимы считался «малым» при его размерах менее 1 см, так как у нелеченных лоскутов или тромбов интимы размерами более 1 см выявляется более высокая частота прогрессирования заболевания. .
Рисунок 4
Фронтальное (А) и сагиттальное (В) КТ-изображение органов грудной клетки 32-летнего мужчины (прыгнул с крыши здания). Определяется крошечный внутрипросветный тромб (стрелки) в аорте на уровне перешейка, без наружной гематомы или неправильной формы контура, позволяющей думать о повреждении аорты.
Рисунок 5
КТ-изображение органов грудной клетки в аксиальной плоскости 41-летнего мужчины (падение с мотоцикла). Определяетсянебольшой лоскут интимы (указан черной стрелкой) в переднем нисходящем отделе грудной аорты без наружной гематомы или деформации наружного контура, что соответствует минимальному повреждению аорты. Также мы видим перелом левого ребра (указан белой стрелкой) и двустороннее скопление жидкости в плевральной полости.
Как и в случае с диагностикой MПА, также нет единого мнения относительно ведения и наблюдения за этими травмами. В большинстве исследований предполагается, что их можно лечить неинвазивно путем контроля частоты сердечных сокращений и артериального давления, а также антикоагулянтной или антиагрегантной терапии. Выбор подходящей тактики лечения должен проводиться индивидуально с учетом других сопутствующих заболеваний. Предлагается первоначальное использование отрицательных инотропов (чаще всего бета-адреноблокаторов) для достижения целевых значений АД и ЧСС для уменьшения напряжения сдвига сосудов — систолического АД 120 мм рт. ст. или среднего значения АД 80 мм рт. ст., а также частоты сердечных сокращений менее 80 ударов в минуту. Препаратами второго ряда являются блокаторы кальциевых каналов или артериальные вазодилататоры. В рекомендациях Общества сосудистой хирургии (SVS) предлагается «выжидательная» тактика с последовательным наблюдением за состоянием интимы.
В последних руководствах Восточной ассоциации хирургии травм (EAST) отмечается, что нет достаточных доказательств для формулирования рекомендаций по консервативному лечению МПА с необходимостью проведения дополнительных исследований. Даже в рекомендациях SVS отсутствуют какие-либо конкретные рекомендации по «ожидаемому» течению заболевания и протоколу последующих действий. Визуальное наблюдение за MПА обычно варьируется в зависимости от опыта каждого конкретного учреждения и его текущих наблюдений. Хотя в последнем исследовании медицинского центра Harborview Heneghan с соавт. предполагают, что после проведения консервативного лечения МПА нет необходимости в последующей визуализации, в предыдущем исследовании, проведенном тем же институтом в 2014 году, Gunn с соавт. предложили использовать КТ-ангиографию на 3-й день, через 1 неделю и 1 месяц после травмы. В другом исследовании Mosquera с соавт. рекомендовали проводить КТ-ангиографическое исследование через 1, 3, 6 и 12 месяцев после травмы с последующим ежегодным МР-сканированием сердца и сосудов. Хотя нет единого мнения относительно графика профилактических исследований, большинство исследователей предполагает, что наблюдение обычно заканчивается, когда аорта возвращается к нормальному виду. Почти все исследования показывают, что у большинства пациентов заболевание не прогрессирует, а если это и происходит, то в первый месяц после травмы. Такой характер прогрессирования заболевания также подтверждается экспериментальными исследованиями на животных, которые показывают, что максимальная клеточная активность интимы и ее утолщение происходят через 3–4 недели после травмы. Если через это время отмечаются признаки стабилизации или улучшения визуализационной картины травмы, дальнейшее наблюдение может не потребоваться. В конечном счете существует необходимость в проспективном многоцентровом исследовании с использованием «фиксированного» анатомического определения «незначительного» повреждения аорты, при котором группу пациентов с MПА следует последовательно контролировать с заранее определенной частотой проведений КТ и продолжительностью наблюдения.
Существует несколько различных классификационных систем ОТПА (Таблица 4). Одна из наиболее широко используемых оценок ОТПА была предложена Azizzadeh с соавт. (одобрена Обществом сосудистой хирургии) и делит травмы на 4 степени: 1 класс — разрывы интимы (рис. 5), 2 класс — внутригрудная гематома или большой клапан интимы (рис. 6), 3 класс — псевдоаневризма (рис. 7,  и 4 класс — свободный разрыв (рис. 9). Хотя эта система оценок дает прямое описание травмы, она не является руководством по лечению.
и 4 класс — свободный разрыв (рис. 9). Хотя эта система оценок дает прямое описание травмы, она не является руководством по лечению.
Таблица 4 | Классификации ОТПА
Рисунок 6
Мужчина 45 лет с тупой травмой грудной клетки. Аксиальная (А), фронтальная (В) и сагиттальная (С) плоскости изображении КТ-ангиографии. Определяется ОТПА в проксимальной части нисходящей аорты, вызвавшее интрамуральную гематому в области дуги аорты, ветвей дуги аорты (изогнутая стрелка на изображении С) и нисходящей грудной аорты (белые стрелки) с тромбом (полые стрелки на изображениях А и С).
Рисунок 7
Женщина 63 лет, пострадала в результате мототравмы. Аксиальный (А) и сагиттальный (В) срезы КТ органов грудной клетки. Определяется небольшая псевдоаневризма (указана белыми стрелками) в области перешейка аорты с медиастинальной гематомой (указана полой стрелкой).
Рисунок 8
Мужчина, 33 года, ОТПА. Аксиальное (А) и фронтальное (В) изображения КТ-ангиографии с ЭКГ-синхронизацией. Визуализируется псевдоаневризма восходящей грудной аорты из области над синотубулярным соединением. Размеры псевдоаневризмы 1,4 х 0,7 см. Нет признаков активной экстравазации контраста. Открытая стрелка указывает на небольшое кровотечение из жировой клетчатки средостения.
Рисунок 9
70-летняя женщина с травматическим разрывом аорты. Аксиальное (А) и фронтальное (В) КТ-изображения. Есть признаки полного разрыва передней стенки нисходящей грудной аорты (указаны стрелкой), вызывающего экстравазацию контрастного вещества (указано звездочкой). Обратите внимание на медиастинальную гематому и билатеральные скопления жидкости в плевральных полостях.
Существует множество вариантов лечения пациента с ОТПА, такие как традиционное открытое вмешательство, эндоваскулярное стентирование и выбор консервативной тактики для некоторых групп пациентов. Таким образом, оценка КТ-ангиографии ОТПА является в высшей степени ценной для планирования лечения. В дополнение к информации о степени тяжести и типе травм результаты КТ должны включать описание анатомии дуги аорты, признаков доминирования позвоночной артерии, любого существенного ранее существующего атеросклеротического заболевания или стеноза, предшествующие послеоперационные изменения (такие как аортокоронарный шунт), длину повреждения аорты, диаметр аорты выше и ниже травмы, а также близость расположения левой подключичной артерии (в случае травмы перешейка аорты). Эта информация помогает врачу выбирать варианты лечения и вид оперативного вмешательства. Например, хирургическое восстановление аорты обычно включает левую задне-боковую торакотомию, часто требующую подключения пациента к аппарату искусственного кровообращения. Визуализация помогает хирургу определить точную область травмы и предоставляет информацию о других травмах, которые можно лечить, используя тот же доступ.
Несколько дополнительных важных рентгенологических результатов, на которые следует обратить внимание при планировании эндоваскулярного стентирования — наличие какого-либо очагового поражения или тромба, информация о проксимальной и дистальной зоне установки стента (предпочтительная длина — 2 см), наличие кальцификации в зоне установки стента, извитость аорты и диаметр сосудов доступа.
Существуют разные мнения относительно лучшего варианта ведения пациентов с такой травмой. Исследования показали, что рост использования эндоваскулярных стентов среди пациентов, нуждающихся в оперативном лечении, привел к снижению частоты ранних осложнений и уменьшению сроков пребывания в стационаре. В последних руководствах EAST рекомендуется использовать эндоваскулярное протезирование у пациентов, у которых нет противопоказаний к процедуре.
Рекомендации также предполагают, что у гемодинамически стабильных пациентов окончательное лечение ОТПА должно быть отложено до тех пор, пока не будут устранены другие острые опасные для жизни травмы. Раннее лечение ОТПА может быть связано с более высокой частотой возникновения параплегии и почечной недостаточности. Но если пациент гемодинамически нестабилен и на КТ имеются прямые признаки повреждения аорты, необходимо неотложное лечение повреждения аорты. Предлагаемый алгоритм тактики при ОТПА у пациентов с тупой травмой, основанный на рекомендациях EAST Practice Work Group, приведен в таблице 5.
Таблица 5 | Тактика при ОТПА, основанная на рекомендациях Восточной Ассоциации Хирургов-Травматологов (EAST practice work group)
Анализ национальной стационарной выборки Ultee et al. показали, что лечение с помощью эндоваскулярных методов (TEVAR — thoracic endovascular aortic repair) увеличилось с 6,5 % от оперативного объема в 2005 году до 87 % в 2011 году. Общая смертность от травмы аорты также снизилась, что объясняется использованием TEVAR, расширением показаний к применению, улучшением навыков хирургов и расширением технических возможностей. Травма аорты, относительно распространенная в младшей возрастной группе, приводит ко многим уникальным проблемам, связанным с ее лечением и исходами. Средний размер аорты в этой популяции намного меньше, чем при аневризматических заболеваниях, и поэтому ранний опыт применения EVAR (endovascular aortic repair — эндоваскулярные вмешательства на аорте) столкнулся с проблемами при определении размеров трансплантата. Геометрия дуги у более молодых пациентов также является более острой, что связано с плохой совместимостью эндотрансплантата с дугой аорты. Сообщается о 0–18 % степени инфолдинга, миграции, коллапса стента и даже острой окклюзии аорты, требующих повторного вмешательства, при этом большинство осложнений происходит на ранних сроках после операции. Ремоделирование аорты у этих пациентов может также отличаться тем, что аорта, дистальная к левой подключичной артерии, расширяется с большей скоростью, чем проксимальные сегменты. Помимо технических достижений, было предложено использование процедурных модификаций, таких как ограничение избыточного размера трансплантата до 10 % для приспособления к последующему ремоделированию. Влияние этих факторов на отдаленные результаты требует дальнейшего изучения.
Благодаря тому, что гибридные операционные залы и становятся все более распространенными, параллельные улучшения в визуализации, такие как КТ с конусным пучком, термоядерная визуализация и IVUS (intravessel ultrasound — внутрисосудистое ультразвуковое исследование), также облегчают оперативные и интервенционные процедуры, сводя к минимуму облучение и использование контрастных препаратов. Это, а также лучшее качество изображения, имеют решающее значение для технического успеха сложных эндоваскулярных процедур на аорте. Лучшее программное обеспечение для планирования и визуализация слияния полезны для точного развертывания трансплантата, и это может быть дополнительно подтверждено IVUS. Использование IVUS при вмешательствах на аорте улучшает понимание сложной анатомии и, как показано, уменьшает количество используемого контраста и общее время операции.
Пациент с тупой травмой требует междисциплинарного подхода к лечению. Поскольку ОТПА является жизнеугрожающим состоянием, исходы которого почти всегда непредсказуемы, необходимо формирование многопрофильных бригад для быстрой оценки, сортировки и ведения пациентов с подозрением на ОТПА (на основании физикального осмотра, внешних или КТ-признаков, или известного предшествующего анамнеза). В эту группу входят специалисты по визуализации сердечно-сосудистой системы, интервенционной радиологии, кардиохирургии, сосудистой и эндоваскулярной хирургии, кардиологии, анестезиологии-реаниматологии. Команда должна обеспечить экспертную оценку для всех острых ситуаций и обсудить различные варианты подходов к лечению ОТПА, включая использование эндоваскулярных методов, минимально инвазивных и открытых операций. По опыту исследователей, именно междисциплинарный командный подход к ведению пациентов с ОТПА имеет решающее значение для надлежащего лечения.
Источники:
- Fox N, Schwartz D, Salazar JH, et al. Evaluation and manage- ment of blunt traumatic aortic injury: a practice management guideline from the Eastern Association for the Surgery of Trauma. J Trauma Acute Care Surg. 2015;78(1):136–46.
- Neschis DG, Scalea TM, Flinn WR, Griffith BP. Blunt aortic injury. N Engl J Med. 2008;359(16):1708–16.
- Heneghan RE, Aarabi S, Quiroga E, Gunn ML, Singh N, Starnes BW. Call for a new classification system and treatment strategy in blunt aortic injury. J Vasc Surg. 2016;64(1):171–6.
- Ungar TC, Wolf SJ, Haukoos JS, Dyer DS, Moore EE. Derivation of a clinical decision rule to exclude thoracic aortic imaging in patients with blunt chest trauma after motor vehicle collisions. J Trauma. 2006;61(5):1150–5.
- Steenburg SD, Ravenel JG, Ikonomidis JS, Schonholz C, Reeves S. Acute traumatic aortic injury: imaging evaluation and man- agement. Radiology. 2008;248(3):748–62.
- Nagpal P, Khandelwal A, Saboo SS, Bathla G, Steigner ML, Rybicki FJ. Modern imaging techniques: applications in the management of acute aortic pathologies. Postgrad Med J. 1078;2015(91):449–62.
- Seimens Healthineers USA
- Starnes BW, Lundgren RS, Gunn M, et al. A new classification scheme for treating blunt aortic injury. J Vasc Surg. 2012;55(1): 47–54.123
- Lamarche Y, Berger FH, Nicolaou S, et al. Vancouver simplified grading system with computed tomographic angiography for blunt aortic injury. J Thorac Cardiovasc Surg.2012;144(2):347–54.
- Rogalla P, Kloeters C, Hein PA. CT technology overview: 64-slice and beyond. Radiol Clin North Am. 2009;47(1):1–11.
- Voitle E, Hofmann W, Cejna M. Aortic emergencies-diagnosis and treatment: a pictorial review. Insights Imaging. 2015;6(1):17–32.
- Nagpal P, Saboo SS, Khandelwal A, Duran-Mendicuti MA, Abbara S, Steigner ML. Traumatic right atrial pseudoaneurysm. Cardiovasc Diagn Ther. 2015;5(2):141–4.
- Soto JA, Anderson SW. Multidetector CT of blunt abdominal trauma. Radiology. 2012;265(3):678–93.
- Fishman EK, Ney DR, Heath DG, Corl FM, Horton KM, Johnson PT. Volume rendering versus maximum intensity projection in CT angiography: what works best, when, and why. Radiograph- ics. 2006;26(3):905–22.
- Sammer M, Wang E, Blackmore CC, Burdick TR, Hollingworth W. Indeterminate CT angiography in blunt thoracic trauma: is CT angiography enough? AJR Am J Roentgenol. 2007;189(3):603–8.
- Fabian TC, Richardson JD, Croce MA, et al. Prospective study of blunt aortic injury: Multicenter Trial of the American Association for the Surgery of Trauma. J Trauma.1997;42(3):374–80 (dis- cussion 80–83).
- Kram HB, Appel PL, Wohlmuth DA, Shoemaker WC. Diagnosis of traumatic thoracic aortic rupture: a 10-year retrospective analysis. Ann Thorac Surg. 1989;47(2):282–6.
- Gavant ML. Helical CT grading of traumatic aortic injuries. Impact on clinical guidelines for medical and surgical manage- ment. Radiol Clin North Am. 1999;37(3):553–74.
- Malhotra AK, Fabian TC, Croce MA, Weiman DS, Gavant ML, Pate JW. Minimal aortic injury: a lesion associated with advancing diagnostic techniques. J Trauma.2001;51(6):1042–8.
- Forman MJ, Mirvis SE, Hollander DS. Blunt thoracic aortic injuries: CT characterisation and treatment outcomes of minor injury. Eur Radiol. 2013;23(11):2988–95.
- Gunn ML, Lehnert BE, Lungren RS, et al. Minimal aortic injury of the thoracic aorta: imaging appearances and outcome. Emerg Radiol. 2014;21(3):227–33.
- Paul JS, Neideen T, Tutton S, et al. Minimal aortic injury after blunt trauma: selective nonoperative management is safe. J Trauma. 2011;71(6):1519–23.
- de Mestral C, Dueck A, Sharma SS, et al. Evolution of the inci- dence, management, and mortality of blunt thoracic aortic injury: a population-based analysis. J Am Coll Surg. 2013;216(6):1110–5.
- Osgood MJ, Heck JM, Rellinger EJ, et al. Natural history of grade I–II blunt traumatic aortic injury. J Vasc Surg. 2014;59(2):334–41.
- Kidane B, Abramowitz D, Harris JR, DeRose G, Forbes TL. Natural history of minimal aortic injury following blunt thoracic aortic trauma. Can J Surg Journal canadien de chirurgie.2012;55(6):377–81.
- Mosquera VX, Marini M, Lopez-Perez JM, et al. Role of conservative management in traumatic aortic injury: comparison of long-term results of conservative, surgical, and endovascular treatment. J Thorac Cardiovasc Surg. 2011;142(3):614–21.
- Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases: document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult. The Task Force for the Diagnosis and Treat- ment of Aortic Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(41):2873–926.
- Lee WA, Matsumura JS, Mitchell RS, et al. Endovascular repair of traumatic thoracic aortic injury: clinical practice guidelines of the Society for Vascular Surgery. J Vasc Surg. 2011;53(1):187–92.
- Neville RF, Padberg FT Jr, DeFouw D, Hernandez J, Duran W, Hobson RW 2nd. The arterial wall response to intimal injury in an experimental model. Ann Vasc Surg.1992;6(1):50–4.
- Azizzadeh A, Keyhani K, Miller CC 3rd, Coogan SM, Safi HJ, Estrera AL. Blunt traumatic aortic injury: initial experience with endovascular repair. J Vasc Surg. 2009;49(6):1403–8.
- Forcillo J, Philie M, Ojanguren A, et al. Outcomes of traumatic aortic injury in a primary open surgical approach paradigm. Trauma Mon. 2015;20(2):e18198.
- Fanelli F, Dake MD. Standard of practice for the endovascular treatment of thoracic aortic aneurysms and type B dissections. Cardiovasc Intervent Radiol. 2009;32(5):849–60.
- Ultee KH, Soden PA, Chien V, et al. National trends in utilization and outcome of thoracic endovascular aortic repair for traumatic thoracic aortic injuries. J Vasc Surg.2016;63(5):1232–9.
- Forbes TL, Harris JR, Lawlor DK, Derose G. Aortic dilatation after endovascular repair of blunt traumatic thoracic aortic inju- ries. J Vasc Surg. 2010;52(1):45–8.
- Farber MA, Mendes RR. Endovascular repair of blunt thoracic aortic injury: techniques and tips. J Vasc Surg. 2009;50(3):683–6. 36. Kolbel T, Dias N, Resch T, Holst J, Sonesson B, Malina M. In situ bending of thoracic stent grafts: clinical application of a novel technique to improve conformance to the aortic arch.
- J Vasc Surg. 2009;49(6):1613–6.
- Neschis DG, Moainie S, Flinn WR, Scalea TM, Bartlett ST, Griffith BP. Endograft repair of traumatic aortic injury—a tech- nique in evolution: a single institution’s experience. Ann Surg. 2009;250(3):377–82.
- Stangenberg L, Shuja F, Carelsen B, Elenbaas T, Wyers MC, Schermerhorn ML. A novel tool for three-dimensional roadmap- ping reduces radiation exposure and contrast agent dose in com- plex endovascular interventions. J Vasc Surg. 2015;62(2):448–55.
- Song TK, Donayre CE, Kopchok GE, White RA. Intravascular ultrasound use in the treatment of thoracoabdominal dissections, aneurysms, and transections. Semin Vasc Surg. 2006;19(3):145–9.
- Guo BL, Shi ZY, Guo DQ, et al. Effect of intravascular ultrasound- assisted thoracic endovascular aortic repair for ‘‘complicated’’ type B aortic dissection. Chin Med J (Engl). 2015;128(17):2322–9.
- Dijkstra ML, Eagleton MJ, Greenberg RK, Mastracci T, Her- nandez A. Intraoperative C-arm cone-beam computed tomogra- phy in fenestrated/branched aortic endografting. J Vasc Surg. 2011;53(3):583–90.
- Bashore TM, Bates ER, Berger PB, et al. American College of Cardiology/Society for Cardiac Angiography and Interventions Clinical Expert Consensus Document on cardiac catheterization laboratory standards. A report of the American College of Car- diology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2001;37(8):2170–214.
- Alberta HB, Secor JL, Smits TC, et al. Comparison of thoracic aortic diameter changes after endograft placement in patients with traumatic and aneurysmal disease. J Vasc Surg. 2014;59(5):1241–6.
- Watson J, Slaiby J, Garcia Toca M, Marcaccio EJ Jr, Chong TT. A 14-year experience with blunt thoracic aortic injury. J Vasc Surg. 2013;58(2):380–5.
- Fearn S, Lawrence-Brown MM, Semmens JB, Hartley D. Follow- up after endovascular aortic aneurysm repair: the plain radio- graph has an essential role in surveillance. J Endovasc Ther. 2003;10(5):894–901.
- Riesenman PJ, Brooks JD, Farber MA. Acute blunt traumatic injury to the descending thoracic aorta. J Vasc Surg. 2012;56(5):1274–80. 47. Estrera AL, Miller CC 3rd, Guajardo-Salinas G, et al. Update on blunt thoracic aortic injury: fifteen-year single-institution expe- rience. J Thorac Cardiovasc Surg. 2013;145(3 Suppl):S154–8. 48. Rabin J, DuBose J, Sliker CW, O’Connor JV, Scalea TM, Griffith BP. Parameters for successful nonoperative management of trau- matic aortic injury. J Thorac Cardiovasc Surg. 2014;147(1):143–9.
Виды открытых хирургических операций при аневризмах аорты:
- Операция Бенталла-Де-Боно (протезирование восходящего отдела аорты клапансодержащим кондуитом с механическим протезом аортального клапана);
- Операция Дэвида (протезирование восходящего отдела аорты с сохранением собственного аортального клапана);
- Супракоронарное протезирование аорты;
- Протезирование восходящего отдела аорты и её дуги (техника Борста, использование косого агрессивного анастомоза и другие методики);
- Протезирование грудного отдела аорты;
- Протезирование брюшного отдела аорты.
Аорта и ее отделы. Ветви дуги аорты, их анатомия, топография, области ветвления (кровоснабжения)
Аорта, aorta — самый большой непарный артериальный сосуд большого круга кровообращения. Аорту подразделяют на три отдела: восходящую часть аорты, дугу аорты и нисходящую часть аорты, которая в свою очередь делится на грудную и брюшную части.
Восходящая часть аорты, pars ascendens aortae,
выходит из левого желудочка позади левого края грудины на уровне третьего межреберья; в начальном отделе она имеет расширение — луковицу аорты,
bulbus aortae
(25—30 мм в поперечнике).
В месте расположения клапана аорты на внутренней стороне аорты имеется три синуса, sinus aortae.
Каждый из них находится между соответствующей полулунной заслонкой и стенкой аорты. От начала восходящей части аорты отходят правая и левая венечные артерии.
Восходящая часть аорты лежит позади и отчасти справа от легочного ствола, поднимается вверх и на уровне соединения II правого реберного хряща с грудиной переходит в дугу аорты (здесь ее поперечник уменьшается до 21—22 мм).
Дуга аорты, arcus aortae,
поворачивает влево и назад от задней поверхности II реберного хряща к левой стороне тела IV грудного позвонка, где переходит в нисходящую часть аорты.
В этом месте имеется небольшое сужение — перешеек аорты, isthmus aortae.
К передней полуокружности аорты с правой и левой ее сторон подходят края соответствующих плевральных мешков.
К выпуклой стороне дуги аорты и к начальным участкам отходящих от нее крупных сосудов (плечеголовной ствол, левые общая сонная и подключичная артерии) прилежит спереди левая плечеголовая вена, а под дугой аорты начинается правая легочная артерия, внизу и чуть левее — бифуркация легочного ствола. Сзади дуги аорты находится бифуркация трахеи.
Между вогнутой полуокружностью дуги аорты и легочным стволом или началом левой легочной артерии имеется артериальная связка, tig.
arteriosum. В этом месте от дуги аорты отходят тонкие артерии к трахее и бронхам. От выпуклой полуокружности дуги аорты начинаются три крупные артерии: плечеголовной ствол, левая общая сонная и левая подключичная артерии.
Нисходящая часть аорты, pars descendens aortae,
— это наиболее длинный отдел аорты, проходящий от уровня IV грудного позвонка до IV поясничного, где она делится на правую и левую общие подвздошные артерии; это место называется бифуркацией аорты,
bifurcdtio aortae.
Нисходящую часть аорты в свою очередь подразделяют на грудную и брюшную части.
Грудная часть аорты, pars thordcica aortae,
находится в грудной полости в заднем средостении.
Верхний участок ее расположен впереди и слева от пищевода. Затем на уровне VIII—IX грудных позвонков аорта огибает пищевод слева и уходит на его заднюю поверхность. Справа от грудной части аорты располагаются непарная вена и грудной проток, слева к ней прилежит париетальная плевра, у места перехода ее в задний отдел левой медиастинальной плевры. В грудной полости грудная часть аорты отдает парные париетальные ветви; задние межреберные артерии, а также висцеральные ветви к органам заднего средостения.
Брюшная часть аорты, pars abdomindlis aortae,
являясь продолжением грудной части аорты, начинается на уровне XII грудного позвонка, проходит через аортальное отверстие диафрагмы и продолжается до уровня середины тела IV поясничного позвонка.
Брюшная часть аорты располагается на передней поверхности тел поясничных позвонков, левее срединной линии; лежит забрюшинно. Справа от брюшной части аорты находятся нижняя полая вена, кпереди — поджелудочная железа, горизонтальная (нижняя) часть двенадцатиперстной кишки и корень брыжейки тонкой кишки. Брюшная часть аорты отдает парные париетальные ветви к диафрагме и к стенкам брюшной полости, а сама непосредственно продолжается в тонкую срединную крестцовую артерию.
Висцеральными ветвями брюшной части аорты являются чревный ствол, верхняя и нижняя брыжеечные артерии (непарные ветви) и парные — почечные, средние надпочечниковые и яичковые (яичниковые) артерии.
Ветви дуги аорты
Плечеголовной ствол, truncus brachlocephdlicus,
отходит от дуги аорты на уровне II правого реберного хряща.
Впереди него находится правая плечеголовная’вена, сзади — трахея. Направляясь кверху и вправо, плечеголовной ствол не отдает никаких ветвей и лишь на уровне правого грудино-ключичного сустава делится на две конечные ветви — правую общую сонную и правую подключичную артерии.
Правая общая сонная артерия, a.
carotis communis dextra, является ветвью плечеголовного ствола, а левая общая сонная артерия,
a. carotis communis sinistra,
отходит непосредственно от дуги аорты.
Левая общая сонная артерия обычно длиннее правой на 20—25 мм. Общая сонная артерия лежит позади грудино-ключично-сосцевидной и ло-паточно-подъязычной мышц, следует вертикально вверх впереди поперечных отростков шейных позвонков, не отдавая по пути ветвей.
Кнаружи от общей сонной артерии располагаются внутренняя яремная вена и блуждающий нерв, кнутри — вначале трахея и пищевод, а выше — гортань, глотка, щитовидная и околощитовидные железы.
На уровне верхнего края щитовидного хряща каждая общая сонная артерия делится на наружную и внутреннюю сонные артерии, имеющие примерно одинаковый диаметр. Это место называется бифуркацией общей сонной артерии. Небольшое расширение у начала наружной сонной артерии — сонный синус, sinus caroticus.
В области бифуркации общей сонной артерии располагается небольшое тело длиной 2,5 мм и толщиной 1,5 мм — сонный гломус,
glomus caroticum
(каротидная железа, межсонный клубочек), содержащий густую капиллярную сеть и много нервных окончаний (хеморецепторов).
Наружная сонная артерия, a.
carotis externa, является одной из двух конечных ветвей общей сонной артерии. Она отделяется от общей сонной артерии в пределах сонного треугольника на уровне верхнего края щитовидного хряща. Вначале она расположена медиальнее внутренней сонной артерии, а затем — латеральнее ее. Начальная часть наружной сонной артерии снаружи покрыта грудино-ключично-сосцевидной мышцей, а в области сонного треугольника — поверхностной пластинкой шейной фасции и подкожной мышцей шеи.
Находясь кнутри от шило-подъязычной мышцы и заднего брюшка двубрюшной мышцы, наружная сонная артерия на уровне шейки нижней челюсти (в толще околоушной железы) делится на свои конечные ветви — поверхностную височную и верхнечелюстную артерии. На своем пути наружная сонная артерия отдает ряд ветвей, которые отходят от нее по нескольким направлениям.
Переднюю группу ветвей составляют верхняя щитовидная, язычная и лицевая артерии. В состав задней группы входят грудино-ключично-сосце-видная, затылочная и задняя ушная артерии.
Медиально направляется восходящая глоточная артерия.
Передние ветви наружной сонной артерии
Верхняя щитовидная артерия,а. thyreoidea superior,
Язычная артерия,a. lingualis,
Лицевая артерия,a. facidlis,
Задние ветви наружной сонной артерии:
1. Затылочная артерия,a.
occipitdlis
2. Задняя ушная артерия,a. auriculdris posterior
Медиальная ветвь наружной сонной артерии — восходящая глоточная артерия, a.
pharyngea ascendens. Это относительно тонкий сосуд, отходит от внутренней полуокружности наружной сонной артерии у ее начала, поднимается вверх к боковой стенке глотки.
От восходящей глоточной артерии отходят: 1) глоточные ветви, rr. pharyngedles,
к мышцам глотки и к глубоким мышцам шеи; 2)
задняя менингеальная артерия, a. meningea posterior,
следует в полость черепа через яремное отверстие; 3)
нижняя барабанная артерир, a.
tympdnica inferior, через нижнее отверстие барабанногскканальца проникает в барабанную полость.
Конечные ветви наружной сонной артерии
Поверхностная височная артерия,a. tempordlis superficid-lis,
Верхнечелюстная артерия,a. maxilldris,
Эндоваскулярные вмешательства
Позволяют резко уменьшить объем операционной травмы, сократить сроки госпитализации и уменьшить неизбежные страдания пациента, связанные с хирургическими доступами. Одним из основных недостатков метода, является необходимость повторных вмешательств.
Виды эндоваскулярных операций при аневризме аорты:
- имплантация стент-графта в брюшной отдел аорты,
- имплантация стент-графта в восходящий (грудной) отдел аорты.
Наиболее современным методом лечения аневризмы аорты является гибридный метод, позволяющий достичь оптимальных результатов лечения при наименьшей операционной травме.
Гибридные операции сочетают в себе преимущества открытых и эндоваскулярных вмешательств.
Для профилактики развития аневризм аорты наиболее важным является необходимость контроля факторов риска, а именно — артериальной гипертензии. Кроме артериальной гипертензии,наиболее значимыми факторами риска являются возраст (старше 55 лет), мужской пол, курение, наличие аневризм у прямых родственников, повышенный уровень холестерина.
Функции
На аорту сердца возложена огромная роль. Являясь началом и главной магистралью большого круга кровообращения, она доставляет кровь ко всем органам грудной клетки, брюшной полости и малого таза. Из ее дуги берут начало сосуды, снабжающие кровью голову и верхние конечности, а из брюшной части аорты кровь попадает в нижние конечности. Из этого следует сделать вывод о том, что посредством аорты сердца кровоснабжаются почти все органы и ткани человеческого тела.
До того места, где начинается бифуркация аорты, от нее отходят артерии ко всем жизненно важным органам:
- в грудной полости — к сердцу и расположенным вокруг тканям;
- в брюшной полости от инфраренального отдела брюшной аорты — к органам ЖКТ, мочевыделения;
- в брюшной полости от интраренального отдела сосуда — к органам половой системы.
Завершает брюшную часть аорты раздвоение, то есть бифуркация аорты, на подвздошную левую и правую артерии, по которым кровь поступает в нижние конечности.
Помимо питания тканей сосуд принимает участие в регуляции артериального давления. Механизм растяжения и расслабления стенок он препятствует возникновению большого разрыва между показателями АД в систоле и диастоле.