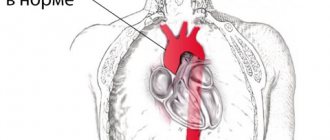
Она ветвится как дерево, вначале — на крупные ветви (стволы), затем на более мелкие ветви и веточки, и условно делится на несколько частей или отделов:
- 1. Восходящий отдел аорты — это участок от аортального клапана до плече-головного ствола.
- 2. Дуга аорты представляет собой короткий отдел, от которого отходят все сосуды, питающие руки и голову (плече-головные артерии). Они анатомически образуют дугу, соединяющую восходящий и нисходящий отделы аорты.
- 3. Нисходящий (грудной) отдел аорты начинается от устья левой подключичной артерии и продолжается до диафрагмы.
- 4. Ниже диафрагмы и до раздвоения аорты (бифуркации) располагается брюшной отдел аорты.
Деление аорты на отделы очень важно для оценки риска и выбора оптимальной тактики лечения у пациентов с аневризмами аорты.
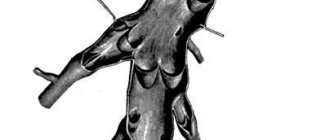
Аневризмой аорты называют участок её локального расширения.
Что такое аневризма
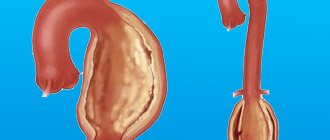
Аневризма грудной части аорты – аномальная выпуклость на стенках артерии, сформированная вследствие интенсивного давления крови на слабый участок сосуда. Аневризма может быть:
- веретенообразной – имеет выпуклую форму, выпячивается с обоих сторон аорты;
- мешковидной – образование округлой формы, выпячивается с одной стороны сосуда.
Аневризма небольшого размера не представляет угрозы для здоровья. Однако при ее наличии нужно обязательно наблюдаться у врача, чтобы не упустить момент прогрессирования заболевания.
Классификация заболевания
Патология делится на 3 типа в зависимости от протяженности и локализации:
- В восходящей части аорты с продвижением по дуге. Встречается в 50% от общего количества зафиксированных случаев заболевания.
- В восходящей части аорты. Диагностируется в 35% случаев.
- В нисходящей части аорты с продвижением вниз\вверх по дуге. Встречается в 15% случаев.
Растяжение сосуда происходит быстро – на это не требуются недели. Процесс можно сравнить с надуванием воздушного шара, который при наполнении воздухом увеличивается в несколько раз.
В зависимости от давности процесса аневризма бывает:
- острой – с момента образования расслоения аорты произошло 1-2 дня;
- подострой – дефект эндотелия появился 2-4 недели назад;
- хронической – аневризма образовалась 4 и более недель назад.
Некоторые пациенты игнорируют симптомы заболевания и годами не обращаются к врачу. Но то, что не происходит разрыв аневризмы грудной аорты – чистая случайность и удача. Это может произойти в любой момент, и в 90% случаев человека ждет летальный исход.
Симптомы патологии
Симптомы аневризмы грудной аорты отличаются в зависимости от локализации образования. В ряде случаев человек не чувствует никакого дискомфорта вообще, что значительно затрудняет своевременную диагностику заболевания.
Аневризма восходящего фрагмента аорты сопровождается:
- Острой болью в области сердца. Это связано с давлением поврежденного сосуда на близлежащие органы и ткани;
- Одышкой, значительно усиливающейся с течением времени. Человеку с аневризмой проблематично ходить пешком на длительные расстояния, подниматься по лестнице;
- Постоянное ощущение сердцебиения. Это одна из самых распространенных жалоб пациентов. Такое явление связано с давлением крови на ослабленные стенки сосуда;
- Головокружение. Может сопровождаться сильной головной болью, которая не устраняется таблетками;
- Отечность лица, верхней половины туловища. Данное явление связано с тем, что аневризма передавливает верхнюю полую вену.
Аневризма дуги аорты характеризуется такими признаками:
- Проблемы с глотанием. Вздутый участок сосуда давит на пищевод;
- Сиплый голос, периодическое покашливание. Основная причина недомогания – давление аневризмы на возвратный нерв;
- Повышенное слюноотделение. Возникает вследствие давления поврежденной аорты на блуждающий нерв;
- Проблемы с дыханием, одышка. Проявляется в случае давления аневризмы на трахею и бронхи;
- Односторонняя пневмония. Аневризма может давить на корень легкого, что мешает его нормальной вентиляции. При попадании в организм инфекции в 94% случаев данное состояние перерастает в одностороннее воспаление легких.
Аневризма нисходящей части аорты сопровождается:
- Боли непонятной природы в левой руке, острый болевой синдром в области лопатки;
- Парез, паралич. Возникает вследствие давления аневризмы на межреберные артерии, что нарушает поступление кислорода в спинной мозг;
- Смещение позвонков, если аневризма у пациента находится в хроническом состоянии;
- Болевые ощущения в боку, грудине, по характеру напоминающие боли при радикулите\невралгии.
Признаки и симптомы разрыва аневризмы:
- Внезапная, интенсивная и стойкая боль в животе, груди или спине
- Боль, которая отдает в спину или ноги
- Потливость
- Липкий пот
- Головокружение
- Низкое артериальное давление
- Учащение пульса
- Потеря сознания
- Одышка
- Слабость или паралич одной стороны тела, затруднение речи или другие признаки инсульта.
Лечением таких состояний занимается неотложная кардиология.
Еще одним осложнением аневризм аорты является риск образования тромбов. Небольшие тромбы могут развиваться в области аневризмы аорты. Если тромб отрывается от внутренней стенки аневризмы и закупоривает кровеносный сосуд в другой части тела. Это вызывает боль или блокирует поступление крови к органам и тканям, вызывая ишемию нижних конечностей, головного мозга, органов брюшной полости.
Причины развития
Такое заболевание, как аневризма грудной аорты, развивается вследствие:
- Атеросклероза. Именно эта патология в 90% случаев является причиной образования аневризма;
- Травматического повреждения сосуда. Происходит чаще всего вследствие ДТП, падения с большой высоты, сильного удара в грудную клетку.
- Врожденных патологий. В случае, когда у пациента имеется системное заболевание соединительной ткани, стенки сосудов находятся в хронически воспаленном состоянии.
- Осложнений после лечебных манипуляций. К ним относятся реконструктивные операции на аорте, катетеризация сердца и другие вмешательства в сердечно-сосудистую систему.
- Инфекционных заболеваний. Аневризма может развиться у пациентов с туберкулезом, сепсисом, сифилисом, остеомиелитом, перикардитом.
Ранее патология диагностировалась преимущественно у пациентов, старше 50 лет. Однако с каждым годом заболевание молодеет. Уже сегодня к врачам нередко обращаются молодые люди в возрасте 25-30 лет, у которых в ходе обследования обнаруживается аневризма грудного отдела.
Виды открытых хирургических операций при аневризмах аорты:
- Операция Бенталла-Де-Боно (протезирование восходящего отдела аорты клапансодержащим кондуитом с механическим протезом аортального клапана);
- Операция Дэвида (протезирование восходящего отдела аорты с сохранением собственного аортального клапана);
- Супракоронарное протезирование аорты;
- Протезирование восходящего отдела аорты и её дуги (техника Борста, использование косого агрессивного анастомоза и другие методики);
- Протезирование грудного отдела аорты;
- Протезирование брюшного отдела аорты.
Факторы риска
Патология имеет ряд факторов риска, при наличии которых вероятность ее развития значительно увеличивается:
- Мужской пол. По статистике, аневризму грудного отдела диагностируют в 14 раз чаще у мужчин, нежели у женщин.
- Курение. Специалисты Московского областного научно-исследовательского института провели массовую скрининговую диагностику пациентов с атеросклерозом и аневризмой. Выяснилось, что 3\4 больных имели стаж курения более 25 лет.
- Возраст старше 55 лет. В этот период стенки сосудов прекращают вырабатывать коллаген и эластин, вследствие чего истончаются.
- Наследственная предрасположенность. У 14% пациентов с расслоением аорты грудного отдела есть аналогичная патология у близких родственников.
- Недостаточная физическая активность. Малоподвижный образ жизни провоцирует застой крови в конечностях, оказывает серьезную нагрузку на сердечно-сосудистую систему.
- Ожирение. Избыточная масса тела отрицательно сказывается на работе сердца и проходимости сосудов.
- Повышенный уровень холестерина в крови. Ученые давно доказали, что организму человека для должного функционирования вовсе не нужен холестерин, поступающий извне – печень вырабатывает его в достаточном количестве.
Выводы
Создание aortic team в отдельном центре позволило получить хороший воспроизводимый результат лечения больных с различной патологией восходящей аорты. Объем хирургической коррекции при патологии восходящей аорты сам по себе не является значимым фактором риска. Дальнейшее совершенствование лечения данной патологии связано с научными разработками на стыке различных клинических и медико-биологических специальностей (хирургия, радиология, молекулярная биология и генетика). Актуальной задачей является создание единого регистра пациентов с заболеваниями аорты. Выявление новых информативных биохимических маркеров может повлиять на сроки и объемы операции у пациентов данного профиля.
Конфликт интересов отсутствует.
Потенциальные осложнения
Наиболее распространенное осложнение заболевания – разрыв аневризмы грудной аорты. В этом случае кровь свободно изливается в грудную, брюшную полость, перикард, пищевод. Данное состояние требует экстренной госпитализации и оперативного вмешательства. Разорванная аневризма в грудной части аорты без оказания медицинской помощи неизменно приведет к смерти пациента.
Другими осложнениями патологии являются:
- Компрессия, эрозия прилегающих структур;
- Тромбоэмболия;
- Окклюзия коронарной артерии.
Данные состояния являются смертельно опасными. Сама по себе аневризма является благоприятной средой для образования тромбов, которые под давлением кровеносного русла в любой момент могут оторваться. В случае попадания сгустка крови в легкие, сердце или мозг вероятность смерти пациента – более 90%. Именно поэтому так важно при первых же симптомах заболевания обратиться к врачу, который проведет диагностику и подберет корректную тактику лечения.
Диагностика
Первое, что нужно сделать пациенту – записаться на прием к терапевту. Он проведет осмотр, соберет анамнез и выдаст направление к узкому специалисту.
В 50% случаев патология обнаруживается случайно в ходе проведения рентгенологического исследования легких. В 70% случаев аневризма прослушивается фонендоскопом и проявляется в виде характерных шумов. Также проблема может быть выявлена в ходе проведения ультразвукового исследования сердца.
Специфическими методами диагностики аневризмы являются:
- магнитно-резонансная томография;
- компьютерная томография;
- ангиография.
На основе данных, полученных в ходе обследования, врач принимает решение о наиболее подходящем способе лечения.
Хирургическое лечение
Заключается в удалении поврежденного участка аневризмы и его замены искусственным кровеносным сосудом – протезом аорты. Он устанавливается навсегда. Реабилитационный период после операции колеблется от 7 дней до 1 месяца в зависимости от возраста пациента, наличия сопутствующих заболеваний.
Важно понимать, что протезирование аорты не дает гарантии повторного появления аневризмы на другом участке сосуда. Поэтому необходимо строго следовать рекомендациям врача касательно питания, образа жизни.
Основными показаниями к хирургическому лечению аневризмы являются:
- Крупный размер. Среднестатистический показатель – более 5,5 см в диаметре. Однако здесь все зависит от изначального диаметра аорты. Если у пациента в норме он 3-3,5см, то операция показана в случае образования аневризмы более 6,5-7см;
- Быстрый рост – поврежденный участок сосуда расширяется более, чем на 0,5см ежегодно;
- Аневризма провоцирует компрессию бронхов, образование аортопищеводного\аортобронхиального свища;
- Растяжение сосуда возникло вследствие травматического повреждения.
Разрыв аневризмы брюшной аорты
Экстренные хирургические вмешательства у больных с разрывом АБА представляют собой сложную проблему. Они сопровождаются высокой летальностью и большим количеством осложнений. В то же время отказ от операции равносилен вынесению пациенту смертного приговора.
Исходя из отмеченного выше, для хирургического вмешательства при разорвавшейся аневризме альтернативы не существует. Однако хирургическую активность при данной патологии нельзя расширить беспредельно, поскольку в ряде случаев операция заведомо обречена на неудачу. В связи с этим хирург должен тщательно оценить ситуацию, чтобы, с одной стороны, не сделать напрасной операции, а с другой — не лишить больного последнего шанса на спасение.
Следует иметь в виду 5 факторов риска, ассоциированных с летальностью: возраст старше 76 лет, признаки ишемии миокарда, показатели гемоглобина < 90г/л, креатинина > 190ммоль/л и отсутствие сознания при поступлении в больницу.
Естественно, что аневризма брюшного отдела аорты никогда не бывает изолированным проявлением общего атеросклероза. Практически у каждого больного имеется ишемическая болезнь сердца, у многих атеросклеротическое поражение мозговых сосудов. Все это существенно отягощает состояние больных, в особенности, если в анамнезе имеются инфаркт миокарда или нарушение мозгового кровообращения. Вместе с тем, указанные обстоятельства не делают прогноз абсолютно безнадежным. Тем не менее, наличие у больного свежего инфаркта миокарда или острого нарушения мозгового кровообращения полностью исключает возможность оперативного лечения разрыва АБА.
Нарушение функции мочевыделения у данного контингента больных является плохим прогностическим признаком, так как даже при нормальном исходном диурезе после аневризмэктомии часто развивается прогрессирующая почечная недостаточность, являющаяся во многих случаях причиной летального исхода. Борьба за жизнь больного с разрывом АБА должна начинаться с приемного отделения больницы. В идеале, здесь должны устанавливаться катетеры в центральную вену, в мочевой пузырь, определяться основные показатели гемостаза, группа крови, резус-фактор и т.д.
Целесообразно госпитализировать больного в палату интенсивной терапии, где наряду с продолжающейся подготовкой к операции выполняются УЗИ, при возможности, КТ. Кроме того, должна проводиться оценка функции сердца, легких и почек. На тот случай, когда немедленная операция по каким-либо случаям невозможна, существуют бескровные методы временной остановки кровотечения из разорванной аневризмы аорты. Успешно применяется пневматическая компрессия тела, позволяющая остановить кровотечение из аорты на период около 2-5 часов. Однако область ее использования ограничена временем транспортировки больного.
Операция по поводу разрыва аневризмы брюшной аорты относится к разряду таких хирургических вмешательств, при которых особое значение имеют быстрота и четкая последовательность манипуляций. Малейшая ошибка или отступление от оптимального для данной ситуации технического варианта операции может стоить больному жизни. Вот почему необходимо подробно остановиться на технических деталях вмешательства.
Оптимальный оперативный доступ при разрыве аневризмы брюшной аорты — срединная лапаротомия от мечевидного отростка грудины до лобка. Этот хирургический подход дает широкую экспозицию инфраренальной аорты и подвздошных артерий. Некоторые хирурги пользуются поперечной лапаротомией, производя горизонтальный разрез передней брюшной стенки на 3-4 см выше пупка. Однако этот доступ ограничивает зону оперативного действия, так как в условиях поперечной лапаротомии экспозиция подвздошных артерий достигается с большим трудом. Кроме того, поперечный доступ более травматичен и длителен по сравнению с вертикальным срединным. Что касается торакофренолюмботомии, которая позволяет широко мобилизовать аорту вместе с почечными артериями и висцеральными ветвями, то для вмешательства по поводу разрыва инфраренальной аневризмы в этом оперативном доступе просто нет необходимости. В ряде случаев при обширном объеме поражения и при необходимости реваскуляризации нижних конечностей требуется комбинированный подход: срединная лапаротомия и бедренный доступ (одно- или двусторонний).
После вскрытия брюшной полости первоначальной задачей хирурга является осуществление проксимального контроля брюшной аорты, т.е. прерывание кровотока в аорте выше аневризмы. Выделяют три уровня проксимального контроля брюшной аорты: инфраренальный, супраренальный, поддиафрагмальный.
Верхний полюс аневризмы брюшной аорты чаще всего располагается на 2 и более см, ниже отхождения почечных артерий. В связи с этим следует стремиться осуществить проксимальный контроль на инфраренальном уровне. Этот ответственный этап операции производят следующим образом. После вскрытия брюшной полости тонкий кишечник перемещают в правую половину раны или вообще выводят из брюшной полости, укутав его во влажное полотенце. Далее рассекают заднюю париетальную брюшину у корня брыжейки поперечной ободочной кишки, задний листок брыжейки и связку Трейтца. Двенадцатиперстную кишку смещают вправо, после чего пальцем выделяют инфраренальный участок аорты. В большинстве случаев это удается сравнительно легко, т.к. окружающие аорту ткани смещены в сторону парааортальной гематомой. Вслед за этим на выделенный участок накладывают зажим.
В ряде случаев существенной помехой для наложения инфраренального зажима является левая почечная вена. Когда в условиях парааортальной гематомы затруднен визуальный контроль, она может быть повреждена, вследствие чего возникает дополнительный источник кровотечения. Не следует тотчас пытаться отыскать дефект венозной стенки и зашивать его, т.к. это приводит к потере драгоценного времени. Необходимо осуществить гемостаз тампонадой кровоточащего участка и продолжить манипуляции на аорте. Если левая почечная вена оказывается непреодолимым препятствием для наложения на аорту инфраренального зажима, она может быть пересечена между зажимами вблизи устья, чтобы сохранить функционирующие коллатерали в воротах почки. После завершения операции на аорте нужно восстановить целостность пересеченной (или случайно поврежденной) почечной вены. В принципе, как крайний вариант, допустима и перевязка почечной вены, но это дополнительный фактор, который может усугубить и без того часто развивающуюся почечную недостаточность у оперированных больных.
Если возникли трудности с выделением инфраренальной аорты, можно воспользоваться эндоваскулярной окклюзией «шейки» аневризмы с помощью катетера Фолея, баллона — обтуратора типа Фогарти.
Следует сказать, что в случаях профузного кровотечения из разрыва аневризмы эндовоскулярный проксимальный контроль может оказаться спасительной мерой. Метод не лишен и недостатков. Не всегда достигается полноценная обтурация аорты, что обусловливает подтекание крови помимо баллона. Трудно точно определить, где расположен баллон: ниже, на уровне или выше почечных артерий. При внезапном повышении артериального давления обтуратор может быть смещен вниз струей крови и перестанет выполнять свою функцию. Наконец, баллонная обтурация, как и наружная компрессия — временная мера для экстренного гемостаза, после чего на инфрареналь-ную аорту должен быть наложен зажим.
Существенные трудности как для проксимального контроля, так и для наложения верхнего анастомоза возникают, если верхний полюс аневризмы расположен близко к почечным артериям. При этом допустимо наложение зажима на супраренальном уровне. Длительность супраренального пережатия аорты должна быть максимально сокращена, поэтому тотчас после наложения проксимального анастомоза аорты с протезом зажим должен быть перемещен ниже почечных артерий.
Поддиафрагмальный уровень проксимального контроля брюшной аорты показан в тех случаях, когда: состояние больного настолько критическое, что не остается времени для выделения «шейки» аневризмы; имеется обширная забрюшинная гематома, затрудняющая поиск и выделение ин-фраренальной аорты.
Методика поддиафрагмалъного пережатия аорты заключается в следующем. Сразу после вскрытия брюшной полости рассекают левую треугольную связку печени и левую ее долю отводят вправо. Вскрывают полость малого сальника, тупо выделяют аорту тотчас ниже отверстия в диафрагме и пережимают ее пальцами или зажимом (рис. 17.4). Поддиафрагмальное пережатие аорты сопровождается ишемией почек и всех брюшных органов, в связи с чем оно должно быть кратковременным. Оно необходимо только на период осуществления инфраренального (или супраренального) контроля, после чего тотчас должно быть устранено.
Таковы способы и уровни проксимального контроля брюшной аорты. Каждый из них имеет свои преимущества и недостатки, а также показания к применению. Более трех десятилетий прошло с того дня, когда Ch. Dubost (1951) выполнил первую операцию по поводу аневризмы брюшного отдела аорты. За истекший период времени техника операции претерпела существенные изменения, в связи с чем операция перестала в полной мере соответствовать термину «аневризмэктомия». В настоящее время общепризнано, что не следует удалять аневризматический мешок целиком, т.к. это чревато травмой спаянных с аневризмой органов, увеличивает кровопотерю и длительность операции, имеет следствием тяжелый послеопераци онный парез кишечника. В современном варианте объем операции включает в себя удаление содержимого аневризмы (атероматозные и тромботические массы), иссечение передней и частично боковых стенок аневризматического мешка, в связи с чем правильнее было бы назвать такое вмешательство «субтотальной аневризмэктомией». Тотальное удаление аневризмы допустимо при маленьких ее размерах, но такая возможность встречается редко, поскольку разрываются обычно крупные аневризмы.
Приступая к аневризмэктомии, необходимо одновременно решить вопрос о том, какое протезирование предпочесть: прямое или бифуркационное. В отличие от плановой операции, объем которой нередко включает реконструкцию почечных и других висцеральных сосудов, а также артерий нижних конечностей, при экстренной аневризмэктомии главная задача — спасение жизни больного. В связи с этим объем вмешательства следует по возможности не расширять. В частности, прямое протезирование аорты (трубчатый протез) предпочтительней бифуркационного. К сожалению, возможность прямого протезирования представляется далеко не всегда.
Как было отмечено выше, с целью сокращения времени выполнения операции и уменьшения ее травматичности полностью пересекать аорту в области «шейки» аневризмы не следует. Переднюю стенку аневризмы рассекают вертикальным разрезом, который у проксимального конца имеет Т-образную форму. Если предполагается прямое протезирование аорты, нижнему концу разреза придают такую же форму. Если аневризма вовлекает обе общие подвздошные артерии, разрез делают таким образом, чтобы появилась возможность вшить бифуркационный протез в малоизмененные участки подвздошных сосудов. После освобождения полости аневризмы от тромботических и атероматозных масс прошивают устья поясничных артерий для окончательного гемостаза. Далее приступают к наложению проксимального анастомоза аорты с протезом. Это — технически наиболее сложный этап протезирования, в особенности, если культя инфраренального отдела аорты короткая.
Анастомоз накладывают непрерывным обвивным швом. Необходимо отметить опасность прорезывания швов задней полуокружности анастомоза. Здесь отсутствует свободный край аорты и поэтому вкол иглы необходимо делать на глубину, вдвое превышающую толщину аортальной стенки. В том случае, если произошло прорезывание шва, целесообразно наложить несколько П-образных швов с синтетическими «прокладками», которые надежно фиксируют протез к стенке аорты. При необходимости между П-образными швами можно наложить обвивной шов. Аналогичным способом накладывают дистальный анастомоз, выполнение которого значительно легче в связи с лучшей экспозицией дистального отдела аорты. До завершения дистального аностомоза путем временного ослабления инфраренального зажима производят «смачивание» протеза кровью с последующим вымыванием сгустков с помощью шприца.
Весьма ответственен момент снятия с аорты зажимов. При этом возникает быстрое перераспределение крови и развиваются метаболические нарушения, т.е. синдром реваскуляризации (после более или менее длительного периода ишемии нижней половины тела). С целью профилактики возможных гемодинамических расстройств зажим с аорты надо снимать медленно под контролем системного артериального и центрального венозного давления.
После снятия зажимов необходимо убедиться в герметичности анастомозов. При подтекании крови из вколов иглы или между швами следует прижать к этому месту салфетку, смоченную спиртом, что чаще всего оказывается достаточным для осуществления гемостаза. Если этот прием не дал ожидаемого эффекта, необходимо наложить дополни тельные П-образные швы. Затем, с целью изоляции протеза от окружающих органов, поверх него сшивают оставшиеся участки стенки аневризматического мешка после частичного их иссечения.
Вопрос о дренировании брюшной полости и забрюшинного пространства должен быть решен в зависимости от конкретной ситуации. Если предвидится возможность капиллярного кровотечения из ложа аневризмы, следует поставить аспирационный (не присасывающийся) дренаж, если хирург уверен в достижении окончательного гемостаза — еобходимость дренирования отпадает.
Важно упомянуть еще об одном обстоятельстве. В период выделения аорты и наложения на нее зажимов может произойти эмболия подвздошных артерий и артерий нижних конечностей (тромбами, атеросклеротическими бляшками). Вот почему перед завершением дистального анастомоза необходимо проверить характер ретроградного кровотока из обеих подвздошных артерий, последовательно на короткое время снимая с них зажимы. Однако даже в этом случае, если ретроградный кровоток хороший, целесообразно провести ревизию артерий с помощью катетера Фогарти. После окончания сосудистого этапа операции необходимо осмотреть нижние конечности больного на предмет выявления признаков ишемии.
Бифуркационное аортоподвздошное протезирование показано при вовлечении в аневризму общих подвздошных артерий, а также тогда, когда их устья имеют выраженные атеросклеротические изменения. Так же, как и при прямом протезировании аорты, перед завершением дистальных анастомозов с подвздошными артериями необходимо произвести ревизию периферического артериального русла с помощью катетера Фогарти.
При распространенном атеросклерозе подвздошных артерий показано аортобедренное шунтирование, которое для экономии времени целесообразно выполнять двумя бригадами хирургов.
Особо следует остановиться на тех случаях, когда кровоток в нижней конечности восстановлен слабо или совсем не восстановлен. В этом можно легко убедиться по внешнему виду конечности, а также по результатам ультразвукового исследования. Расширять объем операции за счет бедренно-подколенного протезирования и прочих методов реваскуляризации нет смысла, т.к. у этой тяжелой по многим параметрам категории больных такое вмешательство окажется непереносимым. Учитывая это обстоятельство, при тяжелой ишемии, включающей мышечную контрактуру, логично выполнить первичную ампутацию конечности.
В последние годы в качестве альтернативы традиционному хирургическому лечению при разрыве АБА используется установка эндоваскулярного стента. В отличие от открытого хирургического вмешательства этот метод является значительно менее инвазивным. По немногочисленным данным литературы, установка стента уменьшает уровень смертности и количество послеоперационных осложнений. Однако для успешной установки эндоваскулярного стентового протеза в аневризму аорты необходимо, чтобы проксимальная «шейка» аорты не была бы короче 1,5 см и там не должно быть выраженной кальцификации. Перегиб аорты и тазовых сосудов делает установку стента более сложной.
Описан широкий спектр осложнений при имплантации эндоваскулярных стентов. По данным литературы, в 10 % случаев может произойти дистальная миграция стентового протеза. Другими осложнениями могут быть перекрытие стентом почечных артерий и окклюзия протеза (19 %).
Подводя итог сказанному, мы надеемся, что сведения, изложенные в настоящей главе, послужат делу улучшения хирургической помощи больным с разрывом аневризмы брюшной аорты.
Эндоваскулярное вмешательство
Если форма и расположение аневризмы не критичны, применяется методика эндопротезирования. Операция проходит следующим образом:
- на бедре пациента делается прокол, через который в аорту вводится проводник (узкая силиконовая трубка);
- через проводник в поврежденную аорту вводится сосудистый протез, который фиксируется к нормальным отделам сосуда выше и ниже места расположения аневризмы.
Вмешательство относится к категории малоинвазивных. Для его проведения не требуется полостной доступ, вследствие чего операция гораздо легче переносится пациентом. Реабилитационный период – 2-3 дня. В течение суток после операции больной находится под наблюдением врача.
Прогноз
В случае обнаружения аневризмы пациент нуждается в постоянном контроле со стороны врачей. Даже после операции необходимо регулярно обследоваться, чтобы следить за состоянием сосудов. Сегодня ни одно вмешательство не дает 100% гарантии того, что аневризма не появится вновь на другом участке аорты. Поэтому следует ответственно относиться к собственному здоровью и не пренебрегать регулярными визитами к специалисту.
Статистика по операциям на аневризме гласит, что смертность пациентов через полгода после хирургического вмешательства и проведения протезирования аорты составляет 10-15%. В течение 10 лет с момента операции данный показатель увеличивается до 40%. Это связано с тем, что у большинства пациентов имеются сопутствующие хронические заболевания.
В случае проведения эндоваскулярного вмешательства прогноз более благоприятный. Вероятность развития осложнений и повторного образования аневризмы составляет всего 10%, в то время как смерть пациента наступает лишь в 2% случаев.
Медицинское наблюдение
При небольших размерах аневризмы врач может рекомендовать медицинское наблюдение, который включает регулярное обследование, чтобы убедиться, что аневризма не увеличивается в размерах, а также лечение сопутствующих заболеваний, которые способствуют образованию или увеличению размера аневризмы.
Врач будет назначать вам регулярные обследования с целью определения размера аневризмы. После диагностирования аневризмы вам назначат эхокардиографию через 6 месяцев, а также повторные визуализационные обследования.
Если у вас высокое артериальное давление или есть бляшки в артериях, вполне вероятно, что ваш врач назначит препараты для снижения артериального давления и снижения риска развития осложнений аневризмы. К таким препаратам относятся:
- Бета-адреноблокаторы. Бета-блокаторы снижают артериальное давление, замедляя частоту сердечных сокращений.
- Блокаторы рецепторов ангиотензина II. Ваш врач может также назначить эти препараты, если бета-адреноблокаторы недостаточно снижают артериальное давление. Эти препараты рекомендованы лицам с синдромом Марфана, даже если у них не повышен уровень артериального давления.
- Статины. Эти препараты для лечения атеросклероза аорты позволяют снизить уровень холестерина, приводя к уменьшению отложения бляшек в артериях и снижению риска развития осложнений аневризмы.
Если вы курите или жуете табак, важно, чтобы вы отказались от этой вредной привычки. Употребление табака может ухудшить состояние аневризмы.
Профилактика
Специфических мер профилактики такой патологии, как аневризма грудной аорты, не существует. Врачи дают общие рекомендации:
- Полный отказ от курения, в том числе кальяна, электронных сигарет.
- Полный отказ от алкоголя (максимум, что допускается – 100г спиртного средней крепости на праздники).
- Регулярные занятия физкультурой. Однако физические нагрузки должны быть умеренными. Рекомендуется обратиться к реабилитологу и специалисту по ЛФК, которые подберут подходящие упражнения исходя из диагноза пациента, наличия сопутствующих заболеваний и текущего состояния здоровья.
- Контроль факторов, которые могут спровоцировать подъем артериального давления. К ним относятся стрессы, патологии почек, длительное пребывание на открытом воздухе в теплое время года.
- Контроль атеросклероза. Данная патология нуждается в лечении, ведь может привести к другим серьезным осложнениям помимо аневризмы.
- Незамедлительное обращение к врачу в случае малейших подозрений на сбои в работе сердечно-сосудистой системы, желудочно-кишечного тракта или легких. Необходимо реагировать на сигналы организма, чтобы предотвратить серьезные осложнения.
Если аневризма аорты уже имеется, профилактика заключается в предупреждении развития осложнений патологии:
- Прием антикоагулянтов, назначенных специалистом. Такие препараты стоят недешево, однако являются жизненно необходимыми. Именно они предотвращают образование тромбов в просвете аневризмы.
- Оптимальные физические нагрузки. В случае, когда пациент работает на должности, подразумевающей поднятие тяжестей или другой физический труд, необходимо задуматься о смене профессии. Чрезмерные усилия могут спровоцировать разрыв стенки аорты.
- Контроль гипертонии. Необходимо принимать все лекарства, назначенные врачом, чтобы избежать нарастания давления тока крови на истонченную стенку аневризмы. Больной должен осознавать, что она может разорваться в любой момент.
- Контроль за психологическим состоянием. В медицинской практике зафиксированы случаи, когда разрыв аорты был вызван незначительной стрессовой ситуацией.
Для того, чтобы контролировать состояние сердечно-сосудистой системы, необходимо ежегодно посещать кардиолога. И делать это не «для галочки», а проходить комплексное обследование. Так вы сможете обнаружить развивающиеся заболевания на ранних стадиях, что в разы увеличивает вероятность успешного излечения без разрезов и боли. Заботьтесь о своем здоровье!
Результаты
Наиболее часто выполняли операцию Бенталла—ДеБоно — 177 (39,1%), 2, 3 и 4-е места по частоте выполнения заняли сочетанная операция надкоронарного протезирования ВА и протезирования АК — 89 (19,6%), протезирование АК в сочетании с пластикой ВА — 67 (4,8%) и операция Дэвида I — 65 (14,3%). Реже выполняли операции надкоронарного протезирования ВА как изолированно, так и в сочетании с пластикой АК. В 6 (1,3%) случаях выполняли операцию «хобот слона», в том числе 1 операция «замороженный хобот слона» с применением гибридного устройства E-Vita Open Plus (рис. 1).
Рис. 1. Хирургические операции, использованные при лечении аневризм восходящей аорты (n=453). 1. Бенталл—ДеБоно — 177; 2. НП+ПАК — 89; 3. ПАК+плАо — 67; 4. Дэвид — 65; 5. Н.П. Ао — 33; 6. НП+плАК — 9; 7. плАо — 7; 8. «Хобот слона» — 6.
Наибольшей продолжительностью экстракорпорального кровообращения (ЭКК) и аноксии миокарда отличались операции Дэвида (рис. 2). В ближайшем послеоперационном периоде 13 (2,9%) больных перенесли рестернотомии в связи с кровотечением. У 4 (0,9%) больных в течение пребывания в стационаре потребовалось выполнение фенестрации и дренирования полости перикарда. У 11 (2,4%) больных интраоперационно и в раннем послеоперационном периоде наблюдались выраженные проявления сердечно-сосудистой недостаточности (ССН), в 6 случаях потребовавшие применения механической поддержки кровообращения (3 — внутриаортальный баллонный контрпульсатор, 3 — левожелудочковый обход). Осложнения ближайшего послеоперационного периода отражены на рис. 3. Госпитальная летальность составила 2,6% (12 пациентов). Причинами неблагоприятных исходов стали острая ССН (4 пациента), нарушения ритма сердца (2), острое нарушение мозгового кровообращения (ОНМК) (2), мультиорганная недостаточность (2) и неконтролируемое интраоперационное кровотечение (2) при исходном тяжелом инфекционном поражении структур ВоА. Строгой зависимости осложненного течения ближайшего послеоперационного периода от объема хирургической коррекции не выявлено.
Рис. 2. Параметры экстракорпорального кровообращения.
Рис. 3. Осложнения ближайшего послеоперационного периода.
С 1 января 2006 г. по 1 октября 2015 г. нами были выполнены 68 операций клапансберегающего протезирования корня аорты по методике Дэвида I при аневризмах и расслоениях корня аорты. Из 47 пациентов 69% составили мужчины, 4 (5,9%) больных оперированы на фоне расслоения ВоА. Госпитальная летальность составила 2 (2,9%) больных, причины: острая ССН — 1 и фатальное ОНМК — 1. В ближайшем послеоперационном периоде 7 пациентов перенесли рестернотомии по поводу кровотечений. При оценке степени аортальной недостаточности (АН) в ближайшем послеоперационном периоде у подавляющего большинства больных наблюдалась регургитация 0—I степени; тяжелой АН выявлено не было. В отдаленном послеоперационном периоде в группе больных, которым выполнялись операции Дэвида с применением протеза корня аорты Valsalva, АН более I степени выявлено не было; в группе пациентов с линейными протезами аорты в 76% случаев наблюдалась АН 0—I степени, в 16% — АН II степени и в 8% — выраженная А.Н. Из последней подгруппы 3 пациента были реоперированы (выполнено протезирование АК), 2 находятся под усиленным наблюдением. При изучении предикторов рецидива АН в отдаленном послеоперационном периоде мы выделили такие факторы, как исходный диаметр фиброзного кольца (ФК) АК (коэффициент корреляции со степенью АН в отдаленном послеоперационном периоде r
=0,55), положение точки коаптации створок АК (
r
=–0,778), а также наличие асимметричного пролапса створок АК (
r
=0,818).