Лечение хронической сердечной недостаточности
М.Ю.СИТНИКОВА
, д.м.н., профессор,
Т.А.ЛЕЛЯВИНА
, Федеральный центр сердца, крови и эндокринологии им. В.А.Алмазова, С.-Петербург
Основными целями лечения пациентов с сердечной недостаточностью (СН) являются облегчение симптомов, предотвращение госпитализации и преждевременной смерти [1, 2]. Основными принципами медикаментозной терапии СН являются как можно более раннее с момента развития дисфункции миокарда начало лечения и его пожизненное продолжение.
Главные задачи лечения хронической сердечной недостаточности (ХСН): устранение симптомов заболевания — одышки, сердцебиения, повышенной утомляемости, задержки жидкости в организме; защита от поражения органов-мишеней (сердце, почки, мозг, сосуды, скелетная мускулатура); улучшение качества жизни пациента; уменьшение количества госпитализаций; улучшение прогноза (продление жизни) [2]. Реализация этих задач в значительной степени обеспечивается за счет назначения лекарственных препаратов, способствующих снижению пред- и постнагрузки на миокард путем воздействия на нейрогормональные механизмы патогенеза ХСН; нормализацию водно-солевого баланса; повышение сократимости миокарда.
Появление в клинической практике в середине 1970-х гг. ингибиторов ангиотензинпревращающего фермента (иАПФ) стало большим достижением в лечении сердечно-сосудистых заболеваний. В ряде исследований показана [3—5] эффективность иАПФ в снижении нейрогормональной активации.
Ингибируя ангиотензинпревращающий фермент и снижая образование ангиотензина (АТ) II, эти препараты противодействуют ренин-ангиотензиновой системе. Гемодинамические эффекты иАПФ обусловлены вазодилатацией с последующим снижением артериального давления (АД).
Вазодилатирующий, диуретический и натрийуретический эффекты иАПФ увеличиваются в связи с блокадой разрушения брадикинина. Назначение препаратов данной группы способствует предотвращению развития гипертрофии левого желудочка и фиброза миокарда или даже вызывает их инверсию [3—5].
Эффекты иАПФ начинают проявляться через 3–4 недели лечения: развивается дилатация артериол, снижается общее периферическое сопротивление сосудов и АД, улучшается функция почек, увеличивается диурез, повышается кровоток в работающих мышцах. Показано, что ингибиторы АПФ улучшают функциональный класс у пациентов с сердечной недостаточностью, увеличивая толерантность к нагрузке и уменьшая такие клинические симптомы, как одышка, слабость и отеки [3—5]. Положительными свойствами применения этих препаратов является возможность снижения дозы диуретиков, пролонгирование действия сердечных гликозидов.
Основными принципами медикаментозной терапии сердечной недостаточности являются как можно более раннее с момента развития дисфункции миокарда начало лечения и его пожизненное продолжение
Применение иАПФ после инфаркта миокарда значительно уменьшает выраженность ремоделирования миокарда. Применение иАПФ эффективно у больных с любой стадией ХСН, включая бессимптомную дисфункцию левого желудочка и сердечную недостаточность при сохраненной систолической функции сердца. Но чем раньше начато лечение, тем больше шансов продлить жизнь больному с ХСН. В таблице 1 представлены лекарственные средства данной группы, рекомендованные для лечения больных ХСН [2].
Применение иАПФ после инфаркта миокарда значительно уменьшает выраженность ремоделирования миокарда. Противопоказаниями к назначению иАПФ являются текущая симптомная гипотензия, выраженный стеноз аортального клапана и двусторонний стеноз почечной артерии
Противопоказаниями к назначению иАПФ являются текущая симптомная гипотензия, выраженный стеноз аортального клапана и двусторонний стеноз почечной артерии. Терапию иАПФ начинают с низких доз (табл. 1) и постепенно увеличивают до дозы, эффективность которой доказана клиническими испытаниями. После каждого увеличения дозы необходимо оценивать уровень артериального давления пациента, а также содержание в крови калия и креатинина. Наличие у больного начальных проявлений дисфункции почек не являются противопоказаниями для назначения иАПФ, но требуют более частого контроля показателей биохимического анализа крови. Примерно у 15% больных, получающих лечение иАПФ, возникает сухой кашель и, если он причиняет беспокойство (число таких случаев не превышает 3%), рекомендуется заменить иАПФ на антагонисты рецепторов к ангиотензину II (АРА). При развитии ангионевротического отека прием иАПФ следует прекратить или заменить иАПФ на АРА.
До недавнего времени бета-адреноблокаторы были противопоказанны больным ХСН, так как считалось, что они снижают сократимость миокарда. Однако исследования последних лет показали, что терапия бета-адреноблокаторами способствует умеренному в пределах 3—4% снижению фракции выброса левого желудочка (ФВлж) лишь в первые 10—14 дней лечения [6, 7]. Механизмы действия бета-адреноблокаторов заключаются в уменьшении частоты сердечных сокращений (ЧСС), блокировании процессов ремоделирования сердца и улучшении диастолической функции левого желудочка, уменьшении электрической нестабильности миокарда; уменьшении гипоксии миокарда и восстановлении чувствительности бета-адренорецепторов [6, 7].
На фоне длительной терапии бета-адреноблокаторами, к примеру карведилолом (акридилолом), проявляется их уникальное гемодинамическое действие — увеличение насосной функции сердца при уменьшении ЧСС. В плацебо-контролируемых исследованиях MERIT-HF и CIBIS-II [5] показано, что назначение метопролола гемисукцината с модифицированным высвобождением и бисопролола на фоне приема иАПФ и диуретиков способствовало снижению общей и сердечно-сосудистой летальности.
Результаты этих исследований позволяют рекомендовать для лечения ХСН бета-блокаторы: акридилол — с 3,125 мг два раза в сутки, бисопролол — 1,25 мг один раз в сутки, метопролола сукцинат CR|XL — 12,5 мг один раз в сутки, небиволол – 1,25 мг в сутки (табл. 2). При отсутствии выраженной гипотонии или брадикардии, задержки жидкости, нарастания симптомов ХСН дозы препаратов рекомендуется удваивать каждые 2-4 недели. Эффекты бета-адреноблокаторов проявляются спустя 2-3 месяца после начала лечения. Следует помнить, что бета-адреноблокаторы назначают лишь на фоне обязательного приема иАПФ. Бета-адреноблокаторы, рекомендованные для лечения больных ХСН, представлены в таблице 2 [2]. Выбор конкретного препарата во многом определяется сопутствующей патологией. Так, при ХОБЛ более безопасно применение небиволола [20], а при наличии перемежающей хромоты – карведилола.
Бета-адреноблокаторы при хронической сердечной недостаточности назначают лишь на фоне обязательного приема иАПФ
Антагонисты рецепторов к ангиотензину II блокируют связывание ангиотензина II (АII) cо специфическим рецептором. Тот факт, что АII синтезируется в некоторых органах и тканях не только с участием АПФ, но и с помощью других ферментов (химазный путь обеспечивает образование 80% АII в миокарде), обосновывает необходимость использования лекарственных средств, подавляющих активность АII независимо от пути его синтеза. Такими препаратами являются антагонисты рецепторов к ангиотензину II (АРА). Посредством воздействия на специфические рецепторы (АТ1) осуществляются основные потенциально негативные эффекты ангиотензина II, которые заключаются в вазоконстрикции, стимуляции синтеза и секреции альдостерона, задержке натрия и жидкости, увеличении объема циркулирующей крови, высвобождении катехоламинов из мозгового слоя надпочечников, усилении фиброза миокарда, пролиферации гладкомышечных и эндотелиальных клеток, фибробластов сосудистой стенки и т.д. АРА не ингибируют кининазу II и распад брадикинина, поэтому крайне редко (не более чем у 1% больных) вызывают кашель или ангионевротический отек.
Многими исследователями показано, что длительное применение АРА способствует уменьшению гипертрофии левого желудочка, улучшению диастолической функции миокарда [8—10]. Назначение комбинации АРА с диуретиком, например препарата лозап, в качестве единственного блокирующего агента РААС дополнительно к дигоксину способствует развитию тех же положительных эффектов, что и у иАПФ, и может замещать эту группу препаратов у больных, у которых на фоне применения иАПФ возникает кашель или ангионевротический отек [9—10]. Прием АРА в клинически эффективных дозах может вызвать неблагоприятные эффекты, такие как гипотензия, дисфункция почек и гиперкалиемия так же часто, как и прием иАПФ. Как и в случае с иАПФ, рекомендуется постепенное достижение целевых доз АРА, польза которых была подтверждена клиническими испытаниями. АРА, рекомендованные для лечения больных ХСН, представлены в таблице 3.
Показано, что длительное применение АРА способствует уменьшению гипертрофии левого желудочка, улучшению диастолической функции миокарда
Антагонисты альдостерона блокируют нежелательные действия альдостерона, описанные ранее, и действуют как калийсберегающие диуретики. Прием антагониста альдостерона спиронолактона способствует уменьшению выраженности симптомов ХСН, снижению количества госпитализаций и улучшению выживаемости при добавлении к иАПФ (и диуретикам и дигоксину) у пациентов со сниженной фракцией выброса левого желудочка (ФВлж) и СН III – IV ФК [11]. Терапия эплереноном, другим антагонистом альдостерона, снижает смертность и заболеваемость при добавлении и к иАПФ, и бета-блокаторам у пациентов со сниженной ФВлж и диабетом после перенесенного инфаркта миокарда. Следовательно, следует рассматривать возможность применения антагониста альдостерона у пациентов с СН III-IV ФК по классификации Нью-Йоркской ассоциации кардиологов в добавление к диуретикам, иАПФ (или АРА) и бета-блокаторам.
Лечение антагонистом альдостерона следует начинать с малой дозы (табл. 4) при тщательном контроле содержания калия и креатинина в сыворотке крови. Гиперкалиемия – наиболее опасный неблагоприятный эффект терапии антагонистами альдостерона (как и в случае с иАПФ и АРА). Антагонисты альдостерона не рекомендуется назначать пациентам с нарушением функции почек, в частности при концентрации креатинина в сыворотке >221ммоль/л (>2,5 мг/дл) и калия в сыворотке >5ммоль/л. Спиронолактон может оказывать антиандрогенное действие, в частности вызывать болезненную гинекомастию у мужчин. У таких больных разумной заменой спиронолактона является эплеренон, поскольку он не блокирует андрогеновые рецепторы [12]. Антагонисты альдостерона, рекомендованные для лечения больных ХСН, представлены в таблице 4.
Лечение антагонистом альдостерона следует начинать с малой дозы при тщательном контроле содержания калия и креатинина в сыворотке крови
Важнейшей группой препаратов в терапии ХСН являются диуретики, а их рациональная комбинация и гибкость дозирования – залог успешной терапии больного с тяжелой сердечной недостаточностью. Различают два основных типа мочегонных средств – салуретики и акваретики. Салуретики уменьшают реабсорбцию натрия и других электролитов в канальцах нефрона, что способствует повышению выделения этих веществ с мочой, а вместе с электролитами выводится и вода. Акваретики уменьшают проницаемость канальцев для воды, снижая ее реабсобцию и увеличивая экскрецию свободной воды и вместе с ней электролитов. Хотя, по данным крупных исследований, не доказано, что диуретики снижают уровень заболеваемости и смертности, они показаны почти всем пациентам с симптоматической сердечной недостаточностью для облегчения диспноэ и признаков задержки натрия и воды [13, 14].
Большинство современных диуретиков (за исключением этакриновой кислоты) являются дериватами сульфаниламидов. Различие в действии диуретиков, прежде всего, зависит от локализации их действия в нефроне. Например, ацетазоламид действует в области проксимальных канальцев и тормозит действие фермента карбоангидразы. При метаболическом алкалозе действие ингибиторов карбоангидразы усиливается и сопровождается активацией ионообмена натрия на водород, блокадой реабсорбции натрия и диурезом. В остальных случаях (при отсутствии алкалоза) диуретическое действие диакарба весьма слабое.
Тиазидные диуретики (гидрохлоротиазид, индапамид) действуют на кортикальный сегмент петли Генле и области дистальных канальцев, блокируя активность натриево-хлорного транспортера. На реабсорбцию натрия и, следовательно, диурез они оказывают умеренное действие, которое наблюдается при нормальной функции почек (при клиренсе креатинина больше 30 мл/мин).
Наиболее мощными являются петлевые диуретики (фуросемид, этакриновая кислота, буметанид), блокирующие активность специального переносчика натрия в клетках канальцев на протяжении всего восходящего сегмента петли Генле. Эти препараты оказывают сильное диуретическое действие, которое сохраняется даже при сниженной функции почек (при клиренсе креатинина не ниже 5 мл/мин).
Если пациенту с сердечной недостаточностью однажды потребовался диуретик, то применение этой группы препаратов, как правило, необходимо в течение всей жизни, хотя доза и тип препарата могут различаться. Основной принцип лечения мочегонными препаратами состоит в том, чтобы назначить минимальную дозу диуретика, необходимую для поддержания состояния без отека («сухой вес»).
Чрезмерное применение диуретических препаратов может привести к электролитному дисбалансу (гипонатриемии, гипокалиемии, гипохлоремии и гипомагнезиемии), гиперурикемии (с риском возникновения подагры) и снижению объема циркулирующей жидкости (с риском развития ортостатической гипотензии). При использовании мочегонных препаратов рекомендуется соблюдать несколько правил: назначать мочегонные в минимальных дозах в сочетании с иАПФ; не стремиться к форсированному диурезу; не назначать сразу сильнодействующие препараты.
При использовании мочегонных препаратов рекомендуется назначать их в минимальных дозах в сочетании с иАПФ; не стремиться к форсированному диурезу; не назначать сразу сильнодействующие препараты
При наличии отеков диурез не должен превышать количество потребляемой жидкости более чем на 800 мл. Целесообразным считается ежедневное применение подобранных мочегонных препаратов, позволяющих поддерживать стабильный диурез и массу тела больного. «Ударные» дозы мочегонных препаратов, применяемых 1 раз в несколько дней, тяжело переносятся больными и не рекомендуются. При рефрактерных отеках, обусловленных прогрессированием ХСН, а также снижением функции почек, гипотонией, диспротеинемией, дисбалансом электролитов, целесообразно сочетание высоких доз фуросемида, вводимого внутривенно (до 1000 мг/сут), тиазидного диуретика и спиронолактона (до 200 мг/сут).
В случае выраженной декомпенсации сердечной недостаточности, когда проводится активная терапия мочегонными препаратами, а пациент еще прикован к постели, целесообразно применение нефракционированного или фракционированных гепаринов (например, фраксипарина). Эта мера позволяет предупредить развитие ТЭЛА.
Сердечные гликозиды применяются при лечении ХСН с 1785 г., однако в последнее время были открыты неизвестные свойства этих препаратов. При применении дигоксина в малых дозах (0,25 мг/сут) у больных с синусовым ритмом он в основном оказывает нейромодулирующее действие, снижая активность симпатоадреналовой системы (САС) [15], тогда как инотропный эффект проявляется при назначении только больших доз. При фибрилляции предсердий дигоксин является препаратом выбора, так как за счет замедления атриовентрикулярного проведения достигается значительное снижение ЧСС. Это сопровождается снижением потребности миокарда в кислороде, несмотря на положительный инотропный эффект. Чем больше исходная частота ритма, тем более выражено положительное действие гликозидов. Больным с синусовым ритмом дигоксин назначают в малых дозах (до 0,25 мг/сут).
Концентрация дигоксина в плазме крови возрастает постепенно, достигая максимума к 8-му дню лечения, поэтому через 1 неделю терапии дигоксином целесообразно не только оценить ЭКГ, но и провести холтеровское мониторирование. Такой подход обеспечивает безопасное продолжение терапии сердечными гликозидами, поскольку позволяет не пропустить появление желудочковых нарушений ритма и нарушений атриовентрикулярного проведения. Учитывая невозможность оценки концентрации дигоксина в крови, мы считаем целесообразным применение этого препарата в режиме 5 дней в неделю (график КСВ — «кроме субботы и воскресенья»).
Заключение
Эффективность терапии больных ХСН ингибиторами ангиотензинпревращающего фермента, АРА, блокаторами бета-адренергических рецепторов, антагонистами альдостерона доказана результатами крупных рандомизированных исследований [3—12]. Тем не менее в реальной практике иАПФ назначают лишь 30—70% больным ХСН [16], целевые дозы иАПФ—10—20% [17], а антагонисты альдостерона—5—20% [18]. При назначении бета-адреноблокаторов акцент, к сожалению, делается на атенолол и пропранолол: врачи рекомендуют их более чем 95% больных, а например, широко исследованный при ХСН карведилол применяется редко [19]. Для повышения эффективности медикаментозной терапии больных с ХСН необходимо разработать новые подходы к организации длительного наблюдения и лечения в соответствии с международными и российскими стандартами.
Литература
1. Guidelines for diagnosis and treatment of Acute and Chronic heart failure. // EHJ.—2008. — V. 10 (1093). — P. 309. 2. Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. и др. Национальные рекомендации по диагностике и лечению ХСН (второй пересмотр). // Журнал Сердечная Недостаточность. — 2007. — Т. 8. №. 2. — С. 1—35. 3. Effects of enalapril on mortality in severe congestive heart failure. The CONSENSUS Trial Study Group. // N Engl J Med. – 1987. – V. 316 (23). – P. 1429—55. 4. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. The SOLVD Investigators // N. Engl. J. Med. – 1991. – V. 325. – P. 293–302. 5. Flather M.D., Yusuf S., K?ber L., et al. Long-term ACE-inhibitor therapy in patients with heart failure or left-ventricular dysfunction: a systematic overview of data from individual patients. ACE-Inhibitor Myocardial Infarction Collaborative Group. // Lancet. — 2000. – V. 355. – P. 1575–81. 6. Packer M., Bristow M.R., Cohn J.N., et al. The effect of carvedilol on morbidity and mortality in patient with chronic heart failure. // N. Engl. J. Med. – 1996. – V. 334 (21). – P. 1349—55. 7. CIBIS II Investigators and Committees. The cardiac insufficiency Bisoprolol Study II. // Lancet. – 1999. – V. 353(9146). – P. 9—13. 8. Granger C.B., McMurray J.J., Yusuf S., et al. CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial // Lancet.- 2003. – V. 362. – P. 772–6. 9. Maggioni A.P., Anand I., Gottlieb S.O., et al. Val-HeFT Investigators (Valsartan Heart Failure Trial). Effects of valsartan on morbidity and mortality in patients with heart failure not receiving angiotensin-converting enzyme inhibitors. // J. Am. Coll. Cardiol. — 2002. – V. 40. – V. 1414–21. 10. Cohn J.N., Tognoni G.; Valsartan Heart Failure Trial Investigators. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. // N. Engl. J. Med. — 2001. – V. 345. – V. 1667–75. 11. Pitt B., Zannard F., Remme W.J., et al. The effect of spironolacton on morbidity and mortality in patient with severe heart failure. // N. Engl. J. Med. – 1999. – V. 341 (10). – P. 709—717. 12. Pitt B., Remme W., Zannad F., et al. Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study Investigators. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. // N. Engl. J. Med. — 2003. – V. 348. – P. 1309–21. 13. Goebel J.A., Van Bakel A.B. Rational use of diuretics in acute decompensated heart failure. // Curr. Heart Fail. Rep. — 2008. – V. 5. — P.153–62. 14. Faris R., Flather M., Purcell H., et al. Current evidence supporting the role of diuretics in heart failure: a meta analysis of randomised controlled trials. // Int. J. Cardiol. – 2002. – V. 82. P. 149–58. 15. Hood W.B., Jr., Dans A.L., Guyatt G.H., et al. Digitalis for treatment of congestive heart failure in patients in sinus rhythm: a systematic review and meta-analysis. // J. Card. Fail. — 2004. – V. 10. P. 155–64. 16. Krum H., Tonkin A.M., Currie R., Djundjek R., Johnston C.I. Frequency, awareness and pharmacological management of chronic heart failure in Australian general practice. The Cardiac Awareness Survey and Evaluation (CASE) Study. // Med. J. — Aust 2001. — V. 174. – P. 439—444. 17. Rumsfeld J.M. Heart failure disease management works, but will it succeed? // Eur. Heart J. — 2004. — Vol. 25(18). — P. 1565—1567. 18. Gonseth J. The effectiveness of disease management programmes in reducing hospital readmission in older patient with heart failure: a systematic review and meta-analysis of published reports. // Eur. Heart J. — 2004. – V. 25 (18). — P. 1570—1595. 19. Cline C.M. A cost effective management programme for heart failure reduced hospitalization. // Heart. – 1998. – V. 80 (9). — P. 442—446.
Рисунки и таблицы см. в приложении
XII Конгресс «Сердечная недостаточность» – 2012: Стратегия назначения мочегонных препаратов
Мочегонные в контексте обязательной терапии
Отеки являются одним из распространенных симптомов внутренних болезней, особенно часто с ними приходится сталкиваться терапевтам, кардиологам и нефрологам. Как отметила заведующая кафедрой внутренних болезней Пермской государственной медицинской академии, д.м.н., профессор Н.А. КОЗИОЛОВА, возникают отеки вследствие нарушения одного или нескольких факторов коллоидно-осмотической теории Старлинга, определяющих обмен воды между капиллярами и тканями. К этим факторам относятся:
- Гидростатическое давление крови в капиллярах и величина тканевого сопротивления.
- Коллоидно-осмотическое давление плазмы крови и тканевой жидкости.
- Проницаемость капиллярной стенки.
Патогенетические механизмы образования отеков при сердечной недостаточности включают множество звеньев. Именно поэтому процесс устранения отечного синдрома должен быть многоэтапным. На первой стадии необходимо перевести жидкость из внеклеточного пространства в сосудистое русло. Для достижения этой цели используются препараты различных групп: диуретики, нейрогормональные модуляторы (ингибиторы ангиотензинпревращающего фермента, антагонисты рецепторов ангиотензина II) и ряд других. Следующим этапом устранения отечного синдрома является обеспечение доставки избыточной жидкости к почкам и ее фильтрации. С этой целью применяются препараты, усиливающие фильтрацию, – дигоксин при мерцательной аритмии, допамин при артериальной гипотонии и синусовом ритме, эуфиллин у пациентов с систолическим артериальным давлением (САД) выше 100 мм рт. ст.
На завершающей стадии лечения осуществляется блокировка реабсорбции в почечных канальцах. Тем самым обеспечивается выведение избыточной жидкости из организма. На этом этапе незаменимыми являются диуретики. Данные о влиянии диуретиков на жизненный прогноз больных, страдающих сердечной недостаточностью, противоречивы. Однако можно считать доказанным, что смертность и количество госпитализаций на фоне применения диуретиков растут лишь в тех случаях, когда пациентам одновременно с диуретиком не назначаются ингибиторы ангиотензинпревращающего фермента (АПФ) [1].
Существуют данные, указывающие на способность диуретиков благотворно влиять на прогноз. Так, согласно кокрановскому метаанализу, адекватная диуретическая терапия на 76% снижает относительный риск смерти и на 93% – прогрессирование хронической сердечной недостаточности (ХСН) [2]. Влияние диуретической терапии на жизненный прогноз пока четко не установлено, но выявлена способность этих препаратов улучшать клиническое состояние пациентов с отечным синдромом.
Отечный синдром широко распространен у пациентов с ХСН III–IV функционального класса (ФК) по классификации Нью-Йоркской ассоциации кардиологов (NYHA, New York Heart Association). ХСН IV ФК нередко встречается в старших возрастных группах: среди лиц в возрасте от 50 до 60 лет заболеваемость составляет 28 случаев на 1000 человек населения, в возрастной группе 60–70 лет – 51 случай. В возрасте 90 и более лет тяжелыми формами сердечной недостаточности, сопровождающейся отеками, страдает каждый 10-й человек.
В Европе для лечения пациентов с ХСН широко применяются диуретики, их используют, по разным данным, 70–80% пациентов с данным диагнозом, в то время как в нашей стране, согласно результатам исследования ЭПОХА-2002, диуретики назначаются только 24% больных ХСН. Как подчеркнула профессор Н.А. Козиолова, сложившуюся в российской клинической практике ситуацию необходимо изменить, поскольку периферические отеки являются симптомом, достоверно (p
Показательно отношение к диуретикам кардиологов – авторов американских и европейских рекомендаций. В рекомендациях, выпускаемых Американской коллегией кардиологов, в частности, указано, что «диуретики и ограничение соли показаны всем больным с имеющимися или впервые выявленными симптомами ХСН и сниженной фракцией выброса левого желудочка (ФВ ЛЖ) при наличии доказательств задержки жидкости». В рекомендациях Европейского общества кардиологов утверждается, что «диуретики могут быть использованы при необходимости для облегчения признаков и симптомов задержки жидкости независимо от ФВ ЛЖ, но не показаны для снижения риска госпитализаций и смерти». Указания на целесообразность диуретической терапии можно встретить также в документах Американского общества по борьбе с сердечной недостаточностью и Всероссийского научного общества кардиологов, причем рекомендации по диуретической терапии имеют высокий уровень доказательности – Ia. Авторы этих документов также подчеркивают, что диуретическая терапия должна быть непрерывной (за исключением отдельных случаев, когда удалось достичь значительного улучшения клинического статуса и функций сердца – тогда терапию можно прервать), назначение же ударных доз один раз в несколько дней может даже привести к ухудшению состояния.
Согласно американским и европейским рекомендациям, для стартовой диуретической терапии должны использоваться петлевые диуретики (фуросемид, торасемид). Если достичь необходимого эффекта при помощи петлевого диуретика не удается, следует прибегнуть к комбинированной терапии (к петлевому диуретику может быть присоединен калийсберегающий или тиазидный диуретик). Начинать терапию следует с минимальных эффективных доз, помня о том, что высокие дозы диуретиков увеличивают риск общей смертности у пациентов с ХСН.
В настоящее время используется несколько петлевых диуретиков: фуросемид, торасемид, буметанид и этакриновая кислота. Метаанализ исследований этих препаратов показал, что торасемид способен привести к снижению смертности и числа госпитализаций по сравнению с фуросемидом, а также к улучшению ФК сердечной недостаточности у больного [5]. В исследовании GOLD-CHF сравнивались короткодействующие петлевые диуретики и препараты пролонгированного действия. В группе пациентов, получавших пролонгированный диуретик, наблюдалось достоверно более выраженное снижение уровней предсердного и мозгового натрийуретических гормонов, а также существенное снижение веса.
При назначении петлевых диуретиков следует обращать внимание на продолжительность действия препарата и рекомендуемые стартовую и максимальную дозы (табл. 2) [6]. Следует выбирать препарат с максимальным временем полувыведения, например торасемид. Необходимым условием безопасной диуретической терапии является титрование дозы от стартовой к целевой. При соблюдении этого правила при режиме дозирования пациент будет получать минимально эффективную (а значит, максимально безопасную) дозу препарата, что позволит продолжить диуретическую терапию, не нанося вреда здоровью пациента.
Пациент с хронической сердечной недостаточностью: плейотропное действие мочегонных. Можно ли снизить риск смерти?
Заведующий кафедрой терапии ГБОУ ВПО «РНИМУ им. Н.И. Пирогова», д.м.н., профессор Г.П. АРУТЮНОВ коснулся вопроса эволюции диуретической терапии. История использования диуретиков насчитывает столетия. Еще Парацельс пытался использовать фитосборы и соли тяжелых металлов для выведения избытка жидкости из организма своих пациентов. Позже путем наблюдений было установлено, что мочегонным эффектом обладают сульфонамидные препараты. Кроме того, они характеризуются слабой способностью ингибировать карбоангидразу.
Производные сульфонамидов стали развиваться как мочегонные препараты сразу по нескольким направлениям: как ингибиторы карбоангидразы, а также в качестве петлевых и тиазидных диуретиков. Сульфонамидные препараты были открыты в 1949 г., и эту дату можно считать отправной точкой диуретической терапии в современном ее понимании. При этом многие диуретики появились сравнительно недавно, так, торасемид был открыт в 1993 г. Все диуретики характеризуются общим основным механизмом действия – они повышают объем выделяемой мочи, увеличивая тем самым экскрецию катионов натрия и выводимых вместе с ними анионов, в первую очередь Cl-. Объем внеклеточной жидкости напрямую зависит от содержания NaCl в плазме, а значит, он уменьшается вследствие потери этих ионов. Диуретическая терапия широко применяется при ХСН, так как она уменьшает выраженность симптомов заболевания и повышает качество жизни пациента. Однако назначение диуретиков пациентам с ХСН должно осуществляться в соответствии с определенными правилами:
- Терапия начинается только при наличии симптомов недостаточности кровообращения.
- Назначение диуретиков должно происходить на фоне терапии ингибиторами АПФ и бета-адреноблокаторами.
- Мочегонная терапия осуществляется только в ежедневном режиме. Прерывистые курсы мочегонной терапии приводят к гиперактивации нейрогормональных систем и росту уровня нейрогормонов.
- Назначение диуретиков должно осуществляться по принципу «от слабейшего к сильнейшему».
- При достижении клинического эффекта (уменьшение клинических проявлений недостаточности кровообращения, увеличение толерантности к физическим нагрузкам) начинается титрование дозы мочегонного «на понижение».
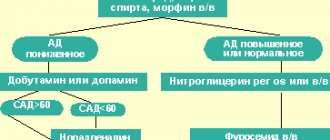
Выбор диуретика осуществляется на основании специального алгоритма (рис. 1). Назначая терапию пожилым необследованным пациентам, следует предполагать возможный нефросклероз, и в случае наличия ХСН требуется мочегонная терапия; предпочтение при выборе стартовой терапии необходимо отдавать петлевым диуретикам. Тиазидные диуретики считаются безопасными только в комбинации с ингибиторами АПФ и бета-адреноблокаторами, среди петлевых же наиболее безопасны препараты с максимальным периодом полувыведения, поскольку они защищают функционирующие клубочки, отсрочивая момент наступления «рикошета», при котором натрий возвращается в организм из первичной мочи после окончания действия петлевого диуретика. Целесообразно также отдавать предпочтение препаратам, обладающим плейотропными эффектами, например, воздействующим на депозицию коллагена. К таким препаратам относится петлевой диуретик торасемид, блокирующий C-концевую протеиназу проколлагена и сокращающий таким образом синтез коллагена.
Особый интерес в контексте продолжительности действия представляют пролонгированные диуретики с замедленным высвобождением (Бритомар). Их концентрация в плазме крови меняется постепенно, без скачков, что приводит к увеличению интервала Tmax на 45% (рис. 2). На фоне применения торасемида также существенно реже, чем на фоне приема фуросемида, развиваются нарушения калиевого обмена. Еще одним немаловажным плейотропным эффектом торасемида является его способность в минимальной степени влиять на ритм жизни пациентов: количество мочеиспусканий после приема этого препарата существенно ниже, чем после приема других диуретиков. Последнее утверждение было подтверждено в ходе 9-месячного исследования, в котором фуросемид сравнивался с торасемидом [7]. Выявлено, что торасемид обладает целым рядом преимуществ перед тиазидными диуретиками и фуросемидом (табл. 3), что позволяет широко использовать препараты на основе торасемида у пациентов, страдающих ХСН и имеющих признаки недостаточности кровообращения.
Длительная терапия мочегонными препаратами
Основным требованием, предъявляемым к долговременной диуретической терапии, отметила заведующая консультативно-поликлиническим отделением НИИ кардиологии им. А.Л. Мясникова ФГБУ РКНПК, д.м.н. Я.А. ОРЛОВА, является безопасность и лишь затем – переносимость. Назначение диуретиков в ряде случаев сопровождается нарушениями углеводного обмена и повышением уровня мочевой кислоты, однако эти расстройства являются отсроченными, в отличие от гипокалиемии, развивающейся достаточно быстро и представляющей собой одно из наиболее серьезных осложнений диуретической терапии. Влияние гидрохлоротиазида на перечисленные показатели было изучено в 9-недельном исследовании S.M. Smith и соавт. (рис. 3) [8].
Исследование, посвященное изучению профиля безопасности торасемида, продемонстрировало, что длительное назначение препарата в дозировке 5 мг/сут (равно как и 10 мг/сут) не оказывало негативного влияния на показатели биохимического анализа крови. Прямые сравнительные исследования гидрохлоротиазида и торасемида также продемонстрировали отсутствие достоверно фиксируемого влияния последнего на уровень калия и глюкозы крови, в то время как гидрохлоротиазид снижал концентрацию ионов калия и повышал уровень глюкозы.
В сравнительном исследовании, проведенном J. Cosin и соавт. (2002) [9], пациенты с ХСН с сохраненной систолической функцией сердца (ХСН-ССФ) получали торасемид и фуросемид (9,6 ± 1 и 31 ± 2 мг/сут соответственно) на протяжении 6 месяцев. По окончании этого срока у 7% пациентов из группы фуросемида было зафиксировано снижение уровня К+
Тем не менее снижение дозы диуретика возможно только при устранении известной причины декомпенсации, cледовательно, особое внимание безопасности назначаемых препаратов должно уделяться еще на этапе выбора диуретика. Одним из диуретиков с оптимальным профилем безопасности считается торасемид, минимальное влияние этого препарата на смертность больных с ХСН подтверждено крупными исследованиями (рис. 4) [9]. Доказано, что торасемид почти в 2 раза по сравнению с фуросемидом снижает риск общей смертности у больных с ХСН и более чем в 2 раза – смертность от сердечно-сосудистых заболеваний. Кроме того, на фоне приема торасемида наблюдается более выраженное улучшение клинического состояния пациентов, что отражается, в частности, в результатах 6-минутного теста ходьбы [11]. Торасемид также характеризуется лучшей, чем у тиазидных диуретиков, переносимостью и более длительным периодом полувыведения, что свидетельствует о целесообразности его назначения пациентам с ХСН, нуждающимся в диуретической терапии. При этом начинать терапию необходимо с минимальных эффективных доз, не увеличивая их без необходимости.
Заключение
Диуретическая терапия является неотъемлемой частью комплексного лечения пациентов с ХСН. При этом, как правило, она назначается больным с высоким (III–IV) ФК ХСН, а длительность приема диуретиков измеряется годами. Все это объясняет особые требования к безопасности и переносимости диуретических препаратов. На сегодняшний день считается доказанным, что оптимальным сочетанием безопасности, переносимости и эффективности обладают петлевые диуретики пролонгированного действия, например Бритомар. Он также характеризуется рядом плейотропных эффектов, например способностью блокировать синтез коллагена. Эффективность и безопасность торасемида подтверждены рядом крупных исследований, в которых препарат сравнивался как с плацебо, так и с другими диуретиками, в том числе петлевыми. В ходе этих исследований торасемид продемонстрировал способность существенно уменьшать выраженность отеков, не оказывая при этом негативного влияния на метаболические процессы.