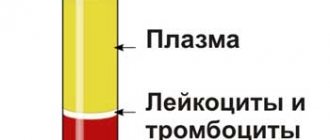
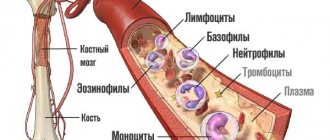
Каждый практикующий врач знает, как сложно найти причину заболевания. Часто приходится тратить на это много времени, сил и средств. В настоящее время появляются новые методы тестирования, помогающие выявить причину заболевания. Одним из таких методов является гемосканирование
–
темнопольная микроскопия нативной крови.
Разработал метод доктор Курт Грейндж
(магистр нутрициологии, доктор философии в нутрициологии и доктор натуропатии Университета Клейтона). В чем же особенность этого метода? Прежде всего, микроскопия крови проводится при увеличении в 1800–2000 раз в присутствии пациента. Кровь не высушивается и не подкрашивается, за счет этого клетки крови, плазма и другие ее компоненты продолжают свою жизнь в течение некоторого времени (при определенных условиях до 5–7 дней). Исследование крови методом темнопольной микроскопии позволяет оценить количественный, качественный состав крови, функциональную активность ее компонентов, выявить наличие бактерий, грибов, вирусов, паразитов, простейших, а также включений в виде кристаллов холестерина, билирубина, мочевой кислоты, сахара и др. По совокупности всех выявленных в крови признаков можно с достаточно высокой достоверностью определить наличие у пациента тех или иных заболеваний или предрасположенность к ним.
Гемосканирование крови: как проводится
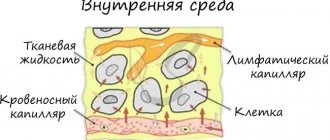
Микроскоп соединён с видеокамерой, которая выводит изображение на монитор, а также даёт возможность делать фото- и видеосъемку интересных объектов. Известно, что кровь выполняет очень важные функции в организме. Прежде всего, кровь – это транспортная система, которая соединяет работу всех органов и систем. Кровь взаимодействует с каждой клеткой организма, доставляя им кислород, биоактивные, питательные вещества, и выводит продукты жизнедеятельности, токсины и шлаки, которые выделяют клетки в процессе функционирования. Кровь транспортирует иммунные клетки в очаги воспаления или внедрения чужеродных агентов (инфекции, аллергенов), доставляет тромбоциты в очаги кровотечения. На состоянии и составе крови отражаются все патологические процессы, возникающие в организме – воспалительные, инфекционные, метаболические, иммунные, аллергические и др. При нарушении пищеварения, функции органов выведения (почки, кишечник, кожа и легкие), при дисбактериозе и паразитозе кровь закисляется, перегружается токсическими веществами, свободными радикалами.
Активность лейкоцитов, содержание эозинофилов и базофилов
О состоянии иммунной системы человека можно судить по количеству, размерам, активности лейкоцитов
, качественному составу. Наличие неактивных, маленького размера, склонных к объединению в группы из двух трёх клеток, уменьшение общего количества лейкоцитов говорит о снижении иммунитета, наличии воспалительного процесса (острого или хронического) в организме. Повышение рН крови угнетает фагоцитарную активность лейкоцитов, снижает иммунологический ответ.
При увеличении количества эозинофилов и базофилов
можно судить о предрасположенности к аллергическим реакциям и наличии в организме паразитарной инвазии.
Заболевания крови, влияющие на эритроциты
Заболевания крови, которые влияют на эритроциты, включают в себя:
Анемия: люди с анемией имеют низкое количество красных кровяных телец. Легкая анемия часто не вызывает никаких симптомов. Более тяжелая анемия может вызвать усталость, бледность кожи и одышку при физической нагрузке.
Железодефицитная анемия: Железо необходимо организму для образования красных кровяных телец. Низкое потребление железа и потеря крови из-за менструации являются наиболее распространенными причинами железодефицитной анемии. Он также может быть вызван потерей крови из желудочно-кишечного тракта из-за язвы или рака. Лечение включает в себя таблетки железа или, реже, переливание крови.
Анемия хронического заболевания: люди с хронической болезнью почек или другими хроническими заболеваниями склонны к развитию анемии. Анемия хронического заболевания обычно не требует лечения. Инъекции синтетического гормона эпоэтина Альфа (Эпоген или Прокрит) для стимуляции выработки клеток крови или переливания крови могут быть необходимы у некоторых людей с этой формой анемии.
Пернициозная анемия (дефицит В12): состояние, которое препятствует усвоению организмом достаточного количества В12 в рационе питания. Это может быть вызвано ослабленной слизистой оболочкой желудка или аутоиммунным заболеванием. Помимо анемии, в конечном итоге может возникнуть повреждение нервов (невропатия). Высокие дозы B12 предотвращают долгосрочные проблемы.
Апластическая анемия: у людей с апластической анемией костный мозг не производит достаточного количества клеток крови, включая эритроциты. Это может быть вызвано целым рядом заболеваний, включая гепатит, Эпштейн-Барр или ВИЧ-побочный эффект лекарства, химиотерапевтические препараты, беременность. Для лечения апластической анемии могут потребоваться лекарства, переливание крови и даже пересадка костного мозга.
Аутоиммунная гемолитическая анемия: у людей с этим заболеванием гиперактивная иммунная система разрушает собственные эритроциты организма, вызывая анемию. Лекарства, которые подавляют иммунную систему, такие как преднизон, могут потребоваться, чтобы остановить этот процесс.
Талассемия: это генетическая форма анемии, которая в основном поражает людей средиземноморского происхождения. Большинство людей не имеют никаких симптомов и не нуждаются в лечении. Другим может потребоваться регулярное переливание крови для облегчения симптомов анемии.
Серповидноклеточная анемия: генетическое заболевание, которое поражает в основном людей, чьи семьи прибыли из Африки, Южной или Центральной Америки, Карибских островов, Индии, Саудовской Аравии и средиземноморских стран, включая Турцию, Грецию и Италию. При серповидноклеточной анемии эритроциты липкие и жесткие. Они могут блокировать кровоток. Может возникнуть сильная боль и повреждение органов.
Полицитемия вера: организм производит слишком много клеток крови, по неизвестной причине. Избыток эритроцитов обычно не создает никаких проблем, но может вызвать тромбы у некоторых людей.
Малярия: укус комара переносит паразита в кровь человека, где он заражает эритроциты. Периодически красные кровяные тельца разрываются, вызывая лихорадку, озноб и повреждение органов. Эта инфекция крови наиболее распространена в некоторых частях Африки, но также может быть обнаружена в других тропических и субтропических районах по всему миру; те, кто путешествует в затронутые районы, должны принимать профилактические меры.
Что может «рассказать» количество тромбоцитов
Тромбоциты
являются клетками свертывающей системы крови. Изменения количества, формы, агрегации тромбоцитов являются признаками нарушении гомеостаза: при кровопотерях, разрегулированности свертывающей системы, обезвоживании, смещении рН в кислую среду, острых инфекциях, анемиях, обменных нарушениях, синдроме внутрисосудистого свертывания. Увеличение количества тромбоцитов, их агрегацию вызывают провоцирующие и способствующие проявлению факторы: гипокинезия, ожирение, чрезмерные физические нагрузки, охлаждение, внутривенные манипуляции, прием гормональных противозачаточных препаратов.
Анализ состояния плазмы
Жидкая часть крови – плазма
, дает нам достаточно большой объем информации о состоянии внутренней среды организма. Наличие в ней различных включений: кристаллов холестерина, солей мочевой и ортофосфорной кислот, бактерий, личинок, грибов и их спор, быстрое появление нитей фибрина – является указанием на предрасположенность к развитию той или иной болезни. Кристаллы холестерина формируются при нарушении липидного обмена. Несостоятельность процесса пищеварения, функции печени и поджелудочной железы ведет к гиперлипидемии, что со временем приводит к патологическому состоянию – гиперхолестеринемии. Холестерин кристаллизуется, адсорбирует на своей поверхности шлаки, продукты жизнедеятельности бактерий, фиксируется в сосудах и становится основой атеросклеротического поражения. Это может стать причиной развития сердечно-сосудистой патологии.
Полезная информация
Т. Шузель
Простой анализ мазка крови позволяет точно и быстро получить информацию. Дополнительный количественный подсчет клеток крови обеспечивается с помощью гематологического автомата – счетчика.
В мазках крови проводят подсчет и оценку различных морфологических форм клеток крови. Следует иметь в виду, что полную информацию нельзя получить только с помощью автоматических счетчиков.
В данной статье описаны способы приготовления и методы анализа мазков крови, а также получение дополнительной информации путем использования автоматических методов исследования.
ТЕХНИКА ВЫПОЛНЕНИЯ МАЗКОВ КРОВИ
Показаний к исследованию крови много, и они ориентированы не только на диагностику анемии. Большая часть системных заболеваний также приводит к изменению гемограммы, анализ которой является основой диагностики.
1. Взятие материала для исследования
Чаще всего мазок крови выполняют путем нанесения на предметное стекло капли венозной крови, взятой из пробирки, для консервирования которой используют этилендиаминтетраацетат (ЭДТА), что позволяет сохранить морфологию клеток. Необходимо соблюдать процентное соотношение кровь/антикоагулянт: избыток ЭДТА вызывает артефакт псевдотромбопении и изменяет морфологию клеток (зубчатый край эритроцитов).
Наносят материал на предметное стекло сразу после его забора, потому что при хранении возникают повреждения клеток (вакуолизация лейкоцитов, пикноз ядра1).
1 Пикноз (гр. puknosis, конденсация) [англ. pyknosis]. Трансформация ядра в клетке с конденсацией хроматина. Ядро становится гомогенным и имеет однородную окраску. Проявление этого феномена связано с гибелью клетки.
2. Способ нанесения материала
- Каплю крови наносят на поверхность предметного стекла, расположенного горизонтально, с помощью пипетки близко к его краю (фото 1).
Фото 1. Выполнение мазка крови: одну каплю крови поместить на конец предметного стекла. Другое стекло, с помощью которого необходимо сделать мазок, помещают на предметное стекло перед каплей крови приблизительно под углом 30-45° (фото 2). Путем скольжения по предметному стеклу его приближают к капле крови, пока последняя не распределится по перемещаемому краю (фото 3). После этого стекло односторонним движением смещают по поверхности предметного стекла в сторону противоположного края. Предметное стекло маркируют до или после нанесения материала, что позволяет избежать возможных ошибок.
| Фото 2. Выполнение мазка крови: стекло для выполнения мазка крови помещают на предметное стекло с каплей крови под углом 30-45°. | Фото 3. Выполнение мазка крови: предметное стекло смещают близко к капле крови до того момента, когда она начинает распределяться по всему фронту его края за счет капиллярности. |
- Цель нанесения материала на предметное стекло — получить однородный мазок с утончением на конце (хвостики, которые еще называют косичками). В этой тонкой части мазка клетки крови располагаются в один слой, что позволяет исследовать их морфологию (фото 4). На рисунке 1 показано, как должен быть выполнен мазок крови.
| Фото 4. Выполнение мазка крови: мазок крови имеет гомогенную структуру с целлюлярным истонченным монослоем, расположенным в части предметного стекла, противоположной по отношению к нанесенной на него капли крови. | Рис.1. Картина мазка после нанесения материала на предметное стекло |
- Если подсчет клеток не может быть выполнен сразу на месте, то полученные мазки, доставляемые с остальным материалом в лабораторию, не окрашивают.
- Перед проведением окраски мазки надо высушить на свежем воздухе, избегая при этом высокой температуры, потому что это может привести к возникновению артефактов вследствие деформации поверхности эритроцитов.
Эти предосторожности крайне важны, потому что при заражении животных с инвазией эритроцитов риккетсиями (Hemobartonella felis) и пироплазмами (Babesia canis) артефакты, возникшие при окраске мазков, могут затруднить идентификацию возбудителей. С помощью красителя Май-Грюнвальд-Гимза (метод Паппенгейма) получают очень качественную микроскопическую картину мазка с детализацией ядерного и цитоплазматического аппаратов клетки (приложение 1). Следует заметить, что этот метод окраски занимает много времени (более 20 минут). Кроме того, быстрое ополаскивание может вызвать повреждение исследуемого материала. Но быстрая окраска мазков (Diff-Quik, RAL) в экстренных случаях позволяет получить необходимые результаты анализа за короткий промежуток времени. Основной недостаток использования быстрых наборов (Kits) в том, что они не дают возможности достаточной детализации нюансов внутри самой клетки (генез артефактов хроматина, качественной оценки цитоплазматического состояния).
Приложение 1. Схема окраски по Май-Грюнвальд -Гимза
Схема классической окраски
— Поместить предметное стекло с нанесенным на него материалом в краску Май-Грюнвальда и выдержать в течение 4 минут. — Поместить предметное стекло с нанесенным на него материалом в краску Май-Грюнвальда, разведенную водой на 50%, и выдержать в течение 2 минут. — Сполоснуть предметное стекло дистиллированной водой. — Поместить предметное стекло в емкость с 5% раствором краски Гимза, разведенным водопроводной водой, и выдержать в течение 15 минут. — Сполоснуть предметное стекло и высушить.
Упрощенная схема
— На мазок наливают краску МайГрюнвальда-Гимза (2-3 мл), при этом предметное стекло должно быть помещено горизонтально в поддерживающее устройство. Окраску осуществляют в течение 5 минут. — Аккуратно слить краситель и нанести вновь раствор красителя Гимза, разведенный 1:10 водой экстемпоре в течение 10 минут. — Сполоснуть предметное стекло и высушить.
АРТЕФАКТЫ
- Артефакты, которые могут возникать при очень быстром или недостаточном высушивании, а также вследствие высокой температуры или избытка ЭДТА, имеют следующие проявления:
— зубчатые формы эритроцитов или эхиноцитоз (необходимо дифференцировать от акантоцитоза2); — преломления света под микроскопом в телах, расположенных на эритроцитах (необходимо дифференцировать от пироплазм или бабезий) (фото 5).
2 Акантоцитоз (гр. akanta, шип, игла; kutos, клетка) [англ. akanthocytosis]. Деформация эритроцитов, которая напоминает иглу ежа.
| Фото 5. Артефакт при неправильном высушивании эритроцитов: светопреломляющиеся тела, располагающиеся на поверхности эритроцитов. Активированный лимфоцит. |
Артефакты, возникающие в результате окраски вследствие применения старого раствора красителя или нарушения режима окраски (недостаточное время пропитывания):
— слабая окраска клеток, в основном ядерного аппарата; — депо красителя (фото 6); — псевдовключения (наложение двух элементов).
| Фото 6. Артефакт окраски: депо красителя. |
СПОСОБ СЧИТЫВАНИЯ
Анализ мазка крови осуществляют всегда одним и тем же способом, выполняя соответствующие этапы.
Сбор информации начинают с момента нанесения материала на предметное стекло, до того как проводить исследование клеток крови под иммерсией.
1. Макроскопическое обследование
- Интерпретацию мазка крова начинают путем его анализа невооруженным глазом сразу после нанесения крови на предметное стекло. На этом этапе оценивают качество полученного мазка крови (утонченность конца мазка и гомогенность, наличие агглютинации капли крови).
- Присутствие макроскопической агглютинации до высушивания и окраски характеризуется неоднородностью распределения крови на предметном стекле в виде «точечных сгустков», что свидетельствует об аутоагглютинации или присутствии эритроцитарных столбиков (фото 7).
| Фото 7. Макроскопическая агглютинация. Следует обратить внимание на отсутствие однородности крови. Эта агглютинация вызвана аутоагглютинацией или персистенцией эритроцитарных (монетных) столбиков. |
- У собаки аутоагглютинация возникает вследствие сенсибилизации эритроцитов антителами. Это является серьезным доказательством гемолитических процессов иммунной природы, тогда как наличие формирования монетных (эритроцитарных) столбиков в основном возникает в случае диспротеинемии. Чтобы различить эти два феномена, каплю крови смешивают с физраствором. Это вызывает исчезновение агглютинации в случае формирования монетного столбика. Персистенция такого состояния крови свидетельствует об аутоагглютинации.
- Макроскопическая агглютинация у кошки, проявляющаяся нагромождением эритроцитов, носит неспецифический характер и не поддается интерпретации.
Затем предметное стекло с нанесенным не нее мазком крови просушивают, окрашивают и исследуют под микроскопом.
2. Исследование мазка под малым увеличением
Первый этап микроскопического исследования материала осуществляют при малом увеличении (объектив ×10 или ×20). Это позволяет оценить качество мазка и получить первую информацию.
В области самой тонкой части мазка отмечают большое скопление лейкоцитов, что дает возможность уже при первой оценке определить их количество (фото 8).
| Фото 8. Обследование косички мазка крови при слабом увеличении. Возможен подсчет эритроцитов. На данном снимке выраженный лейкоцитоз с преобладанием нейтрофилов. | Фото 9. Обследование мазка при слабом увеличении: наблюдается скопление тромбоцитов. |
Обнаружение скоплений тромбоцитов (фото 9) свидетельствует об артефакте, который может привести к ложному выводу о тромбоцитопении.
- На уровне моноцеллюлярного слоя полное визуальное исследование предметного стекла при малом увеличении (×40) позволяет подсчитать лейкоцитарную формулу.
- Рекомендуется провести поиск ядерных эритроцитов. Если мы их обнаруживаем в большом количестве, то это свидетельствует о нарушении (речь может идти о циркуляции микрофиллярий, или мы имеем дело с аномальными клетками). Исследователь всегда акцентирует свое внимание на предполагаемом наличии макроскопической агглютинации эритроцитов (фото 10) или формировании монетных столбиков (фото 11).
- Затем исследование различных клеток проводят под большим увеличением.
| Фото 10. Обследование целлюлярного монослоя (×40): микроскопическая аутоагглютинация. | Фото 11. Исследование целлюлярного монослоя (×40): эритроцитарные столбики. |
ОЦЕНКА СОСТОЯНИЯ ЭРИТРОЦИТОВ
- Оценку состояния эритроцитов проводят под иммерсией (×100) в средней части мазка: в моноцеллюлярном слое, где они хорошо разделены и не деформированы.
- При морфологической оценке выявляют симптомы медуллярной регенерации, а также изменение размера, формы и присутствие включений.
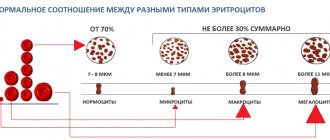
- Нормальные эритроциты у домашних плотоядных представлены округлыми безъядерными клетками в форме двояковогнутого диска (дискоцит), диаметр которого приблизительно равен 7 мкм у собаки и 6 мкм у кошки. В моноцеллюлярной зоне они представлены моноцеллюлярным слоем, имеют округлую форму с бледным свечением в центре (практически отсутствует у кошки), окрашены в желто-оранжевый цвет (умеренная эозинофилия). При этом можно наблюдать физиологически умеренный анизоцитоз3 (фото 12).
| Фото 12. Эритроциты и нормальные тромбоциты у собаки. |
3 Анизоцитоз (гр. an, отрицательная приставка; isos, равный; kutos, клетка) [англ. anisocytosis]. Патологическое состояние эритроцитов, когда они сильно варьируются, в то время как в норме они должны быть одинаковыми. Этот термин также приемлем по отношению к вариациям диаметра лейкоцитов.
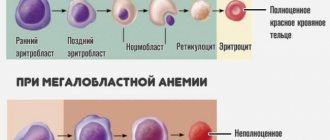
1. Признаки регенерации
- Информация, полученная при анализе крови, не указывает на причину анемии или ее регенеративный характер. Но она позволяет оценить тяжесть нарушений путем подсчета количества эритроцитов, определения концентрации гемоглобина и гематокрита.
Исследование мазков крови животного, страдающего анемией, в совокупности с гематологическим анализом, проведенным с использованием автоматизированной техники, позволяет оценить степень регенерации и в некоторых случаях выявить причину возникновения анемии.
- Патогномоничные симптомы регенерации в мазках крови следующие: полихроматофилия; анизоцитоз; тельца Гавела-Жоли; эритробласты (эритроциты, содержащие ядро), ассоциирующиеся с ретикулоцитозом, наблюдаемым при специальной окраске.
- Полихроматофилию (фото 13) определяют по наличию в крови эритроцитов большого диаметра фиолетовой окраски с элементами базофилии, которые контрастируют с оранжевым цветом нормальных эритроцитов. Эти полихроматофильные клетки соответствуют незрелым формам эритроцитов, которые широко распространены в костном мозге и визуализируются при дегенеративных изменениях костного мозга. В цитоплазме они содержат остатки рибосомальной РНК, которая придает фиолетовую окраску. Это соответствует у собаки и кошки ретикулоцитам с прижизненной окраской (мерцающий крезиловый голубой).
| Фото 13. Обследование моноцеллюлярного слоя в мазке с большим увеличением (×100). Следует отметить наличие полихроматофильных эритроцитов, анизоцитоз эритроцитов и присутствие сфероцитов. Эритробласт наблюдается внизу слева. | Фото 14. Исследование моноцеллюлярного слоя при большом увеличении (×100). Следует обратить внимание на эритроцитарный анизоцитоз и небольшие азурофильные включения круглой формы, которые содержатся в некоторых эритроцитах: тельца Гавела-Жоли. |
- Анизоцитоз (фото 14) — вариации размера эритроцитов. Увеличивается количество эритроцитов большого размера, находящихся в крови. Полихроматофилия связана с большим размером и соответствует анизоцитозу. Присутствие эритроцитов с более интенсивной окраской и большим размером эритроцитов — веский аргумент в пользу регенеративной анемии.
- Эритробласты (ядерные эритроциты, незрелые формы), обычно находящиеся в костном мозге, имеют тенденцию иногда в малом количестве появляться в циркулирующей крови здорового организма.
Они характеризуются большим размером, имеют серовато-фиолетовую цитоплазму, объемное, круглое, интенсивно окрашенное ядро. Их количество возрастает при регенеративной анемии, но присутствие только этих клеток не позволяет ставить диагноз на предполагаемое заболевание. Эритробласты можно наблюдать в большом количестве в циркулирующей крови при отравлении свинцом, выраженной септицемии, при различных заболеваниях крови (синдром миелопролиферации и т.д.).
- Для подтверждения регенеративной анемии обязательно требуется вести подсчет циркулирующих в крови ретикулоцитов после окраски голубым бриллиантовым крезилом (приложение 2). При проведении такой окраски различают зрелые формы эритроцитов с голубой интенсивной окраской цитоплазматического ретикулума. У собаки учитываются все клетки с такой окраской, тогда как у кошки подсчитываются только ретикулярные эритробласты (распознаются благодаря выраженному скоплению цитоплазматической грануляции).
Приложение 2. Методы определения количества ретикулоцитов
Выполнение метода
— Смешать 500 мкл крови с 500 мкл раствора голубого бриллиантового Крезила (1 г порошка бриллиантового голубого Крезила и 0,4 г цитрата, разведенные в 100 мл изотонического раствора). — Выдержать 10-20 минут при комнатной температуре. — Нанести данную смесь на предметное стекло, как это осуществляют для получения мазка крови. — Подсчитать количество наблюдаемых ретикулоцитов при большом увеличении (приблизительно для визуализации 100 эритроцитов в поле зрения микроскопа под иммерсией) и осуществить эту процедуру в 10 полях объектива. Полученное количество выражается в процентном содержании циркулирующих ретикулоцитов. Относительная оценка трансформируется в абсолютную величину путем умножения этого количество на общее число эритроцитов.
Интерпретация
Некоторые авторы говорят о регенерации костного мозга при количественном показателе 80 000-30 000 ретикулоцитов в мм3 у собаки и кошки. Другие говорят о0 ретикулоцитах в мм3. При сомнительной оценке, или таковой, указывающей на нижнюю границу нормы, осуществляют повторный подсчет через два или три дня. Кинетика ретикулоцитов способствует более точной интерпретации.
Тельца Гавела-Жоли (фото 14) относятся к единичным включениям малого размера, имеют азурофильную и круглую форму, присутствуют в молодых эритроцитах, находящихся в фазе созревания. Они относятся к фазе нуклеарного материала эритробластов и элиминируются при созревании. Небольшой процент (менее 1%) может присутствовать у кошек в нормальном физиологическом состоянии. Их количество возрастает при регенеративной анемии, спленэктомии, у животных при лечении глюкокортикостероидами, химиотерапевтическими препаратами.
2. Аномалии размера
- Сфероцитоз — наиболее часто встречаемая аномалия размера эритроцитов. Он свидетельствует об иммунологическом воздействии на эритроциты при развитии гемолитической анемии. Наличие сфероцитов объясняется частичным лизисом макрофагами печени и селезенки эритроцитов, покрытых антителами. Сфероциты распознаются по малому размеру, имеют однородную цитоплазму и интенсивную окраску, у них отсутствует бледное пятно в центре. Эти клетки труднее идентифицировать у кошки: здоровые эритроциты у этого вида не имеют в центре бледного окрашивания.
При гемолитической анемии, опосредованной иммуноглобулинами, мазки указывают на выраженную концентрацию сфероцитов, что ассоциируется с признаками регенерации костного мозга (присутствие полихроматофилов, телец Гавела-Жоли и анизоцитоз).
- Симптомы медуллярной регенерации с наличием эритроцитов большого (макроциты) или малого (микроциты) размера можно наблюдать в циркулирующей крови. Эти клетки имеют тинкториальные и морфологические свойства нормальных эритроцитов. Значительно сложнее выявить аномалию: необходимо оценить средний объем эритроцитов (VGM) с помощью автоматического счетчика.
Среди причин, вызывающих снижение VGM, могут быть портосистемное шунтирование или арегенеративная анемия, вызванная недостаточностью железа. Аномалия размера является ранним признаком сидеропении (низкого содержания железа). Гипохромазия (пониженное окрашивание) проявляется значительно позже и возникает через несколько месяцев с момента начала заболевания.
- Некоторые особи, относящиеся к определенным породам собак (например, пудель), имеют VGM, превышающий норму. Такие макроциты иногда выявляют в мазках крови.
3. Аномалии формы
- Эритроциты собаки и кошки, циркулирующие в крови, обычно имеют округлую форму. Повышенное содержание эритроцитов разных форм называют пойкилоцитозом (фото 15). Этот неспецифический термин обозначает вариации форм эритроцитов по отношению к физиологической норме без указания природы или тяжести нарушений. Эту аномалию относят к артефакту, или она ассоциируется с множеством системных заболеваний.
| Фото 15. Исследование моноцеллюлярного слоя при большом увеличении (×100). Следует обратить внимание на варьирующиеся формы эритроцитов (эритроцитарный пойкилоцитоз) и тромбоциты большого размера (макротромбоциты). |
- Многие термины, часть из которых предназначена для описания цитологической картины, используют для описания формы аномалий эритроцитов: кодоциты, дакриоциты, кератоциты, стоматоциты и так далее. Наличие отдельных форм является патогномоничным признаком некоторых нарушений и коррелирует с клинической картиной заболевания. При развитии пойкилоцитоза в основном следует искать выраженные расстройства, связанные с воспалительным процессом или патологией гепатобилиарной системы.
- При нарушениях метаболизма эритроциты могут быть деформированы в связи с аномалией их мембраны. Акантоциты — это деформированные эритроциты, удлиненная форма которых напоминает палец. Они образуются при аномалиях мембраны, вызванных нарушением печени (шунтирование, новообразования печени, липопротеинопатия, гиперхолистеролемия).
- Механическая фрагментация эритроцитов при нарушениях гемоциркуляции ведет к образованию шизоцитов: это фрагменты эритроцитов различных размеров, которые могут иметь неправильную форму (точек, серпа и т.д.). Они возникают вследствие турбулентности крови, например, при стенозе клапанов. Шизоциты характерны для кавального синдрома. Это выраженный гемолитический криз у особей, которые являются носителями различных паразитов, например взрослых форм Dirofilaria immitis. Они персистируют в каудальной полой вене, вызывают вторичные реологические нарушения крови. Также механическая фрагментация эритроцитов может быть вызвана иммунологическими или физическими агрессиями (ДВС, гемангиосаркомой, выраженными воспалениями и т.д.).
4. Аномалии окраски
Интенсивность окраски эритроцитов пропорциональна концентрации содержащегося в них гемоглобина.
- Гипохромия (фото 16) определяется по наличию бледности в центральной части эритроцита в связи с выраженным снижением содержания гемоглобина. Часто выявляется при сидеропенической анемии. Гемоглобин концентрируется в виде тонкого периферического кольца в эритроцитах, которые называют аннулоцитами.
| Фото 16. Исследование моноцеллюлярного слоя при большом увеличении (×100). Следует отметить наличие аннулоцитов: эритроциты имеют выраженное просветление в центре по причине сниженного содержания гемоглобина. |
Большинство подобных анемий связано с недостаточностью железа вследствие хронической потери в системе пищеварения (язвы, разрушающиеся опухоли и т.д.).
- Напротив, некоторую степень гиперхромии (оптической) можно обнаружить при гемолитической анемии по присутствию сфероцитов, униформных эритроцитов при интенсивной их окраске.
5. Наличие включений
Обычно эритроциты имеют униформную (однородную) окраску без каких-либо включений. Большое количество эритроцитарных включений идентифицировано у собаки и кошки, некоторые из них присутствуют в норме.
- Тельца Гейнца проявляются как протуберанции палевого цвета на мембране или внутри эритроцитов, вызваны окислением молекул гемоглобина. Они значительно проще идентифицируются с помощью специальных окрасок (метиленовым синим, голубым бриллиантовым крезилом), но их можно наблюдать при обычной окраске за счет большого размера.
- Присутствие телец Гейнца обычно отмечают у представителей семейства кошачьих в небольшом количестве (менее 3%). Это связано с большим содержанием сульфгидрильных групп на молекуле гемоглобина и объясняет повышенную чувствительность к процессам окисления. При большом количестве телец Гейнца у кошки предполагают в первую очередь отравление токсическими дозами препаратов, вызывающих окисление (парацетамол, потребление лука), а также заболевания, связанные с обменными процессами (диабет, гипертироидоз), или онкологической природы (злокачественная лимфома). При выраженной интоксикации окисленный гемоглобин может конденсироваться в части эритроцитов. Оставшаяся цитоплазма в оптическом поле выглядит опустошенной и образует эксцентроцит. Его морфология схожа с тельцами Гейнца.
- Исследование мазка крови позволяет выявить некоторых возбудителей заболеваний у собаки и кошки. Наиболее часто это гемобартенеллез (Hemobartonella felis) и пироплазмоз (Babesia canis).
- Гемобартенеллы имеют форму небольших кокков или палочек, локализующихся на поверхности мембраны эритроцитов, которые иногда с трудом поддаются дифференциации от артефактов, возникающих при приготовлении мазка крови.
- Пироплазмы характеризуются базофильными включениями в форме груши в цитоплазме эритроцитов. Сдвоенная форма является классической для заболевания, но интра- или экстрацеллюлярную персистенцию четырех паразитов также можно наблюдать в мазках.
- Включения вирусных частиц при заболевании чумой также можно обнаружить в эритроцитах. Они располагаются в цитоплазме, имеют округлую форму, голубой и бледно-розовый цвет. В основном их наблюдают при остром течении инфекционного заболевания, когда симптомы носят слабо специфический характер. Несмотря на редкое проявление, эти включения могут быть единственным показателем при постановке диагноза на вирусное заболевание.
ИССЛЕДОВАНИЕ ТРОМБОЦИТОВ
- Кровяные пластинки, или тромбоциты, имеют круглую или овальную форму, слабо дифференцируемый контур и зернистость розового цвета. Размер их меньше, чем у эритроцитов.
- Если обнаруживают скопления в мазке крови, то это указывает на артефактную тромбоцитопению при пункции (активация первичного гемостаза, агрегация тромбоцитов в пробирке, что исключает возможность подсчета) или на избыток EDTA.
- Количественное содержание тромбоцитов определяют под объективом с иммерсией (приложение 1). Этот метод исследования используют у кошек. Некоторые автоматы часто совершают ошибки в связи со слабой дифференциацией объема между эритроцитами и тромбоцитами, что является причиной неточного подсчета.
- Присутствие мегатромбоцитов (размер равный, иногда превышающий объем эритроцита) часто связано с ранней, а также вторичной регенерацией тромбоцитов при их деструкции или периферической утилизации. Значительно реже увеличенные в размере тромбоциты могут быть следствием дисплазии костного мозга, где затрагивается мегакариоцитарная линия клеток (при инфекционном заболевании, вызванном вирусом лейкоза у кошек).
- Присутствие микротромбоцитов в мазках крови свидетельствует об их деструкции, опосредованной иммунной реакцией (тромбоцитопеническая пурпура иммунной природы). Эти малые тромбоциты представлены их фрагментами, покрытыми антителами. Они имеют значение, аналогичное сфероцитам, которые выявляют при анемиях иммунной природы.
- Включения в тромбоцитах встречается редко, но их выявляют при инфицировании Ehrlichia platys (вызывает циклическую тромбоцитопению).
Приложение 3. Формула подсчета тромбоцитов (объектив с иммерсией)
Собака: тромбоциты/мкл. Определяют количество тромбоцитов в поле зрения микроскопа (×100, ×15 000).
Кошка: тромбоциты/мкл. Определяют количество тромбоцитов в поле зрения микроскопа с увеличением (×100, ×20 000).
Здоровое животное имеет от 8 до 25 тромбоцитов, наблюдаемых при среднем увеличении в поле зрения микроскопа. Этот подсчет позволяет идентифицировать с высокой точностью тромбоцитопению (менее 3 тромбоцитов в поле зрения) и выраженный тромбоцитоз.
ИССЛЕДОВАНИЕ ЛЕЙКОЦИТОВ
- Контроль лейкоцитов осуществляют на первом этапе исследования с помощью автоматизированного подсчета. Данное исследование проводят в косичках мазка при малом увеличении.
- Плотность лейкоцитов в конце мазка и в его центральной части позволяет определить их количество, тогда как дифференцированный подсчет 100 или 200 лейкоцитов позволяет более точно определить лейкоцитарную формулу крови, чем это можно сделать в настоящее время с помощью большинства используемых для этой цели автоматов. Качественная оценка при визуальном исследовании требует квалификации исследователя. Количество форменных элементов и лейкоцитарная формула, просчитываемые в мазках крови, должны соответствовать результатам автоматического исследования.
- Подсчет формулы или обследование линий формирующихся лейкоцитов позволяет распознать аномальные или бластные клетки в циркулирующей крови при злокачественных гемопатиях. Используемые в настоящее время автоматы, относящиеся к типу Coulter, не позволяют дифференцировать нормальные лейкоциты от аномальных. Эти клетки подсчитываются как нормальные лейкоциты, и их наличие может оказаться вне поля зрения клинициста (фото 17).
| Фото 17. Анормальные или бластные клетки, которые могут не идентифицироваться при автоматическом исследовании. |
- Далее морфологический анализ выполняют при более сильном увеличении (×40 или ×100) в зоне мазка с моноцеллюлярным слоем там, где хорошо просматривается морфология клеток. Определяют нейтрофильные гранулоциты (полинуклеарные нейтрофилы, PNN). Лимфоциты и моноциты представлены в достаточно большом количестве в циркулирующей крови, что позволяет провести морфологический анализ. У домашних плотоядных формула крови имеет нейтрофильный профиль. У молодых особей могут преобладать лимфоциты (наблюдается в возрасте до одного года).
- Наиболее частые модификации связаны с изменением морфологии полинуклеарных нейтрофилов при системных воспалительных процессах или клеточной патологии (в случае сепсиса, эндотоксимии или выраженного некроза). В таком случае мы говорим о токсической полинуклеарной нейтрофилии. Первый этап указывает на умеренную токсичность и определяется путем обнаружения телец Дойла: сероватые неравномерные включения в цитоплазме, которые вызваны агрегацией цитоплазматического ретикулума. Эти трудно обнаруживаемые цитоплазматические включения являются наиболее ранним индикатором. Диффузная базофилия цитоплазмы проявляется в более тяжелых случаях. При повышенной токсичности наблюдается два перечисленных признака: микровакуолизация цитоплазмы, имеющей картину пены («мыльные пузыри») (фото 18). В критических случаях отмечают клеточный гигантизм. Полный лизис ядерного аппарата дополняет картину.
| Фото 18. Оценка лейкоцитов. Представлен полинуклеарный нейтрофил с цитоплазматическими микровакуолями в форме «мыльных пузырей»: речь идет о токсическом «полинуклеаре». | Фото 19. Оценка лейкоцитов. Гиперсегментированный полинуклеар (более 5 долей в полинуклеарах). Обследование этих клеток указывает в основном на физиологический характер изменения клеток (старение клеток). |
- Гиперсегментация ядра (правостороннее отклонение ядра или кривой Арнета) без признаков токсичности часто является морфологическим изменением в популяции нейтрофилов (фото 19). Это состояние определяют в популяции нейтрофильных полинуклеаров по выраженной сегментации ядра (больше 5 долей), что в основном свидетельствует о старении клеток крови. Увеличение контакта с ЭДТА (длительное консервирование крови перед выполнением мазка), кортикостероидная терапия со снижением циркуляции в тканях, хроническое воспаление — причины не физиологического увеличения гиперсегментации полинуклеарных нейтрофилов.
- Для стадии неполного созревания, или «band form» (фото 20), характерна неполная сегментация ядер, имеющих форму подковы лошади или земляного ореха (арахиса). Наличие этой несовершенной стадии клеток в большом количестве ассоциируется с нейтрофилией (отклонение ядра или кривой Арнета влево). Указывает на увеличение гранулопоэза, часто вследствие роста фагоцитоза в периферической ткани, например, при остром гнойном воспалении.
| Фото 20. Оценка лейкоцитов. Молодой нейтрофильный полинуклеар, или «band form»: его ядро находится в состоянии гипосегментации и имеет форму земляного ореха. Эритроцитарный анизоцитоз также может быть отмечен. |
- Другие группы лейкоцитов также могут изменяться, что имеет следующее объяснение: лимфоциты не проявляют признаков токсичности, но реагируют при стимуляции антигеном инфекционного агента, а также при иммунном или неопластическом процессе. Эти реактивные лимфоциты, или «иммуноциты» характеризуются увеличенным размером и выраженной базофилией. Другие модификации, например азурофильные цитоплазматические включения, также могут быть обнаружены в лимфоцитах, которые называют «зернистыми лимфоцитами» (фото 21). Их наблюдают в циркулирующей крови при неспецифической стимуляции иммунной системы (вирусные заболевания, недавно проведенная вакцинация), а также в случае новообразований и некоторых хронических нарушений (эрлихиоз). Эти активированные клетки относятся NK (естественным киллерам).
| Фото 21. Оценка лейкоцитов. Следует отметить наличие лимфоцита в состоянии зернистости, который содержит азурофильные включения в цитоплазме. |
- Лейкоцитарные включения встречаются крайне редко. Они относятся к морулам эрлихоза собак (Ehrlichia canis) в моноцитах и телам Лентза при заболевании чумой, которые включаются в лимфоциты, моноциты и нейтрофильные гранулоциты.
- Наличие эритрофагоцитов (моноциты, которые фагоцитируют эритроциты) можно наблюдать при гемолизе иммунной экстрацеллюлярной природы, например при бабезиозе.
Клиницист, располагающий автоматическим оборудованием для анализа крови, которое позволяет получить результаты на период консультации, имеет большие преимущества. Тем не менее, рекомендуется проводить дополнительные исследования мазка крови для того, чтобы оценить и объяснить аномалии системных нарушений.
Приложение 4. Основные положения
Высушивание мазков крови осуществляется на свежем воздухе, без теплового источника, который может вызвать наличие артефактов, которые мешают оценке морфологического статуса клеток крови.
Макроскопическая агглютинация является физиологичной у кошки. У собаки она может соответствовать как формированию монетных столбиков, так и микроскопической агглютинации, часто возникающей при гемолитической анемии.
Необходимо уточнить наличие тромбоцитопении, определяемой при использовании автоматизированного исследования, с помощью внимательного исследования мазков, чтобы выявить скопления тромбоцитов, ответственных за псевдотромбоцитопению.
Присутствие полихроматофилов, наличие эритроцитарного анизоцитоза и Телец Гавела-Жоли на мазке крови являются симптомом регенеративной анемии.
В случае присутствия повышенного содержания активированных лимфоцитов необходимо вести систематический поиск персистенции хронического воспаления.
СВМ 5/2004
Наличие кристаллов мочевой кислоты в крови
Наличие кристаллов мочевой кислоты
в крови позволяет оценить уровень белкового обмена в организме, работу почек, печени. Мочевая кислота представляет собой побочный продукт усвоения белков. При•прохождении мочевой кислоты через печень, она перерабатывается в мочевину, после чего•почки выводят ее из организма. Нарушение метаболизма белков приводит к избыточному образованию мочевой кислоты, ее солей (уратов), формированию конкрементов в мочевыводящих путях, отложениям в суставных капсулах и суставных поверхностях.
Условия взятия и хранения образца
Клинический анализ крови выполняется из венозной крови, стабилизированной калиевой солью ЭДТА, если не указано иначе в инструкции к анализатору. Взятие крови выполняется натощак. Образец крови должен быть немедленно после взятия перемешан 9 раз осторожным переворачиванием, следует избегать образования пены и резкого встряхивания. До исследования образец крови может храниться при комнатной температуре (23–24 °С) в течение 24 часов в штативе, в вертикальном положении, в удаленном от света месте.
При использовании образца капиллярной крови для клинического анализа необходимо получить свободнотекущие капли капиллярной крови из предварительно прогретой области прокола. Сбор капиллярной крови без сдавливания пальца обеспечивает сохранность клеток. Надавливание области прокола и сбор образца из охлажденной конечности приведут к искажению результатов гемограммы. Образцы капиллярной крови должны быть стабилизированы калиевой солью ЭДТА, поэтому для взятия образца следует использовать капилляры, обработанные K3ЭДТА. Образцы могут храниться при комнатной температуре (23–24 °С) в течение 24 ч в штативе, в вертикальном положении, в удаленном от света месте.
О чем свидетельствуют соли ортофосфорной кислоты
Соли ортофосфорной кислоты
в крови свидетельствуют о выраженном нарушении фосфорно-кальциевого обмена, дефиците кальция в организме, что опять же является предпосылками к развитию различных заболеваний. Фосфорная кислота образуется при утилизации белков, тяжелой физической нагрузке, употреблении продуктов с загустителями, ароматизаторами и т.п. Фосфорная кислота является «маркером» потерь кальция. Она насыщает себя•ионами кальция, и когда•организм•выводит ее, вместе с ней выбрасывает и накопившийся в ней кальций.