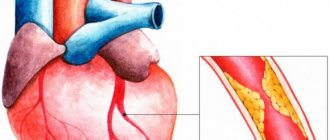
В Российской Федерации 7 % взрослых людей страдают хронической сердечной недостаточностью (ХСН). Ежегодно, даже в условиях лечения в специализированном стационаре, умирает до 12 % больных с клинически выраженной ХСН. Единственное, что может помочь пациенту в терминальной стадии этого заболевания, — трансплантация сердца.
Не все нуждающиеся в операции доживают до ее проведения, но с тех пор как 46 лет назад бригада доктора Кристиана Барнарда провела первую в мире пересадку сердца от человека к человеку, у них по крайней мере появилась надежда на выздоровление.
История вопроса
Успехи трансплантологии связаны с развитием двух независимых сфер медицины: совершенствованием хирургической техники и методов анестезии с одной стороны, и достижениями иммунологии и фармакологии — с другой. Первое обеспечило удачное проведение операций, а второе — благополучное протекание послеоперационного периода.
Первые шаги
Еще в XVI веке итальянский хирург Гаспаро Тальякоцци после ряда неудачных экспериментов с пересадкой кожи от человека к человеку представил публике успешный результат аутотрансплантации (пересадки собственного органа реципиента, в данном случае — кожи). В 1596 году он описал свои наблюдения «силы и мощи индивидуальности» в труде «De Curtorum Chirurgia per Insitionem» (Замещающая хирургия с использованием пересадки).
Однако широкий интерес идея трансплантации органов вызвала лишь спустя 300 лет, когда хирурги массово приступили к практическим опытам. Вновь столкнувшись с проблемой отторжения, они обогатили медицину тремя важными выводами: межвидовые пересадки органов (ксенотрансплантации) всегда неуспешны; пересадки между представителями одного вида (аллогенетические трансплантации) в большинстве случаев тоже, причем повторные пересадки органов между одними и теми же донорами и реципиентами ускоряли отторжение; если между донором и реципиентом было кровное родство, вероятность благоприятного исхода операции значительно увеличивалась, причем пересадка собственных органов (аутотрансплантация) почти всегда были удачна.
Первая описанная в литературе успешная трансплантация датируется II веком нашей эры: индийский хирург Шушрата произвел пересадку кожи в ходе ринопластики.
А в III веке, если верить хроникам римской католической церкви, святые Дамиан и Косма пересадили потерявшему ногу от гангрены римскому дьякону Юстиниану конечность недавно умершего эфиопа.
Собачье сердце
В 1905 году в череде опытов по пересадке органов очередь дошла и до сердца. Первую трансплантацию сердца собаки-донора на сосуды шеи собаки-реципиента осуществили хирург, биолог и патофизиолог Алексис Каррель и физиолог Шарль Гатри, американцы французского происхождения. Донорское сердце проработало 2 часа.
В 1933 году американский физиолог Фрэнк Манн с коллегами повторил опыт Карреля и показал возможность функционирования гетеротопически (то есть размещенного в нетипичном месте) трансплантированного сердца собаки вплоть до 8 суток (собственное сердце собаки оставалось на месте и продолжало работать).
В ногу со временем шли и советские хирурги. Наиболее весомый вклад в экспериментальные основы трансплантации сердца в СССР внес Владимир Петрович Демихов. С 1946 по 1955 год он в нескольких сотнях экспериментов разработал 24 (!) варианта хирургической техники гетеротопической трансплантации сердца в грудную клетку. В некоторых опытах донорское сердце эффективно обеспечивало кровообращение собаки-реципиента в течение более чем 15 часов.
Борьба с ишемией
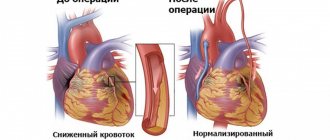
Самой явной проблемой, вставшей на пути хирургов, стала ишемия: в условиях недостаточного кровотока повреждались и ткани реципиента, и донорские сердца. Трансплантацию невозможно провести в сжатые сроки, поэтому хирурги и анестезиологи стали искать способы, позволяющие продлить время операции. Так были разработаны методы управляемой гипотермии и спроектированы аппараты искусственного кровообращения (ИК).
Управляемая гипотермия позволяет снизить кровопотерю, а также продлить время операции без повышения риска ишемизации тканей.
В 1953 году американские хирурги Уилфорд Нептун и Брайан Куксон с коллегами выполнили первую трансплантацию сердечно-легочного комплекса собаки в условиях глубокой гипотермии (во время операции в комнате поддерживалась температура порядка минус 4 °С).
В 1957 году американцы Уильям Вебб и Хизер Говард повторили этот эксперимент, подключив собаку-реципиента к аппарату ИК. Позднее они сообщили о пересадке в тех же условиях изолированного сердца. Они накладывали девять анастомозов между аортой, легочной артерией, легочной и полой венами. Правда, этот трансплантат профункционировал всего 7 часов.
К середине 60-х Норман Шумуэй и Ричард Лоуэр с коллегами из клиники при Стэнфордском университете разработали методику трансплантации сердца, которая используется по сей день: с использованием «локальной гипотермии» — местного охлаждения до 18–21 °С. С этого момента для успешного проведения операции осталось только одно препятствие — иммунологическое отторжение.
Причины отторжения
В 1952 году иммунологи Жан Доссе (Франция) и Барух Бенасерраф (США) вместе с генетиком Джорджем Снеллом (США) обнаружили, что важнейшие антигены, участвующие в отторжении трансплантата, – антигены главного комплекса гистосовместимости (HLA). За это открытие в 1980 году они были удостоены Нобелевской премии.
Существует порядка 150 вариантов антигенов HLA, и у каждого человека на мембранах клеток присутствует по шесть вариантов таких антигенов. Следовательно, возможно более триллиона их комбинаций – вероятность существования двух людей с одинаковыми комплексами HLA-антигенов близка к нулю, конечно, если они не однояйцевые близнецы. Идеально, если у донора и реципиента наблюдается несовпадение лишь одного антигена из шести. Операции проводят и в том случае, если не совпадают два, однако при этом увеличивается риск развития иммунологического отторжения.
На практике определение совместимости тканей — гистотипирование — осуществляется по лимфоцитам крови.
Со стороны «хозяина» основные эффекторы трансплантационного отторжения – это цитотоксические CD8 T-клетки и CD4 Т-клетки. Последние привлекают в зону отторжения трансплантата клетки воспаления (в том числе макрофаги). Распознание трансплантационных антигенов происходит либо непосредственно на клетках трансплантата, либо в ближайшей лимфоидной ткани.
Немалую роль в отторжении трансплантата могут сыграть и антитела в организме реципиента (например, появившиеся из-за предшествующего переливания цельной крови). Взаимодействуя с антигенами эндотелия сосудов, пронизывающих трансплантат, они инициируют систему комплемента и каскад реакций, приводящий к закупорке сосудов.
Иммуносупрессия
Первыми веществами, которые начали использовать для подавления иммунного ответа, стали кортикостероиды.
В 1948 году американский врач Филип Хенч, применив кортизон в лечении ревматоидного артрита, показал, что препарат обладает выраженным противовоспалительным действием. В 1952 году американский хирург Роджер Бэйкер с коллегами продемонстрировал, что кортизон может использоваться и для иммуносупрессии после трансплантации.
В 1962 году американцы Уиллард Гудвин и Мэтт Мимс впервые использовали азатиоприн — иммуносупрессивный препарат, обладающий наибольшей активностью в отношении Т-лимфоцитов, для предотвращения острого отторжения трансплантированной почки. Пациентам с пересаженным сердцем также планировалось назначать азатиоприн в сочетании с кортикостероидами.
Очередь человека
Человеку сердце было впервые пересажено в 1964 году. Джеймс Харди с коллегами трансплантировали сердце крупного шимпанзе, весившего более 43 кг, больному 68 лет с тяжелой формой ИБС в терминальной стадии прогрессирующей сердечной недостаточности. Вначале трансплантат работал удовлетворительно, однако через час после отключения аппарата ИК развилась острая сердечная недостаточность, обусловленная объемной перегрузкой трансплантата, и больной погиб.
Первая аллогенетическая трансплантация сердца человеку была проведена три года спустя в Кейптауне южноафриканским хирургом Кристианом Барнардом, прошедшим стажировку под руководством Нормана Шумуэя. Бригада доктора Барнарда пересадила сердце 25-летней девушки, погибшей в автомобильной аварии, 55-летнему диабетику, перенесшему три инфаркта и страдавшему от застойной сердечной недостаточности. Трансплантация прошла удачно, но на 18-е сутки после операции пациент умер от двусторонней пневмонии. Через месяц в этой же клинике была выполнена вторая трансплантация донорского сердца, после которой реципиент прожил полтора года, умерев от хронического отторжения.
В СССР первая успешная трансплантация сердца была осуществлена в 1987 году знаменитым врачом-трансплантологом академиком АМН СССР Валерием Ивановичем Шумаковым (1931–2008).
Успех первого клинического опыта увлек медицинское сообщество, и к решению задачи трансплантации сердца обратились хирурги всего мира. Однако большинство пациентов умирало вскоре после проведения операции, и интерес исследователей начал угасать: если в 1968 году было проведено 100 трансплантаций сердца, то в 1970 — всего 18. Главной причиной смерти оставалось отторжение пересаженных органов.
Лишь четверо из прооперированных в период с 1967 по 1973 год прожили с новым сердцем дольше года; с 1974 по 1983 год годичная выживаемость увеличилась до 60 %, а вот пятилетняя составила лишь 21 %.
Иммунологи и фармакологи берутся за дело
В 1983 году увенчались успехом клинические исследования нового иммуносупрессора — циклоспорина, нерибосомного полипептида, получаемого из почвенных грибов вида Beauveria nivea. Его выделили в 1970 году в рамках программы по скринингу новых антибиотиков. В 1972 году бельгийский иммунолог Жан-Франсуа Борель открыл способность циклоспорина ингибировать культуру лимфоцитов при отсутствии общего цитостатического эффекта. В конце 70-х британский хирург Рой Калне провел первые испытания эффективности циклоспорина после трансплантации сердца и почек на экспериментальных животных. Его внедрение в широкую практику открыло новую эру в трансплантации сердца, поскольку позволило значительно продлить жизнь пациентов после трансплантации. В 1994 году было одобрено использование для послеоперационной терапии еще одного нового иммуносупрессора — такролимуса (FK-506) из группы макролидов, продуцируемого актиномицетом Streptomyces tsukubaensis. В 1987 году японские иммунологи Шиничи Савада и Джен Судзуки в экспериментах in vitro обнаружили, что такролимус в 100 раз активнее циклоспорина подавляет пролиферацию Т-лимфоцитов. В исследованиях на крысах, собаках и приматах, проводившихся с 1988 по 1993 год, такролимус обеспечивал профилактику отторжения трансплантата в дозах в 10–100 раз более низких, чем циклоспорин, и с меньшим количеством побочных эффектов. Впрочем, модификации циклоспорина, разработанные в то же время, обладали аналогичными преимуществами.
Последние успехи иммуносупрессии связаны с поли- и моноклональными антителами (подробно об этом мы рассказывали в КС № 5 (118) 2013, статья «Достижения фармацевтики: моноклональные антитела»), позволяющими предотвратить стероид-резистентное — не купируемое даже пульс-терапией метилпреднизолоном — отторжение тканей, которое встречается с частотой 10–18 %.
В настоящее время используется трехкомпонентная схема иммуносупрессивной терапии: циклоспорин А или такролимус в сочетании с метилпреднизолоном и микофенолата мофетилом (цитостатиком, который наиболее эффективен в отношении лимфоцитов). Препараты антилимфоцитарных антител (ALG, ATG, ОКТ-3) применяются в качестве вводной терапии, а также при выраженных признаках отторжения или стероид-резистентном отторжении.
Какие осложнения могут последовать после пересадки?
Наиболее известные осложнения хорошо изучены клиницистами, поэтому распознаются на ранних этапах. К ним относятся:
- присоединение инфекции;
- реакция отторжения к тканям пересаженного сердца;
- сужение коронарных артерий, признаки ишемии;
- застойные явления в легких и нижнедолевая пневмония;
- образование тромбов;
- аритмии;
- послеоперационное кровотечение;
- нарушение функций мозга;
- за счет временной ишемии возможно повреждение разных органов (почек, печени).
Для подавления отторжения донорских тканей пациенту назначаются сильные препараты, воздействующие на иммунные клетки крови. Этим одновременно создаются благоприятные условия для заражения любой инфекцией и ракового перерождения.
Современная статистика
На сегодняшний день в мире проведено уже более 15000 трансплантаций сердца. 10-летняя выживаемость пациентов составляет около 50 %. Самая большая летальность — в первый год после операции (в разных клиниках – от 15 до 25 %). Основные причины смерти — инфекционные заболевания и саркома Капоши, развивающиеся на фоне иммуносупрессивной терапии.
Описаны и счастливые случаи, когда пациенты с трансплантированным сердцем прожили более 25 лет. Мировым рекордсменом стал Тони Хьюзман — пациент клиники при Стэнфордском университете. Его прооперировали в 1978 году, показанием послужила дилатационная кардиомиопатия. После трансплантации он прожил 30 лет и умер в 51 год от рака кожи.
В мире ежегодно выполняется от 2,7 до 4,5 тысяч трансплантаций сердца. Из них в России — всего около 100 операций. Лидер по количеству трансплантаций — США: там проводится до двух тысяч пересадок сердца ежегодно.
На сегодняшний день в России существует 10 центров, осуществляющих трансплантацию сердца (все данные приведены в соответствии с информацией, опубликованной в журнале «Вестник трансплантологии» за 2009–2013 год).
Показания для проведения операции по пересадке сердца
Диагноз:
— кардиомиопатии различного генеза;
— доброкачественные опухоли сердца;
— неоперабельные врожденные пороки сердца (например, гипоплазия левого желудочка).
Клинико-функциональная характеристика пациентов:
— хроническая сердечная недостаточность III-IV ФК по NYHA, резистентная к медикаментозной терапии;
— фракция выброса ЛЖС < 30%;
— конечно-диастолический размер ЛЖС > 7 см;
— конечно-диастолическое давление ЛЖС > 20 мм рт. ст.
— сердечный индекс (CI) < 2,5 л / (мин × м2);
— рефрактерность желудочковых тахиаритмий;
— ожидаемая выживаемость потенциального реципиента без трансплантации сердца < 6–12 мес.;
— возраст до 55 лет.
Абсолютные противопоказания:
— стойкая легочная гипертензия (транспульмональный градиент давления > 15 мм рт. ст., общее легочное сопротивление (ОЛС) > 5 ед. Вуда, систолическое давление в легочной артерии более 60 мм рт. ст.);
— острые инфекционные заболевания и/или обострение хронических;
— необратимая полиорганная недостаточность;
— злокачественные новообразования в анамнезе;
— тромбофлебит;
— системные заболевания;
— ожирение (> 30 % должной массы тела);
— психические заболевания, алкоголизм, наркомания;
— недисциплинированность в приеме медикаментов, несоблюдение больничного режима.
Относительные противопоказания
— активный диффузный миокардит;
— инсулинозависимый сахарный диабет;
— язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения;
— нарушение мозгового кровообращения в анамнезе;
— инфицирование вирусами гепатита С и гепатита В;
— атеросклероз сосудов нижних конечностей;
— ограниченная поддержка семьи.
Первые шаги от естественного к искусственному
Механический насос
4 апреля 1969 года в кардиологический центр г. Хьюстона поступает умирающий пациент сорока семи лет с диагнозом «сердечная недостаточность». Оперирующий хирург идёт на рискованную операцию: он устанавливает пациенту механический насос, который временно исполняет функцию отказавшего органа. Трое суток установленный насос качает кровь за него. Благодаря именно этому насосу пациент выживает до пересадки ему донорского органа. Так дата 4 апреля 1969г. стала началом подобия имплантации искусственного сердца.
Задачи на будущее
Только порядка 10–15 % больных, ожидающих трансплантацию сердца, доживают до ее проведения. Один из вариантов продления жизни до момента операции — установка искусственного сердца. Средняя выживаемость пациентов с таким протезом — около года. Если за это время подходящего донора не нашлось, больной может погибнуть, как правило, из-за тромботических осложнений. К сожалению, гемодинамические характеристики искусственных сердец пока далеки от совершенства. Новейшее достижение в этой области принадлежит немецкой : разработчики заменили механические подшипники прибора миниатюрной турбинкой, подвешенной в управляемом магнитном поле. Это позволило значительно снизить тромбообразование в протезированном сердце.
Член Совета Европейского общества трансплантологов, директор НИИ трансплантологии и искусственных органов академик РАМН Сергей Готье в «Вестнике трансплантологии и искусственных органов» (№ 3, 2012 год) отмечает, что главная причина, по которой в нашей стране не выполняется необходимое количество трансплантаций, — отрицательное отношение населения к посмертному донорству органов. Нужно отметить, что в России, в отличие от США и стран Западной Европы, действует презумпция согласия: закон допускает изъятие тканей и органов у трупа, если умерший или его родственники не выразили своего несогласия.
Интересная методика, позволяющая продлить жизнь ожидающим пересадку сердца пациентам с дилатационной кардиомиопатией, разработана в 2002 году специалистами Научного центра хирургии РАМН во главе с доктором медицинских наук Алексеем Коротеевым. Его команда успешно опробовала на практике следующую методику: после курса интенсивной кардиотерапии больному делают спиральную томографию, чтобы создать точную трехмерную компьютерную модель сердца. Затем по индивидуальному муляжу шьется сетка из специального полиэфирного материала – дакрона. В ходе последующей операции сетку надевают на живое сердце, что препятствует дальнейшей дилатации.
До сих пор актуален поиск эффективной терапии послеоперационных осложнений. Большинство из них (инфекции, саркома Капоши, поражение почек и печени, а также быстрое развитие атеросклероза коронарных сосудов трансплантата) развиваются из-за постоянного использования иммуносупрессоров.
Возможно, когда-нибудь этих проблем удастся избежать, например, «вырастив» для пациента его собственное сердце in vitro из стволовых клеток. В апреле 2006 года ученые калифорнийского Института регенеративной медицины под руководством доктора Энтони Аталы сообщили об успешном выращивании и пересадке пациентам купола мочевого пузыря. Но структурированную ткань сердечной мышцы ни одному коллективу исследователей вырастить не удалось, по крайней мере, пока.
Что делают после пересадки сердца?
Пациент переводится в отделение реанимации или интенсивной терапии. Здесь к нему подключают кардиомонитор для контроля за ритмом.
Искусственное дыхание поддерживается до полного восстановления самостоятельного.
При достаточном собственном объеме дыхательных движений интубационная трубка извлекается, но постоянно подается кислород через маску или носовые катетеры
- Контролируется артериальное давление, отток мочи.
- Для обезболивания показаны наркотические аналгетики.
- С целью профилактики застойной пневмонии больному необходимы форсированные дыхательные движения, назначаются антибиотики.
- Для предупреждения тромбообразования показаны антикоагулянты.
- В зависимости от электролитного состава крови назначаются препараты калия, магния.
- С помощью щелочного раствора поддерживается нормальный кислотно-щелочной баланс.
Источники
- Jessen NH., Jensen H., Helsper CW., Falborg AZ., Glerup H., Gronbaek H., Vedsted P. Cancer suspicion, referral to cancer patient pathway and primary care interval: a survey and register study exploring 10 different types of abdominal cancer. // Fam Pract — 2021 — Vol — NNULL — p.; PMID:33904928
- Li T., Ruan DG., Xu XY. . // Sheng Li Xue Bao — 2021 — Vol73 — N2 — p.263-274; PMID:33903888
- Pineda C., Matsumoto K. Types of the New World Stigmoderini (Coleoptera: Buprestidae) deposited in Natural History Museum, London Buprestidae: Buprestinae: Stigmoderini. // Zootaxa — 2021 — Vol4964 — N3 — p.zootaxa.4964.3.2; PMID:33903504
- Singh SM., Liverpool A., Romeiser JL., Thacker J., Gan TJ., Bennett-Guerrero E. Types of surgical patients enrolled in enhanced recovery after surgery (ERAS) programs in the USA. // Perioper Med (Lond) — 2021 — Vol10 — N1 — p.12; PMID:33902705
- Azman NI., Wan-Mustapha WN., Goh YM., Hassim HA., Selamat J., Samsudin NIP. Climatic conditions and farm practices affected the prevalence of Aspergillus section Flavi on different types of dairy goat’s feed. // Int J Food Microbiol — 2021 — Vol347 — NNULL — p.109205; PMID:33901942
- van Wigcheren GF., Roelofs D., Figdor CG., Flórez-Grau G. Three distinct tolerogenic CD14+ myeloid cell types to actively manage autoimmune disease: Opportunities and challenges. // J Autoimmun — 2021 — Vol120 — NNULL — p.102645; PMID:33901801
- Raikova R., Krasteva V., Krutki P., Drzymała-Celichowska H., Kryściak K., Celichowski J. Effect of synchronization of firings of different motor unit types on the force variability in a model of the rat medial gastrocnemius muscle. // PLoS Comput Biol — 2021 — Vol17 — N4 — p.e1008282; PMID:33901164
- Zheng WL., Wang JW., Jiang AD., Rehman Khan SA., Yang XQ., Zhang X., Zhang ZY. Study on environmental performance evaluation of different linkage development types of the logistics and manufacturing industries considering the unexpected output. // J Air Waste Manag Assoc — 2021 — Vol — NNULL — p.; PMID:33900887
- Scharnweber K., Chaguaceda F., Eklöv P. Fatty acid accumulation in feeding types of a natural freshwater fish population. // Oecologia — 2021 — Vol — NNULL — p.; PMID:33900451
- Segal NL. Twin Types: Variations and Common Themes/Twin Research Reviews: Birth Weight and Brain Development; Twinning and Vocabulary Knowledge; Fetal Loss in Twin Pregnancy; Twin-Family Olympic Medal Winners/Human Interest: Young Twin Soldiers; Twin-Run Laundry; Male-Female Pair and Politics; Twin-Based Graphic Novel; Twin Sisters’ Deliveries. // Twin Res Hum Genet — 2021 — Vol24 — N1 — p.89-94; PMID:33900160