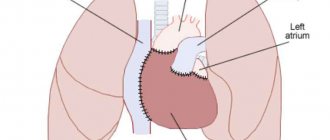
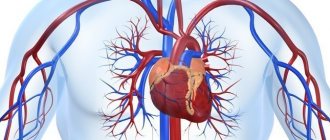
Пересадка сердца — показания
Заболевания, выступающие показанием к трансплантации:
- кардиомиопатия — замещение волокон миокарда рубцующимися тканями;
- неоперабельные пороки сердца врожденного и приобретенного характера;
- опухолевые процессы в области сердечной мышцы;
- стенокардия и сбои сердечного ритма, не подающиеся медикаментозной коррекции;
- врожденные нарушения развития сердечной мышцы, не подлежащие пластической коррекции;
- терминальная стадия сердечной недостаточности.
Пересадка сердца показана в крайних случаях. Когда все прочие варианты коррекции состояния пациента уже испробованы и не дали желаемого результата.
4 Последствия операции
Ранний послеоперационный период является самым сложным в плане адаптации нового органа к изменившимся условиям функционирования. При позитивном исходе операции и отсутствии серьезных осложнений, нормальная работоспособность сердца возвращается примерно через 3-5 дней. Именно в этот период могут проявиться такие осложнения, как:
- отторжение донорского сердца;
- тромбоз сердечных артерий;
- нарушение функций мозга;
- нарушение работы легких, печени, почек и других органов.
В последующие 7-10 дней сказываются такие осложнения, как:
- инфекционное заражение;
- болезнь коронарных артерий;
- внутреннее кровотечение;
- пневмония;
- аритмия;
- развитие онкологического новообразования на фоне иммуносупрессивных препаратов в предоперационный период.
Все эти последствия могут проявляться в разном порядке и в разные временные промежутки после проведения операции. Появление осложнений после пересадки возникает более чем в 90% случаев, чаще всего это аритмия, болезнь коронарных артерий и внутреннее кровотечение. Любые осложнения в той или иной степени способны стать причиной смерти пациента.
Коррекция недостаточности артриовентрикулярных клапанов.
Функциональная недостаточность атриовентрикулярных клапанов наблюдается почти у всех пациентов ишемической или дилатационной кардиомиопатией. Ишемия приводит к развитию прямой дисфункции или разрыву папиллярных мышц и формированию митральной недостаточности. Снижение контрактильности миокарда ЛЖ вызывает дилатацию его полости, дисторсию задней папиллярной мышцы и усиливает митральную регургитацию. Оратный сброс крови в левое предсердие увеличивает перегрузку объемом ЛЖ и еще больше усиливает ишемию миокарда. Возникает порочный круг, прервать который может только восстановление запирательной функции митрального клапана.
Для этого коррекции митральной недостаточности используются опорные кольца с измененной пространственной геометрией, которые позволяют снизить рецидив митральной недостаточности в отдаленном послеоперационном периоде.
Что может препятствовать проведению операции
К сожалению, далеко не каждый пациент сможет получить донорское сердце. Этому есть множество различных причин:
- Очень небольшое количество доноров. Им может стать только то лицо, у которого зарегистрирована смерть головного мозга, а сердце абсолютно здорово.
- На получение данного органа очень большая очередь (лист ожидания), наиболее актуально это для детей. Орган должен полностью соответствовать всем заявленным требованиям и, возможно, такие параметры будут еще у нескольких десятков больных, стоящих гораздо раньше в списке.
- Иногда донорский орган невозможно доставить в нужное место вовремя, так как операцию нужно провести не позже, чем через шесть часов после изъятия.
- Многие не соглашаются на проведение пересадки по этическим или религиозным понятиям. Например, в христианстве человек жив, пока бьется его сердце.
- Пациента может остановить страх перед длительной и довольно дорогой реабилитацией.
- Преклонный возраст. Обычно операции не проводят людям после 60 лет, но бывают и исключения.
Кроме перечисленных препятствий, пересадку не будут проводить при ряде других, не относящихся к кардиологии, болезней. Это могут быть:
- легочная гипертензия в тяжелой форме;
- сахарный диабет в стадии, при которой уже начались негативные изменения сетчатки глаз, в сосудах или почках;
- инфекционные заболевания в острой стадии;
- ВИЧ и туберкулез;
- аутоиммунные болезни – ревматизм, артрит, красная волчанка и т. д.;
- печеночная или почечная недостаточность в тяжелой форме;
- хронические тяжелые формы заболевания легких;
- онкология;
- зависимость от алкоголя или наркотиков;
- тяжелые психические расстройства.
Каким должен быть донор
Донором выступает человек с подтвержденным фактом смерти мозга. Это люди после инсульта или чрезвычайных происшествий, находящиеся в коме.
С помощью медицинской аппаратуры и лекарственных препаратов поддерживается жизнедеятельность сердечно-легочной системы. Поэтому сердечная мышца функционирует даже после смерти мозга и подходит для трансплантации.
Для изъятия донорского сердца требуется письменное разрешение родственников или прижизненное и юридически заверенное согласие самого донора.
Если у предполагаемого донора нет кровных родственников или его личность не была установлена, изъятие органа может произойти без оформления вышеуказанных документов.
Условия для изъятия сердца в качестве трансплантата:
- донор должен быть не старше 65 лет;
- у донора не должно быть инфекционных заболеваний, которые могут передаться реципиенту;
- сердце должно быть абсолютно здоровым;
- группы крови донора и реципиента должны совпадать;
- ткани донора и реципиента должны быть совместимы на уровне антигенной структуры рецепторов;
- смерть мозга донора должна быть зафиксирована и подтверждена клинически;
- разница в размере сердечной мышцы донора и реципиента не должна превышать 50%.
Причиной, препятствующей трансплантации, может стать религиозный фактор, т.к. отдельные религии не признают человека мертвым, если сердце еще функционирует.
Еще одним препятствием для изъятия органа может стать расстояние, которое необходимо преодолеть для транспортировки органа в соответствующее учреждение. Так как жизнеспособность сердца после смерти донора не превышает 6 часов.
Сколько стоит трансплантация сердца
Все граждане РФ имеют право на бесплатную высокотехнологичную медицинскую помощь, к которой и относятся операции по пересадке. Исходя из этого, при наличии подходящего сердца оно ничего не будет стоить пациенту. Но, кроме операции по пересадке сердца, больного ожидает длительная и дорогостоящая реабилитация. Этот период может затянуться и потребовать от реципиента от 50 тысяч долларов. Детям такая пересадка будет стоить гораздо дороже, так как и подбор донора, и саму операцию придется проводить в зарубежной клинике.
Историческая справка
Первая пересадка сердца произведена в 1964 году Джеймсом Харди. Больному досталось сердце шимпанзе. После этого удалось поддерживать жизнь пациента только полтора часа.
Значимой вехой в успешной трансплантологии считается пересадка человеческого сердца донора, проведенная в ЮАР в 1967 году Кристианом Бернардом. Донором была погибшая в ДТП молодая женщина 25 лет. А реципиентом — больной мужчина 55 лет, не имеющий шансов в дальнейшем лечении. Несмотря на мастерство хирурга, пациент скончался от двусторонней пневмонии спустя 18 суток.
Главной проблемой выживания считается степень отторжения донорского органа иммунной системой человека. В настоящее время оперативной техникой владеют многие профильные кардиологические центры.
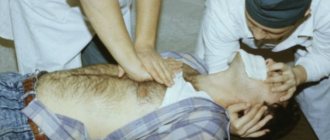
Проведение операции по пересадке сердца
Пересадка сердца требует современного оборудования и высококвалифицированных врачей для проведения операции.
По этой причине трансплантацию проводят в специальных научно-исследовательских центрах, оснащенных специфической аппаратурой.
- Пересадка поджелудочной железы при сахарном диабете: показания, особенности операции, результаты
Операцию выполняет несколько бригад хирургов, которые сменяют друг друга. В ходе процедуры состояние больного контролирует бригада анестезиологов.
Для пересадки сердца используют две методики:
- биатриальная — сердце пациента удаляют частично, сохраняя предсердия, к которым подводят донорский орган;
- бикавиальная — донорское сердце подводят к верхней и нижней полым венам, без сохранения предсердий реципиента.
Ход операции
- Рабочее поле обеззараживают. Грудину разрезают вдоль грудной клетки при помощи электроножа.
- В область хирургического доступа вводят расширитель, фиксируя ткани. Складки плевры сдвигают.
- Перикард вскрывают и к полым венам подводят аппарат для стимуляции кровообращения. Сердце ограничивают зажимами для исключения его из системы кровообращения.
- Удаляют его по линиям, соответствующим избранному способу трансплантации.
- Орган донора подготавливают к пересадке.
- Донорское сердце внедряют в организм реципиента и накладывают швы согласно избранной ранее методике.
- Кровоток возобновляют, удаляя зажимы на сосудах.
- Если сердце не начало функционировать самостоятельно, его запускают полостным дефибрилятором или ритмичными сжиманиями.
- Грудную полость очищают от крови.
- Расширитель вынимают, кости фиксируют проволочными швами или пластинами. Мягкие ткани сшивают.
Как проводится реабилитация послеоперационного больного?
Реабилитация начинается с восстановления вентиляции легких.
- Пациенту рекомендуют заниматься дыхательными упражнениями по нескольку раз в день, надувать воздушный шар.
- Для предупреждения тромбоза вен ног проводят массаж и пассивные движения в голеностопах, сгибание поочередное коленей.
- Наиболее полный комплекс реабилитационных мероприятий больной может получить в специальном центре или санатории. Вопрос о направлении следует обсудить с врачом.
- Не рекомендуется быстро увеличивать нагрузку на сердце.
- Исключаются горячие ванны. Для мытья можно использовать теплый душ.
Все препараты, назначаемые врачом, необходимо принимать в нужной дозировке.
Оперативная техника.
Циркулярные швы, идущие в толще тканей на глубине не менее 5 миллиметров, накладывают со стороны эндокарда с шагом рассчитанным на основании эхокардиографических данных. Формируется конус ЛЖ с заранее рассчитанным конечнодиастолическим объемом.
После восстановления сердечной деятельности с помощью транспищеводной ЭхоКГ проводится оценка хирургического ремоделирования ЛЖ.
| до операции | после операции |
Хирургическое ремоделирование левого желудочка.
Патологическое ремоделирование ЛЖ у больных с кардиомиопатией приводит к увеличению объема желудочка и напряжению его стенки. После того, как ЛЖ приобретает сферическую форму, меняется ориентация кардиомиоцитов. При одной и той же фракции укорочения фракция выброса в сферическом желудочке значительно уменьшается. При естественном течении заболевания 5-летняя выживаемость при КСИЛЖ < 100 мл/м2 составляет 85%, а при КСИЛЖ > 100 мл/м2 — 53%. Таким образом, любое вмешательство, направленное на оптимизацию этих отношений, оправдано, а благоприятный прогноз для пациента возможен при снижении КСИЛЖ < 90 мл/м2 .
Оперативная техника.
Коррекция указанных нарушений осуществляется путем имплантации многокамерного кардиостимулятора с раздельной стимуляцией правого предсердия и желудочков. Для этого три электрода проводятся через подключичную вену и фиксируются к стенке правого предсердия, в верхушке ПЖ и через коронарный синус в левой боковой вене ЛЖ у основания сердца.
При открытых операциях реваскуляризации миокарда, ремоделирования ЛЖ или пластики митрального клапана электроды фиксируются эпикардиально — в правом предсердии и у основания сердца к обоим желудочкам. Обязательным условием эффективности ресинхронизации является оптимизация работы кардиостимулятора.