- Преимущества
- Врачи
- Контакты
- Лицензии
Преимущества
- Новейшее, постоянно обновляемое оборудование
- Беспроцентная рассрочка на все услуги
- Онлайн-консультации лор-врача
- Выезд лор-врача на дом
- Доброжелательный и квалифицированный персонал
- Круглосуточная лор-помощь
Легочная гипертензия – это заболевание сердечно-сосудистой системы, характеризующееся высоким кровяным давлением в легочной артерии. Давление повышается из-за сужения стенок артерий, ведущих от сердца к легким. Из-за этого сердце вынуждено работать интенсивнее, чтобы перекачивать кровь через легкие. Дополнительное усилие в конечном итоге приводит к ослаблению сердечной мышцы и развитию серьезной сердечной недостаточности.
Легочная гипертензия может быть опасной для жизни. Хотя некоторые ее виды неизлечимы, при своевременной диагностике лечение легочной гипертензии уменьшает проявление симптомов и улучшает качество жизни.
Код легочной гипертензии по МКБ 10 – I27.0.
Симптомы легочной гипертензии
Признаки легочной гипертензии появляются медленно. Их можно не замечать месяцами или даже годами. Симптомы усиливаются (или проявляются ярче) по мере прогрессирования болезни. Они включают:
- одышку, сначала во время физических нагрузок, а затем и в состоянии покоя;
- усталость;
- головокружение;
- обмороки;
- давление или боль в груди;
- отек лодыжек, ног и, в конечном итоге, брюшной полости (асцит);
- синюшный цвет губ и кожи (цианоз);
- учащенный пульс и сердцебиение.
Диагностика
Помимо первичной легочной гипертензии данный синдром всегда является осложнением определенного заболевания, которое и нужно установить при диагностике:
- анализ анамнеза болезни;
- анализ анамнеза жизни пациента;
- общий осмотр пациента;
- электрокардиография;
- рентгенография органов грудной клетки;
- УЗИ сердца;
- катетеризация артерии легких;
- консультация у кардиолога или пульманогола.
Могут использоваться и дополнительные методики, которые дают возможность установить тип и класс гипертензии, и переносимость пациентом нагрузок:
- спирометрия и бодиплетизмография;
- анализ газового состава крови;
- оценка диффузионной способности легких;
- томография грудной клетки;
- ангиопульмонография;
- общий и биохимический анализ крови;
- подробная коалулограмма;
- УЗИ органов брюшной полости;
- тест на ходьбу в течение 6 минут, который позволяет понять класс болезни и переносимость пациентом нагрузок.
Степени легочной гипертензии
В зависимости от стадии развития заболевания, выделяют его степени.
- Легочная гипертензия 1 степени. Клинические проявления отсутствуют, физические нагрузки переносятся хорошо, но на некоторых участках легочной артерии есть признаки нарушения кровообращения, которые можно обнаружить только при специальном обследовании.
- Легочная гипертензия 2 степени. Физические нагрузки начинают приносить дискомфорт. Беспокоит одышка, слабость, головокружение. В состоянии покоя самочувствие нормальное.
- Легочная гипертензия 3 степени. Даже легкая физическая нагрузка причиняет сильный дискомфорт.
- Легочная гипертензия 4 степени. Все симптомы легочной гипертензии ощущаются даже в состоянии покоя, человек не может вести привычный образ жизни.
Бронхолегочная дисплазия
Бронхолегочная дисплазия (БЛД) – это полиэтиологическое хроническое заболевание морфологически незрелых легких, развивающееся у новорожденных, главным образом глубоко недоношенных детей, в результате интенсивной терапии респираторного дистресс-синдрома и/или пневмонии.Протекает с преимущественным поражением бронхиол и паренхимы легких, развитием эмфиземы, фиброза и/или нарушением репликации альвеол; проявляется зависимостью от кислорода в возрасте 28 суток жизни и старше, бронхообструктивным синдромом и симптомами дыхательной недостаточности. Характеризуется специфичными рентгенографическими изменениями в первые месяцы жизни и регрессом клинических проявлений по мере роста ребенка [9].
Диагностика
Критерии диагностики: • искусственная вентиляция легких (ИВЛ) на первой неделе жизни и/или респираторная терапия с постоянным положительным давлением в дыхательных путях через носовые катетеры (NCPAP – nose continious positive airway pressure); • терапия кислородом более 21 % в возрасте 28 дней и старше (кислородозависимость); • дыхательная недостаточность, бронхообструктивный синдром в возрасте 28 дней и старше, зависимость от кислорода, развивающаяся при проведении кислородотерапии (ИВЛ, NCPAP); • интерстициальный отек, чередующийся с участками повышенной прозрачности легочной ткани, фиброз, лентообразные уплотнения на рентгенограмме грудной клетки. Диагноз “бронхолегочная дисплазия” правомерен в качестве самостоятельного только для детей до 3-летнего возраста. В более старшем возрасте БЛД указывается лишь как заболевание, имевшее место в анамнезе.
Основным методом диагностики заболевания считается рентгенологический (рентгенография и компьютерная томография грудной клетки). Для объективной оценки степени выраженности рентгенографических изменений Г.В. Яцык, И.В. Давыдова, О.В. Кустова в 2010 г. предложили и запантентовали шкалу, по которой каждый диагностический признак оценивался от 0 до 3 баллов, причем оценка в 0 баллов означала отсутствие признака [10, 11]. Баллы суммировались: при сумме баллов от 1 до 5 диагностировалось легкое течение, при сумме баллов от 6 до 10 – среднетяжелое течение, а при сумме баллов от 11 до 15 – тяжелое течение БЛД (табл. 2).
. Рентгенографическая шкала балльной оценки степени тяжести БЛД, по данным МСКТ.
Лечение
Детям со сформировавшейся БЛД показана длительная (до 6–12 месяцев) базисная терапия кортикостериодами, в настоящее время предпочтение отдается ингаляционным глюкокортикостероидам (будесонид) 500–100 мкг/сут через компрессионный небулайзер. Критерием отмены будесонида служит отсутствие бронхообструктивного синдрома при очередной острой респираторной вирусной инфекции (ОРВИ). В остром периоде показано применение диуретиков (фурасемид 2 мг/кг), бронхолитиков (Беродуал 1 капля на 1 год жизни через небулайзер 3–4 раза/сут), кардиотрофиков, антибиотикотерапия по показаниям. При необходимости дополнительной оксигенации желательна сатурация SaO2 ≥ 92–95 % у детей, формирующих cor pulmonale до 96 %. [11, 12].
Причины легочной гипертензии
Легочная гипертензия подразделяется на пять групп в зависимости от причины.
Группа 1: легочная артериальная гипертензия.
Причины включают:
- Неизвестная причина (идиопатическая легочная артериальная гипертензия).
- Генетическая мутация (наследственная легочная артериальная гипертензия).
- Употребление некоторых рецептурных диетических препаратов или запрещенных препаратов.
- Проблемы с сердцем с рождения (врожденный порок сердца).
- Другие состояния, такие как заболевания соединительной ткани (склеродермия, волчанка и др.), ВИЧ-инфекция или хроническое заболевание печени (цирроз).
Группа 2: легочная гипертензия, вызванная левосторонним пороком сердца.
Причины включают:
- Левостороннее заболевание сердечного клапана.
- Отказ нижней левой камеры сердца (левого желудочка).
Группа 3: легочная гипертензия, вызванная заболеванием легких.
Причины включают:
- Хроническая обструктивная болезнь легких.
- Легочный фиброз.
- Обструктивное апноэ во сне.
- Длительное пребывание на большой высоте у людей, которые подвержены более высокому риску легочной гипертензии.
Группа 4: тромбоэмболическая легочная гипертензия, вызванная хроническими тромбами.
Причины включают:
- Хронические тромбы в легких (легочная эмболия).
- Другие нарушения свертывания крови.
Группа 5: вторичная легочная гипертензия, вызванная другими заболеваниями.
Причины включают:
- Заболевания крови.
- Воспалительные заболевания.
- Нарушения обмена веществ, включая болезнь накопления гликогена.
- Заболевания почек.
- Опухоли, давящие на легочные артерии.
- Синдром Эйзенменгера.
Легочная гипертензия у детей может быть всех вышеописанных форм. Однако наиболее часто у них встречается легочная артериальная гипертензия, развившаяся вследствие пороков сердца и идиопатическая легочная гипертензия.
Медицинские интернет-конференции
Первичная легочная гипертензия (ПЛГ) – болезнь Айэрсы – является редким тяжелым прогрессирующим заболеванием неизвестной этиологии и характеризуется неблагоприятным прогнозом [1, 2]. Легочная артериальная гипертензия (ЛАГ) диагностируется при повышении среднего давления в легочной артерии до и более 25 мм рт. ст. в покое и 30 мм рт. ст. при нагрузке [3].
По данным литературы встречаемость идиопатической легочной гипертензии составляет 1 – 1,7 случаев на миллион человек населения [2], причем заболевание встречается чаще у женщин, чем у мужчин почти в 2 раза. Возраст пациентов с таким диагнозом в среднем составляет 36,4 года [1]. Не утешительны данные статистики выживаемости пациентов с ПЛГ – при отсутствии интенсивного лечения средняя продолжительность жизни составляет около 3 лет с момента постановки диагноза [2].
Несмотря на активное изучение проблемы, этиология ПЛГ остается невыясненной, однако исследователи предполагают важную роль генетических нарушений в развитии заболевания [4]. В частности, развитие ПЛГ ассоциируют с мутацией гена BMPR2, локализованном во второй хромосоме, однако патогенетическая связь между данным нарушением и ПЛГ не открыта [11].
Несмотря на то, что факторы, приводящие к запуску патологических изменений в легочных сосудах, точно не установлены, на сегодняшний день исследователи основной в вопросах этиологии и патогенеза данного заболевания считают теорию эндотелиальной дисфункции (ЭД), которая свидетельствует, что повреждение и дисфункция эндотелия легочных сосудов приводит к развитию вазоконстрикции и ремоделированию сосудистого русла. В патогенезе выделяют четыре основных патофизиологических феномена: вазоконстрикция, редукция легочного сосудистого русла, снижение эластичности легочных сосудов, их облитерация вследствие тромбоза и пролиферация гладкомышечных клеток (ГМК). Эти процессы индуцируются возникающим при ЭД дисбалансе выработки вазоактивных медиаторов, который заключается в усиленном синтезе эндотелиоцитами вазоконстрикторных веществ (тромбоксан А2, эндотелин-1) и дефиците выработки вазодилатирующих (NO, простациклин). Играет роль также нарушение работы потенциал-зависимых калиевых каналов ГМК, которое вызывает вазоконстрикцию и пролиферацию ГМК вследствие повышенного внутриклеточного содержания ионов кальция. Ключевое значение в развитии и прогрессировании ЛАГ отводится дефициту NO, который способствует хроническому вазоспазму, клеточной пролиферации, внутрисосудистому тромбообразованию [5].
Таким образом, замыкается порочный круг – прогрессирующее повреждение эндотелия приводит к ремоделированию сосудов [11].
Патологические процессы при ЛАГ затрагивают все слои сосудистой стенки, различные типы клеток (эндотелиальные, ГМК, фибробласты). Структурные нарушения начинаются с артерий мышечного типа и артериол легких. Процесс начинается с гипертрофии и мускуляризации средней оболочки артериол. Кроме того, наблюдается миграция ГМК в интиму сосуда, в которой происходит активная пролиферация клеточных элементов. Сначала утолщение интимы обратимо, однако вскоре развиваются необратимые изменения – фиброз и фиброэластоз. В ряде случаев концентрический фиброз интимы полностью закрывает просвет сосуда. При этом могут определяться плексогенные и плексиморфные структуры, которые, как правило, возникают проксимальнее места обтурации. В адвентиции наблюдается повышенная продукция экстрацеллюлярного матрикса, включая коллаген, эластин, фибронектин и тенасцин. Секреция медиаторов выраженного сосудосуживающего действия трансформирует состояние сосудистого русла из обычного антикоагулянтного в прокоагулянтное и способствует развитию тромбоза [10, 11].
Современные функциональные исследования с помощью различных неинвазивных методик оценки состояния периферического кровотока не подтверждают генерализацию эндотелиальной дисфункции у пациентов с ПЛГ, однако отмечается повышенная констрикторная способность ГМК [6].
Рост сосудистого сопротивления в малом круге кровообращения (МКК) инициирует возникновение синдрома гипердинамии миокарда с развитием гипертрофии правого желудочка (ПЖ). Данное явление обусловлено физиологической реакцией, описанной Старлингом, которая заключается в увеличении силы сердечного сокращения в ответ на нагрузку объемом или сосудистым выходным сопротивлением [7]. Легочное сердце (ЛС) развивается при первичной или вторичной ЛАГ, возникшей в результате нарушения функции эндотелиоцитов сосудов легких, структурных и функциональных изменений легочных сосудов [8]. В развитии легочного сердца выделяют несколько стадий. В начальную стадию происходит увеличение резистентности легочных сосудов, является следствием ЛАГ. Во вторую стадию выявляются изменения в ПЖ в ответ на повышение легочного артериального давления. Третья стадия заключается в выраженной гипертрофии и дилатации ПЖ, происходят изменения в васкуляризации последнего, может наблюдаться правожелудочковая сердечная недостаточность (ПЖСН) [9].
При формировании ЛС наблюдаются изменения миокарда в виде гипертрофии, дистрофии, атрофии и некроза кардиомиоцитов ПЖ. В мышечных волокнах ПЖ могут наблюдаться атрофически-склеротические процессы, в правом предсердии и ПЖ – выраженный фиброэластоз эндокарда. Реже отмечается расширение полости левого желудочка [12].
Диагностика ПЛГ затруднена, поскольку жалобы пациентов носят неспецифический характер и могут напоминать врожденный порок сердца. В большинстве случаев клинические проявления формируются после развития необратимых изменений в легких. Отмечают слабость, усталость, одышку, кровохарканье, ангинозную боль в области сердца, головокружение, абдоминальный дискомфорт. При осмотре обнаруживаются пульсация шейных вен, гепатомегалия, периферические отеки, асцит. Пальпаторно определяется пульсация в четвертом межреберье слева от грудины, увеличение правого желудочка. Аускультируется усиление второго тона во втором межреберье справа [13].
Консервативное лечение ПЛГ предусматривает, в первую очередь, назначение антагонистов кальция, проведение антикоагулянтной терапии, применение диуретиков при ПЖСН. Силденафила цитрат (действующее вещество «Виагры») имеет одинаковые вазодилатирующие способности как в сосудах гениталий, так и легких, в связи с чем был одобрен в США в качестве препарата для лечения ПЛГ [4]. Возможно и хирургическое лечение – трансплантация органокомплекса «сердце-легкие» [11]. Однако полное устранение ПЛГ на данный момент не представляется возможным, лечение носит поддерживающий характер.
В отдельную категорию относят персистирующую легочную гипертензию новорождённых (ПЛГН) в связи с наличием характерных патогенетических и клинико-морфологических аспектов, связанных с особенностями кровообращения плода и отличающими её от ПЛГ. ПЛГН – заболевание, характеризующееся аномально повышенным давлением в легочных сосудах и, как следствие, право-левым шунтированием крови через овальное отверстие и (или) открытый артериальный проток при отсутствии других пороков сердца. Среди вариантов ПЛГН, в свою очередь, выделяют идиопатическую (первичную) и осложняющую различные неонатальные сердечно-легочные осложнения (вторичную) [14]. ПЛГН встречается в 0,2-0,3 случаях на 1000 новорождённых, однако идиопатический вариант составляет до 20% от всех случаев ПЛГН [15].
Ведущей этиологией идиопатической ПЛГН является длительная внутриутробная гипоксия, которая приводит к ремоделированию сосудистого русла, которое выражается в гиперплазии гладких мышц сосудов, распространяющейся на внутридольковые артерии, что приводит к повышению сосудистого сопротивления [15].
У здоровых новорождённых в ответ на многочисленную стимуляцию, происходящую во время рождения, в том числе на увеличение парциального давления кислорода, изменения pH крови, меняется активность вазоактивных веществ [14]. Основным патогенетическим звеном идиопатической ПЛГН также считается дисбаланс синтеза вазоконстрикторных и вазодилатирующих веществ [15].
Таким образом, первичная легочная гипертензия – редкое и тяжелое, с крайне неблагоприятным прогнозом заболевание. Однако накопившийся клинический опыт предоставляет возможности открывать механизмы его патогенеза и разрабатывать новые методы диагностики и лечения, позволяющие не только продлить жизнь пациентам, но и улучшить ее качество. В этой связи актуальным является описание клинических случаев идиопатической легочной гипертензии.
Клинический случай
Из анамнеза известно, что мальчик Е.Д. родился от пятой беременности (вторые роды), протекающей на фоне угрозы прерывания беременности, отеков беременных, низкой плацентации, частичной прогрессирующей отслойки низкорасположенной плаценты, отягощённого акушерско-гинекологического анамнеза, хронической внутриутробной гипоксии плода. Преждевременные роды при сроке гестации 32-33 недели были разрешены путем операции кесарева сечения в экстренном порядке.
Новорождённый находился в тяжелом состоянии с оценкой по шкале Апгар 4-5-6-6 баллов. Тяжесть состояния была обусловлена дыхательными нарушениями, неврологической симптоматикой на фоне недоношенности и морфофункциональной незрелости. Антропометрические данные ребенка при рождении: масса тела 2530 г, рост 47 см, окружность груди 31 см, окружность головы 33 см.
С рождения находился на ИВЛ. На этапе родильного дома проводилась респираторная, инфузионная, антибактериальная и гемостатическая терапия. С целью дальнейшего обследования, лечения и выхаживания мальчик был переведён бригадой санитарной авиации из роддома в отделение реанимации и интенсивной терапии новорождённых Саратовской Областной Детской Клинической больницы (СОДКБ).
На основании проведенных обследований был поставлен основной конкурирующий клинический диагноз: 1. Врождённая пневмония. 2. Церебральная ишемия 3 степени, острый период. Синдром угнетения. Осложнения: синдром полиорганной недостаточности (отек головного мозга, кома 3 степени; дыхательная недостаточность 3 степени; острая сердечно- сосудистая недостаточность 3 степени; острая почечная недостаточность в стадии олигоанурии; отечный синдром; геморрагический синдром; легочная гипертензия). Сопутствующие заболевания: дефект перимембранозный подтрикуспидальный межжелудочковой перегородки 0,24 см; открытый артериальный проток: 0,30см; открытое функционирующее овальное окно: 0,42см, лево-правый сброс. Фоновый диагноз: респираторный дистресс-синдром новорождённых; недоношенность 32-33 недели.
В условиях проводимой терапии (инотропная поддержка, сурфактанты, увеличение параметров вентиляции до максимально возможных) состояние ребенка оставалось тяжелым с динамикой ухудшения. На фоне прогрессирующей полиорганной недостаточности была отмечена асистолия, констатирована биологическая смерть ребенка.
При вскрытии грудной полости отмечено обычное расположение органов, однако легкие полностью выполняют плевральную полость. Форма сердца конусовидная, расположение обычное. Величина и расположение вилочковой железы без особенностей. В мягких тканях имеются кровоизлияния ярко-красного цвета размерами до 1 см.
При исследовании дыхательных путей отмечены обычных размеров отечные розовые небные миндалины. В просвете гортани, трахеи и бронхов определяется небольшое количество слизистого содержимого. Слизистая оболочка указанных органов отечная, гладкая по всей длине. Листки париетальной и висцеральной плевры гладкие, бледно-розового оттенка. Легкие темно-красного цвета, плотной консистенции, легочная ткань на разрезе однородная, обильно пропитана кровью, при надавливании выделятся жидкая кровь и отечная жидкость. Масса левого легкого 40 грамм, правого легкого 37 грамм. Кусочки, вырезанные из легких, при погружении в воду тонут. На гистологическом исследовании легких в просветах альвеол обнаружены очаговые скопления эритроцитов, формирующиеся гиалиновые мембраны; в сосудах отмечена гипертрофия мышечного слоя артерий и вен более чем на 25%, выявлены пролиферация интимы с фиброзом, а также тромботические массы.
При исследовании органов кровообращения обнаружено небольшое количество желтоватой прозрачной жидкости в сердечной сорочке. Листки перикарда гладкие, блестящие. Сердце массой 20 г. Миокард розово-красный, упругой консистенции. Клапанный и пристеночный эндокард на всем протяжении тонкий, полупрозрачный, блестящий, с сероватым оттенком. Толщина миокарда левого желудочка 0,7 см, правого 0,3 см (норма 0,2 см). Периметр легочного ствола над клапанами 2,2 см, аорты – 1,9 см. Интима аорты гладкая, блестящая, красновато-желтого цвета. В полостях сердца и в крупных сосудах темная жидкая кровь. Клапаны сердца развиты правильно, не изменены. Межжелудочковое сообщение размером 0,2 см; овальное окно размером около 0,3 см открыто; открытый артериальный проток размером 0,3 см. На гистологическом исследовании обнаружены дистрофия и гипертрофия кардиомиоцитов.
При вскрытии полости черепа обнаружено, что твердая мозговая оболочка тонкая, с перламутровым блеском. Мягкие мозговые оболочки отечные, полнокровные. Извилины головного мозга уплощены, борозды сглажены. Боковые желудочки немного увеличены в размерах, содержат прозрачный ярко-желтый ликвор. В полости правого желудочка имеется небольшой сверток крови ярко-красного цвета объемом около 5 мл. Сосудистые сплетения полнокровные, с прозрачным содержимым. Белое и серое вещество больших полушарий различимо, на поверхности разрезов определяются темно-красные точки, легко смываемые водой. Остальные структуры головного мозга без видимых изменений. Масса головного мозга 265 грамм. На гистологическом исследовании выявлено неравномерное кровенаполнение сосудов головного мозга.
При вскрытии брюшной полости выделилось около 5 мл желтой жидкости. Петли тонкого кишечника в нижних отделах темно-красного цвета, немного увеличены в размерах; сосуды кишечника полнокровны. Слизистая тонкого кишечника со сглаженным рисунком, темно-красного цвета. В просвете нижних отделов тонкого кишечника геморрагическое содержимое. Печень массой 105 грамм красного цвета, на поверхности и на разрезе имеет обычную структуру. На гистологическом исследовании печени обнаружена дистрофия гепатоцитов, полнокровие печеночных синусов.
При вскрытии почек отмечено, что на разрезе корковое вещество синюшно-красного цвета, а мозговое – темно-красное; паренхима плотной консистенции; слизистая лоханок гладкая, чистая с единичными мелкими кровоизлияниями. Слизистая оболочка мочеточников и мочевого пузыря без особенностей. На гистологическом исследовании почек обнаружена дистрофия эпителия извитых почечных канальцев, а также неравномерное кровенаполнение сосудов.
При вскрытии остальных органов и систем значимых особенностей выявлено не было.
На основе проведенного вскрытия и гистологического исследования был поставлен патологоанатомический диагноз – первичная легочная гипертензия; осложнения основного заболевания – гипертрофия миокарда правого желудочка сердца; вторичные гиалиновые мембраны; кровоизлияния в легких; паренхиматозная дистрофия внутренних органов.
Обсуждение
В данном случае ПЛГ у новорожденного сочеталась с открытым овальным окном и открытым артериальным протоком, а также перимембранозным дефектом межжелудочковой перегородки, что привело к существенным изменениям гемодинамики в неонатальном периоде. Следствием длительной гипоксии стало ишемическое повреждение различных органов, развитие паренхиматозной дистрофии и полиорганной недостаточности, что и обуславливало тяжесть состояния пациента. Непосредственной причиной смерти больного стала дыхательная недостаточность.
Заключение
Таким образом, ПЛГ – тяжелое прогрессирующее заболевание, плохо поддающееся лечению, – у новорожденных осложняется особенностями гемодинамики и неминуемо приводит к летальному исходу. Изучение этиологии и патогенетических механизмов идиопатической легочной гипертензии позволит найти новые пути помощи больным, страдающим от данной болезни.
Факторы риска
По мере взросления увеличивается риск развития хронической легочной гипертензии. Заболевание чаще диагностируется у людей в возрасте от 30 до 60 лет. Однако идиопатическая форма чаще встречается у молодых людей.
Другие факторы, которые могут повысить риск легочной гипертензии, включают:
- семейную историю болезни;
- лишний вес;
- нарушения свертываемости крови или наличие тромбов в легких в семейном анамнезе;
- воздействие асбеста;
- генетические нарушения, в том числе врожденные пороки сердца;
- жизнь на большой высоте;
- использование некоторых препаратов для снижения веса;
- употребление запрещенных и наркотических средств;
- использование селективных ингибиторов обратного захвата серотонина, используемых для лечения депрессии и тревоги.
Лечение
При заболевании легочная гипертензия, лечение включает немедикаментозные и медикаментозные способы. Немедикаментозные способы:
- ограничение потребления жидкости до 1,5 литра в сутки, уменьшение количества в рационе поваренной соли;
- кислородотерапия, которая позитивно сказывается на восстановлении функций ЦНС и помогает устранить ацидоз, при этом разрывая цепь действия синдрома;
- пациенту нужно избегать проявлений одышки, болей, обмороков. Для этого нужно контролировать физическую нагрузку;
- необходимо исключить подъемы на высоту.
Медикаментозные способы:
- антагонисты кальция, которые могут не только менять частоту сокращений сердца, но и снижать спазмы сосудов малого круга кровообращения, расслаблять мускулатуру, увеличивать устойчивость мышцы сердца относительно гипоксии;
- диуретики – это препараты, которые удаляют из организма лишнюю жидкость и снижают давление. При лечении диуретиками должны находиться под контролем электролитный состав и вязкость крови;
- ингибиторы АПФ. Снижают давление, снижают нагрузку, расширяют сосуды;
- нитраты – снижают нагрузку с помощью расширения вен конечностей;
- антиагреганты — помогают снизить уровень склеивания эритроцитов и тромбоцитов и их прилипания к оболочке внутренних сосудов;
- антикоагулянты прямого действия – препараты, которые препятствуют образованию фибрина и предупреждают развитие тромбов;
- антикоагулянты непрямого действия. Препараты данной группы действуют на образование факторов, которые провоцируют свертывание крови, тем самым снижая ее;
- антагонисты для рецепторов эндотелина. Это мощные средства, которые расширяют сосуды;
- препараты, которые улучшают проходимость бронхов – бронходилататоры. Они улучшают вентиляцию в легких, особенно при тех состояниях, которые сопровождаются обратимыми спазмами бронхов;
- антибиотики (при наличии бронхолегочной инфекции);
- оксид азота — используется для ингаляции с целью расширения сосудов;
- ингибиторы фосфодиэстеразы 5 типа, помогающие улучшить ток крови по сосудам и расширяющие их;
- простогландины — это мощные расширители сосудов, у которых также есть много дополнительных эффектов – антиагрегационный, антипролиферативный, цитопротективный.
Хирургическое лечение:
- предсердная септостомия — создается искусственное отверстие между левым и правым предсердиями, что помогает снизить уровень давления в легочной артерии;
- тромбэндатерэктомия – удаление кровяных сгустков из сосудов посредством хирургического вмешательства;
- трансплантация легких либо легких одновременно с сердцем. Используется при тяжелой форме легочной гипертензии и сопутствующих сложных сердечных заболеваниях.
Осложнения
Сопровождать болезнь могут такие осложнения:
- появление правожелудочковой недостаточности сердца, при которой правые отделы сердца не могут справиться с нагрузкой. В результате состояние больного становится еще хуже;
- тромбоз легочных артерий. Это состояние серьезно угрожает жизни пациента и обуславливается механическими закупорками ствола артерии легких;
- нарушения сердечного ритма – мерцание и дрожание предсердий;
- гипертонические кризы в артериальной системе легких, которые проявляются как приступы отека легких: резкое нарастание удушья, сильный кашель, мокрота, посинение покровов кожи.
- в общем, при таком синдроме, как гипертензия артерии легких, сильно ухудшается качество жизни пациента и заболевание может стать причиной сокращения срока жизни.
При таком заболевании, как легочная гипертензия, прогноз не всегда может быть оптимистичным. Вероятен летальный исход в результате острой либо хронической недостаточности сердца и легких, а также тромбоэмблиолии артерии в легких.
Профилактика
С целью предотвращения такой проблемы, как легочная гипертензия, рекомендации таковы:
- здоровый образ жизни, отказ от вредных привычек, в особенности от курения. Излечение основного заболевания, которое спровоцировало легочную гипертензию. (Если речь не идет о первичной гипертензии);
- диспансерное наблюдение за людьми, у которых были диагностированы бронхолегочные болезни и вовремя и грамотно приняты меры терапевтического характера;
- людям с легочной гипертензией необходима регулярная физическая активность. Это упражнения с невысокой интенсивностью, такие как умеренно быстрые прогулки на воздухе в случае их нормальной переносимости. Сильная активность опасна, потому противопоказана;
- устранение интенсивных нагрузок психоэмоционального характера – стрессов, конфликтных ситуаций, поскольку они также имеют прямое влияние.
Диагностика легочной гипертензии
Легочную гипертензию сложно диагностировать на ранней стадии, поэтому ее редко выявляют при обычном медицинском осмотре. Даже симптомы более поздней стадии легочной гипертензии часто схожи с другими заболеваниями сердца и легких.
Врач проводит медицинский осмотр и задает вопросы о медицинском и семейном анамнезе. После чего назначаются медицинские исследования, которые помогут поставить диагноз «легочная гипертензия» и определить ее причину. Тесты на легочную гипертензию могут включать:
- анализы крови;
- рентгенограмму грудной клетки;
- электрокардиограмму (ЭКГ);
- эхокардиограмму (иногда во время тренировки на велотренажере или беговой дорожке);
- катетеризацию правых отделов сердца;
- компьютерную томографию (КТ);
- магнитно-резонансную томографию (МРТ);
- тест легочной функции (измеряет, сколько воздуха могут удерживать легкие, а также поток воздуха в легкие и из них);
- полисомнограмму (во время сна);
- гистологическое исследование биопсийного материала открытого легкого;
- генетические тесты (если результат теста положительный, врач может порекомендовать пройти обследование и другим членам семьи).
Клиническое наблюдение
С целью акцентирования внимания на этой проблеме педиатров, детских кардиологов и пульмонологов приводим интересный клинический случай течения ЛАГ на фоне сочетания БЛД и врожденного порока сердца у ребенка с ЭНМТ при рождении.
Ребенок А. женского пола, от 1-й беременности, протекавшей с угрозой прерывания в первой и второй половине, рожден от 1-х преждевременных родов на 26-й нед. гестации, путем операции «кесарево сечение», с массой 870 г и длиной 34 см, с оценкой по шкале Апгар 4/6 баллов.
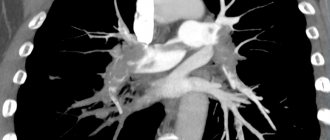
С первых часов жизни у девочки отмечалось тяжелое состояние с проявлением синдрома дыхательных расстройств. Проводились реанимационные мероприятия с применением ИВЛ, кислородотерапии, заместительная терапия сурфактантом, режим кувеза. На 2-е сут жизни выявлен гемодинамически значимый открытый артериальный проток (ОАП), применен ибупрофен внутривенно 3 дозы по обычной схеме, без положительного эффекта. В динамике проявления сердечной недостаточности нарастали. В связи с этим ребенок получал сердечные гликозиды, дофаминомиметики, β-адреномиметики (допамин, дигоксин, добутамин). На этой терапии состояние несколько стабилизировалось, хотя оставалось тяжелым. Отмечалась стойкая дыхательная недостаточность III степени, с 3-х сут отмечены анемия (Hb 102 г/л), гематурия, аускультативно в легких выслушивались мелкопузырчатые хрипы и крепитация с обеих сторон. На 8-е сут жизни выявлены рентгенологические изменения в виде двустороннего снижения пневматизации за счет нежных инфильтративных затенений в обоих легких с усилением бронхососудистого рисунка за счет интерстициального компонента (рис. 1), лейкоцитоз (21,0×109/л), имелась отрицательная динамика в анализах крови на 1-й нед. жизни (нарастание лейкоцитоза, СОЭ, снижение гемоглобина).
Был выставлен диагноз: Неонатальная пневмония, двусторонняя, очаговая, тяжелой степени тяжести, стадия инфильтрации. ДН III степени. Микробиологический посев из зева и эндотрахеального аспирата выявил Klebsiella pneumoniae
. Кроме того, у ребенка с отягощенным акушерским анамнезом, артериитом и флебитом пупочных сосудов, анемией, пневмонией регистрировались признаки SIRS (тромбоцитопения, нарушение терморегуляции, воспалительные изменения в крови), которые предполагали ведение его как угрожаемого по неонатальному сепсису. В связи с множеством заболеваний девочка получала комплексную терапию (в т. ч. антибактериальную) и продолжала длительно находиться на ИВЛ (FiO2 0,45; f 40 в 1 мин; piр. 19 мм в. ст.; SaO2 90–92%). Периодически предпринимались попытки снизить параметры ИВЛ, однако из-за стойкой гиперкапнии (pCO2 55 мм рт. ст.) и гипоксии (рО2 24 мм рт. ст.), ацидоза, по данным кислотно-щелочного состава крови (лактат 1,1 ммоль/л; сНСО3 38,2 ммоль/л; ВЕ 12,3 ммоль/л), низких показателей сатурации кислорода экстубировать ребенка не удавалось.
С 28-го дня жизни в соответствии с комплексом критериев [14] был выставлен диагноз: Бронхолегочная дисплазия недоношенных, новая форма, тяжелой степени. Основным моментом для постановки диагноза стала потребность в кислороде концентрацией более 21% на 28-е сут жизни, кислородозависимость в 36 нед. постконцептуального возраста свидетельствовала о тяжелом течении БЛД. На компьютерной томограмме были выявлены основные признаки БЛД — фиброзные тяжи, «матовое стекло», буллезные вздутия (рис. 2). По поводу заболевания ребенок получал терапию ингаляционным глюкокортикостероидом (ИГКС) будесонидом в дозе 1,0 мг/сут, муко- и бронхолитическую терапию через небулайзер (амброксол, фенотерол, ипратропия бромид).
В возрасте 2,5 мес. жизни подтвержден диагноз: Врожденный порок сердца (ВПС): ОАП. На ЭХО-КГ: ОАП 3,5 мм со сбросом крови в легочную артерию с градиентом 4 мм рт. ст., аневризма межпредсердной перегородки (АМПП) и открытое овальное окно 3,5 мм со сбросом крови справа налево, высокая ЛАГ 89 мм рт. ст. с расширением правого предсердия (ПП) (рис. 3).
На ЭКГ выявлялись признаки перегрузки ПП. Рентгенографически: признаки расширения правых отделов сердца. В гемограмме: анемия Hb 90 г/л, Эр 3,88 × 1012/л, ЦП 0,9, лейкоцитарная формула без признаков воспаления. Глюкоза крови составляла 5,0 ммоль/л, креатинин 51,5 ммоль/л, АЛТ 0,5 мкмоль/л, АСТ 0,94 мкмоль/л. В возрасте 3,5 мес. в Федеральном центре сердечно-сосудистой хирургии (Астрахань) проведена операция по поводу ОАП (лигирование). Ранний послеоперационный период прошел без осложнений.
По поводу выявленной патологии ВПС + ЛАГ ребенок получал комплексную терапию, включающую кислородотерапию, диуретики (спиронолактон под контролем креатинина и калия), силденафил (в дозе 3,5 мг × 4 р./сут), дигоксин в поддерживающей дозе (10 мг/кг/сут), добутамин (1,5 мкг/кг/мин). Состояние ребенка стабилизировалось, одышка уменьшилась, улучшился аппетит, и девочка начала прибавлять в массе тела от 350 г и более за неделю.
Выставлен диагноз: Глубокая недоношенность (26 нед. гестации). БЛД недоношенных, новая форма, тяжелой степени тяжести, дыхательная недостаточность II степени. ВПС: ОАП, сердечная недостаточность IIА стадии, ФК II, малая аномалия развития сердца: открытое овальное окно. Последствия гипоксического поражения ЦНС, синдром угнетения. Ранняя анемия недоношенных средней степени тяжести. Ретинопатия сетчатки обоих глаз III стадии, активная фаза.
Далее на фоне лечения и положительной клинико-лабораторной динамики (прирост весоростовых показателей, отсутствие воспалительных изменений в гемограмме, отрицательные показатели СРБ и ПКТ, отсутствие патологических отклонений остальных биохимических показателей, улучшение показателя SaО2: 94–95%) на 65-й день жизни ребенок был экстубирован и переведен на самостоятельное дыхание. Ингаляционная терапия по поводу тяжелой БЛД ИГКС (будесонидом) была продолжена в прежнем объеме.
На фоне стабилизации состояния в возрасте 5 мес. проведено оперативное лечение ретинопатии недоношенных (в Санкт-Петербургском государственном педиатрическом медицинском университете Минздрава России, отделении патологии новорожденных и детей грудного возраста). После операции в динамике у ребенка сохранялась стойкая дыхательная недостаточность (ЧДД 42–44, при беспокойстве до 85 в минуту; SаО2 90–94%), с которой связана продолжительная кислородная поддержка, общая продолжительность получения воздушно-кислородной смеси составила около 6 мес.
Амбулаторно ребенок наблюдался у педиатра, пульмонолога, кардиолога с диагнозом: Бронхолегочная дисплазия недоношенных, новая форма, тяжелой степени тяжести, осложненная вторичной высокой легочной гипертензией (89 мм рт. ст.). Состояние после коррекции ВПС (лигирование ОАП, АМПП, открытое овальное окно, эктопическая хорда в полости левого желудочка). Парез левой голосовой связки. Последствия гипоксического поражения ЦНС. Задержка физического и моторного развития. Ретинопатия сетчатки обоих глаз III стадии, активная фаза (оперативное лечение: транспупиллярная лазеркоагуляция сетчатки). Анемия недоношенных средней степени. Белково-энергетическая недостаточность III степени.
На протяжении первого года жизни ребенок имел крайне низкое физическое развитие, дисгармоничное за счет дефицита массы (в 1 год масса 6,0 кг и длина тела 58 см) -6,2SD и -3,2SD по росту и массе соответственно [17]. Обращали на себя внимание повышенная слабость, утомляемость, сухой кашель в течение дня, периодически стридорозное дыхание, одышка в покое смешанного характера от 65 дыхательных движений в минуту в покое, ремиссии и до 82 в минуту в периоды обострения БЛД. Сатурация кислородом в периферической крови при пульсоксиметрии составляла 90–95%. За период наблюдения наиболее тяжелое ухудшение состояния отмечалось дважды в возрасте 6 мес. и 8 мес., что было связано с респираторными инфекциями.
Девочка получала базисную терапию БЛД препаратом будесонид в дозе 1,0 мг/сут с момента установления диагноза непрерывно в течение 6 мес., затем 0,5 мг 1 р./сут в течение 6 мес. В период обострения заболевания доза ИГКС увеличивалась до 2,0 мг/сут, для купирования одышки применялся ипратропия бромид в дозе 0,075 мг (до 6 капель).
При амбулаторном лечении по поводу легочной гипертензии был продолжен курс силденафила в дозе 4 мг/кг/сут × 4 р./сут в течение 2 нед., затем 1 мг/кг/сут в течение 6 мес., спиронолактон 2 мг/кг × 2 р./сут.
За время наблюдения в течение 1 года систолическое давление в легочной артерии (СДЛА) имело положительную динамику. На ЭКГ регистрировался синусовый ритм, миграция водителя ритма, электрическая ось сердца резко отклонена вправо, â=+150°, ЧСС 120–150 в минуту, PQ 0,1. На ЭХО-КГ отмечается: состояние после лигирования ОАП, проток закрыт герметично, пограничные размеры правых камер сердца (правый желудочек 1,77 см; ПП 1,76 см). Глобальная сократимость левого желудочка не нарушена. Фракция выброса SF 60%. Эктопическая хорда в полости левого желудочка. Митральная регургитация 0–I степени. Трикуспидальная регургитация I степени. Легочная артерия 1,46 см, СДЛА 46 мм рт. ст. Перикард без особенностей. Максимальный градиент давления на Ао 8,1 мм рт. ст. Сатурация О2 94%.
На фоне лечения отмечена положительная динамика СДЛА с 89 до 46 мм рт. ст., клинические признаки ЛАГ значительно уменьшились, сохраняются признаки БЛД и последствия гипоксического поражения ЦНС, задержки физического и психомоторного развития, перенесенной коррекции ВПС.