Кратко о методе лечения
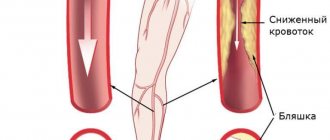
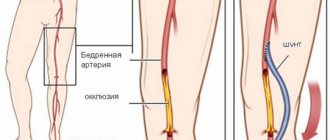
Бедренно-подколенное шунтирование — открытая хирургическая операция по созданию обходного пути для кровотока при закупорке бедренной артерии на ноге. Операция показана при критической ишемии и угрозе потери конечности, но иногда и при лимитирующей перемежающейся хромоте, если пациенту для повседневной жизни недостаточно проходимого расстояния. Операция заключается в соединении шунта (искусственного сосуда) с общей бедренной артерией в паховой области и проведении его к проходимому участку подколенной артерии выше или ниже коленного сустава. Бедренно-подколенное шунтирование может проводиться с помощью искусственного протеза или с помощью собственной вены пациента. Операция продолжается обычно около 60 минут, проводится под эпидуральной или спинальной анестезией. Для операции требуется как минимум два хирургических разреза. Эффективность операции высокая. При использовании ее по показаниям проходимость шунта составляет 80% в течение 5 лет.
Лечение критической ишемии нижних конечностей (КИНК) является одним из сложнейших вопросов современной сосудистой хирургии. Частота встречаемости КИНК достигает 500—1000 случаев на 1 млн населения в год [29].
Для лечения больного с КИНК врач выбирает один из двух вариантов: ампутация пораженной конечности или попытка восстановления кровотока по ней. В настоящее время от 70 до 90% ампутаций в мире проводят по поводу КИНК, в России этот показатель еще выше [8, 9, 22]. При ампутации ноги резко снижается качество жизни, уменьшается ее продолжительность [32, 33, 41]. С хирургической точки зрения, ампутация у больных данной категории не может являться операцией выбора. При ампутации ниже коленного сустава развивается до 60% гнойно-некротических осложнений [38], повторная ампутация в данном случае требуется еще у 15% больных [29], а летальность при ее выполнении превышает 30% [12]. Рана после ампутации выше колена заживает лучше, но процедура ухудшает возможность реабилитации больного.
Важнейшей задачей для сохранения конечности является поддержание кровотока на минимально необходимом уровне. Это достигается тремя путями [26, 28, 31, 45]:
— прямая реваскуляризация (шунтирующие операции или чрескожная ангиопластика магистральных артерий (ЧКА МА)
;
— непрямая реваскуляризация: денервирующие вмешательства, стимуляция неоангиогенеза хирургическая (перфорирующая остеотрепанация, пересадка большого сальника на конечность) и терапевтическая (введение мононуклеаров костного мозга, генных препаратов, тромбоцитарной взвеси);
— медикаментозное лечение.
Единой тактики для лечения таких больных до сих пор не определено, каждый из авторов старается показать наиболее оптимальный с его точки зрения метод как «панацею».
Общепризнано, что наиболее эффективным вариантом реконструкции является прямая реваскуляризация конечности. Однако при выполнении вмешательств врач сталкивается с рядом вопросов об экономической эффективности процедуры, отдаленных результатах и наибольшей безопасности для больного.
Большая часть больных с КИНК имеют тяжелые сопутствующие заболевания, которые увеличивают летальность в ближайшем послеоперационном периоде [21]. Лучший вариант лечения должен быть: малоинвазивным, безопасным, простым в исполнении и доступным для использования.
КИНК является жизнеугрожающим состоянием, при котором основной целью является сохранение конечности и жизни больного. С нашей точки зрения, лечение КИНК можно и нужно разделить на два этапа:
— 1-й этап: непосредственно спасение конечности
наименее инвазивным методом с последующей стабилизацией клинического состояния. Этот этап должен обеспечивать компенсацию кровообращения в ноге. Оптимальным условием считаем наличие магистрального кровотока в течение 3 мес после реконструкции. Этого срока достаточно для проведения тщательного обследования и коррекции сопутствующих заболеваний, например, выполнения реваскуляризации миокарда и/или реконструкции брахицефальных артерий (БЦА), а также реабилитации после этих вмешательств;
— 2-й этап: хирургическая реконструкция, направленная на поддержание функции конечности «неограниченно» длительный срок
.
Исходя из сказанного выше, мы будем анализировать варианты лечения в 2 клинических ситуациях: поражение на уровне бедренно-подколенного сегмента и на уровне подколенно-берцового сегмента. Аортобедренный сегмент из данного обзора исключен, так как по общему мнению данный вопрос решен в мировом сообществе: восстановление адекватного притока к ноге является залогом качества оказания помощи и не зависит от метода лечения (шунтирующие операции имеют схожие показатели отдаленной проходимости в сравнении с ЧКА) [24].
Восстановление кровотока по бедренно-подколенному сегменту
При планировании реконструкции бедренно-подколенного сегмента хирург сталкивается с выбором из 3 технологий: шунтирующая операция, ЧКА или ЧКА со стентированием. Современная хирургическая наука считает, что наиболее оптимальной ситуацией для выполнения ЧКА является короткий (до 10 см) стеноз или окклюзия поверхностной бедренной артерии (ПБА) [47]. В последнее время ведут работы по оценке безопасности выполнения ЧКА у больных с протяженным поражением, а также поражением, переходящим на подколенную артерию (C и D класс по классификации TASC II). Авторы демонстрируют высокий процент успешных ЧКА (около 94%) и удовлетворительные отдаленные результаты в сроки до 2 лет после выполнения вмешательства [23]. Такие результаты стали возможны с появлением гидрофильных проводников и техники субинтимальной ангиопластики. В большом метаанализе [18] продемонстрировано, что первичная ЧКА показывает схожие отдаленные результаты в сравнении с ЧКА+стентирование. В этой же работе отмечены схожие показатели качества жизни у больных обеих групп. В других исследованиях показано, что 2-летняя проходимость стентированного сегмента без поражения подколенной артерии достигает 87%, а при его поражении через 1 год работает всего 75% реконструкций [20, 46]. G. Rigatelli и соавт. [45] предложили использовать длительную баллонную ангиопластику с давлением 18 атмосфер в течение 2 мин с повторными сеансами, пока на ангиограмме не останется менее 30% резидуальных стенозов. По их данным, средняя продолжительность дилатации составила 5,9±1,9 мин с потребностью в имплантации стента у 11,9% из-за развившейся диссекции. Первичная проходимость зоны реконструкции составила 86,7% в течение 2 лет, что соответствует результатам с имплантацией покрытых стентов. Необходимо отметить, что более 60% больных в этой группе имели поражение TASC C.
Первичная хирургическая реваскуляризация сопровождается малой летальностью и практически 100% эффективностью в сохранении конечности больного. На основании данных литературы [35], можно утверждать об одинаковой степени сохранности конечности в ранние сроки после операции вне зависимости от используемого материала для шунтирования.
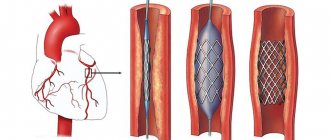
Бедренно-подколенное шунтирование (БПШ) на сегодняшний день является стандартной сосудистой операцией, обеспечивающей удовлетворительные результаты вне зависимости от протяженности поражения ПБА [42]. При оценке отдаленных результатов (до 5 лет) было показано, что проходимость аутовены почти в два раза выше, чем при использовании протеза (75% против 42% соответственно) [49]. С учетом этих данных при выполнении реконструкции рекомендуется использовать аутовенозный шунт из большой подкожной вены [2], однако описаны результаты эффективного применения трупных аллотрансплантатов в этой позиции [26, 39].
Последние чаще применяются при инфекции ранее установленного шунта, но стандартное применение их в качестве биологического материала позволит сократить сроки операции при удовлетворительных отдаленных результатах. Сохраненная собственная подкожная вена может быть в дальнейшем использована при реваскуляризации миокарда.
Для улучшения отдаленных результатов можно использовать гибридные операции — ЧКА в проксимальном отделе и БПШ коротким шунтом от дистального отдела ПБА до подколенной артерии (ПКА) [43]. В другом исследовании [51] продемонстрировано, что такой подход уменьшает число послеоперационных осложнений в 2 раза, но в отдаленном периоде показатели сохранения конечности остаются схожими с хирургической реваскуляризацией.
Сложностью реконструкции бедренно-подколенного сегмента является зависимость от состояния берцовых артерий. Чем лучше дистальное русло, тем лучше результаты. Учитывая, что около 17% больных имеют неудовлетворительное русло, необходимо продумывать тактику одновременного лечения на этом участке конечности [1].
По нашему мнению, при КИНК наиболее оправданным является этапная коррекция русла. Это связано с системными реакциями организма на пуск кровотока после длительной ишемии конечности [1]. Основной задачей хирурга является отбор группы больных, у которых сразу после восстановления кровотока по ПБА необходима реконструкция берцовых артерий ввиду высокого риска раннего тромбоза зоны реконструкции. Для этих больных, по нашему мнению, следует проводить ЧКА берцовых артерий. Для больных с удовлетворительным руслом показана изолированная реконструкция бедренно-подколенного сегмента с дальнейшими мероприятиями, направленными на улучшение кровотока по ноге.
Мы считаем, что у больных с КИНК на 1-м этапе следует проводить ЧКА ПБА без стентирования. Показанием к стентированию являются случаи диссекции интимы и значимого остаточного стеноза. Даже при условии малоудовлетворительных среднесрочных результатов такой подход позволит спасти конечность, начать реабилитацию и продолжить лечение уже в условиях хронической ишемии, используя все доступные методы коррекции дистального русла и/или повторных эндоваскулярных вмешательств. Также стоит учитывать, что ЧКА можно повторять «неограниченное» число раз для улучшения отдаленных результатов [3].
Восстановление кровотока по подколенно-берцовому сегменту
При атеросклеротическом поражении артерий ниже уровня коленного сустава хирурги сталкиваются с проблемой малой эффективности реконструктивных операций. Хирургическое лечение в этой области сопряжено с частой потерей конечности в результате быстрого тромбоза шунта [5, 11].
Использование эндоваскулярных методов позволяет улучшить отток по артериям голени, открыть окклюзии и, что важно, восстановить кровоток по плантарной дуге [7]. Последнее наиболее значимо для больных сахарным диабетом, а также в случаях угрозы малой ампутации. Проблема ЧКА заключается в быстром «рестенозе» берцовых артерий. При коррекции кровотока по голени состояние конечности возвращается на дооперационный уровень у 48% оперированных в течение 1 года [15, 33, 34]. Признаки рестеноза при контрольном обследовании обнаруживают у 2/3 больных уже через 3 мес [48]. Для больных сахарным диабетом эти результаты имеют меньшее значение — основной задачей при диабетической стопе является устранение трофических изменений (как главного инфекционного агента) за этот срок. Указанных 3 мес достаточно для решения этого вопроса у большинства больных [7]. Сохранение конечности у больных КИНК отмечено в 96,7% после выполнения ЧКА на уровне голени [17].
У больных с КИНК ампутация выполняется из-за недостатка кровоснабжения тканей. Перед хирургом встает выбор: для сохранения конечности требуется выполнение ангиопластики каждые 3—6 мес, что экономически не обосновано, или в эти сроки необходимо обеспечить альтернативный путь кровотока по голени и стопе.
Первый вариант имеет высокую трудозатратность и стоимость. Для выполнения изолированной ЧКА необходимо усовершенствование современного технического обеспечения и медикаментозных подходов к лечению. Наиболее распространенной практикой улучшения результатов ЧКА является имплантация стентов в зону стенозов после выполнения ангиопластики, однако в крупном метаанализе [50] продемонстрировано отсутствие эффективности такого подхода на периферических артериях.
После периферической ангиопластики всем больным на 3 мес назначают двойную антиагрегантную терапию, считается, что она улучшает отдаленные результаты [25]. В то же время непосредственно для стентирования берцовых артерий такие исследования не проводились. Цилостазол (сilostazol) также может являться препаратом, улучшающим результаты ЧКА на берцовом уровне. В других сосудистых бассейнах он позволяет значительно снизить частоту рестенозов и ампутаций [37, 40].
Второй путь подразумевает гибридный подход. Применение стимуляции ангиогенеза представляется оправданным способом. На сегодняшний день описаны два метода: терапевтический ангиогенез — введение мононуклеаров костного мозга, обогащенной тромбоцитами плазмы или генных препаратов [5, 13, 16, 30], и хирургический ангиогенез — за счет трансплантации большого сальника [10].
Терапевтический ангиогенез позволяет увеличить дистанцию безболевой ходьбы, уменьшить боли при КИНК и снизить частоту ампутаций [6]. В то же время метод достаточно новый и до сих пор у ученых нет точного представления механизма воздействия и частоты побочных явлений, особенно развития злокачественных новообразований. Хирургический ангиогенез в нашем понимании — это использование большого сальника для улучшения кровоснабжения тканей голени и стопы. Имплантация сальника на сосудистой ножке имеет два места приложения — закрытие дефектов кожных покровов и «прорастание» мышц конечности сосудами из жировой ткани. Основным ограничением для успешного применения трансплантации большого сальника при ишемии нижних конечностей является функциональное состояние регионарного кровообращения [14]. Свобода от ампутации у больных с КИНК в сроки до 5 лет при применении комбинированного лечения, шунтирующая операция совместно с имплантацией большого сальника на голень, достигает 87%, при этом у 42% полностью отсутствовали ограничения длительности ходьбы из-за перемежающейся хромоты [36].
Тактика реваскуляризации нижней конечности при критической ишемии
Эффективность борьбы за сохранение конечности при КИНК в большинстве случаев зависит от состояния дистального сосудистого русла. При минимальных изменениях берцовых артерий подходит любой способ реконструкции бедренно-подколенного сегмента. В крупном исследовании [19] продемонстрировано, что в сроки до 2 лет сохранение конечности схоже между БПШ и ЧКА ПБА, в большие сроки выявлено явное преимущество использования аутовены перед другими методами. Учитывая тяжесть состояния больного, вероятно, ЧКА является операцией выбора с дальнейшей подготовкой больного к выполнению дистального шунтирования.
При неудовлетворительном дистальном русле необходимо восстановить кровоток по максимальному числу берцовых артерий, используя ЧКА. Это позволяет хирургу стабилизировать клиническую ситуацию и дает время на подбор сбалансированной тактики и коррекцию сопутствующей патологии. Зачастую рестенозы развиваются в срок от 3 до 6 мес. За это время необходимо провести компенсацию конечности и, по возможности, улучшить объем принимающего дистального русла. Наиболее оправданной тактикой может являться применение методов ангиогенеза. Терапевтический ангиогенез достаточно слабо изучен, поэтому мы предлагаем использовать трансплантацию большого сальника. По нашему мнению, его необходимо пересаживать на сосудистой ножке. Артерией притока может являться любая дистальная ветвь глубокой артерии бедра. Эти ветви редко поражаются атеросклерозом и располагаются в стороне от мест доступа к ПБА. Важным хирургическим приемом считаем распределение массы большого сальника в зоне скопления основного мышечного массива и проведение его к дистальным отделам стопы.
Исходя из проанализированной литературы, эту операцию не желательно делать в острый период ишемии, так как для наилучшего приживления трансплантируемой ткани необходима компенсация кровотока по конечности. По нашему мнению, именно эта операция позволит наиболее длительно сохранить конечность.
Как возможный вариант следует рассматривать гибридную хирургию: БПШ + ЧКА берцовых артерий. Из недостатков метода можно отметить относительно короткий срок восстановления кровотока по голени, необходимость ежемесячного мониторирования проходимости берцовых артерий и выполнение повторной ЧКА при значимом стенозировании. Эти недостатки, вероятно, могут быть решены за счет применения современных антиагрегантных средств.
Преимущества лечения в ИСЦ
Техника бедренно-подколенного шунтирования в нашей клиники отработана до ювелирной точности. Мы используем эту оперцию чаще всего, как элемент гибридной хирургии при тяжелых поражениях артерий нижней конечности. Для улучшения результатов лечения пациентов с многоэтажными поражениями мы используем бедренно-подколенный шунт, через который затем выполняем ангиопластику и стентирование артерий голени. В качестве самостоятельной операции выполнять бедренно-подколенное шунтирование нет необходимости, так как при изолированной закупорке бедренной артерии у пациентов чаще всего серьезных жалоб нет.
Особенностями операции в нашей клинике является обязательный ультразвуковой контроль за кровотоком во время операции. При выявлении проблем в работе шунта мы выполняем рентгеновскую контрастную ангиографию и можем с помощью ангиопластики улучшить результаты вмешательства.
Подготовка к лечению
Подготовка к операции заключается в специальном обследовании, позволяющем определить характер поражения сосудов:
- УЗИ артерий нижних конечностей
- МСКТ аорты и артерий конечностей
Общем обследовании, определяющем сопутствующую патологию и риски операции:
- Эхокардиография (УЗИ сердца)
- Гастроскопия (ЭГДС)
- Рентгенография легких
- Комплекс анализов для госпитализации
Непосредственная подготовка к вмешательству:
- Бритье операционного поля от паха до средней трети голени проводится в день операции
- Не принимать пищу позже семи часов вечера накануне операции
- Очистительная клизма на ночь
- Установка мочевого катетера (непосредственно на операционном столе)
Зачем необходима процедура?
Эта операция выполняется при наличии стено-окклюзирующих поражений бедренных и подвздошных артерий. Помогает предотвратить развитие атеросклеротических процессов и избежать:
- недостатка кровоснабжения нижних конечностей;
- перемежающейся хромоты;
- утомляемости мышц голени, бедра и ягодиц;
- облитерирующего атеросклероза;
- язв;
- ишемии;
- гангрены;
- ампутации.
Восстановление аорты устраняет боли в области ягодицы, а бедренной и подвздошной артерий – в районе голени и бедра. Операция также является профилактикой ишемии стопы.
Обезболивание при лечении
Операция может проводится под местной, спинальной или эпидуральной анестезией. В нашей клинике используется преимущественно эпидуральная анестезия, так как эпидуральный катетер позволяет проводить эффективное обезболивание в послеоперационном периоде.
Катетер устанавливается в область поясницы с помощью укола специальной иглой. После проведения катетера в перидуральное пространство вводится небольшое количество анестетика, а пациент рассказывает о своих ощущениях. Постепенно доза увеличивается и отключается чувствительность в ногах, а затем и движения.
Во время операции доктор подключает к пациенту следящий монитор, который измеряет давление, с помощью манжеты на плече и снимает ЭКГ в трех отведениях. Кроме того, на палец кисти надевается специальный датчик — пульсоксиметр, который измеряет пульсовую волну и насыщение крови кислородом (сатурацию).
Как проходит метод лечения
Пациент укладывается на операционном столе на спину. Под колено больной ноги укладывается валик. Вся нога и паховая область обрабатывается специальным антисептическим раствором. Стопа укладывается в специальную пеленку, паховая область так же закрывается пеленкой.
Ревизия артерии оттока
Разрез для оценки артерии может быть в нижней трети бедра (выше колена) или сразу ниже коленного сустава, в зависимости от проходимости того или иного участка артерии по данным предварительного обследования. Длина разреза обычно 7-10 сантиметров.
После выделения артерии хирург оценивает ее плотность, наличие атеросклеротических бляшек, с помощью двухпинцетной пробы оценивается заполняемость артерии из голени. Если артерия признана пригодной для шунтирования, то она берется на держалку, если нет, то выделяется на другом участке.
Ревизия артерии притока и проксимальное (верхнее) соустье
Следующий разрез проводится в паховой области. Там должна быть выделена общая бедренная артерия, вместе с ветвями — глубокой и поверхностной. Этот участок артерии является местом, откуда будет запитываться шунт.
Если общая бедренная артерия пригодна как донорский сосуд , то производится ее пережатие сосудистыми зажимами. До этого внутривенно вводится раствор гепарина. После пережатия артерии она рассекается продольно, на 2-3 см. В разрез артерии обвивным швом вшивается сосудистый протез. Сразу после его вшивания зажимы снимаются, а протез заполняется физиологическим раствором с гепарином.
Проведение шунта
Следующим этапом создается тоннель под кожей, для проведения сосудистого протеза. Мы стараемся проводить протез как можно глубже, под мышцами, так как в случае инфекции в ранах, он не попадает в инфицированную зону.
Дистальный анастомоз (нижнее соустье)
Протез выводится в нижнюю рану, где в артерии так же делается продольный разрез, оценивается кровоток из низлежащих отделов. Протез пришивается сосудистым швом в рану артерии. Снимаются все сосудистые зажимы и запускается кровоток.
Контрольное исследование после реконструкции
В нашей клинике после этого всегда проводится интраоперационное УЗИ восстановленных артерий. Кровотока по шунту и подколенной артерии, а так же оценивается кровоток ближе к стопе. Обязательно проводятся пробы с пережатием шунта, чтобы оценить, насколько кровоток в ноге зависим от этого шунта.
Если при контрольном УЗИ выявляются проблемы с проходимостью артерии в анастомозе или в артериях ниже, высокое сопротивление по шунту, то мы проводим рентгеновскую ангиографию, для выявления возможных проблем. При обнаружении сужений сосудов мы выполняем ангиопластику или стентирование проблемных артерий.
Завершение операции
Проводится оценка кровоточивости анастомозов. Если кровотечения не отмечается, то в раны устанавливаются специальные силиконовые трубки (дренажи), которые подключаются к пластиковым грушам. Это необходимо для удаления скопления жидкости возле анастомозов и контроля за возможным кровотечением.
Раны пациента заклеиваются специальными повязками и он переводится в отделение для дальнейшего наблюдения.
Методы лечения окклюзии бедренной артерии
При ограниченной окклюзии организм может компенсировать кровообращение конечности с помощью кровотока по боковым ветвям артериальной системы (коллатерального кровообращения). В этом случае возможно консервативное лечение.
При нарастании тяжести ишемических симптомов, перемежающейся хромоте возникающей менее через 100 метров ходьбы, болей в состоянии покоя необходимо прибегнуть к хирургическому лечению. Подобные симптомы означают, что компенсация кровообращения недостаточна, а это грозит развитием язвенно-некротических изменений, гангреной и потерей конечности.
Хирургическое лечение
При хирургическом лечении окклюзии в зависимости от области поражения артерии используются:
- эндартерэктомия (удаление атеросклеротических отложений из просвета артерии);
- бедренно-подколенное шунтирование;
- бедренно-берцовое шунтирование (если есть сопутствующая окклюзия подколенной артерии).
Записаться на прием Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Оцените, насколько был полезен материал
Спасибо за оценку
Возможные осложнения при лечении
Бедренно-подколенное шунтирование является хорошо отработанной операцией и осложнения при ней встречаются редко. Однако иногда они все же случаются. Мы разделили их на несколько групп.
Осложнения во время операции:
- Кровотечение — встречается очень редко, чаще при резком поражении артериальной стенки кальцинозом.
- Повреждение глубоких вен — крайне редкое осложнение, связанное с проведением держалки под артерией при выраженном спаечном процессе. Приводит к массивному венозному кровотечению.
- Повреждение близлежащих нервов — при хорошем знании анатомии практически не встречается. В последствие может быть снижение чувствительности кожи на ноге.
- Повреждение лимфатических сосудов — может наблюдаться при неправильном подходе к сосудистому пучку в паховой области, либо при повторных вмешательствах через рубцовые ткани.
Осложнения общего характера:
- Геморрагический шок — может наблюдаться при кровотечении во время операции.
- Инфаркт миокарда — редкое осложнение, наблюдаемое у пациентов с исходным тяжелым поражением коронарных артерий.
Послеоперационные осложнения:
- Кровотечение в послеоперационном периоде — случается чаще всего в первые сутки после операции, поэтому и устанавливается дренаж для контроля.
- Лимфоррея или лимфоцеле — истечение лимфатической жидкости из послеоперационной раны или скопление ее в подкожной клетчатке. Для коррекции требуются пункции скоплений жидкости или тщательные перевязки. Постепенно проходит самостоятельно.
- Лимфатический отек — может наблюдаться увеличение объема ноги на несколько сантиметров. Проходит в течение 2-3 месяцев.
- Нагноение протеза в позднем послеоперационном периоде — может возникнуть вследствие плохого заживления ран и при попадании инфекции на сосудистый протез. Осложнение очень опасное и чревато дополнительными осложнениями. При выявлении, требует удаления сосудистого протеза и повторной сосудистой операции для восстановления кровотока.
Цветовое дуплексное сканирование после шунтирующих операций на артериях нижних конечностей
УЗИ сканер HS70
Точная и уверенная диагностика.
Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Введение
Современные клинические рекомендации по диагностике и лечению стеноокклюзирующих заболеваний аорты и артерий нижних конечностей рассматривают цветовое дуплексное сканирование в качестве эффективного метода в оценке характера, локализации, протяженности и степени поражения в каждом сегменте артериального русла (класс показаний I, уровень доказательности В) [1-4]. При динамическом наблюдении пациентов, перенесших операцию шунтирования на артериях нижних конечностей, ультразвуковое исследование сосудов является методом выбора для диагностики стеноза шунта и осложнений реконструктивных операций [5]. Многочисленные исследования показали, что без превентивного хирургического вмешательства риск тромбоза стенозированного шунта составляет около 25% [6-8], а регулярное наблюдение с помощью дуплексного сканирования позволяет уточнять или определять показания к превентивным вмешательствам, включая ангиопластику или замену фрагмента шунтирующего сосуда [4].
Виды шунтирующих операций
Операции шунтирования, в зависимости от уровня наложения проксимального (центрального) и дистального анастомозов, подразделяют на аорто-бедренное (аорто-бифеморальное) шунтирование, подвздошно-бедренное, бедренно-подколенное (выше или ниже щели коленного сустава), бедренно-заднебольшеберцовое шунтирование и др. В качестве шунтирующего сосуда (трансплантанта) может быть использована аутовена и протезы (синтетические или биологические), которые анастомозируются с артериями по типу «конец в конец» (рис. 1, 2) или «конец в бок» (рис. 3-5) [9,10].
Рис. 1.
Бедренно-подколенное шунтирование комбинированным протезом, анастомоз по типу «конец в конец».
Продольное сечение, стрелка 1 — место соединения синтетического протеза из дакрона (стрелка 2) и биологического протеза (внутренняя грудная артерия быка, стрелка 3). Локализация промежуточного анастомоза — выше уровня щели коленного сустава (уровень верхнего края надколенника).
Рис. 2.
Подвздошно-бедренное шунтирование синтетическим протезом из дакрона, проксимальный анастомоз по типу «конец в конец».
а)
Ангиограмма. Продольное сечение, стрелка 1 — место соединения общей подвздошной артерии (стрелка 2) с протезом (стрелка 3).
б)
Эхограмма. Продольное сечение, стрелка 1 — место соединения общей подвздошной артерии (стрелка 2) с протезом (стрелка 3).
Рис. 3.
Аорто-бедренное шунтирование синтетическим протезом из дакрона, проксимальный анастомоз с аортой по типу «конец в бок».
Продольное сечение, стрелка 1 — аорта, стрелка 2 — протез, стрелка 3 — просвет между аортой и протезом.
Рис. 4.
Подвздошно-бедренное шунтирование синтетическим протезом из дакрона, дистальный анастомоз с общей бедренной артерией по типу «конец в бок».
а)
Продольное сечение на уровне дистального анастомоза. Стрелка 1 — стенка синтетического протеза, стрелка 2 — сегмент поверхностной бедренной артерии, стрелка 3 — сегмент глубокой бедренной артерии, стрелка 4 — задняя стенка общей бедренной артерии.
б)
Поперечное сечение на 3-5 мм выше уровня дистального анастомоза (уровень поперечного сечения показан точкой на рисунке «а»). Стрелка 1 — протез, стрелка 2 — общая бедренная артерия.
в)
Поперечное сечение на уровне дистального анастомоза. Стрелка 1 — передняя стенка протеза, стрелка 2 — задняя стенка общей бедренной артерии.
Рис. 5.
Бедренно-подколенное шунтирование аутовеной, дистальный анастомоз с подколенной артерией по типу «конец в бок».
Продольное сечение. Стрелка 1 — аутовена, стрелка 2 — подколенная артерия.
При реконструктивных операциях на артериях бедренно-подколенного и берцового сегментов аутовенозное шунтирование (в позиции in situ или реверсированной большой подкожной веной) характеризуется меньшей частотой тромбоза шунта в отдаленном периоде по сравнению с шунтированием протезом [4, 11-12] (рис. 5-7).
Рис. 6.
Стеноз бедренно-подколенного аутовенозного шунта более 70%, группа наивысшего риска. Стеноз вне зоны анастомоза — верхняя 1/3 шунта (средняя 1/3 бедра).
а)
Допплерограмма кровотока из шунта на 3-5 см выше зоны стеноза (Vps — 83 см/с).
б)
Допплерограмма кровотока из зоны стеноза (Vps — 430 см/с).
в)
Допплерограмма кровотока на 8-10 см дистальнее зоны стеноза (Vps — 35 см/с).
г)
Допплерограмма кровотока из шунта на 2-3 см выше уровня дистального анастомоза (Vps — 25 см/с).
Рис. 7.
Бедренно-подколенный аутовенозный шунт без признаков стеноза, низкий риск тромбоза шунта.
а)
Область проксимального анастомоза, продольное сечение, отсутствует дефект наполнения в режиме ЦДК.
б)
Допплерограмма кровотока из зоны проксимального анастомоза (Vps — 125 см/с).
в)
Допплерограмма кровотока из средней 1/3 шунта (Vps — 76 см/с).
г)
Допплерограмма кровотока из шунта на 2-3 см выше уровня дистального анастомоза (Vps — 80 см/с).
Самым длительным эффектом обладают аорто-бедренные шунты [13-14]. При аорто-бедренном шунтировании используют синтетические протезы, материал которых может быть представлен фторлавсаном или дакроном с ребристой структурой (см. рис. 2-4), политетрафторэтиленом или полиуретаном [4, 10] с гладкой внутренней поверхностью (рис. 8).
Рис. 8.
Аорто-бедренное шунтирование синтетическим протезом из политетрафторэтилена, проксимальный анастомоз.
Стрелка 1 — аорта, стрелка 2 — протез.
В ряде исследований показана высокая эффективность операций с применением биологических протезов [15-16], которые представляют собой специально обработанную пупочную вену или сосуды животных (крупного рогатого скота, свиней). Биологические протезы не отличаются по своей структуре от нативной артерии или вены (рис. 9). Однако биологические протезы, по сравнению с аутовенозными и синтетическими, в большей степени могут быть подвергнуты аневризматическому расширению и последующему тромбообразованию (рис. 10).
Рис. 9.
Бедренно-подколенное шунтирование биологическим протезом (внутренняя грудная артерия быка), средняя 1/3 протеза.
Стрелка 1 — биологический протез, стрелка 2 — анэхогенное жидкостное образование (экссудат) в парапротезном пространстве, косвенный признак воспаления.
Рис. 10.
Аневризматическое расширение и пристеночный тромбоз биологического протеза.
Показана средняя 1/3 бедренно-подколенного шунта, протез неравномерно расширен. Стрелка 1 — функционирующий просвет протеза, стрелка 2 — тромбомассы на уровне максимального аневризматического расширения.
В некоторых случаях в качестве шунтирующего сосуда используют комбинацию протезов (синтетический протез соединяется с аутовеной или соединяют между собой синтетический и биологический протезы) (см. рис. 1). Если реконструкция бедренно-подколенного сегмента выполняется после коррекции поражения аортоподвздошного сегмента, то лучшие результаты наблюдаются при формировании анастомоза с браншей протеза в области дистального анастомоза [4].
Периодичность дуплексного сканирования
Пациенты, перенесшие аутовенозное шунтирование, должны быть периодически (по крайней мере в течение первых 2 лет после операции) обследованы методом дуплексного сканирования с измерением пиковой систолической скорости кровотока (Vps) и расчетом соотношения скоростей кровотока на протяжении всей длины шунта (класс показаний I, уровень доказательности С) [4]. Обследование методом дуплексного сканирования рекомендуется в первый месяц от момента хирургического вмешательства. В том случае, если стеноз аутовенозного шунта не выявляется в первый месяц (примерно 80% шунтов), рекомендуется наблюдение с 6-месячным интервалом в течение первого года, а затем, по истечении первого года после аутовенозного шунтирования, ежегодно [10, 17]. Наблюдение за протезными реконструкциями, как и после аутовенозных реконструкций, рекомендуется с 6-месячным интервалом [17]. Однако в одной из ключевых клинических рекомендаций — Trans-Atlantic Inter-Society Consensus (TASC II) отмечается необходимость только регулярного клинического обследования и измерения плечелодыжечного индекса давления [18].
Основные задачи дуплексного сканирования
В связи с тем, что тромбоз шунта сопровождается низкой вероятностью сохранения конечностей, первостепенными задачами динамического ультразвукового исследования сосудов после шунтирующих операций являются обнаружение ультразвуковых признаков повышенного риска развития тромбоза шунта и ранняя диагностика тромбоза шунта.
Диагностика тромбоза шунта не вызывает затруднений. Заключение о тромбозе делается на основании обнаружения структур в просвете шунта в В-режиме, при отсутствии кровотока в шунте по данным цветового и импульсно-волнового допплеровских режимов (рис. 10, 11), а также на основании характеристик кровотока ниже области дистального анастомоза.
Рис. 11.
Тромбоз (окклюзия) шунта.
а)
Средняя 1/3 бедренно-подколенного аутовенозного шунта. В просвете шунта визуализируются гетерогенные, преимущественно гиперэхогенные структуры (стрелка), кровоток в режиме ЦДК не регистрируется.
б)
Бедренно-подколенное шунтирование протезом из политетрафторэтилена. Средняя 1/3 протеза, анэхогенные структуры в протезе (стрелка), кровоток в режиме ЦДК не регистрируется.
Обнаруженные при ультразвуковом исследовании косвенные признаки воспаления (экссудата) в проекции протеза и инфицирования протеза (см. рис. 9) являются неблагоприятными прогностическими факторами, сопровождающимися высоким риском тромбоза шунта в раннем послеоперационном периоде.
Наиболее значимыми и распространенными предвестниками тромбоза шунта являются стенозы центрального и/или дистального анастомозов, стенозы шунтов вне зон анастомозов, а также снижение скоростных показателей кровотока по шунту [10] (рис. 6, 12, 13). Детально изучена роль дуплексного сканирования после операций аутовенозного шунтирования. Установлено, что около 20% инфраингвинальных аутовенозных шунтов имеют остаточный послеоперационный стеноз или стеноз развивается в течение первого года после реконструкции [6, 10]. Стенозы локализуются как в области анастомозов, так и в любом другом сегменте шунта. Для искусственных или биологических протезов стенотическое поражение протеза вне зон анастомозов менее характерно по сравнению с аутовенозными шунтами [10] (см. рис. 6).
Рис. 12.
Подвздошно-бедренное шунтирование синтетическим протезом из дакрона, стеноз в области дистального анастомоза 50-75%, группа высокого риска.
а)
Допплерограмма кровотока из шунта на 3-5 см выше уровня дистального анастомоза (Vps — 34 см/с).
б)
Допплерограмма кровотока из зоны стеноза (Vps — 292 см/с).
в)
Поперечное сечение поверхностной бедренной артерии в области дистального анастомоза, планиметрическая оценка степени стеноза «по диаметру», стеноз 59%.
г)
Магистральный кровоток в поверхностной бедренной артерии в средней 1/3 бедра (Vps — 111 см/с). Нормальные характеристики кровотока ниже дистального анастомоза позволяют исключить стеноз более 75% и подтверждают результаты планиметрической оценки «по диаметру».
Рис. 13.
Подвздошно-бедренное шунтирование синтетическим протезом из фторлавсана, низкоскоростной кровоток в протезе.
Допплерограмма кровотока из средней 1/3 протеза (Vps — 30 см/с), значимые сужения проксимальных и дистальных сегментов сосудистого русла не обнаружены.
В протоколе ультразвукового исследования аорты и артерий нижних конечностей после шунтирующих операций особое внимание уделяется описанию структурно-анатомических изменений приносящих сосудов и характеристике кровотока в них, характеристике кровотока и оценке состояния проксимального, дистального анастомозов и шунтирующего сосуда на всем протяжении, а также описанию структурно-анатомических изменений выносящих сосудов и характеристике кровотока в них [10].
При исследовании шунтирующего сосуда делаются акценты на анализе Vps и расчете отношения пиковой скорости кровотока в зоне ее локального увеличения (в зоне стеноза) к пиковой скорости кровотока, зарегистрированной проксимальнее стеноза (Vps-ratio). Кроме того, протокол ультразвукового исследования требует максимально полного описания планиметрических характеристик стенозированного сегмента шунта, а в случае аутовенозного шунтирования — оценки диаметра шунтирующей вены в поперечном сечении над и ниже стеноза, протяженности стеноза и четкого указания анатомической локализации стеноза.
Допплерографическая градация степени стеноза и группы риска тромбоза шунта
Существует допплерографическая градация степени стеноза аутовенозных шунтов, которая базируется на оценке Vps в зоне стеноза и Vps-ratio [19], разработанная на основании сопоставления данных дуплексного сканирования с результатами ангиографии (табл.).
Таблица.
Допплерографические критерии степени сужения аутовенозного шунта.
| Степень стеноза,% | Vps в зоне стеноза, см/с | Vps-ratio, у.е. |
| 20-50 | 1,5-2,4 | |
| 50-75 | > 180 | 2,5-4,0 |
| > 75 | > 300 | > 4,0 |
Однако наибольшей прогностической эффективностью обладает оценка степени риска тромбоза аутовенозного шунта на основе комбинации таких показателей, как Vps в зоне стеноза, Vps-ratio, средняя Vps в шунте (среднее значение пиковой систолической скорости кровотока из 3-4 равноудаленных зон шунта вне области стеноза) и лодыжечно-плечевой индекс давления (ЛИД). Низкая скорость кровотока по шунту увеличивает риск тромбоза [20]. Риск тромбоза аутовенозного шунта ниже по сравнению с искусственным протезом [10], а профилактическое назначение антикоагулянтной и дезагрегантной терапии снижает риск развития тромбоза низкоскоростных шунтов [6-7].
К группе наивысшего риска (I степень) с угрозой тромбоза в ближайшее время относятся шунты, стенозированные более чем на 70% с Vps в зоне стеноза > 300 см/с, Vps-ratio > 3,5 у.е., с низкоскоростным кровотоком по шунту (средняя Vps
К группе высокого риска тромбоза (II степень) относятся шунты, стенозированные более чем на 70% с Vps в зоне стеноза > 300 см/с, Vps-ratio > 3,5 у.е., с нормальной скоростью кровотока по шунту вне области стеноза (средняя Vps > 45 см/с) и уменьшением ЛИД (по сравнению с предшествующей оценкой) менее чем на 0,15 у.е.
Группы наивысшего и высокого риска тромбоза (I и II степень) требуют ревизии шунта и хирургического восстановления его проходимости. Вероятность прогрессирования стеноза или развития тромбоза в этих группах в течение 3-6 месяцев составляет 40-50%. Для группы наивысшего риска (I степень) рекомендуется немедленное восстановление проходимости шунта, в то время как для группы высокого риска (II степень) возможно восстановление в плановом порядке в течение 1-2 нед.
К группе умеренного риска тромбоза (III степень) относятся шунты, стенозированные на 50-70% с Vps в зоне стеноза 180-300 см/с, Vps-ratio > 2 у.е., с нормальной скоростью кровотока по шунту вне области стеноза (средняя Vps > 45 см/с) и уменьшением ЛИД (по сравнению с предшествующей оценкой) менее чем на 0,15 у.е.
К группе низкого риска тромбоза (IV степень) относятся шунты, не стенозированные или стенозированные 45 см/с) и уменьшением ЛИД (по сравнению с предшествующей оценкой) менее чем на 0,15 у.е. (см. рис. 7).
В группах риска III и IV степени поражения шунта, обнаруженные в первые 3 мес. от момента шунтирования, в 20-30% случаев регрессируют, в 10-20% случаев остаются стабильными, а в 40-50% случаев прогрессируют до стеноза более 70%.
Для группы умеренного риска рекомендуется динамическое наблюдение с интервалом в 4-6 нед для подтверждения или исключения прогрессирования стеноза. При динамическом исследовании прогрессирование стеноза подтверждается увеличением Vps в зоне стеноза, уменьшением среднего значения Vps по шунту вне области стеноза и снижением ЛИД > 0,15 у.е. и, соответственно, переходом в группу высокого или наивысшего риска [10].
В сравнении с аутовенозным шунтированием исследования, посвященные роли дуплексного сканирования в наблюдении протезных шунтов и определении показаний к хирургическому вмешательству на измененных протезах, не так многочисленны. Однако было показано, что после протезного шунтирования включение в программу наблюдения дуплексного сканирования и выполнение реконструктивного вмешательства на шунтирующих сосудах на основании его результатов сопровождается 5-летней проходимостью шунтов около 88% и превосходит таковые показатели без динамического дуплексного наблюдения [7]. При бедренно-бедренном протезном шунтировании ультразвуковыми предвестниками тромбоза шунта являются Vps в приносящей подвздошной артерии более 300 см/с, наличие стеноза протеза с локальным увеличением Vps более 300 см/с и средним значением Vps в протезе менее 60 см/с [7]. Детальная допплерографическая градация степени стеноза и степени риска тромбоза для синтетических и биологических протезов отсутствует. В связи с этим допустимо использование ультразвуковых критериев степени стеноза и степени риска тромбоза аутовенозных шунтов для синтетических и биологических протезов (рис. 12).
В качестве прогностического критерия риска тромбоза протезного шунта может быть использовано среднее значение Vps в протезе менее 45 см/с [8]. Однако низкая скорость кровотока по шунту (рис. 13) прежде всего предполагает тщательное исследование проксимальных и дистальных сегментов сосудистого русла с целью исключения/подтверждения значимых сужений. Самостоятельное значение низкой скорости кровотока по шунту до конца не определено, однако требует в протоколе ультразвукового исследования указания: «снижение скоростных показателей кровотока по шунту».
Одним из предрасполагающих факторов к развитию тромбоза является перегиб (перекрут) шунта/протеза (рис. 14), сопровождающийся сужением функционирующего просвета и локальными нарушениями кровотока в виде увеличения Vps.
Рис. 14.
Аорто-бедренное шунтирование синтетическим протезом из дакрона, перегиб протеза.
а)
Продольное сечение протеза на 2-4 см ниже уровня проксимального анастомоза, стрелкой показан перегиб протеза.
б)
Допплерограмма кровотока из области перегиба, Vps локально увеличена до 150 см/с.
Диагностика осложнений шунтирующих операций
Дуплексное сканирование обладает высокой точностью в диагностике таких осложнений шунтирующих операций, как аневризма сосудов в области проксимального (центрального) и/или дистального анастомозов (рис. 15), аневризма протеза на протяжении (более характерно для биологических протезов, рис. 10), диагностике пульсирующей гематомы (рис. 16), ложной аневризмы в области проксимального или дистального анастомозов (рис. 17), а также в диагностике артериовенозных фистул (рис. 18, 19).
Рис. 15.
Подвздошно-бедренное шунтирование синтетическим протезом из дакрона, аневризма в области дистального анастомоза.
а)
Допплерограмма кровотока из шунта на 1-2 см выше уровня дистального анастомоза (Vps — 120 см/с).
б)
Зона дистального анастомоза, стрелка 1 — протез, стрелка 2 — расширенная общая бедренная артерия (диаметр — 17 мм).
в)
Магистральный кровоток в поверхностной бедренной артерии на 1-2 см ниже уровня дистального анастомоза (Vps — 70 см/с).
Рис. 16.
Пульсирующая гематома в подвздошно-паховой области. Исследование проведено в первые сутки от момента хирургического вмешательства.
а)
Продольное сечение. Стрелка 1 — полость гематомы, стрелка 2 — общая бедренная артерия, стрелка 3 — канал между общей бедренной артерией и полостью гематомы, диаметр канала — 3-3,5 мм.
б)
Допплерограмма кровотока из канала, Vps локально увеличена до 320 см/с.
Рис. 17.
Ложная аневризма в области дистального анастомоза подвздошно-бедренного шунта. Исследование проведено через 3 месяца от момента хирургического вмешательства.
а)
Продольное сечение. Стрелка 1 — аневризматический мешок, стрелка 2 — широкое основание аневризматического мешка, стрелка 3 — синтетический протез, стрелка 4 — поверхностная бедренная артерия.
б)
Допплерограмма из шунта перед областью аневризматического мешка, магистральный кровоток, Vps — 84 см/с.
в)
Допплерограмма из средней 1/3 поверхностной бедренной артерии, дистальнее аневризматического мешка, магистральный кровоток, Vps — 103 см/с.
Рис. 18.
Артериовенозная фистула между поверхностной бедренной артерией и поверхностной бедренной веной, верхняя 1/3 бедра. Состояние после тромбэктомии из поверхностной бедренной артерии.
а)
Допплерограмма кровотока из области фистулы, диаметр фистулы — 2,5-3 мм. Стрелка 1 — поверхностная бедреннартерия, стрелка 2 — поверхностная бедренная вена.
б)
Допплерограмма из поверхностной бедренной вены на 3-5 см дистальнее фистулы, характер кровотока псевдоартериальный, Vps — 45 см/с.
Рис. 19.
Артериовенозная фистула после аутовенозного шунтирования in situ в нижней 1/3 бедра. Исследование через 1-е сутки после шунтирования.
а)
Допплерограмма кровотока из аутовенозного шунта на 4-5 см выше фистулы (притока аутовены), средняя 1/3 бедра, характер кровотока магистрально-измененный (низкорезистентный), Vps — 120-130 см/с, RI — 0,8 у.е.
б)
Допплерограмма из фистулы (притока аутовены), характер кровотока артериальный, Vps — 95 см/с.
Заключение
Очевидно, что дуплексное сканирование — это первичная диагностическая процедура при подозрении на нарушение функционирования шунта в любой период от момента проведения реконструктивной операции. Результаты дуплексного сканирования, проведенного опытным специалистом, могут рассматриваться в качестве показаний для проведения ангиографического исследования [9] или для превентивного хирургического вмешательства на шунтирующих сосудах [4].
Литература
- Hirsch A.T., Haskal Z.J., Hertzer N.R., et al. ACC/AHA 2005 Guidelines for the Management of Patients With Peripheral Arterial Disease (Lower Extremity, Renal, Mesenteric, and Abdominal Aortic): A Collaborative Report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease) // J Am Coll Cardiol. 2006. N 47. P. e1-e192.
- Layden J., Michaels J., Bermingham S., et al. Diagnosis and management of lower limb peripheral arterial disease: summary of NICE guidance // BMJ. 2011. N 345. P. e4947.
- Rooke T.W., Hirsch A.T., Misra S., et al. ACCF/ AHA Focused Update of the Guideline for the Management of Patients With Peripheral Artery Disease (Updating the 2005 Guideline) // J Am Coll Cardiol. 2011. V. 58. N 19. P. 2020-2045.
- Национальные рекомендации по ведению пациентов с заболеваниями артерий нижних конечностей (Рос. об-во ангиологов и сосудистых хирургов, Ассоц. сердечн.-сосуд. хирургов России, Рос. науч. об-во рентгенэндоваскулярных хирургов и интервенционных радиологов, Всерос. науч. об-во кардиологов, Ассоц. флебологов России) // Ангиология и сосудистая хирургия. 2013. Т. 19. Приложение 2. С. 2-67.
- Tendera M., Aboyans V., Bartelink M.L., et al. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC) // Eur Heart J. 2011. V. 32. N 22. P. 2851-2906.
- Tinder C.N., Chavanpun J.P., Bandyk D.F., et al. Efficacy of duplex ultrasound surveillance after infrainguinal vein bypass may be enhanced by identification of characteristics predictive of graft stenosis development // J Vasc Surg. 2008. V. 48. P. 613-618.
- Stone P.A., Armstrong P.A., Bandyk D.F., et al. Duplex ultrasound criteria for femoral-femoral bypass revision // J Vasc Surg. 2006. V. 44. P. 496-502.
- Brumberg S.R., Back M.R., Armstrong P.A., et al. The relative importance of graft surveillance and warfarin therapy in infrainguinal prosthetic bypass failure // J Vasc Surg. 2007. V. 46. P. 1160-1166.
- Haimovici’s vascular surgery. 6th edition / edited by Ascher Å., Veith F.J., Gloviczki P., et al. — Blackwell Publishing. 2012. 1317 pp.
- Rutherford’s vascular surgery. 6th edition / edited by Cronenwett J.L., Johnston K.W. — Elsevier Health Sciences. 2014. 2688 pp.
- Bradbury A.W., Adam D.J., Bell J., et al. Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) trial: Analysis of amputation free and overall survival by treatment received // Journal of Vascular Surgery. 2010. V. 51. P. 18S-31S.
- Conte M.S. Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) and the (hoped for) dawn of evidence-based treatment for advanced limb ischemia // Journal of Vascular Surgery. 2010. V. 51. P. 69S-75S.
- Szilagyi D.E., Elliott J.P., Smith R.F., et al. A thirty-year survey of the reconstructive surgical treatment of aortoiliac occlusive disease // J Vasc Surg. 1986. V. 3. N 3. P. 421-436.
- Nevelsteen A., Wouters L., Suy R., et al. Aortofemoral Dacron reconstruction for aorto-iliac occlusive disease: a 25-year survey // Eur J Vasc Surg. 1991. V. 5. P. 179-186.
- Барбараш Л.С., Иванов С.В., Журавлева И.Ю. и др. 12-летний опыт использования биопротезов для замещения инфраингвинальных артерий // Ангиология и сосудистая хирургия. 2006. Т. 3. № 12. С. 91-97.
- Журавлева И.Ю., Кудрявцева Ю.А., Иванов С.В. и др. Пути и перспективы совершенствования инфраингвинальных артериальных биопротезов // Патология кровообращения и кардиохирургия. 2005. № 1. С. 78-83.
- Mohler E.R., Gornik H.L., Gerhard-Herman M., et al. ACCF/ACR/AIUM/ASE/ASN/ICAVL/SCAI/ SCCT/SIR/SVM/SVS 2012 appropriate use criteria for peripheral vascular ultrasound and physiological testing, part 1: arterial ultrasound and physiological testing // J Am Coll Cardiol. 2012. V. 60. P. 242-276.
- Norgren L., Hiatt W.R., Dormandy J.A., et al. TASC II Working Group: Inter-Society consensus for the management of peripheral arterial disease (TASC II) // J Vasc Surg. 2007. V. 45. P. S5-S67.
- Jaff M., Mohler E., Roman M., et al. Guidelines for noninvasive vascular laboratory testing: a report from the American Society of Echocardiography and the Society for Vascular Medicine and Biology // Vasc Med. 2006. V. 11. N 3. P. 183-200.
- Bandyk D., Cato R., Towne J. A low velocity predicts failure of femoropoliteal and femorotibial bypass grafts // Surgery. 1985. V. 98. P. 799-809.
УЗИ сканер HS70
Точная и уверенная диагностика.
Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Прогноз после метода лечения
Если операция выполняется по строгим показаниям, то ее результаты очень хорошие. Более 80% бедренно-подколенных шунтов функционируют в течение 5 лет. Если постепенно развивается закрытие этого шунта, то организм компенсирует кровоток в обход этого сегмента и больной может и не почуствовать, что шунт перестал работать.
Вторичные осложения после бедренно-подколенного шунтирования развиваются у 10% больных. Чаще всего это ранний тромбоз шунта. Такой исход наступает при недооценке состояния сосудистого русла оперирующим хирургом, либо при нарушении приема антитромботических препаратов. Для предупреждения этого осложнения проводится регулярный контроль состояния шунта с помощью УЗИ.
Ранний тромбоз шунта может привести к развитию критической ишемии или гангрены. Своевременное повторное вмешательство позволяет сохранить ногу и недопустить ампутации.
Программа наблюдения после метода лечения
Эффективная и долговременная работа бедренно-подколенного шунта невозможна без детальной оценки его работоспособности. Чаще всего проводится ультразвуковое ангиосканирование артерий оперированной конечности.
Первый осмотр после выписки должен проводится через месяц после операции. Оценивается состояние ран на бедре, наличие отека и расстройств чувствительности, объем движения пациента, расстояние безболевой ходьбы. При УЗИ артерий оценивается состояние анастомозов и скорость кровотока по артериям на стопе.
Последующие осмотры рекомендуется проводить каждые 6 месяцев после операции. Спустя год желательно выполнить МСКТ артерий нижних конечностей с контрастированием. Либо это исследование может назначить ваш сосудистый хирург по результатам периодического осмотра.