Введение
Инфаркт миокарда (ИМ) продолжает оставаться одной из ведущих проблем здравоохранения, несмотря на внедрение ряда новых хирургических и консервативных методов и тактик лечения, в том числе чрескожного коронарного вмешательства (ЧКВ) с установкой стента в инфаркт-зависимой артерии. Согласно данным Британского регистра ЧКВ, полученным при анализе 88 188 ИМ с подъемом ST-сегмента за 2005–2013 гг., пятилетняя выживаемость с исключением внесосудистой смерти составляет 87,1% [1]. Долговременный прогноз после проведения реперфузии миокарда в немалой степени зависит от своевременности и качества диагностики структурно-функциональных изменений сердца, способствующей адекватному ведению пациентов.
При стратификации риска для данного контингента фундаментальным критерием выступает величина фракции выброса (ФВ) левого желудочка (ЛЖ) [2]. Вместе с тем значения ФВ, хотя и выражаются количественно, во многом определяются квалификацией специалиста ультразвуковой диагностики, что отражается в 10–14% межисследовательской вариабельности показателя [3]. Кроме того, регионарные дисфункции регистрируют лишь при ИМ, составляющем более 10% от площади ЛЖ, и трансмуральности более 52%, определяя диагностическую точность ультразвуковых показателей систолической функции ЛЖ относительно результатов, полученных с помощью МРТ, на уровне 78%, а прогностическую ценность отрицательного результата — на уровне 62% [4].
Включение в программы современных ультразвуковых сканеров спекл-трекинг технологии дополнило субъективную визуальную оценку глобальной и локальной сократимости сердца полуавтоматической цифровой технологией. В настоящее время, по данным комитета Европейской ассоциации сердечно-сосудистой визуализации (European Association of Cardiovascular Imaging, EACVI), из 96 лабораторий эхокардиографии в 22 странах программу спекл-трекинг визуализации имеют 96%. Однако отсутствие нормативов глобальной и локальной деформации миокарда желудочков обусловливает ее ограниченное использование. В Европе технологию спекл-трекинг используют повседневно только в 37% лабораторий, в отдельных случаях — в 59%, не используют — в 4% [5]. Наиболее часто к ней обращаются при подозрении на дисфункцию ЛЖ при сохранной ФВ.
При анализе данных пациентов, госпитализированных с диагнозом острого ИМ в медико-санитарную часть ФГАОУ ВО КФУ в 2021 г., установлено, что 41,5% имели поражение нижней стенки ЛЖ, которое по сравнению с передним ИМ чаще сопровождалось распространенным коронарным атеросклерозом (в 71,4% и 44,4% случаев соответственно, p=0,01). Пациенты с таким диагнозом, как правило, в стационар попадали позже (в первые сутки — 88,9% и 64,2% соответственно, p=0,01), умирали в более молодом возрасте (медиана возраста — 68 лет и 81 год соответственно), госпитальная летальность среди них была более высокой (6,2% и 2,8% соответственно, p=0,01).
Цель исследования:
оценить результаты эхокардиографии с применением спекл-трекинг технологии пациентов трудоспособного возраста с острым нижним ИМ в раннем периоде после стентирования коронарных артерий.
Материал и методы
Выборка включала данные эхокардиографии 55 человек (44 мужчины и 11 женщин трудоспособного возраста) с острым нижним ИМ из контингента лиц, поступивших в медико-санитарную часть ФГАОУ ВО КФУ с июня 2021 г. по май 2021 г. Контрольная группа состояла из 29 практически здоровых лиц соответствующего возраста и пола. Критериями исключения
из анализа были возраст старше 65 лет, фибрилляция предсердий, постинфарктный кардио-склероз, неудовлетворительное качество ультразвуковых изображений.
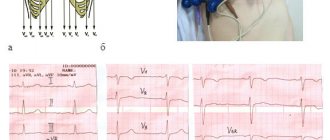
Исследование проводили на ультразвуковом сканере Epiq-7 (Philips, США) через 1 нед. после ЧКВ. Глобальную систолическую функцию ЛЖ оценивали по ФВ по Симпсону, экскурсии латерального конца фиброзного кольца (mitral annular plane systolic excursion, MAPSE) в М-режиме, скоростям систолического движения латерального (S’L) и септального (S’s) концов фиброзного кольца митрального клапана в импульсно-волновом режиме тканевого допплера, глобальным продольной (global longitudinal strain, GLS) и циркулярной (global circumferential strain, GCS) деформациям по спекл-трекинг технологии. За норму принимали ФВ ЛЖ для мужчин >52%, для женщин — >54% [6], GLS — <-18% [7]. Регионарную функцию ЛЖ анализировали визуально в двухмерном режиме по 16 сегментам с подсчетом индекса движения стенки (wall motion score index, WMSI) и количественно по спекл-трекинг технологии согласно продольным и циркулярным деформациям 17 сегментов ЛЖ [6]. Нарушение локальной сократимости диагностировали при визуализации дис-, а- или гипокинеза >2 смежных сегментов.
Модели смертности и повторной госпитализации в связи с сердечной недостаточностью после острого ИМ четко показали большую прогностическую значимость нарушений локальной сократимости по сравнению с ФВ ЛЖ [8]. Исходя из данного положения, пациентов с острым нижним ИМ по результатам визуального исследования в двухмерном режиме сократимости ЛЖ разделили на 2 группы: с наличием зон нарушений локальной сократимости (дис-, а- и гипокинез) — 45 человек, без зон нарушений локальной сократимости — 10 человек. В обеих группах превалировали мужчины 50–65 лет (80%).
Статистическую обработку данных
провели с использованием программы AtteState версии 12.0.5 (Гайдышев И.П., Россия) для Microsoft Excel. Проверку нормальности распределения вариационных рядов осуществляли с помощью общепризнанных критериев Колмогорова — Смирнова. Вычисляли медиану, верхний и нижний квартили (Me (Q25; Q75)) анализируемых выборок. Статистическую значимость различий определяли непараметрическим методом с помощью U-критерия Манна — Уитни. Совпадение значений двух независимых выборок принимали за нулевую гипотезу. Критическим уровнем значимости при проверке статистических гипотез приняли p<0,05.
Результаты исследований
Ангиография показала, что чаще всего причиной ИМ была окклюзия правой коронарной артерии (в группе с наличием зон нарушения локальной сократимости — у 82,2%, в группе без зон нарушения локальной сократимости — у 60%) на фоне многососудистого поражения (у 84,4% и 90% соответственно).
Индекс WMSI, учитывающий не только количество, но и степень поражения (дис-, а- и гипокинез), составил 1,13 (1,06; 1,19) при норме 1,0. У 13,3% пациентов из группы с наличием зон нарушения локальной сократимости выявили акинез, у остальных — гипокинез, характеризующийся снижением систолического утолщения и движения пораженного сегмента. Среди 45 лиц с нарушениями локальной сократимости чаще визуализировали а- и гипокинез медиального нижнего (44,4%), базальных нижнего (68,9%) и нижнебокового (49%) сегментов ЛЖ.
В двухмерном режиме по величине ФВ в группе с нарушениями локальной сократимости в 28,9% случаев регистрировали незначительное снижение глобальной функции ЛЖ (у женщин — до 44%, у мужчин — до 42%), тогда как среди лиц без зон изменений локальной сократимости ФВ ЛЖ оставалась в пределах нормальных значений.
Значения MAPSE в М-режиме и S’L и S’s в импульсно-волновом режиме тканевого допплера отражают продольную систолическую функцию ЛЖ. В группе с нарушением локальной сократимости относительно показателей контрольной группы значение медианы MAPSE снижалось, но оставалось в пределах рекомендуемых норм (табл. 1) [6].
Эхокардиография с использованием спекл-трекинга выявила снижение глобальной деформации миокарда ЛЖ как в продольном, так и в циркулярном направлении относительно и контрольной группы, и рекомендуемых норм. Принципиально важным является то, что такие изменения обнаружили в обеих группах пациентов с острым нижним ИМ.
Среди лиц с нарушением локальной сократимости снижение GLS регистрировали в 86,7% случаев, GCS — в 76,7%, т. е. частота выявления глобальной систолической дисфункции ЛЖ по сравнению с традиционной ориентацией на ФВ повышалась в 3 раза. Более того, в группе с сохранной локальной сократимостью у всех обследованных визуализировали изменения GLS, у 70% — изменения GCS.
В группе с зонами нарушения локальной сократимости у 11 пациентов визуализировали а- или гипокинез базального нижнеперегородочного сегмента ЛЖ, у остальных 34 лиц сократимость данного сегмента сохранена. Величину S’S определяют с септального конца фиброзного кольца митрального клапана в четырехкамерной апикальной позиции, являющегося основанием базального нижнеперегородочного сегмента миокарда ЛЖ. По спекл-трекинг технологии определяют не только глобальную, но и сегментарную деформацию. Для оценки роли наличия или отсутствия нарушения сократимости базального нижнеперегородочного сегмента ЛЖ значения параметров, измеряемых в данном сегменте (S’S, продольная и циркулярная деформация), разделили на подгруппы с а- и гипокинезом базального нижнеперегородочного сегмента и нормокинезом данного сегмента. Статистически значимые различия по значению систолического пика движения септального конца фиброзного кольца (S’s) и регионарной продольной и циркулярной деформации миокарда базального нижнеперегородочного сегмента между подгруппами отсутствовали (табл. 2).
Значения S’L и MAPSE регистрируют по движению латерального конца фиброзного кольца митрального клапана в четырехкамерной апикальной позиции, являющегося основанием базального переднебокового сегмента миокарда ЛЖ. Гипокинез базального переднебокового сегмента ЛЖ среди обследованных пациентов отсутствовал. Тем не менее медиана MAPSE среди лиц с гипокинезом соседнего с ним базального нижнебокового сегмента (14 (13; 16) мм) очень высоко значимо отличалась (p=0,0003) от аналогичного показателя группы без зон нарушения локальной сократимости (16 (14; 17) мм).
По спекл-трекинг технологии определяют не только глобальную, но и сегментарную деформацию. У каждого из 45 лиц группы с наличием зон нарушения локальной сократимости проанализирована локальная систолическая функция 6 нижних сегментов (базальный нижний, базальный нижнеперегородочный, базальный нижнебоковой, медиальный нижний, медиальный нижнеперегородочный и медиальный нижнебоковой). Из этих 270 сегментов 17 сегментов были акинетичны, 82 — гипокинетичны, остальные — нормокинетичны. Вопреки ожиданиям степень снижения сегментарной продольной деформации не зависела от наличия и вида (а-, гипокинез) нарушения систолического сокращения (табл. 3). Более того, ухудшение регионарной продольной деформации всех 6 нижних сегментов ЛЖ у пациентов с острым нижним ИМ наблюдали как в группе с нарушением локальной сократимости, так и в группе с отсутствием нарушения локальной сократимости.
Во всех 3 анализируемых группах (группы с зонами нарушения локальной сократимости и без зон нарушения локальной сократимости, контрольная группа) непараметрическая корреляция между толщиной базального нижнебокового сегмента ЛЖ и величиной сегментарной деформации данного сегмента оказалась статистически незначимой. В двухмерном режиме утолщение базального нижнебокового сегмента (≥11 мм) выявляли у 59% лиц с нижнебоковым гипокинезом: у 50% — с нижним гипокинезом и у 63,6% с нижнеперегородочным гипокинезом. Не исключено, что утолщение вызвано развитием отека мио-карда. У 17,7% пациентов с нарушением локальной сократимости и у 30% с сохраненной локальной сократимостью за нижней и нижнебоковой стенкой ЛЖ визуализировали небольшое количество жидкости в виде диастолической сепарации листков перикарда до 1–2 мм. Такой небольшой объем жидкости в протоколе указывать не принято, но его наличие на фоне ИМ может косвенно указывать на развивающиеся нарушения сократимости данных сегментов.
Электрокардиографическое исследование.
К данным ЭКГ, определяющим степень ГЛЖ, относится дисперсия интервала QT (QT interval dispersion — QTD), которая считается отображением неоднородной желудочковой реполяризации. Увеличение QTD в ряде случаев коррелирует с комплексом желудочковых аритмий (КЖА). Было проведено изучение с целью оценки QTD при артериальной гипертензии с ГЛЖ и выявления отношения между увеличением QTD и наличием КЖА у этой категории больных. Пациенты с ГЛЖ были разделены на две группы по толщине перегородки в диастолу (1,2 см и больше и 1,1 см и меньше ). Значение QTD в среднем было 43,7 (разброс 10-128). Этот показатель был больше у больных 1-й группы, чем 2-й (56,1 и 51,5 соответственно). У части пациентов 1-й группы наблюдался КЖА, причем QTD была больше. Таким образом, у больных с существенной артериальной гипертензией наличие ГЛЖ позитивно коррелирует с увеличением QTD. Однако увеличение QTD не указывает на дополнительный фактор риска для КЖА [8].
Связь между размером левого желудочка , выявленным с помощью ЭКГ: амплитуда зубца R в отведении V5 (RV5) и зубца S в отведении V1 (SV1), и АД, которое оценивается посредством клинических измерений и автоматизированного мониторинга, была изучена на пациентах со II и III стадией ГБ. Сумма амплитуд SV1+RV5 коррелирует с клиническим систолическим, 24-часовым, дневным и ночным уровнями АД, а также с разностью 24-часового, дневного систолического и ночного уровня мониторирования АД [2].
Существуют работы, изучающие взаимоотношения левожелудочковой гипертрофии, выявляемой на ЭКГ (ЭКГ-ГЛЖ), и различных по гемодинамике стенозов внутренней сонной артерии (СВСА) с изолированной систолической гипертензией (ИСГ), смешанной гипертензией (СГ) и изолированной диастолической гипертензией (ИДГ). Частичная корреляция ИСГ, ИДГ, амплитуды зубца R в I отведении и суммы амплитуд SV1+RV5, для каждого гипертензивного подтипа показана плотной положительной корреляцией диастолического АД с амплитудой зубца R в I отведении и SV1+RV5 во всех подтипах, исключая амплитуду RI у больных с ИДГ [9].
Для оценки состояния миокарда используют критерий Соколова-Лайона [10].
На ранних стадиях ГЛЖ сопровождается увеличени ем амплитуды комплекса QRS, который связан с уровнем гипертонии, однако при возникновении сердечной недостаточности амплитуда данного комплекса снижается, имитируя улучшение состояния. В результате такого непостоянства этот параметp оказывается неудобным для определения изменений в миокарде. По мере развития ГБ появляются более существенные поражения сердца, которые на ЭКГ отмечаются депрессией сегмента ST [15, 11, 5, 3].
Таким образом наиболее оптимальными параметра ми для выявления сердечной недостаточности и ее степени при ГБ являются:
1. ДАД;
2. ФВ, КСО, КДО (данные ЭхоКГ);
3. ОПСС, МО (данные реографического исследова ния);
4. SV1+RV5, DQT (данные ЭКГ).
Все перечисленные выше данные по отдельности представляют лишь относительный интерес, так как определить, какой из них должен быть использован в первую очередь, не представляется возможным. Поэтому в настоящее время практический врач опирается на совокупность этих показателей и, анализируя их, составляет представление о сократительной особенности миокарда, которая в случае гипертонической болезни зависит от гипертрофии левого желудочка.
Обсуждение
В зависимости от локализации поражения ЛЖ сердца выделяют передний и нижний ИМ. На сегодняшний день внимание клиницистов смещено в сторону переднего ИМ, характеризующегося более выраженной клиникой и, как считали на протяжении многих десятилетий, худшим прогнозом. Данные о распространенности, госпитальной летальности и трехлетней смертности нижнего ИМ в нашем учреждении совпадают с результатами других исследователей, свидетельствуя о равнозначности встречаемости двух форм ИМ при больших рисках отдаленных неблагоприятных последствий нижнего ИМ [9, 10].
В ряде работ показано, что после реперфузионной терапии сократительная функция ЛЖ восстанавливается относительно быстро. Даже при ФВ ЛЖ менее 40% в острый период уже через 3 мес. она не восстанавливается только у 28% пациентов [11]. Длительное сохранение низкой ФВ ЛЖ расценивают как фактор высокого риска смерти. Наблюдение на протяжении более 10 лет за пациентами с нижним ИМ (n=1000) выявило, что среди умерших были худшие значения ФВ (43±10%) и GLS ЛЖ (-12,0±3,5%) по сравнению с выжившими (48±9% и -14,2±3,5% соответственно; p=0,001) [12].
Значения менее 50% при нижнем ИМ относят к независимым предикторам трехлетней смертности [10]. В нашем исследовании у большинства пациентов на фоне как отсутствия, так и наличия зон нарушения локальной сократимости ФВ ЛЖ оставалась в пределах нормы. В ряде работ также показано, что для нижнего ИМ характерна сохраненная или незначительно сниженная ФВ ЛЖ [13–15]. Нормальные значения ФВ ЛЖ, определяемые в В-режиме, после хирургического вмешательства могут дезориентировать при выборе тактики и стратегии ведения пациента. В этих случаях для установления риска неблагоприятного исхода наиболее оптимальным вариантом выступает величина GLS ЛЖ по спекл-трекинг. Так, значение более -12,65% в первые 48 ч после реперфузии (n=110) свидетельствовало о высокой вероятности неблагоприятных событий через 30 дней: сердечно-сосудистой смерти, повторной госпитализации из-за сердечной недостаточности или необходимости срочной реваскуляризации [2].
В более ранних работах показано, что через 1 нед. после ЧКВ у лиц с нижним ИМ улучшение GLS, GCS и радиальной деформаций не происходит или восстанавливается лишь продольная деформация при сохранении нарушений базальной ротации [16, 17]. Позже использование однофотонной эмиссионной компьютерной томографии позволило установить, что между GLS ЛЖ и размером ИМ существует весомая связь и один показатель можно выводить из другого: при площади ИМ более 20% значения деформации будут менее -11,9%; при площади, превышающей 40%, — более -10,7% [18]. Хотя, по другим источникам (n=1128), нарушения GLS ЛЖ ассоциируются не с размером ИМ, а с наличием и тяжестью остаточной ишемии [19]. Отсутствие восстановления деформации миокарда в раннем периоде после ЧКВ может быть также объяснено сохранением отека и оглушенности миокарда ЛЖ. По результатам МРТ сердца с контрастным усилением на 2-е сутки после ЧКВ у 70,2% пациентов с ИМ развивается феномен микрососудистого повреждения в виде обструкции и/или геморрагического пропитывания миокарда [20]. Подобные повреждения объясняют фрагментацией и дистальной эмболизацией тромба в момент выполнения реканализации.
У лиц с острым ИМ нижней стенки ЛЖ при визуальном осмотре в двухмерном режиме а-, гипокинез обычно выявляют лишь в 2–3 из 16 сегментов ЛЖ. В то же время исследования с применением спекл-трекинг технологии демонстрируют, что регионарная деформация ЛЖ ухудшается в 87% сегментов и улучшается после ЧКВ в 60% сегментов [17]. Территория кровоснабжения правой коронарной артерии (по нашим данным, инфаркт-связанная артерия в 78,2% случаев нижнего ИМ) не превышает 6 сегментов, огибающая артерия (21,2%) — не более 5 из 17 сегментов. Следовательно, площадь ЛЖ с нарушением сегментарной деформации больше области перфузии артерии, ответственной за возникновение ИМ. Предполагают, что нарушение продольной деформации вне области перфузии инфаркт-связанной коронарной артерии может быть ведущим маркером неблагоприятных исходов [21].
Выявленное уменьшение движения латерального конца фиброзного кольца митрального клапана в четырехкамерной апикальной позиции при нормокинезе базального переднебокового сегмента миокарда ЛЖ и гипокинезе базального нижнебокового сегмента, вероятнее всего, свидетельствует о том, что MAPSE в большей степени отражает снижение GLS, чем топографию локальной дисфункции.
Подтверждением могут служить результаты МРТ, по которым уменьшение смещения атриовентрикулярного кольца у пациентов с ИМ через 1 нед. после ЧКВ не зависело от площади и местоположения поражения [22].
Субъективность оценки локальной сократимости по двухмерному режиму определяет интерес к взаимоотношениям а- и гипокинеза со значениями деформации пораженных сегментов, регистрируемых по спекл-трекинг технологии. Показано, что у лиц с ИМ высокую чувствительность и специфичность при диагностике трансмуральных сегментов по МРТ имеет значение сегментарной продольной деформации более -12%, акинетичных сегментов по эхокардиографии — -13,3%, гипокинетичных сегментов ЛЖ по эхокардиографии — -16,8% [23, 24]. При дискинезе стенки ЛЖ в отсутствие коронарного атеросклероза, например при стрессовой кардиомиопатии и псевдодискинезе на фоне сдавления нижней стенки ЛЖ диафрагмой, показатели сегментарной деформации остаются в норме [26, 27]. В то же время при нестабильной стенокардии стеноз более 70% правой коронарной и огибающей артерий снижал продольную сегментарную деформацию соответственно базального нижнего (с -19 до -12,5%) и базального бокового (с -21 до -14%) сегментов ЛЖ в отсутствие нарушения локальной сократимости [25]. По нашим данным, наличие и степень локальной дисфункции не влияют на степень снижения сегментарной деформации (медиана варьировала от -9 до -15%). В 6 нижних сегментах сегментарная деформация снижалась при нижнем ИМ как при наличии их а-, гипокинеза, так и в их отсутствие.
Диастолическая дисфункция левого желудочка
Врач ультразвуковой диагностики Палий К.А.
Под диастолической дисфункцией понимают неспособность левого желудочка наполняться и поддерживать ударный объём без компенсаторного увеличения предсердного давления наполнения.
В значительной степени она определяется способностью миокарда к расслаблению и податливостью (жесткостью) стенки. Нарушение диастолической функции левого желудочка может наблюдаться как в комбинации со снижением систолической функции левого желудочка, так и изолированно (например, при заболеваниях, сопровождающихся гипертрофией левого желудочка). Усиленный фиброз миокарда, развивающийся при старении, также может причиной значительной диастолической дисфункцией.
Для понимания подходов к оценке диастолического наполнения левого желудочка требуется знание четырех фаз диастолы.
- Фаза изоволюмического расслабления. Диастола начинается с началом расслабления левого желудочка, что знаменуется закрытием аортального клапана. В начальном периоде расслабления давление в левом желудочке быстро снижается, однако до тех пор, пока оно не станет ниже давления в левом предсердии, митральный клапан остается закрытым. Таким образом, в эту фазу диастолы аортальный и митральный клапаны остаются закрытыми, поэтому объём полости левого желудочка не изменяется.
- Фаза быстрого раннего наполнения. Следующий период диастолы начинается после того, как давление в левом желудочке падает ниже давления в левом предсердии, что позволяет митральному клапану открыться. При этом кровь начинает пассивно (т. е. согласно градиенту давления) поступать из левого предсердия в левый желудочек. Обычно в эту фазу диастолы происходит основное наполнение левого желудочка (если подразумевать под этим объём поступающей крови и скорость трансмитрального потока).
- Фаза медленного наполнения (диастаз). В эту фазу градиент давления между левым предсердием и левым желудочком минимален, поэтому до окончательного его исчезновения происходит медленное пассивное наполнение левого желудочка.
- Фаза позднего наполнения. В эту заключительную фазу диастолы происходит сокращение левого предсердия, благодаря чему дополнительный объём крови активно «вталкивается» в левый желудочек через отверстие митрального клапана. В норме этот период в левый желудочек поступает 20 – 30% от всего диастолического объёма наполнения.
Вышеописанные фазы диастолы могут быть легко прослежены с помощью импульсно – волновой допплерографии, визуализирующей изменения скорости трансмитрального потока крови.
Типичная кривая скорости трансмитрального потока имеет два пика: первый из них (пик Е) соответствует фазе быстрого раннего наполнения желудочков, тогда как второй относительно низкоскоростной пик (А) имеет более низкую амплитуду и совпадает по времени с сокращением предсердия. Для оценки диастолической функции левого желудочка предложено использовать большое число характеристик пиков Е и А, однако на практике рутинно используются лишь некоторые из них: максимальная скорость пика Е, максимальная скорость пика А, соотношение максимальных скоростей Е/А и время замедления пика Е.
По мере нарушения диастолической функции левого желудочка конечное диастолическое давление в его полости начинает расти, что, в свою очередь, вызывает рост давления в левом предсердии. В результате характер потока крови между левым предсердием и левым желудочком изменяется, что может быть зафиксировано с помощью импульсно –волновой допплерографии входящего трансмитрального потока.
Известно 4 основных типа диастолического наполнения левого желудочка:
- Нормальный. Объём и скорость раннего наполнения преобладает над таковыми во время систолы предсердия (Е>А).
- Нарушенное расслабление (Первый тип нарушения диастолической дисфункции). Нарушение расслабления левого желудочка приводит к затруднению оттока крови из левого предсердия. Поэтому объём и скорость раннего пассивного наполнения уменьшаются, и максимальная скорость пика Е снижается. При этом наполнение левого желудочка закономерно становится все более зависимым от сокращения предсердия в конце диастолы, и на кривой скорости трансмитрального патока начинает доминировать пик А (Е<�А).
Нарушение диастолической функции желудочка по первому типу может быть вариантом нормы у людей пожилого возраста, встречается у лиц с артериальной гипертензией, стенокардией, инфарктом миокарда, миокардитом.
- Псевдонормальный тип наполнения (Второй тип). Более тяжелая дисфункция левого желудочка приводит к еще более значительному повышению давления в левом предсердии, что сопровождается увеличением скорости раннего диастолического наполнения левого желудочка. Поэтому на допплеровской кривой снова преобладает пик Е (Е>А), как и при нормальном наполнении.
- Рестриктивный тип наполнения (Третий тип). В особо тяжелых случаях давление в левом предсердии может оказаться настолько высоким, что наполнение левого желудочка почти полностью происходит в раннюю фазу, а во время других фаз диастола практически отсутствует. В связи с тем, что в такой ситуации давление в левом желудочке по мере его заполнения нарастает гораздо быстрее, трансмитральный кровоток быстро прекращается. Максимальная скорость пика Е намного превышает максимальную скорость пика А (Е>>А). Такой тип трансмитрального потока можно наблюдать при рестриктивной кардиомиопатии (при которой систолическая функция левого желудочка оказывается относительно высокой) или одновременно с тяжелой систолической дисфункцией левого желудочка, обусловленной иными причинами.
Факторы, влияющие на изменение трансмитрального кровотока, можно разделить на физиологические и патологические. В свою очередь патологические подразделяются на внесердечные и сердечные.
Среди физиологических причин выделяются такие как возраст, частота сердечных сокращений, положение пациента, дыхание, преднагрузка (например, изменение профиля трансмитрального кровотока при нагрузочных пробах).
Внесердечные факторы, влияющие на трансмитральный кровоток: ожирение, диабет, почечная недостаточность, синдром ночного апноэ.
Сердечные причины: артериальная гипертензия (АГ), ишемическая болезнь сердца (ИБС), кардиомиопатии, хроническая сердечная недостаточность (ХСН), пороки сердца, миокардиты, заболевания перикарда и др.
Таким образом, эхокардиография является единственным доступным неинвазивным методом оценки диастолической функции левого желудочка, которая имеет важное клиническое значение.
Диастолическая дисфункция рассматривается как дебют в нарушении функции желудочков при различных заболеваниях сердца.
Степень диастолической дисфункции может указывать на тяжесть заболевания у больных с одинаковой степенью систолической дисфункции.
Выраженность диастолической дисфункции может выступать в качестве объективного маркера эффективности проводимого лечения или течения заболевания.
Райдинг Э. Эхокардиография. Практическое руководство/ Элисдэйр Райдинг; пер. с англ. – 4 –е изд. – М.: МЕДпресс-информ, 2021. – 280с.
Рыбакова М. К. Практическое руководство по ультразвуковой диагностике. Эхокардиография / М. К. Рыбакова и др. – М.: Издательский дом Видар-М. 2008. – 512 с.