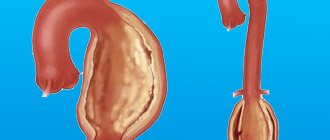
В норме легочные вены несут артериальную кровь из легких и впадают в левое предсердие. Оттуда кровь попадает в левый желудочек и по аорте и артериям разносит кислород по всему организму.
При аномальном дренаже легочных вен они могут впадать в правое предсердие или в полые вены несущие венозную кровь в правое предсердие. Этот порок может быть полным или частичным.
- При полном аномальном дренаже легочных вен нет прямого сообщения между легочными венами (малым кругом кровообращения) и левым предсердием (большим кругом кровообращения). Такое состояние несовсестимо с жизнью. Но если у ребенка имеются другие пороки развития (наличие дефекта межпредсердной или межжелудочковой перегородки, незакрытое овальное отверстие), кровь все-таки может попадать в левые отделы сердца и возможно лечение.
- При частичном аномальном дренаже легочных вен, одна вена может впадать в левое предсердие и тогда состояние новорожденного зависит от объема аномального сброса крови. Полный аномальный дренаж легочных вен встречается с частотой около 3% от всех врожденных пороков сердца.
Четыре типа аномального дренажа легочных вен
- Легочные вены могут впадать в систему верхней полой вены, которая собирает венозную кровь от верхних конечностей и головы, встречается в 55% случаев.
- Впадение легочных вен в правое предсердие или в коронарный синус, встречается в 30% случаев.
- Легочные вены могут впадать в систему нижней полой вены, которая собирает кровь от нижних конечностей, внутренних органов, встречается в 12% случаев.
- В 3% случаев могут быть различные комбинации этого состояния.
Состояние больных зависит от того полный это или частичный порок. При полном аномальном дренаже легочных вен и отсутствии сообщения между правыми и левыми отделами сердца на уровне предсердия, новорожденные находятся в критическом состоянии для спасения их жизни требуется срочная операция в течение первых недель. При частичном пороке возникает перегрузка правых отделов сердца, увеличение давления в сосудах легких. Дети старших возрастных групп жалуются на одышку, быструю утомляемость при физической нагрузке. Затем присоединяются признаки правожелудочковой недостаточности.
В настоящее время выявлены этиологические факторы многих генетических синдромов и семейных врожденных пороков сердца (ВПС), но генетические основы большинства «спорадических» ВПС до сих пор остаются неизвестными. Ведущие причины развития ВПС представлены на рис. 1.
Рис. 1. Этиология ВПС [3].
Определены многие гены, связанные с развитием сердца. Установлено, что ряд отдельных ВПС и генетических синдромов ассоциируется с мутациями в различных единичных генах [1].
Многие гены, кодируемые посредством транскрипционных факторов или сигнальных молекул, в настоящее время ассоциированы с ВПС у человека. Транскрипционные факторы являются белками, которые содержат ДНК-связывающие домены и играют фундаментальную регулирующую роль, контролируя экспрессию генов. Сигнальными молекулами являются белки, которые позволяют клеткам реагировать на их окружение и таким образом участвуют в регуляции многих важных биологических функций.
Фенотипы ВПС варьируют от небольших септальных дефектов, которые могут остаться незамеченными на протяжении всей жизни, до гемодинамически значимых аномалий, которые проявляются клинической симптоматикой. К ним относятся аномалии в диапазоне от персистенции фетального кровообращения (например, открытый артериальный проток) до сложных пороков, таких как транспозиция магистральных сосудов, единый желудочек, синдром гипоплазии левых отделов сердца и другие варианты гетеротаксии. В соответствии с патогенетической классификацией врожденных пороков сердечно-сосудистой системы существуют 6 причинных механизмов: аномалии миграции эктомезенхимальной ткани (аномалии дуги аорты), дефекты внутрисердечного кровотока (септальные дефекты и обструктивные пороки левых или правых отделов сердца), аномалии, связанные с гибелью клеток (септальные дефекты и аномалии клапанов), аномалии экстрацеллюлярного матрикса (дефекты атриовентрикулярного канала), аномальный рост (частичная или полная мальформация легочного венозного возврата и трехпредсердное сердце) и неправильная позиция и перекручивание, что включает нарушение лево-правой асимметрии [2].
Например, homeobox — содержащие белки, кодируемые генами группы NKX-2,5, играют важную роль в регулировании тканеспецифической экспрессии генов, необходимых для дифференцировки тканей, а также для определения временных и пространственных моделей развития. Исследования показали, что в последнее время несиндромные ВПС могут быть результатом дефекта одного гена. Исходя из этого, можно сделать вывод, что предрасположенность к ВПС является результатом одиночных нуклеотидных полиморфизмов или мутаций ключевых генов, которые при взаимодействии с факторами окружающей среды нарушают нормальный морфогенез сердца, что приводит к развитию врожденных сердечных аномалий (см. таблицу)
Генетические причины врожденных пороков сердца [3] [3].
Частичный аномальный дренаж легочных вен (ЧАДЛВ) — это врожденный порок сердца, характеризующийся тем, что одна или более (но не все) легочные вены впадают в правое предсердие, либо в полые вены, либо в их основные ветви [4].
Существуют четыре анатомические формы ЧАДЛВ, в основу которых положена локализация места впадения легочных вен: супракардиальный, интракардиальный, инфракардиальный и смешанный. Аномальный дренаж правых легочных вен встречается в 2 раза чаще, чем левых. Правые легочные вены могут дренироваться в верхнюю полую вену, что часто сочетается с дефектом венозного синуса (рис. 2, а),
Рис. 2. Схема вариантов ЧАДЛВ. а — дренирование правых легочных вен в ВПВ с дефектом венозного синуса; б — в НПВ; в — впадение левых легочных вен в безымянную вену; г — коронарный синус. a — right pulmonary veins drainage into SVC with sinus venosus ASD; b —into IVC; c — connection of left pulmonary veins with innominate vein; d — coronary sinus. или впадать в нижнюю полую вену (см. рис. 2, б) с интактной предсердной перегородкой и бронхолегочной секвестрацией. Левые легочные вены чаще дренируются в безымянную вену (см. рис. 2, в) или в коронарный синус (см. рис. 2, г). Дефект межпредсердной перегородки обычно сопровождается аномальным дренажем левых легочных вен [5].
Впервые порок был описан Winslow в 1739 г. При патологоанатомическом исследовании был обнаружен аномальный дренаж вены верхней доли правого легкого в верхнюю полую вену. Наиболее полно анатомию и клинику этого порока изучил Brody (1942 г.). Систематизировали анатомические варианты (типы) порока R. Darling и соавт. [4] в 1957 г.
Первая успешная операция коррекции частичного аномального дренажа с использованием закрытого метода «атриосептопексии» была выполнена W. Neptune в 1953 г. В 1956 г. J. Kirklin и соавт. [4] сообщили о 5 успешных операциях коррекции порока по полуоткрытому методу Гросса.
Конкретные причины возникновения ЧАДЛВ неизвестны. Они могут быть связаны с хромосомными аномалиями, выявляемыми при кариотипировании более чем у 1/3 больных с ВПС. Чаще всего это трисомия по 21, 18 и 13-й парам хромосом. Помимо болезни Дауна, существует около 20 наследственных синдромов, в большинстве случаев сопровождающихся различными ВПС. В общей сложности синдромальная патология обнаруживается у 6—36% больных. Моногенная природа ВПС доказана в 8% наблюдений; около 90% наследуются многофакторно, т. е. являются результатом сочетания генетической предрасположенности и воздействия факторов окружающей среды. Последние выступают в качестве провоцирующих, выявляющих наследственную предрасположенность при превышении порога их совместного действия [6, 7].
По данным различных исследований [8—10], частота встречаемости ЧАДЛВ среди всех врожденных пороков сердца находится в пределах от 0,7 до 9,4%. Из всех случаев аномального дренажа легочных вен около 2/3 из них приходится на ЧАДЛВ. Чаще в процесс вовлечены правые легочные вены. Верхняя полая вена является наиболее частым местом впадения аномальных правых легочных вен (35—57% от всех случаев ЧАДЛВ). Реже легочные вены впадают в непарную вену, крайне редкий вариант — впадение одной или всех легочных вен в безымянную или добавочную левую вену.
Второе место по частоте занимает интракардиальный тип правостороннего ЧАДЛВ. Аномальный дренаж левых легочных вен встречается крайне редко, при этом легочные вены впадают в коронарный синус или непосредственно в правое предсердие.
При инфракардиальном типе порока вены (чаще средней и нижней долей правого легкого) впадают в нижнюю полую вену (НПВ) сразу под диафрагмой [11].
ЧАДЛВ может также входить в состав более сложных ВПС. Около 20% пациентов с ЧАДЛВ имеют сопутствующие пороки сердца, например, тетраду Фалло, дефект межпредсердной (ДМПП) или межжелудочковой перегородки (ДМЖП), единый (общий) желудочек, общее предсердие, транспозицию магистральных сосудов и синдром гипоплазии левых отделов сердца [12]. Однако чаще всего ЧАДЛВ встречается в комплексе с ДМПП (более 50% случаев) [9].
Между 4-й и 5-й неделями эмбриогенеза в дорсальном мезокарде начинают формироваться легочные вены, исходящие из среднеглоточного эндотелиального стебля [13]. Формирование ЧАДЛВ происходит в результате атрезии крупной ветви общей легочной вены. Как только правая или левая часть общей легочной вены становится атрезированной, то персистенция легочно-системной венозной связи на этой стороне создает этиологическую основу для ЧАДЛВ [12].
Факторами риска развития ЧАДЛВ являются возраст матери выше 40 лет, токсикоз и угроза прерывания беременности в I триместре, наличие мертворождения в анамнезе, наличие детей с врожденными пороками развития у родителей и ближайших родственников [14].
Следует отметить, что у ближайших родственников пациента с аномалиями сердца частота ВПС в 2—5 раз выше [14]. Однако в доступной нам литературе семейной формы ЧАДЛВ описано не было.
Гемодинамика и клинические признаки при ЧАДЛВ соответствуют таковым при ДМПП. При рентгенологическом обследовании можно выявить расширение тени верхней полой вены (ВПВ) и корня правого легкого при аномальном дренаже в ВПВ. При впадении легочных вен в ВПВ в переднезадней проекции на фоне нижней доли правого легкого выявляется тень аномально идущего сосуда в виде «турецкой сабли» (С. Dolter, 1949). Увеличение сосудистого пучка влево позволяет заподозрить аномальное впадение левых легочных вен в левую безымянную вену [15].
В настоящее время эхокардиография (ЭхоКГ) является основным диагностическим методом исследования у пациентов с ЧАДЛВ, однако только компьютерная томография (КТ) с внутривенным контрастированием позволяет установить окончательный диагноз, уточнить анатомию врожденного порока и определить дальнейшую хирургическую тактику [16, 17].
Существует несколько описанных техник коррекции частичного правого аномального дренажа легочных вен: простая туннелизация (переключение легочных вен в левое предсердие заплатой), туннелизация с расширением ВПВ заплаткой, туннелизация с иссечением ВПВ и ее перемещением в правое предсердие (как правило, в ушко предсердия) [18].
Различий в результатах трех техник нет. Выбор техники оперативного вмешательства зависит от типа аномального дренажа и клиники порока [18].
Представляем клиническое наблюдение пациентки А
., 18 лет, поступившей в кардиохирургическое отделение с диагнозом: ВПС, ДМПП. Частичный аномальный дренаж правых верхних легочных вен в верхнюю полую вену. Легочная гипертензия I ст. Недостаточность кровообращения IIa степени, II функциональный класс.
На момент осмотра пациентка предъявляла жалобы на одышку и слабость при умеренных физических нагрузках. Из анамнеза известно, что диагноз ДМПП установлен в ноябре 2021 г. в возрасте 17 лет по данным ЭхоКГ. В январе 2021 г. выполнена мультиспиральная КТ (СКТ) сердца с в/в контрастированием, выявлены вторичный ДМПП без верхнего края, частичный аномальный дренаж правых легочных вен в ВПВ, расширение правых камер сердца.
По данным СКТ, три вены от верхней, средней и частично нижней правых легочных вен единым коллектором (диаметром 17 и 11 мм) от средней доли впадают в нижнюю треть ВПВ (рис. 3, 4).
Рис. 3. Пациентка А., 18 лет. СКТ с в/в контрастированием. 1 — ДМПП. CT-scan. 1 — atrial septal defect.
Рис. 4. Пациентка А., 18 лет. СКТ. Коллектор верхней, средней и частично нижней правых легочных вен, впадающий в ВПВ (указан стрелкой). CT-scan. Partial anomalous pulmonary venous return into SVC (arrow). Расстояние от верхнего края коллектора до уровня впадения ВПВ в правое предсердие составило 17 мм. Также вена от средней доли правого легкого диаметром 5,5 мм впадала в зону ДМПП. Определялся ДМПП без верхнего края размером 25×18 мм. Правая нижняя легочная вена, а также левые легочные вены впадают в левое предсердие.
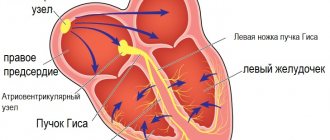
Состояние пациентки при осмотре средней степени тяжести. АД 110/70 мм рт.ст., ЧСС 70 уд/мин. Тоны сердца ясные, ритмичные. Во втором межреберье слева выслушивается систолический шум. На ЭКГ отмечалась атриовентрикулярная блокада 1-й степени (интервал PQ 0,22 с), а также неполная блокада правой ножки пучка Гиса.
По данным ЭхоКГ, отмечались увеличение правых отделов сердца, дискинезия межжелудочковой перегородки, легочная гипертензия до 40 мм рт.ст. В области верхней трети МПП определялся сброс слева направо диаметром 12—13 мм.
Поступившая в наше отделение пациентка была оперирована. Интраоперационно: сердце увеличено в размерах за счет правых отделов. Экстраперикардиально визуализирован коллектор из трех легочных вен от верхней и средней долей правого легкого диаметром 4, 6 и 7 мм (рис. 5),
Рис. 5. Интраоперационное фото. Коллектор верхней, средней и частично нижней правых легочных вен, впадающий в ВПВ (указан стрелкой). Partial anomalous pulmonary venous return into SVC (arrow). впадающий в ВПВ на расстоянии 17 мм от ее устья, высота коллектора 14 мм. Вена от нижней доли правого легкого впадает в левое предсердие. Левые легочные вены также впадают в левое предсердие. При ревизии МПП отмечались дефект без верхнего края 2,5×1,8 см и открытое овальное окно. Нижний край дефекта соединен с открытым овальным окном с образованием ДМПП 3,5×2 см (рис. 6).
Рис. 6. Интраоперационное фото. 1 — ДМПП без верхнего края; 2 — открытое овальное окно. 1 — secundum atrial septal defect; 2 — primum atrial septal defect.
Была выполнена пластика дефекта туннелевидной заплатой из ксеноперикарда (рис. 7).
Рис. 7. Туннелевидная заплата из ксеноперикарда на ДМПП с перемещением устьев правых легочных вен в ЛП. МПП герметична. IAS is sealed.
Послеоперационный период протекал без особенностей и осложнений. Пациентка была выписана на 8-е сутки после операции в удовлетворительном состоянии. При выписке на ЭКГ нижнепредсердный, правильный ритм с частотой 75 уд/мин, а также неполная блокада правой ножки пучка Гиса.
Из анамнеза известно, что у отца пациентки в возрасте 15 лет также были выявлены ЧАДЛВ и ДМПП. Он был оперирован, и интраоперационно обнаружено аномальное впадение верхней правой легочной вены в устье ВПВ. Пациенту была выполнена пластика ДМПП с перемещением легочной вены от верхней доли правого легкого в левое предсердие.
Кроме того, двоюродная сестра пациентки была прооперирована в возрасте 8 мес по поводу ВПС. Были выявлены центральный дефект межпредсердной перегородки диаметром 15 мм и аномальный дренаж верхней правой легочной вены в правое предсердие, дефект закрыт заплатой из ксеноперикарда с перемещением устья легочной вены в левое предсердие.
В нашем центре им было выполнено МРТ сердца для визуализации анатомического строения и контроля отдаленных результатов операционного лечения пациентов (рис. 8),
Рис. 8. Пациент А. (отец пациентки). МРТ сердца. Верхние легочные вены, впадающие в левое предсердие у устья ВПВ (указаны стрелкой). MRI. Partial anomalous pulmonary venous return (arrow). по результатам которой у отца пациентки визуализирован коллектор правых легочных вен, впадающий в левое предсердие. Данных за реканализацию ДМПП, другие дополнительные патологические сбросы или обструкцию кровотока по легочным венам не выявлено в обоих случаях. Особенностью этих операций является наличие нижнепредсердного ритма с адекватной частотой, что связано с наложением швов в проекции синусового узла.
Предрасположенность к ВПС обусловливается результатом одиночных нуклеотидных полиморфизмов или мутаций ключевых генов, которые при взаимодействии с факторами окружающей среды нарушают нормальный морфогенез сердца, что приводит к развитию врожденных сердечных аномалий. Конкретные причины возникновения ЧАДЛВ неизвестны. Отклонения в эмбриогенезе и наличие ВПС у ближайших родственников увеличивают вероятность возникновения аномалии в развитии сердца. В приведенном выше клиническом наблюдении отмечено наличие ЧАДЛВ у отца пациентки и у двоюродной сестры. ЧАДЛВ чаще встречается в комбинации с ДМПП и зачастую представлен одной или несколькими аномально впадающими правыми легочными венами. По данным отдаленных результатов, оперативное вмешательство в виде туннелизации (перемещения устьев легочных вен в левое предсердие заплатой) является надежным и эффективным методом лечения ЧАДЛВ. В доступной литературе мы не встретили описания семейной формы ЧАДЛВ.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Иванов А.С.
— д.м.н., проф.; https://orcid.org/0000-0001-9645-7192;
Гламазда С.В.
— к.м.н.; https://orcid.org/0000-0002-7623-2954;
Луговский М.К.
— к.м.н.; https://orcid.org/0000-0001-6461-7008, e-mail;
Лебедева А.В.
— к.м.н.; https://orcid.org/0000-0001-7000-6254;
Говорова Т.Н.
— ординатор кардиохирургического отделения; https://orcid.org/0000-0001-6537-7173;
Сацюк О.В.
— сердечно-сосудистый хирург; https://orcid.org/0000-0001-8797-3283.
Иванов А.С., Гламазда С.В., Луговский М.К., Лебедева А.В., Абрамова Н.Н., Говорова Т.Н., Сацюк О.В. Семейная форма частичного аномального дренажа легочных вен. Кардиология и сердечно-сосудистая хирурги
я. 2019;12(1):53-59. https://doi.org/10.17116/kardio20191201153
Как нарушается гемодинамика
Во время внутриутробного развития этот порок сердца никак себя не проявляет, так как внутрисердечное кровообращение у плода сопровождается сообщением левого и правого предсердия через открытое овальное окно. АДЛВ начинает давать о себе знать после рождения ребенка, и выраженность гемодинамических нарушений будет определяться типом и вариантом данной аномалии. Кроме этого, на выраженность симптомов порока может влиять наличие сопутствующих дефектов развития сердца и сосудов.
При тотальном АДЛВ поступающая в правое предсердие обогащенная кислородом кровь смешивается с венозной кровью. Далее некоторая ее часть попадает в правый желудочек, а другая поступает в левое предсердие через существующий дефект межпредсердной перегородки или открытое овальное окно. В таких случаях тотальный АДЛВ совместим с жизнью, так как сообщение между большим и малым кругом кровообращения не утрачивается. Подобные гемодинамические нарушения приводят к перегрузке правых камер сердца, повышению давления в легочных сосудах и понижению содержания кислорода в крови, которое приводит к кислородному голоданию органов и тканей.
При частичном АДЛВ нарушения гемодинамики происходят так же как и при межпредсердных дефектах. Тяжесть состояния больного при таком типе аномалии определяется объемом патологического артерио-венозного сброса.
Диагностика
Одним из методов, помогающих обнаружить и верифицировать АДЛВ, является УЗИ сердца.
Впервые АДЛВ может выявляться у плода при УЗ-обследовании в третьем триместре беременности.
Для уточнения всех данных о таком врожденном пороке сердца назначаются следующие инструментальные методики исследования:
- рентгенография;
- ЭКГ;
- Эхо-КГ (взрослым и детям старшего возраста назначается чреспищеводное Эхо-КГ);
- МРТ;
- зондирование камер сердца и ангиокардиография.
Симптомы
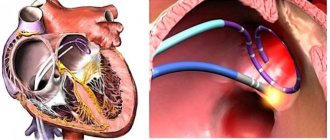
Признаки АДЛВ дают знать о себе сразу же после рождения ребенка. При тотальном пороке, который не сопровождается присутствием дефектов межпредсердных коммуникаций, кровообращение между малым и большим кругом становится полностью невозможным, и новорожденный быстро погибает. Спасти жизнь ребенка в таких случаях может только экстренное выполнение такой кардиохирургической операции по методу Рашкинда как баллонная эндоваскулярная атриосептостомия.
В остальных случаях выраженность клинических проявления АДЛВ обуславливается его анатомическим вариантом, размером дефектов межпредсердной перегородки и характером гемодинамических нарушений. Обычно родители детей с таким врожденным пороком замечают следующие проявления этой патологии:
- быстрая утомляемость;
- появление одышки после физической активности (кормления, плача и пр.);
- боли в области сердца (ребенок плохо спит, беспокойный, громко плачет и вытягивает ножки);
- бледность кожи;
- легкий цианоз;
- кашель;
- тошнота и рвота;
- медленная прибавка веса;
- частые ОРВИ и пневмонии.
При прощупывании пульса врач может выявить его учащенность и аритмичность. При осмотре определяется деформация грудной клетки и усиленный толчок сердца.
Легкий цианоз, возникающий на первых неделях жизни, может со временем исчезать или становится менее выраженным. Как правило, синюшность более выражена при физической нагрузке.
При выслушивании тонов сердца специфические признаки данного порока не выявляются. Могут выслушиваться:
- громкий I тон над сердцем;
- расщепление II тона с усилением легочного компонента;
- выслушиваемый III тон над верхушкой сердца (у многих больных);
- мягкий систолический шум над легочной артерией с вариабельной продолжительностью и интенсивностью.
На ЭКГ определяется перегрузка правых отделов сердца – высокий вольтаж зубца Р в правых отведениях и отклонения электрической оси вправо в стандартных отведениях. На перегрузку правого предсердия указывает высокий Р зубец в правых грудных и стандартном отведениях. Нередко присутствуют признаки неполной блокады правой ножки пучка Гиса.
При наличии большого дефекта в межпредсердной перегородке ребенок может развиваться нормально и тогда в более старшем возрасте возникают жалобы на значительное снижение толерантности к физическим нагрузкам, одышку, бледность и плохое общее самочувствие. Позднее у таких детей возникают признаки правожелудочковой недостаточности.
Лечение
Единственным способом устранения АДЛВ является его кардиохирургическая коррекция. До операции ребенку рекомендуется ограничение физической активности и назначаются лекарственные средства для профилактики острой сердечной недостаточности (мочегонные, сердечные гликозиды). Родители ребенка должны знать о том, что даже плач или температурный дискомфорт способны существенно ухудшать самочувствие при таком пороке сердца. Если ребенок уже взрослый, то они должны постоянно следить за его досугом – он не должен бегать, поднимать тяжести и переутомляться.
Методы хирургической коррекции
Способ выполнения кардиохирургической коррекции при АДЛВ определяется типом и вариантом порока.
При тотальном дренаже находящемуся в критическом состоянии ребенку до 3 месяцев может выполняться паллиативная операция, заключающаяся в увеличении межпредсердного сообщения при помощи проведения баллонной атриосептомии по методике Рашкинда. Такая коррекция способствует поступлению крови в левое предсердие и восстановлению кровообращения в большом круге.
Для радикального устранения АДЛВ проводятся вмешательства направленные на создание широкого анастомоза между левым предсердием и легочными венами, прекращение патологического дренажа легочных вен с другими венозными сосудами и устранение дефекта межпредсердной перегородки. Такие вмешательства предпочтительней выполнять в раннем возрасте. Методика радикальной коррекции выбирается в зависимости от анатомического варианта АДЛВ.
Корректирующие вмешательства являются достаточно эффективными, однако, несмотря на развитие современной кардиохирургии, процент летальных исходов, наступающих во время операции или в послеоперационном периоде, остается высоким. Результат радикальной коррекции во многом зависит от мастерства кардиохирурга, технического оснащения, типа и варианта порока. Кроме этого, наиболее высокий риск наступления смерти наблюдается среди новорожденных и детей раннего возраста, страдающих от выраженной легочной гипертензии. Чаще всего такое проявление порока наблюдается среди больных с субкардиальным вариантом аномалии.
Отдаленные результаты среди выживших после радикальной коррекции АДЛВ детей вполне удовлетворительные. Только у некоторых пациентов возможно развитие слабости синусового узла и легочной гипертензии, плохо поддающихся медикаментозной терапии.
Причины
Вероятно, определенную роль в развитии АДЛВ играет наследственность.
Вероятными причинами развития АДЛВ могут становиться те же внешние факторы, которые провоцируют и другие врожденные аномалии строения сердца и сосудов:
- наследственность (мутации хромосом);
- прием некоторых тератогенных лекарств;
- воздействие токсических веществ на организм во время беременности;
- вредные привычки будущей матери;
- перенесенные беременной инфекционные заболевания;
- эндокринные нарушения;
- токсикоз;
- неблагоприятная экология.
Разобщенность легочных вен с левым предсердием может вызываться следующими факторами:
- отсутствие их соединения с левым предсердием – формируется из-за того, что под влиянием вышеописанных внешних причин левопредсердный вырост не может связаться с венозными сплетениями будущего легкого;
- ранняя атрезия легочной вены – происходит при первоначальном соединении легочного сосудистого ложа и общей легочной вены, просвет которых впоследствии облитерируется, и кровь из легких начинает поступать через иные коллатеральные пути.
Немного истории
Впервые этот редкий врожденный порок был описан Вилсоном еще в 1798 году, но его варианты более детально были рассмотрены только после накопления достаточного кардиохирургического опыта в 50-60 годах XX века. Первая удачная операция по коррекции этой патологии была выполнена Миллером в 1951 году. Впоследствии кардиохирургические методики совершенствовались, и в 1956 году была проведена радикальная коррекция АДЛВ при помощи поверхностной гипотермии. В этом же году подобное вмешательство было выполнено с использованием искусственного кровообращения.
На территории СССР впервые успешная операция по устранению такого порока сердца была проведена Николаем Михайловичем Амосовым в 1978 году, а о выполнении серии удачных коррекций у детей раннего возраста в 1984 году сообщил один из ведущих российских кардиохирургов Георгий Эдуардович Фальковский.