Тромбоз у беременных – патологическое состояние, характеризующееся формированием в просвете кровеносных сосудов свёртков крови, которые называются тромбами. Они не позволяют крови свободно циркулировать по кровеносной системе, серьёзно затрудняя кровоток и провоцируя ряд серьёзных осложнений. Тромбоз вен у беременных – не редкость. Он появляется на фоне целого ряда изменений, происходящих в организме женщины в этот период, и требует особого внимания как со стороны самой женщины, так и со стороны врачей.
Профилактика тромбоза беременных и его лечение – одно из направлений работы отделения флебологии ЦЭЛТ. Наша клиника работает с 1993-го года и является многопрофильной, поэтому флебологи тесно сотрудничают с гинекологами, достигая наилучших результатов. В их распоряжении имеется мощная диагностическая и лечебная база, а также современные щадящие методики, которые позволяют сохранить здоровье пациентки и родить здорового малыша.
В ЦЭЛТ вы можете получить консультацию специалиста-флеболога.
- Первичная консультация — 3 000
- Повторная консультация — 2 000
Записаться на прием
Тромбоз у беременной женщины: причины
В период беременности в женском организме происходит целый ряд серьёзных изменений. Прежде всего они связаны с перестройкой гормонального фона, которая оказывает влияние на работу свёртывающей системы крови, из-за чего кровь становится более вязкой и густой. Другая причина заключается в увеличении размеров матки. Она начинает оказывать компрессионное воздействие на нижнюю полую вену, провоцируя нарушение кровеносного тока, приводящего к застою в сосудах ног. Ещё один фактор – увеличение веса тела. Вышеперечисленное приводит к развитию тромбофлебита. Он может возникнуть либо как самостоятельное заболевание, либо как осложнение тромбоза. Отягчающими факторами при этом являются:
- Возраст женщины старше 35-ти лет;
- Врождённый дефицит антитромбина;
- Длительный приём контрацептивов;
- Серьёзные травмы в прошлом;
- Наличие аутоиммунных болезней.
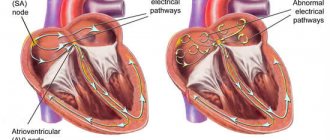
Как происходит свертывание крови
Фактический сгусток образуется путем создания сети фибрина, которая укрепляет и стабилизирует его. Это связано с активацией каскада свертывания — циркулирующие в плазме крови неактивные факторы свертывания крови начинают активировать друг друга.
Под влиянием механических повреждений тромбоциты выделяют тромбокиназу, которая запускает ряд процессов, ведущих к образованию соответствующего фактора, инициирующего свертывание крови — в этом процессе важны ионы кальция и факторы белков плазмы.
Схема свертывания крови
В результате каскада свертывания крови фактор X вместе с фактором Va образует комплекс, называемый протромбиназой, который превращает протромбин в тромбин. Тромбин, в свою очередь, превращает фибриноген (белок плазмы, циркулирующий в крови) в фибрин (нерастворимый в воде белок), который образует сеть волокон, образующих основу сгустка.
Тромбоз у беременной женщины: клинические проявления
Тромбоз у беременных протекает с проявлением следующих симптомов:
- Отёк поражённой ноги;
- Покраснение и отёчность кожи вокруг поражённых вен;
- Локальное и общее повышение температуры;
- Болевая симптоматика;
- Онемение поражённой ноги;
- Быстрая утомляемость;
- Видимость сосудистого рисунка поражённой конечности.
Особенно вышеперечисленное проявляется во второй половине беременности, когда матка сильно увеличивается в размерах. Однако в том случае, если имеется тромбоз глубоких вен, симптоматика появляется ещё позже.
Диагностика тромбоза у беременных
Перед тем, как назначить пациентке лечение тромбоза, специалисты ЦЭЛТ проводят всестороннюю диагностику, направленную на постановку точного диагноза. Как правило, последнее не вызывает сложностей. Наш флеболог проводит сбор анамнеза и назначает беременной прохождение следующих исследований:
- Общий анализ крови – для оценки работы системы свёртывания;
- УЗ-сканирование плода – для определения его состояния и исключения риска гипоксии;
- Допплерография – для определения состояния кровеносных вен и обнаружения нарушений тока крови.
Понятие «тромбофилия» объединяет все наследственные и приобретенные нарушения гемостаза, при которых возникает предрасположенность к раннему проявлению и рецидивированию тромбозов, тромбоэмболии, ишемии и инфарктов органов [2]. Для практических целей очень важно выделять врожденную тромбофилию, поскольку речь идет о тромбогенных факторах, сопровождающих пациентов на протяжении всей жизни. Врожденной тромбофилией называется склонность к тромбозу в силу врожденных предрасполагающих факторов [13], независимо от причины. На протяжении многих лет к приобретенным формам тромбофилии относили антифосфолипидный синдром (АФС), однако в настоящее время имеются данные о генетической природе происхождения АФС [5], что, впрочем, не мешает относить это состояние по-прежнему к тромбофилиям. У пациенток с тромбофилией тромботические осложнения возникают в ситуациях, когда у других людей подобные осложнения не наблюдаются: при назначении пероральных контрацептивов, при беременности, при неосложненных хирургических операциях, при длительных путешествиях и сохраненной неудобной позе и т.д.
Для пациенток с тромбофилией характерно возникновение инфарктов и инсультов в молодом — до 50 лет — возрасте без явных предрасполагающих факторов, а также тромбозов необычных локализаций: сосудов сетчатки, головного мозга, вен верхней половины тела, поверхностных надчревных, срамных вен, илеофеморального тромбоза. Акушерские потери характеризуются выкидышами раннего срока, выкидышами позднего срока, повторяющимися неразвивающимися беременностями, возникновением тяжелых форм позднего гестоза с прерыванием беременности до срока 34 нед, развитием синдрома задержки роста плода, синдромом внезапной гибели плода, преждевременной отслойкой нормально расположенной плаценты.
Клиническими проявлениями тромбофилии служат тромботические осложнения или акушерские потери, о чем имеются соответствующие публикации в медицинской литературе [1, 3, 11]. Этим тромбофилия отличается от простого полиморфизма генов, число различных комбинаций которых превышает 1,5 млн. Поэтому полиморфизм генов фибриногена, фактора VIII (FVIII), фактора XIII (FXIII) и др. следует считать простым полиморфизмом генов, поскольку к настоящему времени не доказана их связь с клинической патологией.
К врожденным тромбофилиям относятся следующие состояния:
— дефицит содержания белков-антикоагулянтов: антитромбина III (АТ III) ниже 70% (по активности), протеина С (ПС) ниже 65%, протеина S (ПS) ниже 55%;
— полиморфизм генов FV Лейден — гомо- (А/А) или гетерозиготное носительство (A/G);
— полиморфизм гена протромбина FII G20210A — гомо- (А/А) или гетерозиготное носительство (A/G);
— полиморфизм гена метилентетрагидрофолатредуктазы (МТГФР) С677Т — гомо- (Т/Т) или гетерозиготное носительство (С/Т);
— полиморфизм гена ингибитора активатора плазминогена I типа (plasminogen activator inhibitor — PAI-I) — гомо- (4G/4G) или гетерозиготное носительство (4G/5G);
— антифосфолипидный синдром (АФС), диагностированный согласно современным диагностическим критериям 2006 г. [10];
— гипергомоцистеинемия — содержание гомоцистеина в плазме крови натощак более 15 ммоль/л.
АФС может быть диагностирован в случае, если имеются 1 клинический и 1 лабораторный критерии. Клинические критерии:
1. Артериальный или венозный тромбоз без воспаления сосудистой стенки.
2. Патология беременности:
а) одна гибель плода после 10 нед беременности и более;
б) эклампсия, гестоз или фетоплацентарная недостаточность в сроке менее 34 нед беременности;
в) 3 самопроизвольных аборта и более в сроки менее 10 нед беременности без анатомических, гормональных, хромосомных нарушений.
Лабораторные критерии:
1. Дважды положительный тест на волчаночный антикоагулянт с интервалом 12 нед;
2. Антикардиолипиновые антитела в высоких титрах (более 40 ед.), определенные методом ELISA с интервалом 12 нед;
3. Наличие антител к β-2-гликопротеину-I.
Следует помнить, что АФС не должен диагностироваться в тех случаях, когда временной интервал между клиническими и лабораторными проявлениями составляет менее 12 нед и более 5 лет, а поверхностные венозные тромбозы не включаются в критерии диагностики АФС.
Показания к обследованию пациенток
Обследование пациенткам назначается при возникновении идиопатических тромбозов, инсультов, инфарктов, наличии выкидыша, тяжелого гестоза, преждевременной отслойки нормально расположенной плаценты, преждевременных родов в сроках до 34 нед гестации, синдрома задержки роста плода в анамнезе, тромбозов на фоне приема пероральных контрацептивов или заместительной гормональной терапии (ЗГТ). На основании 3-летнего опыта Московского областного НИИ акушерства и гинекологии (проведено наблюдение 570 беременных с тромбофилией, в основном обусловленной сочетанием гетерозиготного носительства генов МТГФР и PAI-I), считаем целесообразным обследование для выявления тромбофилии при осложненном течении настоящей беременности даже в отсутствие акушерских осложнений в анамнезе, что позволяет обосновать лечение антикоагулянтами и предупредить прогрессирование осложнений.
Нормальными состояниями считаются активность АТIII 70% и выше, протеина С — 65% и выше, протеина S — 55% и выше; FV Лейден — G/G, протромбин FII G20210A — G/G, МТГФР С677Т — С/С, PAI-I — 5G/5G, содержание гомоцистеина в плазме крови натощак ниже 15 ммоль/л.
Вероятно также, что к тромбофилиям следует относить полиморфизм гена ангиотензинпревращающего фермента (angiotensin converting enzyme — ACE I/D) и полиморфизм эндотелиального рецептора протеина С (endothelial receptor of protein C — ERPC), связанных соответственно с рецидивами тяжелого гестоза и повторных выкидышей раннего срока беременности.
Диагностика тромбофилий
Пациенткам группы риска — при наличии в анамнезе идиопатических, или связанных с беременностью, или с приемом пероральных контрацептивов тромбозов, инфарктов, инсультов, при акушерских потерях, тяжелом гестозе, отслойке нормально расположенной плаценты в анамнезе, неудачах при примерении экстракорпорального оплодотворения и пересадки эмбрионов — назначается обследование. Желательно получить информацию максимально рано, чтобы принять решение для назначения лечения: при пренатальном обследовании, обследовании в I триместре беременности, при возникновении осложнения во время настоящей беременности.
Обследование на тромбофилию включает:
— определение процента активности белков-антикоагулянтов: АТ III, ПС, ПS;
— исследование полиморфизма генов: FV Лейден, FIIG20210A, МТГФРС677Т, PAI-I;
— определение содержания гомоцистеина натощак;
— исследование волчаночного антикоагулянта, антител к кардиолипинам и антител к β2-гликопротеину I.
Забор крови для генетических исследований и определения гомоцистеина проводится в пробирку с этилендиаминуксусной кислотой; для определения волчаночного антикоагулянта, антител к кардиолипинам и β2-гликопротеина-I в пробирку с цитратом (например, моновет-S). На фоне применения гепарина результаты тестов могут искажаться. В случае выявления одного фактора тромбофилии ставится следующий диагноз, например: тромбофилия — гетерозиготное носительство FIIG20210A A/G; в случае выявления нескольких факторов тромбофилии ставится диагноз сочетанной тромбофилии с перечислением дефектных факторов, например: сочетанная тромбофилия — гетерозиготное носительство FV Лейден A/G, гомозиготное носительство PAI-I 4G/4G, гипергомоцистеинемия.
Лечение беременных с тромбофилиями
Лечение антикоагулянтами пациенток с дефицитом белков — антикоагулянтов: антитромбина-III, протеина С, протеина S уменьшало риск потери плода [6].
Пациенток следует делить на две группы:
— имеющих акушерские потери в анамнезе;
— имеющих тромботические осложнения в анамнезе и при настоящей беременности.
Лечение возможно как препаратами нефракционированного гепарина (НФГ), так и низкомолекулярными гепаринами (НМГ): фрагмином, фраксипарином, клексаном. НФГ по сравнению с НМГ оказывают более выраженное антикоагулянтное действие, инактивируя активные молекулы факторов свертывания крови: II, X, IX, XI, XII, снижая количество микровезикул, увеличивая содержание ингибитора тканевого фактора, активизируя фибринолитическую активность, тормозя факторы системы комплемента [7]. Лечение НФГ возможно в виде подкожных инъекций или ингаляций через ультразвуковой ингалятор. Препараты НМГ имеют собственную фармакокинетику и не являются взаимозаменяемыми. Лечение проводится в профилактической дозировке — для НФГ 10 000 или 15 000 ЕД подкожно и, как правило, не требует лабораторного контроля.
При наличии акушерских потерь в анамнезе лечение начинают с ранних сроков гестации для обеспечения адекватной плацентации с 4-5 нед до 34 нед беременности, обычно НФГ подкожно по 5000 ЕД 2 раза в день с интервалом 12 ч. Для исключения гепарининдуцированной тромбоцитопении на 4, 8 и 15-й дни лечения НФГ следует определять число тромбоцитов в клиническом анализе крови. После 34 нед гестации в плаценте наступают естественные инволютивные изменения, и применение гепарина не улучшает исход беременности, теоретически увеличивая риск геморрагических осложнений. В виде ингаляций гепарин применяется в дозировке 500-700 ЕД/кг через 12 ч. При большой массе пациентки (более 90 кг) возможно использование гепарина в той же дозе через 8 ч.
При наличии тромботических осложнений у пациентки с тромбофилией при настоящей беременности и в анамнезе после лечения у сосудистых хирургов проводится терапия НФГ по 5000 ЕД через 12 или 8 ч без лабораторного контроля. Ввиду роста числа тромботических осложнений у беременных в III триместре и в послеродовом периоде, особенно в первые 4 нед, целесообразно назначение режима 5000 ЕД 3 раза в день. Применение НФГ в суточной дозе до 20 000 ЕД не требует лабораторного контроля. Родоразрешение, операции и пункция перидурального пространства безопасны, если показатели тромбинового и активированного частичного тромбопластинового времени нормальны, а количество тромбоцитов у пациентки соответствует норме [12].
Если клинико-лабораторное обследование не дает возможности поставить диагноз АФС, но имеется постоянно высокий титр антикардиолипиновых антител, антител к анти β2-гликопротеину I, постоянно определяется положительный волчаночный антикоагулянт, показано лечение НФГ в профилактической дозе — по 5000 ЕД подкожно с интервалом 12 ч.
При лечении НМГ беременных достижение уровней профилактического лечения (0,3-0,5 ЕД активности анти-Xа-фактора) затруднено ввиду увеличения скорости клубочковой фильтрации и объема распределения по мере прогрессирования беременности, поэтому рекомендованный уровень активности анти-Ха-фактора может быть достигнут только при индивидуальном подборе дозы пациентке [4, 8]. Нередко лечение НМГ не предотвращает развития гипотрофии плода, и применение НФГ является предпочтительным.
Лечение пациенток с тромботическими осложнениями требует минимального перерыва в использовании препаратов на период родоразрешения. При проведении программированных родов и планового кесарева сечения последняя инъекция гепарина проводится накануне вечером, до 15 ч следующего дня проводится родоразрешение и через 3 ч после родов возобновляется гепаринотерапия по 5000 ЕД через 12 ч в течение всего послеродового периода. Назначение полной терапевтической дозы гепарина возможно через сутки после родов и контролируется по уровню активированного частичного тромбопластинового времени для НФГ и уровню анти-Ха-фактора для НМГ. Поскольку при нормально протекающей беременности и ее осложнениях содержание D-димера повышено, этот показатель не может быть использован ни в диагностических целях, ни для контроля эффективности лечения НМГ [9].
На фоне профилактического лечения гепарином пациенток с тромбофилией, как правило, не требуется назначения других препаратов, активно действующих на свертывающую систему крови. Назначение прочих лекарственных веществ не противопоказано.
Подобная практика ведения беременных с тромбофилией позволяет добиться благоприятного исхода беременности.
Наши врачи
Дроздов Сергей Александрович
Врач сердечно-сосудистый хирург, флеболог, доктор медицинских наук
Стаж 47 лет
Записаться на прием
Малахов Юрий Станиславович
Врач — сердечно-сосудистый хирург, флеболог, Заслуженный врач РФ, доктор медицинских наук, врач высшей категории
Стаж 36 лет
Записаться на прием