Открытый артериальный проток
Открытый артериальный проток расположен в верхнем этаже переднего средостения; он берет начало от дуги аорты на уровне левой подключичной артерии и впадает в легочный ствол в месте его бифуркации и частично в левую легочную артерию; иногда встречается правосторонний или двусторонний артериальный проток. Боталлов проток может иметь цилиндрическую, конусовидную, окончатую, аневризматическую форму; его длина составляет 3-25 мм, ширина – 3-15 мм.
Артериальный проток и открытое овальное окно – необходимые физиологические компоненты фетального кровообращения. У плода кровь из правого желудочка поступает в легочную артерию, а оттуда (поскольку легкие не функционируют) через артериальный проток — в нисходящую аорту. Сразу после рождения, с первым самостоятельным вдохом новорожденного, легочное сопротивление падает, а давление в аорте поднимается, приводя к развитию сброса крови из аорты в легочную артерию. Включение легочного дыхания способствует спазму протока за счет сокращения его гладкомышечной стенки. Функциональное закрытие артериального протока у доношенных детей происходит в течение 15-20 ч после рождения. Однако полная анатомическая облитерация Боталлова протока наступает к 2-8 неделе внеутробной жизни.
Об открытом артериальном протоке говорят в том случае, если его функционирование не прекращается спустя 2 недели после рождения. Открытый артериальный проток относится к порокам бледного типа, поскольку при нем происходит сброс оксигенированной крови из аорты в легочную артерию. Артерио-венозный сброс обусловливает поступление дополнительных объемов крови в легкие, переполнение легочного сосудистого русла и развитие легочной гипертензии. Повышенная объемная нагрузка на левые отделы сердца приводит к их гипертрофии и дилатации.
Нарушения гемодинамики при открытом артериальном протоке зависят от размера сообщения, угла его отхождения от аорты, разницы давления между большим и малым кругом кровообращения. Так, длинный, тонкий, извилистый проток, отходящий под острым углом от аорты, оказывает сопротивление обратному току крови и препятствует развитию значимых нарушений гемодинамики. Со временем такой проток может самостоятельно облитерироваться. Наличие короткого, широкого открытого артериального протока, напротив, обусловливает значительный артерио-венозный сброс и выраженные гемодинамические расстройства. Такие протоки к облитерации не способны.
Публикации в СМИ
Открытый артериальный проток (ОАП) — сосуд, через который после рождения сохраняется патологическое сообщение между аортой и лёгочной артерией (ЛА). У здоровых детей функционирование протока прекращается сразу после рождения или продолжается в резко уменьшенном объёме не более 20 ч. Впоследствии артериальный проток постепенно облитерируется и превращается в артериальную связку. В норме облитерация протока заканчивается через 2–8 нед. Артериальный проток считают аномалией, если он функционирует спустя 2 нед после рождения.
Статистические данные: ОАП — один из наиболее часто встречаемых пороков (6,1% всех ВПС у детей грудного возраста, 11–20% всех ВПС, диагностированных в клинике, 9,8% — по данным аутопсий); соотношение мужского пола к женскому — 1:2. Этиология: описаны семейные случаи порока; нередко у матери в анамнезе — краснуха, герпес, грипп на 4–8-й неделях беременности; предрасполагающее значение имеют недоношенность и синдром респираторного дистресса новорождённых, гипоксия новорождённого с высоким содержании Пг. Патофизиология. Направление сброса крови обусловлено разницей давления между аортой и ЛА и зависит от величины сопротивления лёгочного и системного сосудистого русла (пока лёгочное сосудистое сопротивление ниже системного, происходит сброс крови слева направо, при преобладании лёгочного сопротивления происходит смена направления шунтирования). При больших размерах ОАП рано возникают изменения в лёгочных сосудах (синдром Айзенменгера).
Клиническая картина и диагностика Жалобы: быстрая утомляемость, одышка, ощущение перебоев в работе сердца, частые инфекции, парадоксальные эмболии. Объективное обследование • Отставание в физическом развитии • Бледность кожных покровов, непостоянный цианоз при крике, натуживании • Симптомы «барабанных палочек» и «часовых стёкол» • Стойкий цианоз при сбросе крови справа налево • «Сердечный горб», усиленный верхушечный толчок, систолическое дрожание с максимумом во втором межрёберном промежутке слева от грудины • Границы сердца расширены влево и вправо • Снижение диастолического и повышение пульсового АД, усиление верхушечного толчка, усиление обоих тонов сердца (громкость II тона над ЛА коррелирует со степенью выраженности лёгочной гипертензии) • Грубый машинный систолодиастолический шум во II межреберье слева от грудины, иррадиирующий в межлопаточное пространство и на магистральные сосуды • По мере прогрессирования лёгочной гипертензии и снижении сброса слева направо шум ослабевает и укорачивается вплоть до полного исчезновения (в этой стадии может появляться диастолический шум Грэма Стилла, возникающий из-за относительной недостаточности клапана ЛА) с последующим повторным нарастанием при возникновении сброса справа налево • Иногда над верхушкой сердца — шум относительного стеноза или недостаточности митрального клапана. Инструментальная диагностика • ЭКГ: признаки гипертрофии и перегрузки правых, а затем и левых отделов сердца; редко — блокада ножек пучка Хиса. • Рентгенологическое исследование органов грудной клетки. Выбухание дуг ЛА, правого и левого желудочков. Обогащение лёгочного рисунка, расширение и неструктурность корней лёгких. Расширение восходящей части аорты. У взрослых относительно редко может визуализироваться обызвествлённый ОАП. • ЭхоКГ. Гипертрофия и дилатация правого и левого желудочков. Визуализация ОАП, определение его формы, длины и внутренних диаметров (для оценки прогноза и подбора размеров эндоваскулярного окклюзирующего устройства). В допплеровском режиме выявляют специфическую форму сдвига допплеровского спектра частот в ЛА, определяют степень сброса и отношение лёгочного кровотока к системному (Qp/Qs). • Катетеризация левых и правых отделов сердца. Симптом буквы — проведение катетера из ЛА через ОАП в нисходящую аорту. Повышение оксигенации крови в ЛА по сравнению с правым желудочком более чем на 2 объёмных процента. Проводят пробы с аминофиллином и ингаляцией кислорода для определения прогноза в отношении обратимости лёгочной гипертензии. • Восходящая аортография. Поступление контрастного вещества из восходящей аорты в ЛА. Диагностика сопутствующей коарктации аорты. Медикаментозная терапия. До закрытия ОАП необходимо проведение профилактики бактериального эндокардита. Применение индометацина показано при узких ОАП, выявленных в период новорождённости, и противопоказано при почечной недостаточности. Рекомендовано внутривенное введение индометацина: • менее 2 сут: начальная доза 200 мкг/кг; затем 2 дозы по 100 мкг/кг с интервалом 12–24 ч; • 2–7 сут: начальная доза 200 мкг/кг; затем 2 дозы по 200 мкг/кг с интервалом 12–24 ч; • более 7 сут: начальная доза 200 мкг/кг; затем 2 дозы по 250 мкг/кг с интервалом 12–24 ч.
Хирургическое лечение Показания • Безуспешность консервативной терапии в течение 5 сут и более, противопоказания к применению НПВС • Декомпенсация недостаточности кровообращения • ОАП среднего или большого диаметра у всех детей до 1 года. Противопоказания • Тяжёлая сопутствующая патология, угрожающая жизни больного • Терминальная стадия недостаточности кровообращения • Необратимая лёгочная гипертензия. Методы хирургического лечения. В большинстве случаев выполнимо эндоваскулярное закрытие протока при помощи окклюзирующих устройств (спирали Gianturco, спирали Кука или зонтичных устройств). При очень широком протоке или безуспешности эндоваскулярной коррекции проводят открытую операцию перевязки или (реже) пересечения ОАП с последующим ушиванием обоих концов. Торакоскопическое клипирование ОАП не имеет преимуществ перед эндоваскулярными и открытыми вмешательствами, поэтому его проводят редко. Специфические послеоперационные осложнения: травма левого возвратного гортанного нерва, кровотечение, деформация аорты с образованием коарктации, остаточный сброс крови через проток вследствие неадекватной коррекции.
Прогноз. Узкий ОАП в целом не влияет на продолжительность жизни, но увеличивает риск инфекционного эндокардита. Средний и широкий ОАП практически никогда не закрываются самостоятельно, самопроизвольное закрытие после 3 мес происходит редко. Эффективность консервативного лечения узких ОАП достигает 90%. При ОАП летальность в течение первого года жизни — 20%. Синдром Айзенменгера у детей старшего возраста наблюдают в 14% случаев, инфекционный эндокардит и эндартериит — в 9% случаев. Аневризма протока и её разрывы — единичные случаи. Средняя продолжительность жизни при средних ОАП — 40 лет, при широких — 25 лет. Послеоперационная летальность — 3%. Клиническая реабилитация в зависимости от гемодинамических нарушений проходит в течение 1–5 лет. Беременность. У женщин с ОАП небольшого или среднего размера и сбросом крови слева направо можно ожидать неосложнённого течения физиологической беременности. У женщин с высоким лёгочным сопротивлением и шунтом справа налево повышен риск осложнений. Синонимы: Открытый боталлов проток; Незаращение артериального протока; Незаращение боталлова протока. Сокращения. ОАП — открытый артериальный проток. ЛА — лёгочная артерия.
МКБ-10 • P29.3 Стойкое фетальное кровообращение у новорождённого • Q21.4 Дефект перегородки между аортой и лёгочной артерией • Q25.0 Открытый артериальный проток
Норильская межрайонная детская больница
В статье представлены современные сведения о патогенезе и подходах к диагностике и терапии открытого артериального протока (ОАП) у недоношенных детей. Приведена сравнительная характеристика маркеров гемодинамической значимости ОАП, показана роль функционирования протока в формировании ряда заболеваний, характерных для недоношенных новорожденных. Представлены исследования, посвященные различным стратегиям консервативного и оперативного лечения ОАП.
Совершенствование методик выхаживания новорожденных в нашей стране, широкое использование препаратов сурфактанта не только значительно увеличило выживаемость недоношенных новорожденных, но и поставило перед неонатологами новые проблемы. Одна из них — открытый артериальный проток (ОАП).
В течение длительного времени в нашей стране не было официально зарегистрированных препаратов для медикаментозной коррекции этого состояния, возможность хирургического лечения недоношенных детей также была представлена в небольшой части неонатальных реанимационных отделений. Диагностические подходы и показания к терапии нередко были заимствованы из протоколов ведения доношенных новорожденных с врожденными пороками сердца (ВПС).
До конца 90-х годов XX века в отечественной литературе встречались единичные упоминания о проблеме ОАП у недоношенных детей [1-3]. В результате в России до последнего времени отсутствовали единые диагностические и терапевтические подходы в отношении ОАП у недоношенных новорожденных. В представленном материале мы бы хотели обобщить международный и отечественный опыт в отношении совершенствования знаний о физиологии персистирования артериального протока (АП) у недоношенных новорожденных, современных подходах к диагностике и терапии этого состояния. Историческая справка. Впервые фетальное кровообращение было описано еще Галеном (130-200 гг.). В 1583 г. итальянский врач и анатом Леонардо Боталио повторно обнаружил и описал сосуд, соединяющий аорту и легочную артерию, и назвал его АП. Базельская спецификация 1895 г. присвоила этому сосуду его имя. Об установлении клинического диагноза ОАП сообщил впервые Bernuts в 1847 г. В 1907 г. Munro выступил на заседании Филадельфийского хирургического общества с идеей оперативного лечения ОАП.
Первую в мире успешную операцию по закрытию ОАП в 1938 г. выполнил общий хирург R. Gross у пациента 7 лет. Первая подобная успешная операция в нашей стране была выполнена в 1948 г. А.Н. Бакулевым. У недоношенного ребенка весом 1413 г закрытие ОАП впервые было осуществлено в 1963 г. Таким образом, в течение 13 лет, до 1976 г, когда впервые для закрытия ОАП был применен индометацин, хирургическое лечение оставалось единственным способом терапии ОАП у недоношенных детей. С 1995 г. в мире помимо индометацина с целью закрытия ОАП используется также ибупрофен, имеющий ряд преимуществ. В октябре 2008 г. в России был зарегистрирован первый препарат для закрытия ОАП у недоношенных детей -Педеа®.
Распространенность. ОАП — одно из патологических состояний, характерных для глубоконедоношенных новорожденных, в особенности страдающих респираторным дистресс-синдромом (РДС). Частота встречаемости ОАП обратно пропорциональна гестационному возрасту (ГВ) и массе тела (МТ) при рождении. Так, у новорожденных с ГВ менее 28 недель и с МТ менее 1000 г потребность в лечении ОАП составляет 55-70% [4]. По данным Fanaroff А.А. и соавт. [5], частота гемодинамически значимого функционирующего АП (ГЗФАП) у новорожденных с очень низкой МТ при рождении (ОНМТ) составляет от 13% у детей МТ 1251-1500 г до 49% у новорожденных с МТ 501-750 г [5].
Диагноз ОАП ставится обычно в том случае, если он не закрывается самостоятельно к 72 ч жизни [6, 7]. АП является одним из основных компонентов кровообращения плода — это сосуд, соединяющий левую легочную артерию и нисходящую аорту. Высокое легочное сосудистое сопротивление (вследствие констрикции легочных артериол) и низкое сопротивление сосудов плаценты поддерживают направление тока крови справа налево через АП и обратно к плаценте [8, 9].
Направление шунтирования крови. Вопросы терминологии. Вопрос о направлении тока крови по АП является основополагающим для определения клинической значимости шунта. Существует распространенное заблуждение о том, что, несмотря на нарушение закрытия АП у недоношенных детей после рождения, давление в системе легочной артерии настолько высоко, что в первые дни жизни сброс крови по сосуду незначителен.
На самом деле, только у небольшой части недоношенных новорожденных давление в легочной артерии настолько высоко. У большинства недоношенных системное артериальное давление значительно превышает давление в легочной артерии, что определяет направление шунтирования крови преимущественно слева направо [10].
В иностранной литературе термин ОАП («patent ductus arteriosus») определяет шунтирование крови слева направо — из нисходящей аорты в легочную артерию. Шунтирование крови в обратном направлении — из легочной артерии в аорту — является составной частью синдрома персистирующего фетального кровообращения («persistent fetal circulation») в условиях персистирующей легочной гипертензии.
В сущности, этот термин и определяет направление тока крови, так как в норме у плода никогда не происходит лево-правого шунтирования. В то же время согласно МКБ 10 для обозначения «задержки закрытия артериального протока у новорожденного» используется термин «стойкое фетальное кровообращение у новорожденного» (код Р29.3).
Следует обратить внимание на тот факт, что две различные патологии, требующие различного лечения, имеют одинаковый код. В 2009 г. Российская ассоциация специалистов перинатальной медицины рекомендовала расширение перечня диагнозов до трехзначного уровня -использование кода Р29.3.1 для задержки закрытия АП у новорожденного и кода Р29.3.2 — для стойкого фетального кровообращения (персистирующей легочной гипертензии) у новорожденного.
Для обозначения персистирующего АП или врожденной аномалии развития сердца используется код «открытый артериальный проток» Q25.0 в разделе «Врожденные аномалии (пороки развития) крупных артерий» [11]. Регуляция тонуса стенки АП. Антенатальное функционирование АП достигается в результате равновесия между двумя группами факторов, способствующих закрытию протока и поддерживающих его открытым. Факторы, обеспечивающие антенатальное повышение тонуса ОАП, изучены мало. К ним относится уровень содержания внеклеточного кальция.
Доказано, что чувствительность гладкомышечной стенки ОАП к контрактильному влиянию кальция значительно выше, чем у стенок аорты и легочной артерии. Эндотелиин 1 также играет важную роль в формировании тонуса стенки АП [12, 13]. Факторы, способствующие поддержанию АП открытым, изучены значительно лучше. В первую очередь, это высокое давление крови в просвете сосуда, обусловленное высоким сосудистым сопротивлением легочных артериол [13]. Стенка АП чувствительна не только к действию простагландинов (PG), вырабатываемых в самой стенке, но и к уровню циркулирующего PGE2.
Основным источником PG является плацента, а их катаболизм происходит в ткани легких. Таким образом, у плода в условиях резко сниженного легочного кровотока создаются предпосылки для высокой концентрации PG в крови [14]. Значительная роль эндогенного оксида азота (NO), который также вырабатывается в стенке АП и поддерживает его открытым, доказана и клинически, и в эксперименте [15, 16]. Оксид углерода (СО) также является вазодилататором и обнаруживается в эндотелии и мышечной стенке АП. Количество СО, вырабатываемое стенкой АП в обычных условиях, не может значительно повлиять на его тонус, в то же время при увеличении синтеза СО, например, при эндотоксинемии возможно проявление его вазодилатирующего эффекта [14].
Как и у большинства гладкомышечных сосудов под действием гипоксии в АП происходит снижение тонуса мышечной стенки. Относительно невысокое содержание кислорода в крови плода приводит к тому, что АП остается открытым [17]. Сочетание утолщения интимы с констрикцией сосуда вследствие повышения уровня кислорода в крови приводит к функциональному закрытию АП после рождения (обычно в течение первых часов жизни). Анатомическое закрытие с дифференциацией и апоптозом клеток гладкомышечной оболочки в дальнейшем приводит к образованию артериальной связки (к 3-4-й неделе жизни) [18].
Закрытие АП после рождения. Пусковым моментом перестройки кровообращения новорожденного ребенка является перевязка пуповины и первый вдох. Прекращение пупочного кровотока (связи с плацентой) приводит к резкому снижению уровня циркулирующих PG и повышению системного артериального давления. Наполнение легких воздухом и начало газообмена приводит к снижению механического сдавления сосудов легких легочной тканью, повышению напряжения кислорода крови (РаО2), что приводит к резкому увеличению легочного кровотока и снижению сопротивления легочных сосудов.
Таким образом, направление тока по АП меняется на лево-правое, а затем в условиях низкого легочного сопротивления прекращается поток крови по АП. Значительную роль также играет постнатальное повышение уровня парциального давления кислорода крови (РаО2). Цитохром Р450, находящийся в мембране клеток мышечной сосудистой оболочки, играет роль рецептора в вазоконстрикторном влиянии кислорода на стенку АП. Кислород блокирует К+-каналы. Это приводит к деполяризации мембран и повышению содержания внутриклеточного кальция в мышечной стенке сосуда, что приводит к увеличению ее тонуса [13].
Сразу после рождения АП спазмируется, но не происходит его немедленного закрытия. Большинство регистрируемых в первую неделю жизни ОАП у доношенных новорожденных закрываются спонтанно [19]. В то же время у недоношенных новорожденных, особенно детей с экстремально низкой МТ при рождении (ЭНМТ) часто наблюдается нарушение механизмов закрытия АП. Даже в случае, если после рождения происходит функциональное закрытие сосуда, редко достигается этап глубокой ишемии мышечной стенки, что создает предпосылки для повторных открытий АП.
Кроме того, отчетливо прослеживается связь между незрелостью новорожденного, РДС, инфекционными заболеваниями и риском персистирования ОАП [13, 19, 20]. Целый ряд механизмов незрелого ребенка, описанных выше, направлен на поддержание АП открытым и после рождения. К внутренним факторам относятся незрелая мышечная оболочка, вырабатываемые стенкой АП вазодилатирующие вещества (PG, эндогенный N0). К внешним факторам можно отнести низкий уровень кортизола у недоношенных новорожденных (кортизол способствует снижению синтеза PG и снижает чувствительность стенки АП к их действию), высокий уровень циркулирующих PG [21].
Одним из факторов, способствующих выбросу PG в кровь, является, например, искусственная вентиляция легких (ИВЛ), так как легочная ткань богата арахидоновой кислотой -предшественником PG [22]. К возрасту 7 дней жизни уровень PG в крови имеет тенденцию к снижению, что объясняет снижение эффективности ингибиторов циклооксигеназы в терапии ОАП. Позднее (старше 7 суток) повторное открытие АП почти всегда обусловлено инфекционным процессом вследствие выделения провоспалительных цитокинов.
Наибольшую роль в этом играет фактор некроза опухоли a (TNFa). Это медиатор воспаления, уровень которого достоверно повышен у новорожденных с поздним открытием АП, запускает метаболический каскад, в конце которого находятся в частности эндогенный N0 и PG [23]. Время закрытия АП у недоношенных новорожденных значительно варьирует.
Ряд авторов отмечает, что чем быстрее происходит констрикция сосуда в первые часы после рождения, тем вероятнее спонтанное закрытие ОАП. Исключение составляют глубоконедоношенные новорожденные (ГВ<27 нед) [13]
ОАП и БЛД. Большинство новорожденных с ОАП требуют проведения длительной ИВЛ и дотации кислорода. Кроме того, частота ОАП увеличивается с уменьшением ГВ. Таким образом, факторы риска формирования БЛД и терапевтические аспекты лечения ОАП совпадают. Кроме того, в ряде исследований было доказано, что функционирование ОАП независимо и особенно в сочетании с инфекционным процессом является фактором риска формирования БЛД [23, 32].
Повторное позднее (в возрасте более 7 суток) открытие АП и длительное его функционирование достоверно чаще приводят к формированию БЛД, чем так называемый «ранний» ОАП, регистрируемый в первую неделю жизни [33). Ряд авторов обращают внимание на тот факт, что, несмотря на очевидность утверждения о том, что функционирование ОАП является фактором риска формирования БЛД, при профилактическом применении нестероидных противовоспалительных препаратов для закрытия ОАП не происходит снижения частоты развития БЛД [34].
Вероятно, это может быть связано с тем, что на формирование БЛД в большей степени влияет длительность функционирования ОАП, а не сам факт его наличия. Кроме того, высказывается предположение, что функционирование ОАП может быть маркером незрелости, в том числе и легочной ткани.
Диагностика ОАП. Клинические признаки (систолический шум, усиленный сердечный толчок, скачущий пульс) у недоношенных новорожденных имеют низкую чувствительность в диагностике ОАП. Их значимость возрастает после 4 дней жизни. При этом гемодинамическая значимость опережает появление клинической симптоматики в среднем на 2 дня (от 1 до 4 дней) [40].
Другим классическим признаком ОАП принято считать большую систолодиастолическую разницу. Однако разницы в показателях артериального давления у недоношенных новорожденных с ОАП и без ОАП в течение первой недели жизни выявлено не было. Доказано негативное влияние ОАП как на систолическое, так и на диастолическое артериальное давление. В результате у детей с ОАП отмечалось достоверно более низкое среднее артериальное давление, но не отмечено было разницы в показателях пульсового давления [41].
Точная диагностика наличия и гемодинамической значимости АП возможна только при проведении эхо-кардиографии. Диагностическая ценность определения диаметра АП и направления шунтирования по нему не вызывает сомнений в отличие от других признаков гемодинамической значимости АП, достоверность которых широко обсуждается в медицинской литературе. В исследование Evanse и соавт. [42] были включены новорожденные с МТ при рождении менее 1500 г с минимальным шунтом через овальное окно.
Критерием, имеющим наибольшую корреляцию с показателем Qp:Qs (соотношение легочного кровотока к системному), был диаметр ОАП. При исследовании в течение первой недели жизни диаметр АП менее 1,5 мм обычно не имел гемодинамической значимости, при увеличении диаметра более 1,5 мм шунт становился гемодинамически значимым. При диаметре АП более 2 мм показатель Qp:Qs составлял более 2:1. Другим достоверным показателем является диастолический ток в постдуктальном отделе нисходящей аорты.
В нормальных условиях поток крови в этом отделе аорты однонаправленный, но при наличии функционирующего шунта поток крови в диастолу направляется в АП и при допплерографии регистрируется сначала стремящийся к изолинии, а затем ретроградный ток крови. Ретроградный поток ассоциирован с показателем Qp:Qs равным 1,6. Таким образом, легочный кровоток на 60% больше системного [19, 42]. То же происходит и на обратной стороне шунта, где возрастает диастолический поток в левой ветви легочной артерии, что тоже может являться показателем гемодинамической значимости шунта [43].
Помимо перечисленных выше критериев гемодинамической значимости шунтирования крови по ОАП используются также отношение диаметра левого предсердия к диаметру корня аорты (LA/Ao), отношение конечного диастолического размера левого желудочка к корню аорты, а также повышение индексов сосудистой резистентности в церебральных сосудах [44]. Одним из новых эхокардиографических критериев, продемонстрировавших высокую (90%) чувствительность и специфичность, является отношение сердечного выброса левого желудочка к кровотоку в верхней полой вене (LVO/SVC) [45].
Среди новых методик объективной оценки гемодинамической значимости шунта через АП обсуждаются исследование натрийуретического гормона типа В (BNUP) [46-48], кардиотропонина Т (сТпТ) [49, 50].
Ведение новорожденных с гемодинамически значимым ОАП. Существует три способа ведения недоношенных новорожденных с ОАП: консервативное ведение, хирургическое лечение, медикаментозное закрытие с помощью нестероидных противовоспалительных препаратов (НПВП).
В последнее время консервативное ведение новорожденных с ОАП активно обсуждается медицинской общественностью. Высказывается предположение, что существует некоторая категория относительно зрелых новорожденных, для которых функционирование ОАП не является опасным в отношении развития описанных выше патологических состояний. По данным литературы [51, 53], описывается спонтанное закрытие АП у 86% новорожденных (средние ГВ=28 нед, МТ=998 г), выписанных из стационара с ОАП, в течение 11 мес.
Хирургическое лечение. Доказательств каких-либо преимуществ хирургического метода лечения ОАП перед медикаментозным до настоящего времени нет. В 1983 г. было проведено многоцентровое рандомизированное исследование, сравнивающее исходы у новорожденных, изначально в первые дни жизни оперированных по поводу функционирования ОАП и получивших лечение индометацином.
Была выявлена высокая частота пневмотораксов и ретинопатии недоношенных у оперированных детей. При этом в других исходах различий выявлено не было [54]. Работа Cassady и соавт. [55] в 1989 г. показала меньшую частоту энтероколитов в группе новорожденных, которым было проведено раннее профилактическое лигирование ОАП, в других исходах также различий отмечено не было.
Хирургический способ коррекции признается как сопряженный с большим числом осложнений. В рандомизированном исследовании Kabra и соавт. [56] было выявлено, что хирургическая коррекция повышает риск плохих неврологических исходов, значительно повышает риск тяжелой ретинопатии недоношенных.
В другом исследовании Chorne N. и соавт. [57] не было выявлено влияния проведения хирургической коррекции на увеличение риска развития неврологических осложнений, однако было отмечено, что хирургическая коррекция — независимый фактор риска развития БЛД. В большинстве работ, оценивающих отрицательное влияние хирургического лечения ОАП, имеется более длительное функционирование ОАП в группе детей, подвергшихся хирургической коррекции.
В настоящий момент в большинстве клиник хирургическая коррекция ОАП проводится при неэффективности двух курсов медикаментозной коррекции или позднем повторном открытии АП. Вопрос о том, насколько проведение операции защищает ребенка от дальнейших, характерных для функционирования ОАП осложнений остается спорным [38]. В соответствии с рекомендациями Российской ассоциации специалистов перинатальной медицины хирургическая коррекция ГЗФАП проводится только новорожденным, зависимым от ИВЛ при неэффективности двух курсов медикаментозной терапии ингибиторами ЦОГ, наличии противопоказаний для их применения, при возрасте новорожденного более 7 суток [11].
Медикаментозная терапия ГЗФАП. Сравнению различных стратегий медикаментозной терапии ГЗФАП посвящено большое число исследований. Наиболее полно сравнительная характеристика этих исследований представлена в работе David В. Knight [24].
В качестве ингибиторов ЦОГ используются индо-метациниибупрофен. Оба препарата одинаково эффективны в отношении закрытия АП. Использование ибупрофена для закрытия АП было разработано как альтернатива применению индометацина. Ибупрофен значительно меньше влияет на почечный, мезентериальный и мозговой кровоток [58, 59]. В сравнительном исследовании Van Overmeire и соавт. [60] оба препарата были одинаково эффективны в закрытии ОАП, отсутствовала разница в частоте необходимости проведения повторного курса терапии, хирургической коррекции.
Отмечена меньшая частота олигурии у новорожденных, получавших ибупрофен. Мета-анализ 16 исследований (876 детей с ОНМТ, получавших ибупрофен или индометацин для лечения ОАП) показал отсутствие достоверной разницы в частоте неэффективности лечения, потребности в хирургической коррекции и смертности.
Также не было выявлено достоверной разницы в ухудшении исходов -БЛД, ВЖК тяжелой степени, перивентрикулярной лейкомаляции (ПВЛ), НЭК, перфорации кишечника, ретинопатии недоношенных. В 6 исследованиях (336 детей) был отмечен достоверно более низкий уровень креатинина крови, а в 3 исследованиях (358 детей) -достоверно меньшая частота олигурии у новорожденных, получавших ибупрофен [61]. Высокая стоимость внутривенной формы ибупрофена в сравнении с индометацином, недоступность этого препарата в ряде стран привели к тому, что стали проводиться исследования эффективности и безопасности применения ибупрофена внутрь.
На настоящий момент имеется 7 небольших рандомизированных исследова¬ний, посвященных этой проблеме (общее число вклю¬ченных в исследования — 208 детей) и подтверждаю¬щих эффективность препарата в закрытии ОАП [62, 63]. Однако имеется несколько сообщений о серьезных осложнениях, связанных с назначением ибупрофена через рот — развитии острой почечной недостаточности [64] и перфорации кишечника [65], что не позволяет рекомендовать этот способ терапии ОАП.
Одним из наиболее дискуссионных вопросов в ведении детей с ОАП остается время начала лечения НПВП. Сразу следует отметить, что препарат, зарегистрированный в России — раствор ибупрофена для внутривенного введения Педеа® — не рекомендован для профилактического применения.
В исследовании van Overmeire et al. [66] сравнивалось лечебное введение индометацина на 3-й и 7-й день. В группе 3-го дня отмечалось достоверно большее число побочных эффектов, связанных с введением индометацина, при отсутствии преимуществ в отношении респираторных исходов и летальности. При проведении мета-анализа было отмечено, что при раннем введении индометацина реже требуется последующее закрытие ОАП, но отсутствует разница в исходах, включая развитие БЛД и летальность [26].
Исходя из вышеизложенного, если протокол предусматривает позднее (7-й день) введение препарата, можно ожидать, что ОАП закроется самостоятельно, но, с другой стороны, учитывая ранние гемодинамические осложнения (до 3-5 суток) ОАП — легочные кровотечения, НЭК, ранние ВЖК, возможно позднее введение может значительно ухудшить исходы у детей с ОНМТ. Рекомендации по ведению ОАП у недоношенных детей в различных странах и клиниках значительно отличаются.
Перспективно интересным является вариант ведения детей с ОАП, рекомендованный в работе австралийского исследователя N. Evans [19]. В протоколе Department of Neonatal Medicine Royal Prince Alfred Hospital предусмотрено назначение НПВП на основании динамического наблюдения за диаметром ОАП. Всем детям из группы риска проводится эхокардиографическое исследование в возрасте 3-6 ч жизни. Если диаметр АП более медианы 2,0 мм в возрасте 3 ч, ребенок получает первое введение препарата [19].
К сожалению, в современных российских условиях отсутствия возможности оперативного проведения эхокардиографии у новорожденных в первые часы жизни в большинстве клиник такая тактика пока неприемлема. Проблема своевременной диагностики и лечения ГЗФАП у новорожденных с ОНМТ и ЭНМТ является неотъемлемой частью совершенствования терапии глубоконедоношенных новорожденных наряду с применением препаратов сурфактанта, внедрением новых методик респираторной терапии, оптимизацией энтерального и парентерального питания и другими компонентами ведения этой группы пациентов.
Международный опыт применения препаратов для лечения ОАП, накопленный в течение 30 лет, российский клинический опыт в будущем должны позволить значительно улучшить исходы у новорожденных с ОНМТ и ЭНМТ.
Эпидемиология и частота встречаемости
Факторы, ответственные за стойкое раскрытое состояние протока после рождения полностью не понятны. Ясно, что преждевременные роды определенно увеличивают частоту встречаемости ОАП. и это происходит из-за физиологических факторов, связанных с недоношенностью, а не в результате врожденной патологии протока [9]. У доношенных младенцев, частота встречаемости ОАП составляет около одного случая на 2 тыс. рождений, что составляет 5-10% всех врожденных пороков сердца [9]. В большей степени заболеванию подвержены женщины с соотношением к мужчинам – 2:1.
Имеются данные, что генетические факторы могут играть важную роль у многих пациентов с ОАП. Так, ОАП встречается с увеличенной частотой в нескольких генетических синдромах, включая хромосомные отклонения, такие, как трисомия 21 и 4p-синдром, а также генные мутации, связанные с синдромами Carpenter и Holt-Oram. Кроме того, на частоту встречаемости могут влиять внешние факторы, такие, как предродовая инфекция вирусом краснухи в первый триместр беременности, особенно в первые четыре недели.
Гемодинамические последствия
Состояние гемодинамики при ОАП в нормальном сердце связано с величиной шунтирования слева направо. Это зависит от размера и формы протока, поэтому традиционно выделяют крупные, умеренные и малые протоки, а также от градиента давления между аортой и легочной артерией. Шунтирование слева направо через ОАП приводит к перегрузке объемом малого круга и левого желудочка (ЛЖ). Увеличение легочного кровотока приводит к росту легочного объема жидкости и уменьшению эластичности легких, что может сказываться на их функции. В свою очередь увеличение венозного возврата в левые отделы приводит к увеличению их конечного диастолического давления, дилатации и гипертрофии.
В перспективе при крупных протоках и большом сбросе слева направо может наблюдаться гипертрофия меди артериол, пролиферация и фиброз интимы, что приводит к резкому повышению сосудистого сопротивления в малом круге. В конечном итоге давление в легочной артерии начинает приближаться или превышает системное, и, таким образом, формируется синдром Эйзенменгера. Помимо синдрома Эйзенменгера, среди других осложнений ОАП выделяют развитие застойной сердечной недостаточности, инфекционный эндартериит и аневризмы протока, парез гортанного нерва и редко, расслоение легочной артерии и аорты.
Профилактика и прогноз
Так как патология является врожденной, специальных методов профилактики нет. Риск формирования этого порока можно уменьшить, обеспечив нормальные условия протекания беременности и развития плода.
Прогноз при данном заболевании разный. При отсутствии лечения болезнь трансформируется из белого в синий тип порока (со сбросом крови в направлении справа налево). Для благоприятного прогноза важной является ранняя диагностика открытого артериального протока.
Если ребенок родился недоношенным, то наличие открытого артериального протока считается нормой.
Клиническое течение и диагностика
Клинические проявления ОАП зависят от величины шунтирования и могут варьировать от полного отсутствия симптоматики до формирования тяжелой сердечной недостаточности при синдроме Эйзенменгера. При объективном осмотре характерным признаком ОАП является непрерывный систоло-диастолический шум по левому краю грудины, часто описываемый как машинный. Шум часто сопровождается дрожанием грудной клетки и может проводиться на спину.
Описано несколько вариантов ЭКГ при ОАП [1]. ЭКГ-изменения зависят от величины сброса слева направо, поэтому исследование может быть как нормальным, при небольшой величине шунта, так и может наблюдаться синусовая тахикардия или фибрилляция предсердий, гипертрофия ЛЖ и дилатация левого предсердия. У пациентов с большим ОАП на фоне выраженной легочной гипертензии может наблюдаться бивентрикулярная гипертрофия.
Эхокардиография (ЭхоКГ) является методом выбора в диагностике и оценке степени тяжести ОАП. Характерным для ОАП является регистрация ретроградного потока в стволе легочной артерии в парастернальном доступе длинной оси на уровне аортального клапана или потока из нисходящей аорты в легочную артерию в супрастернальном доступе при регистрации спектрального или цветного допплеровского картирования (ЦДК).
ЦДК является наиболее чувствительной методикой, позволяющей выявлять даже крошечные протоки. Обычно ЦДК показывает непрерывную струю в форме пламени из устья протока в бифуркации легочной артерии, ближе к левой ветви, направленную вдоль переднебоковой стенки ствола легочной артерии. Спектральный допплер у пациента с низким давлением в легочной артерии показывает непрерывный, систоло-диастолический поток с самой высокой скоростью в середине систолы и самой низкой – в конце диастолы. Звуковой сигнал, полученный на допплеровском исследовании, очень похож на аускультативный. При синдроме Эйзенменгера, то есть при давлении в легочной артерии, сопоставимом с системным, поток становится двунаправленным, из аорты в легочную артерию в диастолу и из легочной артерии в аорту в систолу [7].
Помимо собственно детектирования ОАП необходимо оценить его гемодинамические последствия. Обычно производится оценка размера полостей сердца и определяется систолическая функция ЛЖ. У пациента с маленьким ОАП размеры полостей обычно нормальные, хотя может присутствовать небольшое расширение левого предсердия и/или ЛЖ. У пациента с умеренным или большим ОАП наблюдается увеличение левых отделов. У пациентов с высоким давлением в легочной артерии и низкой скоростью потока через ОАП или при шунтировании справа налево диагностика порока может быть затруднена, так как демонстрация потока на ЦДК становится проблематичной, даже если он является крупным. Косвенные признаки, такие, как плоская межжелудочковая перегородка, необъяснимая выраженная гипертрофия правого желудочка и высокоскоростная легочная регургитация, должны требовать более тщательного исследования для исключения ОАП [9].
Помимо обязательной регистрации струи ОАП на спектральном допплере и ЦДК необходимо оценить давление в правом желудочке от сигнала трикуспидальной регургитации. Также возможно определение диастолического давления в легочной артерии от потока легочной регургитации и оценка степени шунтирования слева направо через определение ударного объема в выносящем тракте левого и правого желудочков.
Одной из интересных форм заболевания является так называемый немой или тихий ОАП. Как немой ОАП расценивается при: a) отсутствии характерного систолодиастолического шума; б) отсутствии доказательств легочной гипертонии на клиническом осмотре, ЭКГ и ЭхоКГ; в) при наличии характерного потока при ЦДК и спектральном исследовании легочной артерии с относительно высокой скоростью в диастолу.
Немые ОАП являются нередкой формой заболевания с возможной частотой встречаемости до одного случая на 500 человек [6, 9]. Так в одном из исследований описан 21 пациент с немым протоком, причем у 6 из них вообще не имелось шума, два имели мягкие шумы другого дефекта, а у оставшихся 13 наблюдались так называемые невинные шумы [6].
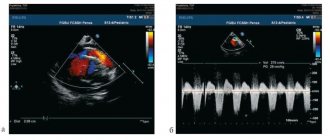
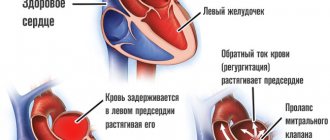
В качестве примера приводим следующий случай. На ЭхоКГ в диагностическое отделение КГУЗ «Красноярская краевая больница № 2» направлена девочка 8 лет по поводу подозрения на пролапс митрального клапана. Аускультативно у пациентки выслушивался мягкий систолический шум в точке Боткина. Клинически чувствовала себя удовлетворительно, вела активный образ жизни. На ЭхоКГ-исследовании полости сердца в пределах нормальных показателей, выявлена «тривиальная» трикуспидальная регургитация, признаков легочной гипертензии не наблюдается, нижняя полая вена нормальных размеров, хорошо реагирует на акт дыхания. Однако в парастернальном доступе длинной оси на уровне аортального клапана и супрастернальном доступе выявлен аномальный поток, характерный для ОАП (рис.)
. Таким образом, на основании клинических данных и ЭхоКГ-признаков был диагностирован немой
ОАП
.
Рисунок. Цветное допплеровское картирование. Левая часть. Супрастернальный доступ показывает кровоток из нисходящей аорты в легочную артерию (нисходящая аорта представлена в поперечном сечении и расположена выше, легочная артерия представлена в продольном сечении и расположена ниже, поток ОАП показан как мозаичный сигнал в левой части разверстки ЦДК). Правая часть. Парастернальный доступ, позиция короткой оси на уровне аортального клапана. Легочная артерия расположена в правой части рисунка. Поток ОАП показан как ретроградная струя из бифуркации легочной артерии, направленная вверх к легочному клапану.
Нормальная физиология
Основной задачей артериального протока наряду с функционирующим овальным окном в фетальном периоде является перенаправление кровотока из правых отделов в левые, минуя легкие, при этом только 5-10% сердечного выброса проходит через малый круг [9]. Важность открытого состояния артериального протока подчеркивает тот факт, что преждевременное его закрытие может привести к правожелудочковой недостаточности и эмбриональной водянке.
Раскрытое состояние артериального протока у эмбриона поддерживают много факторов, самые важные из которых – относительно низкое напряжение кислорода и зависимые от циклооксигеназы продукты метаболизма арахидоновой кислоты (прежде всего простагландин PGE2 и простациклин PGI2), которые продуцируются плацентой. После рождения резкое увеличение напряженности кислорода ингибирует протоковые каналы калия, расположенные в гладкомышечных клетках, что приводит к притоку кальция и компрессии сосуда. Также падает уровень PGE2 и PGI2, которые метаболизируются в функционирующих легких, а не поступают в кровь в результате отделения плаценты.
Таким образом, происходит сокращение гладкомышечных волокон в протоке, что приводит к утолщению стенок и облитерации просвета. Функциональное закрытие протока обычно происходит через 24-48 часов после рождения. В течение следующих 2-3 недель наблюдается пролиферация эндотелия в просвете, что вместе с разрушением интимы приводит к фиброзу и стойкой облитерации протока с формированием ligamentum arteriosum.