Атрезия легочной артерии : причины
Атрезия легочной артерии относится к наиболее сложным и опасным сердечным недугам. Частота данной патологии — примерно 7 случаев на 100 тысяч новорожденных. Среди всех врожденных патологий сердца заболевание составляет 1-3 %.
Формирование порока происходит при аномальном слиянии эндокардиальных валиков, которые являются зачатками полулунных клапанов. В дальнейшем это может вызвать заращение легочной артерии.
Этиология заболевания до сих пор не ясна. По одному из предположений, определенную роль играют неблагоприятные факторы, воздействующие на организм женщины в период беременности, в результате чего эмбриогенез нарушается. Например, негативное воздействие на развитие сердечной системы плода может оказать прием беременной женщиной гормональных лекарственных препаратов и антибиотиков, курение или употребление алкоголя и наркотиков.
В антенатальный период выброс крови в ствол легочной артерии из правого желудочка резко нарушается, что обусловлено слиянием заслонок легочного клапана. В результате давление в правом желудочке возрастает, наполнение эмбриональных синусоидно-коронарных сообщений правого желудочка увеличивается. Кровь оттуда может иметь выход только в случае трискупидальной недостаточности. Эта недостаточность и является причиной существенного увеличения размеров правого предсердия.
Атрезия легочной артерии у детей: статистика, прогнозы
У детей с легочной атрезией нет клапана, позволяющего крови поступать непосредственно из правого желудочка в легочную артерию или этот клапан не открывается, поэтому почти вся кровь из правого предсердия через открытое овальное отверстие шунтируется в левое предсердие. Часть крови, при наличии выраженных синусоидов из правого желудочка, ретроградно поступает в коронарное русло. Это приводит к снижению содержания кислорода в коронарной крови и повышает риск развития гипоксии миокарда.
Выживание ребенка возможно только при наличии альтернативного снабжения кровью легких, когда левый желудочек качает кровь в оба круга кровообращения. Общий прогноз заболевания крайне неблагоприятный : примерно половина малышей с атрезией легочной артерии умирает в первые две недели, остальные — в первый же год жизни.
Консервативное лечение атрезии легочной артерии не эффективно. Спасти новорожденного от заращения легочной артерии может только операция, устраняющая обструкцию на уровне ствола легочной артерии и восстанавливающая эффективность легочного кровотока.
Публикации в СМИ
Атрезия трёхстворчатого клапана (АТК) — ВПС с отсутствием сообщения между правыми предсердием и желудочком. Статистические данные: 1,6–3% всех ВПС, диагностируемых в грудном возрасте.
Этиология • Смещение межжелудочковой перегородки относительно предсердно-желудочкового канала. В результате чего при отсутствии развития синусной части правого желудочка межжелудочковая перегородка, передвигаясь вправо, приводит к облитерации правого предсердно-желудочкового отверстия • См. также Тетрада Фалло.
Патогенез • Пороку всегда сопутствуют межпредсердное сообщение (открытое овальное окно или истинный дефект межпредсердной перегородки [ДМПП]), гипоплазия или аплазия правого желудочка, а также сообщение между большим и малым кругами кровообращения на уровне желудочков (ДМЖП или единственный желудочек сердца) или магистральных сосудов (открытый артериальный проток [ОАП], дефект аортолёгочной перегородки) • Нарушения гемодинамики зависят от анатомического варианта (см. ниже) и не зависят от формы АТК (см. ниже) • При АТК с уменьшенным лёгочным кровотоком у больных выражена гипоксемия, а лёгочный кровоток практически не зависит от сопротивления лёгочных сосудов и полностью определяется общей площадью отверстия клапана лёгочной артерии и ОАП • При АТК с нормальным или увеличенным лёгочным кровотоком последний зависит от динамической резистентности лёгочных сосудов, компенсаторно уменьшающейся по мере сужения естественных артериовенозных коммуникаций (облитерация ОАП и, реже, ДМЖП) • Поскольку при постоянной величине сердечного выброса быстрое увеличение лёгочного кровотока приводит к пропорциональному уменьшению системного, это может привести к системной гипоперфузии и ацидозу • Более постепенное увеличение лёгочного кровотока может приводить к респираторному дистрессу и повреждению микроциркуляторного русла лёгких.
Анатомические варианты АТК • АТК с нормальным или увеличенным лёгочным кровотоком •• Нормальное расположение магистральных сосудов, ДМЖП и отсутствие стеноза лёгочной артерии •• Атрезия лёгочного ствола и ОАП •• ДМЖП, транспозиция магистральных сосудов без стеноза лёгочной артерии •• Транспозиция магистральных сосудов, атрезия устья аорты и ОАП •• Транспозиция магистральных сосудов, ДМЖП, отсутствие стеноза лёгочной артерии, двух- или трёхстворчатый митральный клапан • АТК с уменьшенным лёгочным кровотоком •• Нормальное расположение магистральных сосудов, ДМЖП и стеноз лёгочной артерии •• Нормальное расположение магистральных сосудов, атрезия лёгочного ствола и ОАП •• Транспозиция магистральных сосудов, ДМЖП и стеноз лёгочной артерии •• Транспозиция магистральных сосудов, ДМЖП и гипоплазия правого желудочка •• Транспозиция магистральных сосудов, ДМЖП, стеноз лёгочной артерии, гипоплазия правого желудочка, трёхстворчатый митральный клапан.
Формы АТК • Мышечная форма (76–100%): слепо заканчивающееся дно правого предсердия находится над свободной стенкой левого желудочка (предсердно-желудочковая дискордантность), правый желудочек гипоплазирован за счёт отсутствия его синусового отдела • Мембранная форма (7–12%): дно правого предсердия находится над предсердно-желудочковой частью межжелудочковой перегородки, правый желудочек гипоплазирован за счёт отсутствия его синусового отдела • Клапанная форма (4,8–6%): между правыми предсердием и желудочком находится фиброзная мембрана, представленная полностью сросшимися створками трёхстворчатого клапана (предсердно-желудочковая конкордантность), правый желудочек гипоплазирован, но полностью сформирован, в нём иногда можно найти рудиментарный клапанный аппарат • Атрезия типа аномалии Эбштайна (2–8%): трёхстворчатый клапан, смещённый в полость правого желудочка, имеет сросшиеся и распластанные по стенке правого желудочка створки • Атрезия типа открытого АВ-канала (единичные случаи): створки общего предсердно-желудочкового клапана блокируют выход из правого предсердия.
Клиническая картина. Наличие или отсутствие гипоксемии определяется величиной лёгочного кровотока, а недостаточности кровообращения — величиной межсистемных шунтов. Поэтому описанные ниже симптомы вариабельны и у различных пациентов могут встречаться в различных сочетаниях • Жалобы •• Отставание в физическом развитии •• Постоянная одышка или одышечно-цианотические приступы • Объективно •• Одышка в покое, усиливающаяся при физической нагрузке •• Отставание в физическом развитии •• Системный цианоз •• Симптомы «барабанных палочек» и «часовых стёкол» •• Признаки недостаточности кровообращения по большому кругу (гепатомегалия, отёки и др.) •• Расширение всех границ сердца •• Систолический шум в третьем и/или четвёртом межрёберных промежутках слева от грудины, обусловленный ДМЖП •• Систолический шум стеноза лёгочной артерии во втором межрёберном промежутке справа или слева (при транспозиции магистральных сосудов) от грудины •• Диастолический шум относительного стеноза митрального клапана (симптом Кумбса) на верхушке сердца •• У взрослых пациентов шумы могут не выслушиваться.
Инструментальная диагностика • ЭКГ •• Специфических симптомов АТК не существует •• Изменения ЭКГ обусловлены сопутствующими аномалиями (см. Дефект межпредсердной перегородки, Дефект межжелудочковой перегородки, Проток артериальный открытый, Транспозиция магистральных сосудов, Стеноз клапана лёгочной артерии) • Рентгенография органов грудной клетки •• Выраженность лёгочного рисунка зависит от анатомического варианта порока •• При гипо- и аплазии правого желудочка — западение дуги правого желудочка •• Выбухание дуг отделов сердца •• См. также Транспозиция магистральных сосудов • ЭхоКГ •• Невозможность визуализации створок трёхстворчатого клапана и транстрикуспидального потока •• Уменьшение размеров или отсутствие правого желудочка •• Определяют некоторые критерии успешности гемодинамической коррекции порока (см. ниже) •• См. также Дефект межпредсердной перегородки, Дефект межжелудочковой перегородки, Проток артериальный открытый, Транспозиция магистральных сосудов, Стеноз клапана лёгочной артерии • Катетеризация сердца •• Катетер не проводится из правого предсердия в правый желудочек, но легко проходит в левое предсердие и далее — в левый желудочек •• Повышение давления в правом предсердии •• Снижение насыщения крови кислородом в левом предсердии •• См. также Дефект межпредсердной перегородки, Дефект межжелудочковой перегородки, Проток артериальный открытый, Транспозиция магистральных сосудов, Стеноз клапана лёгочной артерии • Правые и левые атриография и вентрикулография, восходящая аортография •• Симптом светлого треугольника (просветление на месте отсутствия приточного отдела правого желудочка) •• См. также Дефект межпредсердной перегородки, Дефект межжелудочковой перегородки, Проток артериальный открытый, Транспозиция магистральных сосудов, Стеноз клапана лёгочной артерии.
Медикаментозная терапия •• Лечение одышечно-цианотических приступов — см. Тетрада Фалло •• Лечение недостаточности кровообращения •• См. также Транспозиция магистральных сосудов.
Хирургическое лечение
• Показания: все пациенты с АТК.
• Противопоказания •• Необратимая лёгочная гипертензия (при сочетанных аномалиях) •• Тяжёлая сопутствующая патология, угрожающая жизни больного •• Терминальная стадия недостаточности кровообращения •• Противопоказание к радикальной коррекции — аплазия правого желудочка, относительное противопоказание — невозможность коррекции сопутствующих пороков •• Также показания к гемодинамической коррекции для конкретного пациента определяют при помощи критериев операбельности по Шюсса.
• Критерии операбельности при гемодинамической коррекции АТК •• Минимальный возраст больного — 4 года •• Ритм синусовый •• Впадение полых вен нормальное (в правое предсердие) •• Объём правого предсердия не увеличен •• Среднее давление в лёгочном стволе составляет 15 мм рт.ст •• Общее лёгочное сосудистое сопротивление не больше 4 ед/м2 •• Соотношение диаметров лёгочного ствола и аорты не меньше 0,75 •• Фракция выброса левого желудочка не меньше 60% •• Функция митрального клапана не нарушена •• Ранее межсосудистых анастомозов не создавали.
• Методы оперативного лечения •• Паллиативные вмешательства — см. Транспозиция магистральных сосудов •• При увеличенном лёгочном кровотоке, сопровождающемся респираторным дистресс-синдромом или общим ацидозом, проводят операцию сужения лёгочного ствола при помощи манжеты •• При уменьшенном лёгочном кровотоке накладывают системно-лёгочные анастомозы (см. Тетрада Фалло), а пациентам старше 10 лет создают двунаправленный кавапульмональный анастомоз или проводят операцию Геми–Фонтена •• При гипоплазии обеих лёгочных артерий выполняют реконструкцию путей оттока из правого желудочка заплатой из аутоперикарда или синтетического материала •• Радикальное хирургическое лечение — гемодинамическая коррекция (операция Фонтена): ••• пластика дефекта межпредсердной перегородки; ••• правое атриопульмональное шунтирование (при сопутствующей транспозиции магистральных сосудов, гипоплазии или атрезии лёгочного ствола, выраженной гипоплазии правого желудочка) или АВ-шунтирование; ••• имплантация гомоклапана в устье нижней полой вены; ••• создание полного кавапульмонального анастомоза с выключением из кровообращения правых камер сердца.
Специфические послеоперационные осложнения: асцит, гидроторакс, ОПН.
Прогноз • К первому году жизни погибают 75–90% больных • Госпитальная летальность после гемодинамической коррекции — 5–20%, зависит от критериев операбельности (см. выше): при соблюдении всех десяти критериев средняя летальность составляет 4,2%, а при несоблюдении всех десяти — 18,9% • При снижении среднего давления в предсердиях в ближайшие 2 нед после операции ниже 15 мм рт.ст. повышается риск развития недостаточности кровообращения по большому кругу вследствие снижения сердечного выброса (асцит, гидроторакс, гепатомегалия) • ОПН в раннем послеоперационном периоде развивается у 26–31% пациентов • Физическая работоспособность в ранние сроки после операции Фонтена соответствует 30–42% возрастной нормы, через 1 год — 70% • Функциональные показатели сердца, как правило, остаются сниженными у всех больных, а их изменения в ответ на нагрузку — не всегда адекватными, однако это существенно не влияет на качество их жизни • В отдалённые сроки погибают до 6,8–12,5% пациентов, в основном от хронической сердечной недостаточности и цирроза печени. Половине из этих пациентов приходится выполнять повторные вмешательства по поводу стенозов и окклюзий бесклапанных или клапансодержащих протезов • Известны единичные случаи продолжительности жизни оперированных до 30 и 60 лет.
Сокращения. АТК — атрезия трёхстворчатого клапана. ОАП — открытый артериальный проток.
МКБ-10 • Q22 Врождённые аномалии [пороки развития] лёгочного и трехстворчатого клапанов
Симптомы атрезии легочной артерии
Симптомы болезни проявляются обычно в течение первых нескольких часов жизни ребенка. Иногда заболевание появляется через несколько дней после рождения. Основными его признаками являются:
- нарастающий синюшный оттенок кожи (цианоз);
- затрудненное учащенное дыхание;
- одышка;
- быстрая утомляемость при кормлении.
Продолжительность жизни малышей, родившихся с атрезией легочной артерии, в большей степени зависит от диаметра открытого артериального протока, через который поступает кровь в легочную артерию.
Лечение
Выбор метода лечения атрезии легочной артерии непосредственно связан со специфическими характеристиками правого желудочка и легочной артерии. Самым эффективным является оперативное лечение.
- Медикаментозное лечение (не устраняет проблему, обычно назначается перед хирургическим лечением).
- Хирургическое лечение (часто проводится в несколько этапов, каждый их которых осуществляется через определенные промежутки времени):
- эндоваскулярные операции (через бедренную артерию к месту сужения канала, через который отходит кровь из правого желудочка, подводится балонный катетер; его раздувание приводит к улучшению гемодинамики);
- операции на открытом сердце (в процессе операции устанавливается соединение между правым желудочком и легочной артерией).
Диагностика атрезии легочной артерии
Постановка диагноза начинается с врачебного осмотра. Используя стетоскоп, врач тщательно прослушивает сердце. В случае каких-либо отклонений в сердечной деятельности можно услышать шумы. Подробный опрос о симптоматике и особенностях течения заболевания, изучение семейной истории болезней помогают врачу поставить предварительный диагноз.
При дальнейшем диагностировании применяются следующие виды исследований:
- электрокардиография — позволяет выявить признаки перегрузки сердца, в том числе правых его отделов, и определить наличие гипертрофии правого желудочка;
- рентгенография грудной клетки — помогает определить увеличение размера сердечной ткани, а также характерные изменения в легочном рисунке;
- эхокардиограмма — исследование способно определить степень нарушения в строении правого желудочка, а также выявить недостаточность трехстворчатого клапана и открытого артериального потока. Картирование в цвете дает визуализацию патологического тока крови, определяет его скорость и объем;
- фонокардиография — регистрирует патологические шумы, обусловленные нарушением гемодинамики. Таким способом можно выявить шум трикуспидальной регургитации;
- катетеризация полостей сердца — данное инвазивное исследование направлено на выполнение прямой манометрии, что позволяет определить давление в обоих желудочках, а также других отделах сердца;
- ангиокардиография — рентгенографическое исследование, позволяющее избирательно изучить отделы сердца и крупные сосуды. В ходе процедуры в кровоток в исследуемой области вводится контрастное вещество, заполняющее просветы сосудов и полости сердца, что позволяет получить изображение с четкими контурами.
Каталог
Кардиохирург, ученый, педагог и организатор науки, доктор медицинских наук (1973 г.), профессор (1982 г.), академик РАМН (1994 г.), академик РАН (2011 г.), заслуженный деятель науки РФ (1994 г.), лауреат Ленинской премии (1976 г.), Государственной премии СССР (1986 г.), Государственной премии РФ (2002 г.), Премии Правительства РФ (2003 г.).
В 1994 г. Л.А. Бокерия избран по конкурсу на должность директора НМИЦССХ им. А.Н. Бакулева. В 1998 г. одновременно становится директором Центра хирургической и интервенционной аритмологии МЗ РФ.
С 1994 г. является заведующим кафедрой сердечно-сосудистой хирургии Российской медицинской академии последипломного образования (РМАПО) МЗ РФ. С 1995 г. заведует созданной им кафедрой сердечно-сосудистой хирургии № 2 Московской медицинской академии (ныне Первого МГМУ) им. И.М. Сеченова МЗ РФ.
С 2003 г. возглавляет кафедру сердечно-сосудистой хирургии и интервенционной кардиологии Московского государственного медико-стоматологического университета им. А.И. Евдокимова МЗ РФ.
По инициативе Л.А. Бокерия в НМИЦССХ успешно функционирует учебно-исследовательский , который ежегодно проводит 4–6 курсов последипломного повышения квалификации специалистов высшего звена.
Л.А. Бокерия выполняет весь известный арсенал операций на сердце при самой разнообразной патологии: от 3 до 6 операций в день, то есть от 700 до 900 операций с использованием искусственного кровообращения в год.
С 1996 г. он является главным кардиохирургом МЗ РФ.
Л.А. Бокерия – автор и соавтор свыше 3700 научных публикаций, в том числе более 250 книг, более 100 изобретений и полезных моделей, более 300 программ и баз данных для ЭВМ, ряд которых зарегистрированы за рубежом, по различным проблемам сердечно-сосудистой хирургии, кардиологии, медицинского образования и организации медицинской науки.
Л.А. Бокерия принадлежат уникальные работы по теоретическому обоснованию и клиническому использованию метода гипербарической оксигенации в хирургии сердца и сосудов. Он крупнейший специалист в области диагностики и хирургического лечения нарушений ритма и проводимости сердца (особенно тахиаритмий), включая различные сочетания сердечных аритмий с врожденными и приобретенными пороками и аномалиями развития сердца, коронарной болезнью.
Л.А. Бокерия является инициатором развития и другого нового раздела кардиохирургии в нашей стране – минимально инвазивной хирургии сердца. Большой вклад внес Л.А. Бокерия в решение проблемы хирургического лечения ИБС.
Велика роль Л.А. Бокерия в разработке новых подходов к хирургическому лечению терминальной сердечной недостаточности. Его заслугой является разработка новых операций у тяжелой категории кардиохирургических больных с различными формами кардиомиопатий. Он первым развил концепцию динамической кардиомиопластики, в том числе и у детей. Л.А. Бокерия выполнил первую в нашей стране имплантацию искусственного желудочка сердца и после большого перерыва инициировал возобновление в Центре выполнения операций по трансплантации сердца.
По инициативе Л.А. Бокерия в клиническую практику внедрены передовые технологии диагностики и реконструктивной хирургии заболеваний восходящего отдела и дуги аорты.
Он генерировал развитие и другого направления современной медицинской науки – креативной кардиологии, которая определяет необходимость созидательного сотрудничества врачей разных специальностей: кардиологов, кардиохирургов, специалистов по функциональной диагностике, фундаментальным и прикладным дисциплинам.
Под руководством Л.А. Бокерия в Центре разрабатываются и внедряются в клиническую практику новые высокотехнологичные принципы профилактики и лечения больных с сердечно-сосудистой патологией – использование методов генной и клеточной терапии.
Академик Л.А. Бокерия проводит приоритетные исследования по созданию биопротезов клапанов сердца для коррекции клапанных пороков – низкопрофильного, изогнутого по плоскости биопротеза митрального и трикуспидального клапанов, воспроизводящего естественную форму фиброзного кольца, на упругоподатливом каркасе. Продолжено изучение эффективности защиты миокарда у детей первого года жизни при применении нового внутриклеточного кардиоплегического раствора «Бокерия – Болдырева», созданного в НМИЦССХ под руководством Л.А. Бокерия.
Л.А. Бокерия активно занимается методологией медицинской науки и педагогической деятельностью. Он является создателем крупнейшей в стране кардиохирургической школы, воспитавшим не одно поколение врачей – кардиохирургов, кардиологов, реаниматологов и специалистов других смежных специальностей.
Л.А. Бокерия – научный руководитель 350 кандидатских и консультант более 100 докторских диссертаций. Он создатель издательства НМИЦССХ им. А.Н. Бакулева с типографией, основатель и главный редактор журналов «Анналы хирургии», «Бюллетень НМИЦССХ им. А.Н. Бакулева «Сердечно-сосудистые заболевания», «Детские болезни сердца и сосудов», «Клиническая физиология кровообращения», «Анналы ари, информационного сборника «Сердечно-сосудистая хирургия»; главный редактор журнала «Грудная и сердечно-сосудистая хирургия».
Активная деятельность Л.А. Бокерия и его вклад в отечественное здравоохранение отмечены званиями и премиями самого высокого достоинства. Он лауреат Ленинской премии (1976 г.), двух Государственных премий (1986 г. – СССР, 2002 г. – РФ), Премии Правительства Российской Федерации (2003 г.). За выдающиеся достижения Л.А. Бокерия награжден орденом «За заслуги перед Отечеством» III (1999 г.), II (2004 г.) и IV (2010 г.) степени, орденом Достоинства и Чести (Республика Грузия, 1999 г.), орденом Преподобного Сергия Радонежского II степени (2001 г.). Русский биографический институт неоднократно признавал Л.А. Бокерия «Человеком года», а в 2000 г. – «Человеком десятилетия» в номинации «Медицина». В 2002 г. он удостоен титула «Человек-легенда», общероссийской премии «Русский национальный Олимп», учрежденной Правительством, Союзом промышленников и фондом «Третье тысячелетие». Как одному из ведущих кардиохирургов мира в 2003 г. Л.А. Бокерия вручена международная премия «Золотой Гиппократ». В 2004 г. он удостоен премии РАН «Триумф» в номинации «Наука о жизни – медицина». В 2004 г. он отмечен наградным знаком – орденом «Меценат», который присуждается Благотворительным фондом «Меценаты столетия» за выдающийся вклад в дело возрождения и процветания мира, за величие души, за бескорыстную щедрость; в 2004 и 2005 г. – Золотым почетным знаком «Общественное признание», который присуждается Национальным фондом «Общественное признание», Национальным гражданским комитетом по взаимодействию с правоохранительными, законодательными и судебными органами и независимой организацией «Гражданское общество» за большой личный вклад в развитие отечественной медицины, проведение уникальных кардиохирургических операций с применением новейших медицинских технологий, спасших жизни сотен детей и новорожденных, многолетнюю и плодотворную научно-практическую, педагогическую и просветительскую деятельность, активную гражданскую позицию.
В 2006 г. Л.А. Бокерия награжден Почетным алмазным орденом «Общественное признание», удостоен диплома Президиума Парламента народов России «за спасение многочисленных жизней, выдающиеся знания, умение руководить, за уникальные личные качества – благородство, мужество, чувство долга, умение беречь честь и достоинство, держать слово и делать дело, в также за веру в великое будущее Отечества», Золотой медали – за выдающийся вклад в образование России и Золотой звезды «Честь, гордость и слава России».
В 2008 г. Л.А. Бокерия награжден медалью «За практический вклад в укрепление здоровья нации», Орденом Чести с присуждением звания «Опора честного бизнеса» и почетного титула «Выдающийся кардиохирург современности». В 2009 г. огромный вклад Л.А. Бокерия в науку и отечественное здравоохранение отмечен присуждением ему Премии имени А.Н. Косыгина «За большие достижения в решении проблем развития экономики России» и премии города Москвы в области медицины «за разработку и внедрение в клиническую практику нового биологического клапана «Биоглис».
Л.А. Бокерия – действительный член Американской ассоциации торакальных хирургов (1991 г.), член правления (1992 г.) и член Президиума (с 2003 г., консул) Европейского общества грудных и сердечно-сосудистых хирургов, член правления Европейского общества сердечно-сосудистых хирургов, член научного правления Международного кардиоторакального центра Монако (1992 г.), член Сербской академии наук (1997 г.), почетный член Американского колледжа хирургов (1998 г.), академик АМН Украины, почетный профессор МГУ им. М.В. Ломоносова (2011 г.), иностранный член Национальной Академии наук Грузии (2012 г.).
Он президент Ассоциации сердечно-сосудистых хирургов России (1995 г.), президент Общероссийской общественной организации «Лига здоровья нации» (2003 г.), член Общественной палаты РФ всех созывов.
Лечение атрезии легочной артерии
Если диагноз атрезии легочной артерии или заращения легочной артерии подтвердился, приступать к лечению следует незамедлительно. Своевременно начатое грамотное лечение увеличивает шансы малыша на выживание.
Лечение атрезии легочной артерии с помощью медикаментов не является радикальным методом и применяется лишь в качестве поддерживающей терапии перед оперативным вмешательством. Направлено такое лечение на снижение потребления организмом кислорода и коррекцию метаболических нарушений.
Выбор тактики хирургического вмешательства зависит от степени изменения анатомического строения легочной артерии и правого желудочка. При незначительной деформации сердца используется трансторакальный доступ в области четвертого межреберья слева. Операция проводится под общей анестезией и длится несколько часов. Получив доступ к сердцу, хирург расширяет выходное отверстие правого желудочка с помощью специальной установки — трансанулярной заплаты.
После хирургического вмешательства симптомы заболевания полностью исчезают, так как нормализуется выброс крови в легочную артерию. В процессе операции действия хирурга могут быть направлены на перекрытие открытого артериального потока ввиду того, что после коррекции атрезии он становится неактуальным. Добиться закрытия потока можно не только хирургическим путем, но и посредством введения специальных медикаментозных препаратов. Улучшение состояния пациента наблюдается уже в первые часы после операции.
При сильной степени деформации правого желудочка исправить дефект не представляется возможным. В этом случае единственное, что может спасти больного ребенка, — специальный протез, который устанавливают на место удаленного желудочка.
Проблема лечения «синих» пороков конотрункуса у новорожденных является широко обсуждаемой, несмотря на значительное усовершенствование хирургической стратегии. Наиболее часто встречающиеся пороки в этой группе — тетрада Фалло и атрезия легочной артерии (АЛА) в сочетании с дефектом межжелудочковой перегородки (ДМЖП). Недоношенность и малая масса тела при рождении продолжают оставаться факторами риска неудовлетворительных результатов традиционных хирургических вмешательств [3, 8, 12]. Попытки отсрочить операции с помощью поддерживающей терапии приводят к увеличению заболеваемости и смертности [1]. В большинстве неосложненных случаев оптимальным методом лечения больных с обструкцией выводного отдела правого желудочка (ВОПЖ) является радикальная коррекция порока в раннем возрасте. В настоящее время результаты радикальной коррекции рассматриваемой группы пороков конотрункуса успешны у 90—96% пациентов, включая детей младше года [6]. Возможность ее выполнения зависит от индивидуальных анатомо-физиологических особенностей и уровня легочного кровотока. При этом существует категория больных, которые по-прежнему нуждаются в этапном лечении. Одним из первых этапов хирургического лечения остается создание системно-легочных анастомозов. При несостоятельности предварительно наложенных системно-легочных анастомозов предпочтительно выполнение паллиативной реконструкции путей оттока, что и было проведено в данном случае. Эта операция дала хорошие результаты в ближайшем периоде, но спустя 3 мес развилось осложнение — выраженная обструкция ВОПЖ, сопровождающаяся значительным ухудшением состояния ребенка.
В последнее время кроме полостных вмешательств стало возможным применение эндоваскулярных методов лечения, обеспечивающих увеличение легочного кровотока [7, 11]. К таким методам относятся стентирование открытого артериального протока (ОАП), баллонная вальвулопластика и стентирование ВОПЖ. Впервые имплантацию стента в ВОПЖ предложил и разработал Y. Almagor в 1990 г. С 1992 г. имеются сообщения о стентировании ВОПЖ у небольшого числа взрослых детей [5, 10].
Применение этого метода может быть предпочтительным у пациентов с низкой массой тела и другими сопутствующими аномалиями при сложных врожденных пороках сердца. Цель этого метода — обеспечить достаточный уровень легочного кровотока [1].
Приводим случай успешного стентирования ВОПЖ при АЛА в сочетании с ДМЖП у ребенка 6 мес с низкой массой тела, выполненном по экстренным показаниям в виду прогрессирующей гипоксемии и приступами одышки, сопровождающейся цианозом.
Пациентка П., 6 мес, масса тела 3 кг, повторно госпитализирована 15.11.12 по экстренным показаниям в детское кардиохирургическое отделение ФГБУ ФЦССХ Минздрава России (Пенза) с одышкой, тяжелыми приступами одышки, сопровождающейся цианозом до 3 раз в сутки. Ранее, в периоде новорожденности, диагностированы атрезия легочной артерии I типа, ДМЖП, и в нашем учреждении выполнено создание центрального аорто-легочного анастомоза протезом Гор-Текс 3,5 мм. Ранний послеоперационный период осложнился тромбозом шунта, и в эту же госпитализацию была выполнена паллиативная реконструкция путей оттока из правого желудочка с хорошим результатом. При контрольном осмотре через 1 мес насыщение крови кислородом составляло 91%. По данным эхокардиографии (ЭхоКГ): дефект межпредсердной перегородки (ДМПП) 6 мм, субаортальный ДМЖП 10 мм с двунаправленным сбросом, проходное отверстие ВОПЖ 9 мм, Vmax 4,4 м/с, Gmax 78 мм рт.ст. (индекс McGoon 1,33, индекс Nakata 119).
При следующем осмотре через 3 мес состояние ребенка ухудшилось.
15.11.12 при поступлении по данным ЭхоКГ отмечено прогрессирование стеноза ВОПЖ с уменьшением проходного отверстия до 2 мм, Vmax 4,76 м/с, Gmax 92 мм рт.ст. Насыщение крови кислородом составило 70%, снижаясь при беспокойстве до 50%. Тяжесть состояния ребенка была обусловлена артериальной гипоксемией, приступами одышки, сопровождающейся цианозом. С целью минимизации хирургической травмы в качестве очередного этапа лечения решено имплантировать стент в выводной отдел правого желудочка.
16.11.12 пунктирована левая яремная вена. Установлен интродьюсер 5F. Профилактически однократно введен гепарин (100 МЕ/кг). Проводниковый катетер 5F JR (Launcher, Medtronic) установлен в правый желудочек (ПЖ), выполнена правая вентрикулография в 2 проекциях, при которой выявлено выраженное сужение выводного отдела ПЖ. Два коронарных гидрофильных проводника (Wisper ES, Abbot) проведены в дистальные отделы правой ветви легочной артерии. Баллонно-расширяемый непокрытый металлический стент 6,5—12 мм (RX Herculink Elite, Abbot) позиционирован (в боковой проекции) в выводном отделе ПЖ с выходом в средний отдел ствола легочной артерии. Контроль при позиционировании осуществляли с помощью ручной инъекции контрастного вещества через катетер. Имплантирован стент под давлением 12 атм. По данным контрольной ангиографии, стент раскрыт полностью. Для увеличения радиальной устойчивости стента с учетом протяженности инфундибулярного стеноза решено имплантировать дополнительно еще один стент. Выполнена имплантация стента RX Herculink Elite 7,0—18 мм внахлест с предыдущим (перекрытие стентов составило почти 50%) под давлением 14 атм. При контрольной ангиографии: стенты проходимы, полностью расправлены (рис. 1).
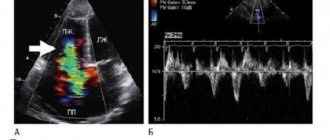
Рисунок 1. Послеоперационная правая вентрикулограмма (боковая проекция). В выводном отделе правого желудочка визуализируются стенты с достаточным широким выходом в легочную артерию. Во время операции не наблюдалось нарушений ритма и проводимости. Общая длительность рентгеноскопии составила 15 мин. Насыщение крови кислородом увеличилось до 95%. Интраоперационно по данным ЭхоКГ в ВОПЖ визуализируется стент длиной 20 мм. Проходное отверстие составило 6 мм, Vmax 2,7 м/с, Gmax 29 мм рт.ст.
(см. рис. 2,на цв. вклейке).
Рисунок 2. Послеоперационные эхокардиограммы. а — парастернальная проекция по короткой оси: визуализируется кровоток через стент в выводной отдел правого желудочка, пунктиром обозначена длина стента; б — допплеровское исследование: пиковый градиент на выводном отделе правого желудочка 29 мм рт.ст. Ранний послеоперационный период протекал без особенностей. Пациентка экстубирована в плановом порядке на 2-е сутки после операции. Насыщение крови кислородом сохранялось на уровне 96—100%.
В динамике через 5 дней в выводном отделе ПЖ по данным ЭхоКГ кровоток осуществляется через стент при Vmax 2,43 м/с, Gmax 24 мм рт.ст., недостаточность I—II степени. Отмечалось также увеличение размеров легочных артерий (индекс Nakata 292, индекс McGoon 2,17).
На 6-е сутки ребенок был переведен в терапевтический стационар по месту жительства с рекомендацией приема профилактической дозы аспирина 5 мг/кг/сут.
Обсуждение
Благодаря постоянному усовершенствованию эндоваскулярных методов, все чаще стали появляться сообщения об их использовании в качестве альтернативы полостным паллиативным операциям [7, 11].
Так, имплантация стента обеспечивает эффективную временную альтернативу хирургической коррекции обструкции ВОПЖ. Тем не менее эта тактика не заменяет хирургическое лечение, а только откладывает его на период соматического роста [1, 5].
Анализ отдаленных результатов наиболее широко применяемых паллиативных эндоваскулярных вмешательств (стентирование ОАП, создание системно-легочного шунта) продемонстрировал ряд проблем. Так, по сравнению со стентированием выводного отдела ПЖ имплантация стента в ОАП может привести к синдрому обкрадывания со снижением перфузии внутренних органов, связанного с более низким диастолическим артериальным давлением. Кроме того, высока вероятность гиперплазии неоинтимы внутри стента, а также необходим артериальный сосудистый доступ при имплантации [2].
В нашем случае стентирование ОАП не было возможным, так как проток уже не функционировал.
Создание системно-легочных анастомозов почти в 35% случаев осложняется гипоплазией и деформацией легочной артерии, особенно если операция была в течение неонатального периода [4].
Имплантация стента в ВОПЖ применима при паллиативном лечении инфундибулярного стеноза в случае других аномалий, когда хирургическая коррекция невозможна или сопряжена с высоким риском. Пульсирующий характер антеградного кровотока по легочным артериям предпочтителен, так как способствует ее физиологическому росту, приближая выполнение радикальной коррекции [1].
Потенциальные ограничения этого подхода включают обструкции стента в связи с гиперплазией неоинтимы или мышечной пролиферацией, переломы стента, а также возможность перфорации путей оттока из ПЖ [1, 5]. Эти осложнения могут быть сведены к минимуму, если после имплантации стента следующий этап хирургического лечения выполняется своевременно.
Вмешательство может быть технически сложным и сопровождаться такими возможными осложнениями, как неверная позиция стента, коллапс стента, миграция стента в легочную артерию, что связано с техникой имплантации и определенным несовершенством существующих стентов [1, 10]. Вопрос расчетов при выборе размеров стента, имплантируемого в ПЖ и легочную артерию, однозначно не решен. L. Gibbs [5] считает разумным имплантировать наибольший возможный диаметр стента для достижения максимальной радиальной силы открытия и для обеспечения возможности постдилатаций в будущем с увеличением диаметра инфундибулярного отдела при росте ребенка, а также компенсации гиперплазии неоинтимы. В то же время создание избыточного легочного кровотока крайне нежелательно [6].
Тем не менее это очень перспективный метод, а с развитием эндоваскулярных технологий и появлением инструментов с малым профилем системы доставки он стал приемлемым для новорожденных и недоношенных пациентов.
Предварительные результаты небольшого числа наблюдений показывают, что имплантация стента при обструкции ВОПЖ — эффективный и часто единственно возможный метод, который позволяет детям в тяжелом состоянии дождаться следующего этапа лечения [1].