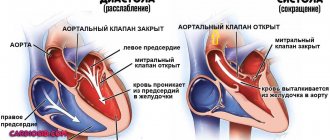
Прослушивать сердце малыша начинают акушеры-гинекологи еще в период его внутриутробного развития. До рождения шум в сердце у ребенка не определяется. Врачи ориентируются на звучность тонов и частоту сокращений, показатели «хорошего самочувствия» плода, неосложненного течения беременности у будущей матери.
После рождения в первые сутки новорожденного осматривает специальный педиатр в родильном доме. В крупных перинатальных центрах имеются специалисты-неонатологи. Это педиатры, специально подготовленные для диагностики и лечения патологии раннего детского возраста, врожденных заболеваний. Они проводят первую аускультацию малыша, в случае выявления шума обязаны установить причину.
Особенности аускультации детей
Терапевт «пугается» при прослушивании ребенка. Аускультативная картина такая же, как у взрослого человека, но слышимость в несколько раз сильнее. Особенно у грудничков.
- Грудная стенка малыша значительно тоньше, все звуки передаются очень отчетливо.
- Новорожденного необходимо уметь слушать на фоне крика. Осмотры грудного ребенка стараются проводить после кормления, чтобы настроение у него было хорошее и появилась возможность прослушать сердце в тишине.
- Детей постарше приходится отвлекать мамам.
- В кабинетах участковых педиатров всегда есть игрушки, должно быть тепло.
- Врач старается согреть в руках головку фонендоскопа, чтобы не испугать пациента прикосновением холодного предмета.
Так приходится объясняться с маленьким человеком
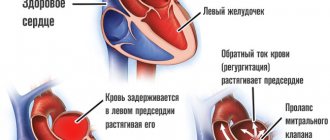
В оценке тонов важно, что у детей и подростков, в отличии от взрослых людей, третий дополнительный тон слышится чаще. Он не указывает на патологию желудочков, лучше прослушивается после нагрузки и дает «ритм галопа».
Почему образуется шум у детей?
О причинах и возможных механизмах образования шума в сердце у ребенка можно прочитать тут.
Наиболее часто шумы в сердце ребенка связаны с процессами роста, являются функциональными.
У новорожденных часто имеется легкий систолический шум в связи с переходом сердца на самостоятельное кровообращение и постепенным перекрытием боталлова протока.
Функциональный шум возникает у детей разного возраста и подростков из-за несоответствия в скорости роста мышечной ткани и створок клапанов. Он усиливается после нагрузки, имеет систолический характер, с взрослением исчезает. При этом ребенок растет и развивается нормально, не отстает от сверстников, в полном объеме занимается физкультурой.
При повышении температуры тела шум вызывается усилением скорости кровотока
Возможно выслушивание систолического шума при острых детских инфекциях, на фоне высокой температуры. В данном случае врач должен проконтролировать остаточные явления в период выздоровления. Интоксикация и воздействие инфекционных агентов на миокард часто вызывают миокардиты с одышкой, тахикардией, слабостью. Поэтому нельзя исключить подобные проявления из диагностики.
С органическими изменениями (пороками) появляются на свет от 1 до 1,5% новорожденных. Аускультация свидетельствует о врожденной патологии с первого дня жизни.
Причиной шумов при органических пороках является:
- сужение отверстий между предсердиями и желудочками, на выходе в аорту и легочную артерию;
- недостаточная фиксация клапанов при их закрытии, образование щели для возвратного потока крови;
- наличие межпредсердного и межжелудочкового дефектов в перегородке;
- дополнительное сообщение между аортой и легочной артерией по открытому боталлову протоку;
- несколько комбинированных дефектов при тетраде Фалло и других редких пороках.
У подростков особенно внимательно следует относиться к любым впервые выявленным шумам. Только так можно своевременно диагностировать начало ревмокардита с формированием приобретенного порока сердца.
Лечебно-диагностическая тактика ведения новорожденных с ВПС на дооперационном этапе
Ключевым моментом в совершенствовании тактики ведения новорожденных с ВПС является четкое подразделение основных направлений терапии у различных групп больных:
1. Адекватной считается этиотропная и патогенетически обоснованная терапия.
2. Возможная терапия — направленная на купирование какого-либо синдрома и не имеющая жизнеугрожающих побочных эффектов.
3. Потенциально опасная — это терапия, приводящая к ухудшению состояния и угрозе жизни.
Для лечения дуктусзависимой легочной циркуляции адекватной терапией является: отсутствие кислородотерапии, внутривенное введение простагландинов, коррекция кислотно-щелочного состояния. Возможной считается терапия с целью коррекции или отсутствие терапии. Потенциально опасной для таких больных будет инсуфляция или ИВЛ кислородом. На сегодняшний день известно, что в механизме закрытия артериального потока играют роль два фактора: повышение насыщения кислородом крови после первого вдоха новорожденного и прогрессирующее снижение уровня материнских простагландинов в зависимости от срока гестации.
Для пороков с большими лево-правыми шунтами адекватной считается терапия кардиотониками, мочегонными; возможной — каким-либо из вышеуказанных средств; потенциально опасной — вазодилататорами, увеличивающими объем сброса и усугубляющими легочную гиперволемию, тем самым снижая системный выброс.
В табл. 2 сгруппированы основные подходы к терапии различных групп ВПС (Л.М. Миролюбов, Ю.Б. Калиничева, 2005).
Аускультативная картина частых врожденных пороков у детей
Органические шумы в сердце всегда говорят о патологии, требуют дальнейшей диагностики и принятия решения о консервативном или оперативном лечении ребенка.
- Незаращение боталлова протока проявляется у грудного ребенка по типичному шуму во втором межреберье слева от грудины. Он имеет грубый систолический протяжный характер («машинный шум»), слабеет во время вдоха.
- При сужении легочной артерии, стенозе перешейка аорты тоже выслушивается шум слева от грудины, но он проводится в третье межреберье, на сонные артерии, в межлопаточное пространство.
- Для дефектов межпредсердной и межжелудочковой перегородок характерны систолический и диастолический равномерные шумы по левому краю грудины на уровне прикрепления третьего и четвертого ребер, проводятся на верхушку, но на сосудах не прослушивается.
Скрининговые технологии выявления врожденных пороков сердца у новорожденных
- Карпова Анна Львовна
- Бокерия Екатерина Леонидовна
- Татьяна Никитична Николаева
- Евгений Маркович Спивак
- Мостовой Алексей Валерьевич
- Александра Владимировна Марасина
Резюме
В обзоре представлена информация о методах раннего выявления врожденных пороков сердца у новорожденных, которые применяются в мировой практике в качестве скрининговых технологий. Показаны актуальность и важность проведения скрининга на врожденные пороки сердца в раннем неонатальном периоде как одного из способов снижения младенческой смертности.
Особое внимание уделено прицельному клиническому осмотру новорожденных, измерению артериального давления с целью выявления кардиальной патологии, сделан акцент на необходимость обязательного дополнения данных клинических методов обследования в раннем неонатальном периоде скринингом сатурации крови кислородом.
Наиболее подробно дана информация о скрининге сатурации крови кислородом у новорожденных, о преимуществах и недостатках метода, о его чувствительности и специфичности, о преимуществах более позднего проведения пульсоксиметрии у новорожденных с целью выявления критических пороков сердца, проанализированы данные по ложноположительным и ложноотрицательным результатам и способам их снижения.
Ключевые слова:новорожденные, сатурация кислорода, врожденные пороки сердца, артериальное давление, периферическая сосудистая пульсация
Неонатология: новости, мнения, обучение. 2021. № 2. С. 40-49.
Врожденные пороки развития (ВПР) являются одной из основных причин гибели детей на первом году жизни, занимая 2-е место в структуре младенческой смертности [1]. Среди них наиболее часто встречаются врожденные пороки сердца (ВПС), которые в нашей стране в 2014 г. в структуре ВПР составили 44,4% (в 2013 г. — 42,1%, в 2012 г. — 41,5%). По данным Росстата, в 2014 г. от ВПС на первом году жизни умерли 1393 ребенка, что среди потерь от ВПР составило 45,3%, показатель младенческой смертности при этом соответствовал 7,3 на 10 тыс. родившихся живыми [2]. Заболеваемость ВПС варьирует в широких пределах и составляет от 2-4 до 14-15 на 1000 новорожденных (в среднем 8-14 на 1000) [3, 4]. По данным T.E. Roberts и соавт. (2012), в Великобритании заболеваемость ВПС составляет 4-10 на 1000 живорожденных детей [5], в Италии — 8-10 на 1000 [6].
Современный уровень диагностики и лечения (в первую очередь речь идет об оперативных методах) в большинстве случаев позволяет сохранить жизнь детям с ВПС. Среди детей первого года жизни, которым выполнялось оперативное вмешательство по поводу ВПС, новорожденные в 2014 г. составили 34,3% (в 2013 г. — 32,7%; в 2012 г. — около 33,1%, в 2011 г. — 29,6%) [2]. В первую очередь это касается «критических пороков сердца». Для сохранения жизни новорожденного в таких случаях неотложные хирургические вмешательства необходимо провести в первые часы или дни после рождения, поэтому наличие кардиальной патологии крайне важно определить как можно раньше.
Понятие «критический порок сердца» применяется для обозначения ВПС, сопровождающихся развитием критических состояний в ближайшие часы или сутки после рождения. Частота встречаемости обсуждаемых ВПС в первые 28 дней жизни составляет от 20 до 30% [4, 7]. Критическое состояние новорожденного с ВПС характеризуется острым дефицитом сердечного выброса, быстрым прогрессированием сердечной недостаточности, кислородным голоданием тканей с развитием декомпенсированного метаболического ацидоза и нарушением функций жизненно важных органов [4].
Критические ВПС могут не проявляться клинически сразу после рождения, но при закрытии открытого артериального протока (ОАП) наблюдается прогрессирующее ухудшение состояния ребенка. Смертность в подобных случаях выше, чем при других вариантах ВПС. Более 70% детей с критическими ВПС могут быть спасены при точной ранней диагностике, адекватной интенсивной терапии и своевременном хирургическом вмешательстве [4].
Однако, к сожалению, до сих пор каждый 4-й критический ВПС диагностируется только после выписки из родильного дома [6]. Так, в Новой Зеландии в 2006-2010 гг. частота поздней диагностики составила 20% случаев при критических ВПС и 51% — при некритических ВПС [8].
Связано это в первую очередь с тем, что нередко при тяжелых ВПС клиническая симптоматика в раннем неонатальном периоде может быть крайне скудной, что существенно затрудняет диагностику, основанную только лишь на клиническом осмотре. Видимый цианоз может отсутствовать, шум в сердце, как правило, не дает объективной характеристики тяжести поражения сердечно-сосудистой системы у новорожденных. По данным C. Lundsgaard и соавт., дети с умеренной гипоксемией и с артериальным насыщением кислородом 80-95% не будут иметь видимый цианоз кожных покровов и слизистых [9]. M.H. Lees и соавт. установили, что для новорожденных с уровнем гемоглобина 200 г/л цианоз будет виден только при артериальном насыщении кислородом менее 80%; при концентрации гемоглобина 100 г/л насыщенность для визуализации цианоза должна быть менее 60% [10]. Нередко при критических ВПС в раннем неонатальном периоде шума в сердце либо нет, либо он может появляться гораздо позже, только после снижения сопротивления в малом круге кровообращения.
С целью улучшения исходов и более своевременной диагностики ВПС во всем мире хорошо зарекомендовала себя практика проведения измерения сатурации крови кислородом (SpO2) у новорожденных в раннем неонатальном периоде [5, 8, 11, 12]. Возможность использования пульсоксиметрии в качестве скринингового теста была впервые подтверждена более 10 лет назад, и с тех пор уже опубликованы данные более чем о 370 тыс. обследованных детей. Пульсоксиметрией называется измерение степени оксигенации крови -степени насыщения гемоглобина кислородом [4, 13], поэтому основной принцип данной технологии базируется на выявлении гипоксемии, которая характерна для критических ВПС у новорожденных.
Американская академия педиатрии (AAP) рекомендует пульсоксиметрию, характеризуя ее как простую, неинвазивную и безболезненную методику для оценки величины SpO2 с целью раннего выделения группы новорожденных, подлежащих углубленному кардиологическому обследованию, в частности эхокардиографии (ЭхоКГ) [14-16]. Эффективность пульсоксиметрии как метода выявления ВПС у новорожденных подтверждают многочисленные исследования, проведенные в разных странах мира [6, 17-21]. В табл. 1 представлен анализ чувствительности и специфичности метода по данным разных авторов [22].
Скрининг SpO2, по данным ряда авторов, привел к существенному снижению смертности новорожденных от ВПС [29], так как ранняя диагностика позволила своевременно выявить более 90% критических ВПС, в том числе гипоплазию левых отделов сердца, в 85% случаев удавалось вовремя обнаружить транспозицию магистральных сосудов (ТМС) [8].
Учитывая опубликованные результаты большого количества исследований и явные доказательства эффективности обсуждаемой скрининговой стратегии в неонатологии, во многих странах мира пульсоксиметрия была рекомендована к включению в скрининговую программу как дополнительный метод для более своевременного выявления критических ВПС у новорожденных в акушерских стационарах, при домашних родах, а также в отделениях реанимации новорожденных [11, 30, 31]. В настоящее время скрининг SpO2 все шире и шире внедряется в отечественную практику [32, 33].
С целью получения объективного результата скрининга SpO2 технология его проведения подразумевает соблюдение определенных требований. Проводится скрининг SpO2 всем новорожденным в любом из неонатальных отделений, за исключением тех детей, у которых ранее (пренатально или постнатально) уже был диагностирован ВПС. Выполняется скрининг врачом, медицинской сестрой или родителями ребенка под контролем медицинских работников. В рекомендациях указывается на необходимость оформления согласия родителей на проведение скрининга, причем данный вопрос, как правило, решается до родов [5].
В ходе исследования очень важно соблюдать ряд условий: выполнение скрининга оптимально на 2-е сутки жизни (декомпенсация состояния ребенка при закрытии артериального протока в более поздние сроки может привести к ложным результатам), очень важно соблюдение температурного режима (в частности, ножки должны быть равномерно теплыми), оценка показателей проводится при наличии стабильной непрерывной пульсовой кривой (в течение как минимум 3 мин при условии отсутствия артефактов) [6], необходимо убедиться в достоверности отслеживаемой пульсоксиметром частоты пульса ребенка (используя пальпацию или аускультацию) [11]. Продолжительность измерения, по данным T.E. Roberts и соавт., составляет 6,9 мин (минимум -1 мин, максимум — 30 мин, в среднем 5 мин) [5]. В среднем, по данным А.Л. Карповой и соавт., у «условно здоровых» новорожденных SpO2 в первые 12-24 ч жизни на всех конечностях составляет 97,47+2,03% [34], по данным B.M. Levesque и соавт. — 97,3+1,3% [35].
Оптимальным считается проведение двухзонной пульсоксиметрии, когда SpO2 измеряется на правой руке и на любой ноге (в зонах кровоснабжения выше и ниже артериального протока), поскольку позволяет выявить не только потенциально цианотичные ВПС, но ВПС с дуктус-зависимым системным кровообращением за счет обнаружения различия значений сатурации крови кислородом между верхними и нижними конечностями с более низкими показателями на ногах [35]. В среднем, по данным T.R. Hoke и соавт., разница SpO2 между верхними и нижними конечностями у здоровых новорожденных, как правило, составляла не более 1% [21], при критических ВПС — более 3%. Добавление оценки градиента SpO2, по данным A. de WahL GraneLLi и соавт., позволяет существенно увеличить чувствительность теста [18].
По результатам полученных измерений сатурации крови кислородом осуществляется их интерпретация (рис. 1).
Возможны два варианта: положительный (ребенку требуется дальнейшее обследование) и отрицательный (данных, свидетельствующих о критическом ВПС, нет). Тест считается положительным, если любое из измерений SpO2 менее 90%; SpO2 = 90-95% на руке и ноге (т.е. выявлены признаки потенциально цианотичного ВПС); разница SpO2 на руке и ноге более 3% (имеют место признаки дуктус-зависимого кровообращения). Тест отрицательный, и его можно не повторять, если SpO2 более 95% с разницей на руках и ногах менее 3% [11].
Любой новорожденный с положительными результатами теста требует комплексного обследования для выявления причин гипоксемии, поскольку пульсоксиметрия помогает выявить не только ВПС, но и другие вторичные причины гипоксемии [36], поэтому лечащий врач о положительном результате теста должен быть уведомлен в течение 10 мин. При отсутствии других причин гипоксемии ВПС должен быть исключен как можно скорее, поэтому в следующие 60 мин после проведения теста и оповещения врача показано срочное проведение ЭхоКГ на месте. При выявлении критического ВПС во всех случаях показаны срочная консультация кардиолога и кардиохирурга и перевод в кардиохирургический стационар в максимально сжатые сроки. В случае нетранспортабельности больного необходимо решить вопрос о паллиативном вмешательстве на месте. Верификация критического дуктус-зависимого ВПС означает необходимость начала инфузии простагландинов группы Е1
Именно поэтому, прежде чем вводить в клинике скрининг сатурации крови кислородом у новорожденных, необходимо решить вопрос дальнейшего уточнения диагноза для детей с положительными результатами. Это могут быть ЭхоКГ на месте, дистанционная консультация с использованием телемедицины, транспортировка ребенка в кардиохирургический стационар.
Также важно отметить, что оптимальным в настоящее время считается выполнение более позднего измерения SpO2 (после 24 ч жизни), поскольку это позволяет снизить количество ложноположительных результатов. Ложноположительными считаются те результаты скрининга, при которых в ходе проведения ЭхоКГ в связи с положительным тестом не был выявлен критический ВПС. В табл. 1 продемонстрированы результаты целого ряда исследований, в которых частота регистрации ложноположительных результатов составляла менее 1% в случае, если измерения SpO2 были выполнены после 24 ч жизни [11, 12, 34].
Таким образом, реализация скрининга сатурации крови кислородом у новорожденных в разных странах мира существенно улучшила выявление критических ВПС. Однако в то же время оказалось, что скрининг сатурации крови кислородом может сопровождаться и ложноотрицательными результатами. За ложноотрицательные результаты принимаются те, при которых тест расценивался как отрицательный, но в ходе проведения ЭхоКГ выявляется критический ВПС. В первую очередь данного метода диагностики оказалось не вполне достаточно для обнаружения пороков развития аорты (коарктация аорты, перерыв дуги аорты), поскольку рутинное проведение двухзонной пульсоксиметрии при обсуждаемой патологии нередко не выявляет снижение сатурации на нижних конечностях.
Так, в исследовании T. Riede и соавт. описываются пропущенные при проведении скрининга SpO2 ВПС, среди которых преобладают пороки развития аорты [19]. J.J. Lhost и соавт. зафиксировали один ложноотрицательный результат, когда оказалась пропущенной коарктация аорты в сочетании с дефектом межжелудочковой перегородки [30]. В исследовании E. Ozalkaya и соавт. было показано, что скрининг пульсоксиметрии у новорожденных в первые 24-48 ч после рождения чаще пропускает коарктацию аорты, выявление которой при помощи данного метода не превышает 25% [37]. L.C. Johnson и соавт. также зарегистрировали один ложноотрицательный скрининг у ребенка с перерывом дуги аорты [28].
Коарктация аорты — врожденное сегментарное сужение, которое может локализоваться на любом уровне и составляет от 7 [38] до 8% [2] в структуре всех ВПС. По отношению к ОАП коарктация аорты подразделяется на: сужение проксимальнее места отхождения ОАП — «предуктальная» коарктация аорты; сужение на уровне отхождения ОАП -«юкстадуктальная» коарктация аорты; сужение дистальнее отхождения ОАП — «постдуктальная» коарктация аорты.
В подавляющем большинстве случаев коарктация располагается на участке от левой подключичной артерии до ОАП («предуктальная» коарктация аорты). В такой ситуации перфузия нижней половины туловища напрямую зависит от функционирующего ОАП (вариант критического ВПС), поэтому по данным пульсоксиметрии между правой рукой и любой ногой может определяться градиент SpO2 более 3%, пульсация на бедренных артериях может быть снижена, артериальное давление при этом также будет ниже на ногах в сравнении с руками. В то же время не следует забывать, что при большом ОАП клиническая картина коарктации аорты может быть стертой, т.е. пульсация на периферических артериях и артериальное давление могут быть практически в норме. Однако двухзонная пульсокисметрия в данной ситуации с высокой вероятностью позволит выявить градиент SpO2.
Значительно реже встречается «юкстадуктальная» и «постдуктальная» коарктация аорты. Гемодинамика при данных видах коарктации аорты характеризуется существенным повышением артериального давления до места сужения и снижением ниже его, поэтому пульсация на бедренных артериях в такой ситуации будет резко ослаблена вплоть до ее отсутствия, а артериальное давление существенно снижено (на 10 мм рт.ст. и более) на ногах по сравнению с руками, в то время как разницы SpO2 между правой рукой и любой ногой может не определяться.
Таким образом, с целью снижения частоты ложноотрицательных результатов наибольшую актуальность приобретает не только изолированное проведение двухзонной пульсоксиметрии, но и обязательное прицельное клиническое обследование любого новорожденного ребенка, включающее не только поиск признаков сердечной и дыхательной недостаточности, но и сравнительный анализ пульсации на периферических артериях [19], т.е.:
■ визуальный осмотр: оценка общего состояния, цвет кожных покровов и слизистых, частота дыхательных движений;
■ оценку пульсации на лучевых и бедренных артериях, и в случае наличия асимметрии, определение артериального давления на обеих руках и обеих ногах;
■ аускультацию: частота и ритмичность сердечных сокращений, наличие сердечных шумов, расщепления и акцентов сердечных тонов.
Оценку пульсации у новорожденных желательно проводить на лучевых и бедренных артериях. У детей определение пульсации на руках принято оценивать в локтевой ямке. В этом месте плечевая артерия (a.
brachialis)
переходит в лучевую
(a.radialis)
[39]. Во избежание ошибок мы намеренно фиксируем внимание врача на данном факте и в дальнейшем, говоря об определении пульсации на периферических артериях на руках у детей первого года жизни, имеем в виду именно лучевую артерию.
Для оценки пульсации на лучевых артериях справа и слева необходимо первые пальцы обеих рук исследователя одновременно расположить на тыльных сторонах предплечий, ближе к медиальным надмыщелкам плечевых костей, обхватив другими пальцами верхние конечности ребенка в области локтевых суставов и предплечий таким образом, чтобы разогнуть руки ребенка в локтевых суставах и удерживать их в выпрямленном состоянии в ходе исследования; прижать артерию к лучевой кости и прощупать пульс (рис. 2).
Для оценки пульсации на бедренных артериях необходимо расположить либо большие пальцы, либо второй и третий пальцы кистей в области паховых складок параллельно телу ребенка справа и слева, прощупать пульс (рис. 3). Кроме того, также необходимо проводить оценку пульса одновременно на правой лучевой и левой бедренной артериях (рис. 4). При оценки пульсации необходимо оценить симметричность пульса, ритмичность, наполнение, напряжение, частоту. В случае слабого пульса или его асимметрии необходимо выполнить осциллометрическое измерение артериального давления на всех конечностях.
Вопрос в отношении рутинного скринингового измерения артериального давления у всех новорожденных на руках и ногах вместе с проведением двухзонной пульсоксиметрии остается в настоящее время дискутабельным. Так, N. Patankar и соавт. рекомендуют всем новорожденным в возрасте от 24 до 48 ч после рождения (после закрытия ОАП) с целью повышения чувствительности скрининга кардиальной патологии проводить измерение SpO2 вместе с определением артериального давления на всех четырех конечностях [38]. В то же время, по мнению K.L. Boelke и соавт., рутинное измерение артериального давления увеличивает частоту ложноположительных результатов скрининга кардиальной патологии у новорожденных, повышая тем самым необходимость в проведении ЭхоКГ, что приводит к удорожанию проекта, однако диагностическая ценность метода при этом не возрастает [40].
Важно отметить также, что снижение ложноотрицательных результатов скрининга SpO2, а также в целом улучшение выявляемости ВПС у новорожденных достигается путем проведения повторного измерения сатурации крови кислородом перед выпиской из родильного дома в комплексе с прицельным клиническим осмотром [23, 26-28, 37, 41].
Заключение
Таким образом, проведение скрининга на врожденные пороки сердца в раннем неонатальном периоде является одним из важных способов снижения младенческой смертности. Добавление пульсоксиметрии как дополнительного метода обследования «условно здоровых новорожденных» значительно снижает частоту пропущенных ВПС. При этом скрининг сатурации крови кислородом не исключает тщательного прицельного медицинского осмотра новорожденного на предмет кардиальной патологии, поскольку пульсоксиметрия в редких случаях не позволяет выявить критические пороки сердца, к которым в первую очередь относятся аномалии развития аорты.
Добавление к скринингу ВПС рутинного измерения артериального давления в раннем неонатальном периоде у всех новорожденных пока не получило убедительного подтверждения своей эффективности и крайней необходимости. Однако данный вопрос требует проведения дальнейших исследований, направленных на оценку чувствительности и специфичности метода в отношении более своевременного выявления ВПС в сочетании с пульсоксиметрией. Измерение артериального давления на всех конечностях в случае выявления слабой или асимметричной пульсации на периферических артериях должно проводится в обязательном порядке и незамедлительно сразу же после выявления симптоматики, подозрительной на ВПС.
Новорожденные с подозрением на ВПС по данным скрининговых исследований (прицельный клинический осмотр, пульсоксиметрия, измерение артериального давления на руках и ногах) не могут быть выписаны домой из неонатального отделения без верификации диагноза, т.е. без проведения ЭхоКГ. Новорожденные с выявленными ВПС не могут быть выписаны домой без консультации кардиолога и решения вопроса о тактике дальнейшего наблюдения.
Коллектив авторов выражает благодарность А.В. Марасиной за оригинальные рисунки, представленные в статье.
ЛИТЕРАТУРА
1. Стародубов В.И., Суханова Л.П. Репродуктивные проблемы демографического развития России. М. : Менеджер здравоохранения, 2012. 320 с.
2. Бокерия Л.А., Гудкова Р.Г. Сердечно-сосудистая хирургия. 2014 год. Болезни и врожденные аномалии системы кровообращения. М. : НЦССХ им. А.Н. Бакулева, 2014. 220 с.
3. Володин Н.Н. (ред.) Неонатология : национальное руководство. М. : ГЭОТАР-Медиа, 2009. 848 с.
4. Неонатальный скрининг с целью выявления критических врожденных пороков сердца : методические рекомендации (№ 12) / сост.: М.А. Школьникова, Е.Л. Бокерия, Е.А. Дегтярева, В.Н. Ильин, Е.С. Шарыкин. М. : М-Арт, 2012. 36 с.
5. Roberts T.E., Barton P.M., Auguste P.E., Middleton L.J. et al. Pulse oximetry as a screening test for congenital heart defects in newborn infants: a cost-effectiveness analysis // Arch. Dis. Child. 2012. Vol. 97, N 3. P. 221-226. doi: 10.1136/archdischild-2011-300564.
6. Zuppa A.A., Riccardi R., Catenazzi P., D’Andrea V. et al. Clinical examination and pulse oximetry as screening for congenital heart disease in low-risk newborn // J. Matern. Fetal Neonatal Med. 2015. Vol. 28. P. 7-11.
7. Сенаторова А.С., Гончарь М.А., Пугачёва Е.А. Роль пульсоксиметрии как скринингового метода выявления кардиальной патологии у новорожденных. Современная кардиология и кардиохирургия — путь от проблем к решению // Материалы научно-практической конференции с международным участием, посвященной памяти кардиохирурга Л.Н. Сидоренко (Судак, 7-8 октября 2013 г.). Судак, 2013. С. 246.
8. Eckersley L., Sadler L., Parry E., Finucane K. et al. Timing of diagnosis affects mortality in critical congenital heart disease // Arch. Dis. Child. 2015 Jun 30. pii: archdischild-2014-307691. doi: 10.1136/archdischild-2014-307691.
9. Lundsgaard C., Van Slyke D.D. Cyanosis // Medicine. 1923. Vol. 2. P. 1-76.
10. Lees M.H. Cyanosis of the newborn infant: recognition and clinical evaluation // J. Pediatr. 1970. Vol. 77. P. 484-498.
11. Kemper A.R., Mahle W.T., Martin G.R., Cooley W.C. et al. Strategies for implementing screening for critical congenital heart disease // Pediatrics. 2011. Vol. 128. P. 1259-1267.
12. Mahle W.T., Newburger J.W., Matherne G.P., Smith F.C. et al. Role of pulse oximetry in examining newborns for congenital heart disease: a scientific statement from the AHA and AAP // Pediatrics. 2009. Vol. 124. P. 823-836.
13. Антонов А.Г., Рындин А.Ю. Транскутанный мониторинг газов крови: клиническое руководство / под ред. Е.Н. Байбариной. М., 2010. 24 с.
14. Bickler P.E., Feiner J.R., Severinghaus J.W. Effects of skin pigmentation on pulse oximeter accuracy at low saturation // Anesthesiology. 2005. Vol. 102. P. 715-719.
15. Mahle W.T., Martin G.R., Beekman R.H. III, Morrow W.R. et al. Endorsement of health and human services recommendation for pulse oximetry screening for critical congenital heart disease // Pediatrics. 2012. Vol. 129. P. 190-193.
16. Ramjattan K., Allen P.J. Pulse oximetry screening for critical congenital heart disease in the newborn // Pediatr. Nurs. 2013. Vol. 39, N 5. P. 250-253.
17. Reich J.D., Miller S., Brogdon B., Casatelli J. et al. The use of pulse oximetry to detect congenital heart disease // J. Pediatr. 2003. Vol. 142. P. 268-272.
18. De Wahl Granelli A., Wennergren M., Sandberg K. et al. Impact of pulse-oximetry screening on the detection of duct-dependent congenital heart disease: a Swedish prospective screening study in 39,821 newborns // BMJ. 2009. Vol. 338. P. a3037.
19. Riede F.T., Worner C., Dahnert I., Mockel A. et al. Effectiveness of neonatal pulse oximetry screening for detection of critical congenital heart disease in daily clinical routine: results from a prospective multicenter study // Eur. J. Pediatr. 2010. Vol. 169, N 8. P. 975-981.
20. Zhao Q., Ma X., Ge X, Liu F. et al. The neonatal congenital heart disease screening group. pulse oximetry with clinical assessment to screen for congenital heart disease in neonates in china: a prospective study // Lancet. 2014. Vol. 384. P. 747-754.
21. Hoke T.R., Donohue P.K., Bawa P.K., Mitchell R.D. et al. Oxygen saturation as screening test for critical congenital heart disease: a preliminary study // Pediatr. Cardiol. 2002. Vol. 23. P. 403-409.
22. Карпова А.Л., Бокерия Е.Л., Николаева Т.Н., Спивак Е.М. и др. Скрининг сатурации крови кислородом как метод выявления врожденных пороков сердца у новорожденных: современные подходы, проблемы, мнения // Детские болезни сердца и сосудов. 2015. № 4. С. 29-37.
23. Richmond S., Reay G., Abu Harb M. Routine pulse oximetry in the asymptomatic newborn // Arch Dis. Child. Fetal Neonatal Ed. 2002. Vol. 87. P. 83-88.
24. De Wahl Granelli A., Mellander M., Sunnegardh J., Sandberg K. et al. Screening for duct-dependent congenital heart disease with pulse oximetry: a critical evaluation of strategies to maximize sensitivity // Acta Paediatr. 2005. Vol. 94. P. 1590-1596.
25. Meberg A., Brugmann-Pieper S., Due R. Jr., Eskedal L. et al. First day of life pulse oximetry screening to detect congenital heart defects // J. Pediatr. 2008. Vol. 152. P. 761-765.
26. Sendelbach D.M., Lai S., Jackson G.J., Fixler D. et al. Pulse oximetry (POx) screening of term and late preterm neonates at 4 hours postnatal (PN) to detect cyanotic congenital heart disease (CCHD). Presented at: Pediatric Academic Societics. Honolulu, Hawaii, May 2-6, 2008. Abstract E-PAS2008:5896.2.
27. Ewer A.K. Evidence for CCHD screening and its practical application using pulse oximetry // Early Hum. Dev. 2014. Vol. 90. P. 19-21. doi: 10.1016/S0378-3782(14)50006-0.
28. Johnson L.C., Lieberman E., O’Leary E., Geggel R.L. Prenatal and newborn screening for critical congenital heart disease: findings from a nursery // Pediatrics. 2014. Vol. 134, N 5. P. 916-922. doi: 10.1542/ peds.2014-1461.
29. Therell B., Lorey F., Eaton R. et al. Impact of expanded newborn screening: United States, 2006 // MMWR Morb. Mortal. Wkly Rep. 2008. Vol. 57, N 37. P. 1012-1015.
30. Lhost J.J., Goetz E.M., Belling J.D., van Roojen W.M. et al. Pulse oximetry screening for critical congenital heart disease in planned out-of-hospital births // J. Pediatr. 2014. Vol. 165, N 3. P. 485-489. doi: 10.1016/j.jpeds.2014.05.011.
31. Goetz E.M., Magnuson K.M., Eickhoff J.C., Porte M.A. et al. Pulse oximetry screening for critical congenital heart disease in the neonatal intensive care unit // J. Perinatol. 2021. Vol. 36. P. 52-56.
32. Карпова А.Л., Спивак Е.М., Пыханцева А.Н. Диагностическое значение определения величины сатурации кислорода у доношенных новорожденных // Пермский мед. журн. 2014. Т. 33, № 5. С. 6-10.
33. Жаркова И.Ю., Ушакова С.А., Петрушина А.Д. Региональный опыт внедрения двухзонной пульсоксиметрии как скрининг-тест для выявления критических врожденных пороков сердца у новорожденных // Материалы VIII Всероссийского образовательного конгресса «Анестезия и реанимация в акушерстве и неонатологии». М., 2015. C. 58-59.
34. Карпова А.Л., Спивак Е.М., Пыханцева А.Н. Бокерия Е.Л. и др. Пульсоксиметрия как метод раннего неонатального скрининга на наличие критических пороков сердца у детей // Неонатология: новости, мнения, обучение. 2015. № 4 (10). С. 68-72.
35. Levesque B.M., Pollack P., Griffin B.E., Nielsen H.C. Pulse oximetry: what’s normal in the newborn nursery? // Pediatr. Pulmonol. 2000. Vol. 30. P. 406-412.
36. Kemper A.R., Knapp A.A., Metterville D.R., Comeau A.M. et al. Weighing the evidence for newborn screening for hemoglobin H disease // J. Pediatr. 2011. Vol. 158, N 5. P. 780-783.
37. Ozalkaya E., Akdag A., Sen I., Comert E. et al. Early screening for critical congenital heart defects in asymptomatic newborns in Bursa province // J. Matern. Fetal Neonatal Med. 2015. Vol. 22. P. 1-3.
38. Patankar N., Fernandes N., Kumar K., Manja V., Lakshminrusimha S. Does measurement of four-limb blood pressures at birth improve detection of aortic arch anomalies? // J. Perinatol. 2016. P. 1-5. doi: 10.1038/ jp.2015.203 (в печати).
39. Атлас анатомии человека : в 4 т. Т. 3. / Синельников Р.Д., Синельников Я.Р., Синельников А.Я. М. : Издатель Умеренков, 2014. 216 с.
40. Boelke K.L., Hokanson J.S. Blood pressure screening for critical congenital heart disease in Neonates // Pediatr. Cardiol. 2014. Vol. 35, N 8. P. 1349-1355.
41. US Preventive Services Task Force. Universal screening for hearing loss in newborns: US Preventive Services Task Force recommendation statement // Pediatrics. 2008. Vol. 122, N 1. P. 143-148.
Как ставят диагноз
В диагностике учитываются:
- клинические симптомы — синюшность губ и лица ребенка, одышка при движениях, изменения ритма, дрожание грудной клетки при пальпации области сердца, наличие видимой венозной сети под кожей, пульсирующие сосуды;
- фонокардиография и ЭКГ — уточняют локализацию поражения камер сердца;
- УЗИ и допплерография — позволяют установить поток крови в разные фазы сокращения миокарда, направление, объем возврата, степень приспособляемости желудочков и предсердий.
Что рекомендуется родителям
Выслушивание шума у ребенка в сердце должно вызвать обеспокоенность родителей. Необходимо довести диагностику до полной уверенности в причинах. Если потребуется, несколько раз проконсультироваться с кардиохирургом.
Только специалист может порекомендовать правильное наблюдение и лечение, запланировать конкретный срок операции. Если риск оперативного лечения превышает по осложнениям возможности предполагаемого развития декомпенсации, то об этом ставят в известность родителей.
Ребенок обязательно ставится на диспансерный учет, осматривается не реже раза в квартал. Малыша нужно беречь от инфекций, простуды, контролировать достаточность витаминов в питании. При необходимости врач назначает поддерживающую терапию, освобождает школьника от занятий физкультурой.
Функциональный шум не требует значительных ограничений. О возможности занятия спортом нужно поговорить с педиатром. Обычная физкультура не противопоказана.
Насколько здоровым вырастет ребенок, зависит от взрослых. С учетом нынешней распространенной тенденции к сокращению специализированных служб в здравоохранении родители должны быть готовы к платным консультациям.
Лечебная тактика при критических ВПС
ВПС с дуктусзависимой циркуляцией:
— кислородотерапия не показана;
— внутривенное титрование простагландина Е1 в начальной дозе 0,02–0,05 мкг/кг/мин, при достижении эффекта дозу можно снизить до 0,01–0,025 мкг/кг/мин;
— коррекция кислотно-щелочного состояния;
— при необходимости ИВЛ ее проведение небольшими концентрациями О2;
— температурный комфорт;
— седативная терапия;
— инфузионная терапия с умеренным положительным балансом
Если ведущий синдром — сердечная недостаточность или ее сочетание с артериальной гипоксемией (ФЗЦ), то к вышеизложенному необходимо добавить кардиотоническую поддержку, мочегонные, осуществить транспортировку больного в отделение кардиохирургии при стабилизации состояния на фоне терапии; терапию продолжить во время транспортировки.
При подозрении на дуктусзависимый порок диагноз выставляется следующим образом: ВПС (дуктусзависимая легочная циркуляция), нарастающая артериальная гипоксемия или ВПС (дуктусзависимая системная циркуляция), недостаточность кровообращения (степень).
Выставление такого диагноза не требует анатомической верификации, подразумевает отмену кислорода, начало титрования препарата группы PGE1 после установления диагностической группы.
Препараты группы PGE1 имеют разные названия в зависимости от фирмы-производителя: простин ВР, алпростан, вазапростан. Действующее вещество — алпростадил. 1 ампула содержит 100 мкг алпростадила. Используется средняя доза 0,02–0,05 мкг/кг/мин.
Эффект препарата появляется практически «на игле». При достижении эффекта (повышение сатурации кислорода до 85–90 % или купирование явлений сердечной недостаточности) дозу можно снизить до 0,01–0,025 мкг/кг/мин.
Препарат обладает побочными действиями, самое грозное из которых — апноэ. При использовании препарата нужно быть готовым к ИВЛ. Другие побочные действия: гиперемия кожи, лихорадка, диарея, судороги, которые купируются уменьшением дозы или отменой препарата.
Терапия сердечной недостаточности при «простой» ТМА:
— тщательное соблюдение/коррекция водно-электролитного балланса. Объем жидкости + еды = 70–80 мл/кг/сут;
— поддержание температуры тела — 36 °С;
— исключить дополнительный кислород!
— простагландин Е1 — 0,02–0,05 мкг/кг/мин;
— допамин, добутамин — 2–3 мкг/кг/мин;
— баллонная атрисептостомия по Rashkind.
Тактика при ВПС, сочетающихся с обструкцией выхода из левого желудочка
Терапия СН у новорожденных с коарктацией аорты и критическим клапанным стенозом аорты является сложной задачей при изолированных пороках. Она может включать следующие мероприятия:
— простагландин Е1;
— диуретики и дигоксин — при сочетании с ДМЖП (непродолжительно!);
— избежание ингаляции кислорода;
— срочная операция или дилатация стеноза. Самое правильное решение — безотлагательная транспортировка в кардиохирургический центр.
Такие пациенты с целью уменьшения нагрузки при дыхании переводятся на ИВЛ. Целью интенсивной терапии при критической коарктации аорты является поддержание адекватной коронарной и системной перфузии, поэтому она включает инотропную поддержку адреналином (0,03–0,1 мкг/кг/мин) или допамином (5–10 мкг/кг/мин). Необходимо очень точно соблюдать водный баланс.
Тактика у пациентов с тетрадой Фалло
В основе самого грозного осложнения этого ВПС — одышечно-цианотического приступа — лежит резкий спазм выводного отдела правого желудочка.
Для уменьшения гипоксемии и снятия спазма выводного отдела правого желудочка (ПЖ) необходимо купировать беспокойство ребенка любым гипнотиком (кроме кетамина, который может сам по себе вызывать спазм выводного тракта обоих желудочков). Обязательной также является инсуфляция кислорода через маску или назальную канюлю.
Показано введение соды (2–3 мл/кг) с целью уменьшения ацидоза, неизбежно сопровождающего гипоксию.
Патогенетическим лечением одышечно-цианотического приступа является введение бета-блокаторов — пропранолола внутривенно в течение 5–10 минут в дозе 0,02–0,1 мг/кг или эсмолола (бревиблок, Baxter), который является препаратом ультракороткого действия и вследствие этого может вводиться не только болюсно (в дозе 500 мкг/кг), но и в виде инфузии (50–200 мкг/кг/мин).
Сердечные гликозиды и любые катехоламины противопоказаны, так как обладают бета-миметическим эффектом и вызывают спазм выводного отдела ПЖ.
При неэффективности консервативных мероприятий показаны перевод ребенка на ИВЛ и выполнение экстренной операции наложения системно-легочного анастомоза.