Биохимические маркеры в диагностике и оценке ОКС
- Биохимические маркеры миокардиального некроза
- Натрийуретические пептиды
- Биохимические маркеры воспаления
- Биохимические маркеры ишемии
Рекомендации NACBLM по использованию биохимических маркеров для диагностики инфаркта миокарда (2008 г.)
- Биомаркеры некроза миокарда следует измерять у всех пациентов с клинической картиной, характерной для ОКС.
- При подозрении на ИМ клиническую картину (история болезни, физический осмотр) и данные ЭКГ следует оценивать в сочетании со значениями биомаркеров.
- Кардиальный тропонин является предпочтительным маркером при диагностике ИМ. Если его измерение невозможно, приемлемая альтернатива – измерение КК МВ.
- Кровь для тестирования следует собирать при поступлении пациента в больницу. Время последующего серийного сбора образцов зависит от клинических обстоятельств. В большинстве случаев кровь следует собирать при поступлении и спустя 6–9 часов.
- При наличии в истории болезни данных, подтверждающих ОКС, следующие отклонения говорят о некрозе миокарда, характерном для ИМ, если:
- Максимальная концентрация кардиального тропонина, превышающая 99 перцентиль, выявляется по меньшей мере в одном случае в течение первых суток после клинического проявления ОКС.
- Максимальная концентрация КК МВ превышает 99 перцентиль в 2–х последовательных образцах.
- У пациентов, поступающих в пределах 6 часов после появления симптомов, возможно измерение раннего маркера некроза миокарда в дополнение к кардиальному тропонину. Наиболее изученный маркер для этой цели – миоглобин.
- Вопрос специфичности сердечных тропонинов не следует связывать с вопросом о механизме повреждения (например, ИМ или миокардит).
- Общую КК, активность КК МВ, АСТ, ЛДГ, ГБДГ не рекомендуется измерять в качестве биомаркера при диагностике ИМ.
Рекомендации по использованию биохимических маркеров для стратификации риска
- Среди пациентов с подозрением на ОКС следует проводить раннюю стратификацию риска на основании комплексной оценки симптомов, клинического обследования, данных ЭКГ и результатов измерения биомаркеров.
- Кардиальный тропонин является предпочтительным маркером при стратификации риска и его, по возможности, следует измерять у всех пациентов с подозрением на ОКС. У пациентов с клинической картиной характерной для ОКС максимальную (пиковую) концентрацию, превышающую 99 перцентиль, следует рассматривать как указание на повышенный риск смерти и повторного ишемического события.
- Кровь для тестирования следует собирать при поступлении пациента в больницу. Время сбора последующих серийных образцов зависит от клинических обстоятельств. В большинстве случаев кровь следует собирать при госпитализации и спустя 6–9 часов.
Источник: “Myocardial Infarction Redefined–A Consensus Document of The Joint European Society of Cardiology/American College of Cardiology J. Am. Coll. Cardiol.36, 959– 962, 2000 (American Heart Ass., 2008).
Маркеры повреждения миокарда В настоящее время считается доказанным, что причиной развивающегося инфаркта миокарда (ИМ) в более чем 80% случаев выступает тромбоз коронарной артерии, возникающий, как правило, на месте атеросклеротической бляшки с поврежденной поверхностью. По мере гибели кардиомиоциты высвобождают в кровоток огромное количество биологически активных веществ, в том числе внутриклеточные ферменты, включая АСТ, КК, ЛДГ, а также ряд специфических белков, таких как миоглобин, тропонины Ти I. Определение некоторых их них используется в клинической практике в качестве маркеров повреждения миокарда (миокардиальных маркеров).
Биомаркеры некроза миокарда
| Биомаркер | Молекул. масса, Д | Специфичность для миокарда | Преимущества | Недостатки | Длительность повышения |
| Миоглобин | 18000 | Нет | Высокая чувствительность и ПЦ (-) | Низкая специфичность при повреждении мышц и почечной недостаточности | ↑ через 1-3ч и держится 12-24ч |
| Сердечный белок, связывающий жирные кислоты (h-FABP) | 15000 | + | Раннее выявление ИМ | Низкая специфичность при повреждении мышц и почечной недостаточности | ↑ через 1-3ч и держится 18-30ч |
| KK-MB (активность от общей КК) | 85000 | +++ | Выявляет повторный ИМ | Низкая специфичность при повреждении мышц | ↑ через 3-4ч и держится 24-36ч |
| Массовая конц-я КК-МВ | 85000 | +++ | Раннее выявление ИМ | Недостаточная доступность | ↑ через 3-4ч и держится 18-30ч |
| Сердечный тропонин I | 37000 | ++++ | Выявление ИМ до 14 сут, высокая специфичность, показатель для ранжирования риска | Не выступает ранним маркером некроза миокарда | ↑ через 3-4ч и держится 10-14сут |
| Сердечный тропонин I | 25000 | ++++ | Выявление ИМ до 7 сут, высокая специфичность, показатель для ранжирования риска | Не выступает ранним маркером некроза миокарда | ↑ через 3-4ч и держится 4-7сут |
Динамика изменений миокардиальных макеров при инфаркте миокарда ИМ представляет собой динамический процесс, развитие которого происходит во времени. Повышение активности миокардиальных ферментов и концентрации миокардиальных белков в плазме крови, сопровождающие ИМ, выступает преходящим феноменом и имеет свои динамические закономерности.
| Параметр | Начало ↑ активности, ч | Максимум ↑ активности, ч | Возвращение к норме, сут | Кратность увеличения,раз |
| АСТ | 4-6 | 24-48 | 4-7 | 2-20 |
| КК | 2-4 | 24-36 | 3-6 | 3-30 |
| КК-МВ | 2-4 | 12-18 | 2-3 | до 8 |
| ЛДГ | 8-10 | 48-72 | 6-15 | до 8 |
| ЛДГ 1 | 8-10 | 30-72 | 7-20 | до 8 |
| Миоглобин | 0,5-2 | 6-12 | 0,5-1 | до 20 |
| Тропонин Т | 3,5-10 | 12-18 (и 3-5 день) | 7-20 | до 400 |
Роль миокардиальных маркеров в диагностике инфаркта миокарда Среди пациентов поступающих в больницу с болями в сердце, только у 10-15% имеется ИМ. Необходимость диагностики ИМ в ранние сроки продиктована тем, что тромболитическая терапия в первые 2-6 часов снижает раннюю смертность у больных в среднем на 30%; терапия, начатая через 7-12 часов, – лишь на 13%; терапия, начатая через 13-24 часа, – не снижает уровня смертности. В 30% случаев ИМ изменения на ЭКГ могут отсутствовать или быть недостаточно специфичными для постановки диагноза. Именно в этих, трудных для диагностики случаях, определение в крови миокардиальных маркеров подтвердить или опровергнуть диагноз ИМ.
Термин “миокардиальные маркеры” подразумевает, что используемые для диагностики ферменты и белки происходят из сердечной мышцы. В действительности это не так. Практически все они содержатся в других тканях, и повышение их уровня может быть результатом не только повреждения миокарда. На протяжении многих лет определение активности в крови АСТ, КК и ее МВ-изофермента и ЛДГ использовали в качестве маркеров для диагностики ИМ. Просто другие маркеры были недоступны для большинства лабораторий. За последние два десятилетия были проведены многочисленные клинические исследования с целью оценить эффективность и безопасность обследования и лечения больных с ИМ. Результаты исследований были положены в основу международных клинических рекомендаций по ведению больных с ИМ. В рекомендациях указывается, что миокардиальные белки (тропонины Т и I) имеют почти абсолютную специфичность для ткани миокарда, а также высокую чувствительность, что позволяет выявлять даже микроскопические участки повреждения миокарда. Исследование тропонинов выступает обязательным для больных с подозрением на ИМ. Кардиальные тропонины должны быть определены при поступлении больного и повоторно через 6-9 часов. Дальнейшие исследования проводятся через 12-24 часа, если результаты предыдущих исследований были отрицательными, а клиническое подозрение на ИМ высоко. В случае рецидива ИМ определение уровня тропонинов возобновляется через 4-6 часов от начала рецидива и далее повторно через 6-9 часов. Определение уровня миоглобина в сыворотке крови и/или активности МВ-фракции КК должны прводиться при недавнем (менее 6 часов от возникновения острых болей за грудиной) появлении клинических симптомов (как ранние маркеры ИМ) и у больных с повторной ишемией после недавнего (менее 2-х нед) ИМ для выявления рецидива. В случае рецидива ИМ значение исследования миоглобина и КК-МВ возрастает, поскольку содержание тропонина может оставаться еще повышенным от первоначального эпизода некроза миокарда. Пациенты с болью в груди и лабораторными результатами тропонинов Т(I) выше верхнего предела референтной величины должны рассматриваться как переносящие “повреждение миокарда”. Они должны быть госпитализированы и интенсивно наблюдаться, чтобы снизить риск, связанный с этим повреждением.
Клинические рекомендации однозначно указывают на то, что исследование активности АСТ, КК, КК-МВ, ЛДГ и ее изоферментов не должны использоваться для диагностики ИМ.
Изменения миокардиальных маркеров при других заболеваниях Повышение активности КК в крови не выступает специфичным для ИМ. В отдельных случаях КК повышена при миокардитах, миокардиодистрофиях. Значительное повышение может наблюдаться при травматических повреждениях скелетной мускулатуры и заболеваниях мышечной системы. Так, при прогрессирующей мышечной дистрофии активность КК может увеличиваться в 50 раз. Высокая активность КК наблюдается при самых различных нарушениях ЦНС: шизофрении, маниакально-депрессивном психозе, синдромах, вызываемых психотропными лекарствами. Активность КК повышается при гипотиреозе, а также при наличии различных опухолей. Повышение концентрации миоглобина наблюдается при повреждении скелетных мышц, т.к. содержится в них в значительном количестве, а также при термических ожогах, вторичной токсической миоглобинурии. Некоронарогенные заболевания сердечной мышцы (миокардит, травма, кардиоверсия), септический шок могут сопровождаться повышением уровня тропонина Т, однако динамика изменения, характерная для ИМ, отсутствует.
Биохимические маркеры повреждения миокарда При ОКС без подъемов сегмента ST cердечные тропонины Т и I, как маркеры некроза миокарда, из-за их большей специфичности и надежности предпочтительнее традиционно определяемых КФК и ее МВ-формы. Повышенный уровень тропонинов Т или I отражает некроз клеток миокарда. При наличии других признаков ишемии миокарда (загрудинная боль, изменения сегмента ST) такое повышение следует называть ИМ.
Определение тропонинов позволяет обнаружить повреждение миокарда примерно у трети больных, не имеющих повышения МВ-КФК.
Для выявления или исключения повреждения миокарда необходимы повторные взятия крови и измерения в течение 6–12 ч после поступления и после любого эпизода сильной боли в грудной клетке. Изменение содержания различных маркеров некроза миокарда во времени по отношению к болевому приступу представлено на рис. 1. Миоглобин является относительно ранним маркером, тогда как повышение МВ–КФК и тропонина появляется позже. Тропонины могут оставаться повышенными в течение 1-2 недель, что затрудняет диагностику повторного некроза у больных с недавним ИМ.
Биохимические маркеры некроза миокарда и изменения их содержания в крови после болевого приступа
А – раннее высвобождение миоглобина или изоформ МВ-фракции КФК В – сердечный тропонин после «классического» острого ИМ С – МВ-фракция КФК после острого ИМ D – сердечный тропонин после микроинфаркта
Источник: Myocardial Infarction Redefined – A Consensus Document of The Joint European Society of Cardiology/American College of Cardiology Committee for the Redefinition of Myocardial Infarction. JAmerCollCardiol 2000; 36: 959– 1062
Натрийуретические пептиды Доказана связь между уровнем НП и исходов у пациентов с ОКС. После начала ИМ концентрация НП быстро возрастает и достигает пика через 24 часа. Пиковая концентрация пропорциональна размеру ИМ. При развитии СН у больных ОКС второй пик максимальных концентраций НП может быть выявлен спустя 5 дней, что отражает неблагоприятное ремоделирование желудочков. Повышенная концентрация НП свидетельствует о более высокой вероятности смертельного исхода или СН, независимо от других прогностических факторов, включая фракцию выброса левого желудочка. В настоящее время полностью доказана тесная связь между тяжестью сердечной дисфункции (прежде всего ЛЖ) и содержанием НП в плазме, что позволяет рекомендовать определение концентрации этих пептидов в качестве «лабораторного теста» ХСН. Наиболее полно охарактеризованы N–концевой предсердный НУП (ANP), мозговой НУП (BNP), и его предшественник, N–концевой мозговой НУП (NТ–рro BNP).
Источник: Российские национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН (второй пересмотр), 2007г.
Преимущества определения NT–pro BNP перед BNP
| BNP | NT–pro BNP |
| Гормонально активный | Гормонально не активный |
| После высвобождения выводится из кровотокаТ1/2~21 мин | После секреции рекомендуем определять в крови в течение нескольких дней, Т1/2~70– 120 мин |
| Наличие циркадного ритма, уровень быстро изменяется в зависимости от состояния и функции левого желудочка, отражает состояние миокарда в момент определения | Не подвержен циркадным ритмам. Кумулятивный уровень NT–pro BNP отражает функцию миокарда в целом, корреллируя со степенью нарушения cердечной функции (наиболее объективная оценка стадии заболевания и прогноза) |
| Относительно низкие плазменные уровни не позволяют диагностировать СН на ранних стадиях | Высокие плазменные уровни позволяют выявлять ранние нарушения функции миокарда (диастолическую дисфункцию) |
| Низкая стабильность в плазме | Высокая стабильность в плазме – до 7 дней при комнатной температуре и 21 день при 4°С |
| Уровень BNP зависит от терапии, в частности, натрекором | Не зависит от проводимой терапии |
Источник: National Institute of Neurological Disorders and Stroke Recombinant, 2007г.Brain Injury Indication
Диагностическая ценность определения уровеня NT–pro BNP
- Высокоспецифический маркер наличия и степени тяжести миокардиальной дисфункции;
- Надежный предиктор прогноза при сердечной недостаточности;
- Прогностический критерий степени выраженности патологического ремоделирования сердца после инфаркта миокарда;
- Может использоваться для мониторинга лечебного эффекта при терапии ингибиторами ангиотензинпревращающего фермента (иАПФ).
Потенциальные возможности использования NT–pro BNP
- Разработка индивидуального курса реабилитации после острого инфаркта миокарда;
- Наблюдение за пациентами со стенокардией (параллельное определение Тропонина);
- Предоперационный мониторинг;
- Ранняя диагностика сердечной недостаточности у больных сахарным диабетом и заболеваниями щитовидной железы;
- Идентификация кардиотоксичных препаратов (онкология, психиатрия);
- Использование в гинекологической, акушерской практике.
Мониторинг и лечение пациентов c сердечной недостаточностью (СН) под контролем уровня NT–pro BNP Измерение NT–pro BNP рекомендуется для первичного скрининга пациентов с одышкой и подозрением на СН до ЭхоКГ обследования, но не заменяет его для диагноза и оценки состояния. Однако NТ – pro BNP не может быть единственным исследованием, а должен трактоваться с учетом клинической картины. Скрининг с использованием NТ–pro BNP показан у пациентов с высоким риском СН, вызванной ИБС, ЭКГ Q-waves, или блокадой левой ножки пучка Гисса. Измерение натрийуретических пептидов – «золотой стандарт» для мониторинга и контроля лечения, оно облегчает оптимальное использование стандартной терапии и уменьшает количество неблагоприятных клинических исходов. Целевая терапия СН направлена на 30%-ное снижение уровня NТ–pro BNP. При отсутствии инцииального уровня, цель терапии – уровень NТ– pro BNP ниже 400 пг/мл. При нормальном ответе на лечение измерение NТ–pro BNP должно проводиться у пациентов с ХСН с интервалом в 3 месяца. Когда клинические признаки и /или только уровень NТ–pro BNP (повышение более чем на 30%) указывают на декомпенсацию, требуется корректировка терапии и дальнейшее повторное измерение NТ–pro BNP с интервалом 1–2 недели. Пациенты, у которых не произошло снижение уровня NТ–pro BNP на 30% во время терапии имеют высокий риск возврата СН или смерти. Уровень NТ–pro BNP около 5000 пг/мл – прогностический признак смертности в течение 76 дней, при уровне около 1000 пг/мл – в течение года.
Динамика содержания NT– pro BNP у больных ОКС Согласно Исследованиям GUSTO-IV, проведенным у пациентов с ОКС без подъема сегмента ST (n = 6806), острая ишемия провоцирует выработку натрийуретических пептидов в первые 24 часа, а примерно через 80 часов от начала болевого синдрома уровень NT–pro BNP нормализуется. В случае неблагоприятного прогноза у больных с обострением коронарной болезни NT–pro BNP может оставаться повышенным в течение 12 недель. Стойкое повышение, вне зависимости от уровня тропонина Т, ЧСС, клиренса креатинина, депрессии сегмента ST является предиктором неблагоприятного исхода. Измерение уровня NТ– pro BNP используется для стратификации риска как во время острой фазы, так и для последующего отдаленного мониторинга. После эпизодов ОКС пациенты с уровнем NТ–pro BNP ≥ 1000 пг/мл имеют высокий риск и должны рассматриваться как группы для ранней инвазивной стратегии. Пациенты с низким уровнем NТ–pro BNP и нормальным уровнем тропонина имеют низкий риск и должны рассматриваться как группы для консервативной терапии. Источник: James Stefan Ketal, Circulation 2003;108:275-81
NТ–pro BNP при стабильной ИБС Миокардиальная ишемия – потенциальный стимул для продукции NТ – pro BNP, содержание которого независимо коррелирует с тяжестью ИБС и величиной ишемизированной области и является показателем отсутствия или наличия дисфункции левого желудочка (ЛЖ). При значении NТ–pro BNP ≤100 пг/мл значительно уменьшает вероятность диагноза дисфункции ЛЖ, а при NТ–pro BNP ≥ 500 пг/мл вероятность диагноза дисфункции ЛЖ увеличивается. Риск, ассоциируемый с повышением NТ–pro BNP при стабильной ИБС независим от возраста, пола, дисфункции желудочков, выраженности ишемии, функции почек и уровня СРБ. Для оценки прогноза полезны дополнительные измерения с интервалами в 12– 18 мес. NТ–pro BNP – важный предиктор прогноза последующих событий СН и смерти при стабильной ИБС.
NТ –pro BNP при заболеваниях клапанного аппарата сердца Концентрация NT–pro BNP повышена у пациентов с поражениями клапанов сердца: увеличение уровня отражает тяжесть заболевания и симптоматический статус. Уровень NT–pro BNPуменьшается после пересадки клапанов у пациентов с аортальным стенозом и после успешной вальвулопластики у пациентов с митральным стенозом. NТ–pro BNP обеспечивает прогностическую информацию для выживания у пациентов с аортальным стенозом и аортальной регургитацией.
NТ–pro BNP при острой легочной эмболии и ПЛГ Поскольку уровни ВNР и NТ–pro BNP повышены не только при дисфункции ЛЖ , но также при изолированной острой или хронической перегрузке ПЖ, они могут cчитаться биомаркерами «кардиоваскулярной одышки», но только как индикатор застойной сердечной недостаточности. Уровень натрийуретических пептидов тесно коррелирует с показателями ЭКГ и гемодинамики и перегрузки ПЖ. Оценка уровня ВNР и NТ–pro BNP включена в прогностическую оценку пациентов с тромбоэмболией ЛА и ПЛГ: Повышенные уровни пептидов при ПЛГ и ТЭЛА – маркеры увеличивающейся летальности. Низкий уровень указывает на благоприятный прогноз.
NТ–pro BNP и ЭКГ (структура сердца и корреляция с функцией) Уровень NТ–pro BNP коррелирует с ЭХКГ находками: нарушением LVEF, выраженной диастолической дисфункцией, объемом ПЖ и давлением перенагрузки и поражением клапанного аппарата. Уровень NТ–pro BNP в границах «нормы» имеет высокое негативное предсказательное значение для исключения систолической дисфункции и контролирует тяжелую диастолическую дисфункцию. Совместное использование измерения уровня NТ–pro BNP и ЭхоКГ должно приниматься в расчет при низком клиническом риске, ассоциированном с нормальным уровнем NТ–pro BNP.
NТ–pro BNP в педиатрии при врожденных сердечных заболеваниях У здоровых детей уровень NТ–pro BNP повышен при рождении, уменьшаясь в первые дни жизни и остается относительно стабильным или слегка снижается на протяжении детства и взросления. У детей с заболеваниями сердца уровень NТ–pro BNP повышен и коррелирует с тяжестью заболевания. Маркер NТ–pro BNP может использоваться для идентификации детей и подростков с признаками или симптомами заболеваний сердца, а также для дифференцировки между сердечной или несердечной этиологией. Уровень NТ–pro BNP прогнозирует исход у детей и подростков с хронической ДКМП и у детей, подвергающихся операции по поводу врожденных сердечных заболеваний.
NT–pro BNP и группы высокого риска: диабет и гипертония Уровень NT–pro BNP увеличивается с развитием гипертензии, сердечной дисфункции или поражения почек и может использоваться при скрининге нарушений функции ЛЖ при диабете для предсказания «молчащей» ишемии миокарда, кардиоваскулярных исходов и смертности у данных пациентов. Циркулирующий уровень пептидов отражает структуру и функцию сердца у пациентов с АГ и помогает предсказать заболеваемость и смертность, связанную с гипертонией.
Клиническое биохимическое исследование крови
Биохимический анализ крови
— лабораторный метод исследования, который отражает функциональное состояние органов и систем организма.
Биохимический анализ крови показан
, даже если у человека отсутствуют жалобы. По изменениям в химическом составе крови можно установить, какой из органов функционирует с отклонением от нормы, что может свидетельствовать о развитии заболевания и необходимости срочного лечения.
Маркеры повреждения миокарда и сердечной недостаточности:
Миоглобин
– гемопротеин, в больших количествах содержащийся в скелетной мускулатуре и в небольшом количестве в сердечной мышце. Принимает участие в тканевом дыхании. При инфаркте миокарда концентрация миоглобина в крови повышается через 2 часа, однако это неспецифический маркёр инфаркта миокарда, так как в сердечной мышце содержится небольшое количество миоглобина. Данный маркер используется в диагностике инфаркта миокарда в комплексе с другими биохимическими тестами.
Тропонин I
– белок, специфический маркёр поражения сердечной мышцы, используемый в диагностике инфаркта миокарда. Повышение тропонина I отмечается уже через 4 – 6 часов после приступа. Данный тест позволяет диагностировать даже микроскопические участки повреждения миокарда.
КФК-МВ
– креатинфосфокиназа-МВ
— изофермент креатинфосфокиназы, характерный для ткани сердечной мышцы.
Определение активности КФК-МВ- имеет большое значение при диагностике инфаркта миокарда и мониторинге постинфарктного состояния, позволяя оценить объём поражения и характер восстановительных процессов. Диагноз острого инфаркта миокарда подтверждается также наблюдением характерной динамики показателя, серийное определение КФК-MB с интервалом 3 часа в течение 6 — 9 часового периода при неспецифических изменениях ЭКГ более информативно, чем единичное измерение. Уровень КФК-МВ может быть измерен как в весовом выражении, так и в единицах активности. В настоящее время для диагностики инфаркта миокарда предпочтительным является определение не активности, а массы КФК-МВ.
Для адекватной оценки соотношения концентрации КФК-MB и общей активности креатинфосфокиназы введён расчётный относительный индекс RI = КФК-MB (мкг/л) / КФК общ. (Ед/л) х 100 (%). Для повреждения сердечной мышцы характерен RI > 2,5 — 3%.
Маркер сердечной недостаточности ProBNP
– это предшественник мозгового натрийуретического пептида — BNP (BNP — brain natriuretic peptide). Название «мозговой» связано с тем, что впервые он был выявлен в мозгу животных. У человека основным источником ProBNP является миокард желудочков, он высвобождается в ответ на стимуляцию кардиомиоцитов желудочков, например при растяжении миокарда при сердечной недостаточности. ProBNP расщепляется на два фрагмента: активный гормон BNP и N — терминальный неактивный пептид
NT — proBNP
. В отличие от BNP, для
NT — proBNP
характерны более длительный период полувыведения, лучшая стабильность in vitro, меньшая биологическая вариабельность и более высокие концентрации в крови. Перечисленные особенности делают этот показатель удобным для использования в качестве биохимического маркера хронической сердечной недостаточности. Определение уровня
NT — proBNP
в плазме крови помогает оценить степень тяжести хронической сердечной недостаточности, прогнозировать дальнейшее развитие заболевания, а также оценивать эффект проводимой терапии.
Отрицательная предсказательная ценность теста более 95% — то есть, нормальный уровень NT-proBNP
с высокой вероятностью позволяет исключить сердечную недостаточность (например, в случаях одышки, обусловленной резким обострением хронического обструктивного лёгочного заболевания, или отеков, не связанных с сердечной недостаточностью). Следует отметить при этом, что
NT-proBNP
не должен использоваться в качестве единственного критерия.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ИНФАРКТА МИОКАРДА: СОВРЕМЕННЫЕ ТРЕБОВАНИЯ Д.С.Бенево…
Главная \ Публикации \ ЛАБОРАТОРНАЯ ДИАГНОСТИКА ИНФАРКТА МИОКАРДА: СОВРЕМЕННЫЕ ТРЕБОВАНИЯ Д.С.Беневоленский
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ИНФАРКТА МИОКАРДА: СОВРЕМЕННЫЕ ТРЕБОВАНИЯ Д.С.Беневоленский Представительство (Дания)
Резюме: Лабораторные методы на сегодняшний день играют ключевую роль в диагностике инфаркта миокарда. Однако все существующие на сегодняшний день биомаркеры некроза кардиомиоцитов не идеальны. Наиболее чувствительны и специфичны тропонины
I иT. Наименее специфичен миоглобин, но он быстрее появляется в крови после инфаркта. Промежуточными характеристиками обладает третий рекомендованный биомаркер – креатинкиназаMB. Для точного определения верхней границы нормы для биомаркеров аналитический метод должен обладать высокой чувствительностью и специфичностью. В результате использования производителями разных наборов антител в иммунохимической реакции и отсутствия четкой стандартизации концентрации биомаркеров, измеренные на разных анализаторах, часто не совпадают. Каждый анализатор имеет свои референтные диапазоны. Это относится, прежде всего, к тропонину. В кардиологии очень важна быстрота постановки диагноза, поэтому все большее значение приобретает проведение анализа непосредственно у постели больного. Некоторые современные анализаторы, как напримерRadiometer AQT90FLEX, позволяют очень просто получить высококачественный результат измерения биомаркеров.
Ключевые слова: инфаркта миокарда, диагностика, тропонин, миоглобин, креатинкиназа
MB.
Сегодня биохимические маркеры играют ключевую роль в точной диагностике инфаркта миокарда, и, что очень важно, в оценке риска неблагоприятного исхода и выборе наиболее адекватного метода лечения. Впервые лабораторный метод диагностики инфаркта миокарда (измерение активности аспартатаминотрансферазы в крови) был применен более 50-ти лет назад [5]. С тех пор роль лабораторных методов в кардиологии постоянно возрастала. Произошел знаменательный переход от измерения активности аспартатаминотрансферазы и лактатдегидрогеназы к трем широко применяемым сегодня биомаркерам: миоглобину, креатинкиназе MB (КФК-MB) и тропонинам I и T. Вначале результаты лабораторных исследований рассматривались лишь как дополнение к клиническому обследованию и ЭКГ. Но в 2000 году и затем в 2007 году решением наиболее авторитетных американских, европейских и международных кардиологических ассоциаций диагноз инфаркта миокарда был впрямую связан с повышением уровня биомаркеров (предпочтительно тропонина) в крови [12]. Все остальные методы клинического и функционального обследования призваны лишь подтвердить ишемическую природу наблюдаемого некроза миокарда. В опубликованном документе подчеркивается ключевая роль биомаркеров в диагностике: «Термин инфаркт миокарда следует использовать при наличии данных о некрозе миокарда на фоне клинической картины, соответствующей ишемии миокарда». Причем под данными о некрозе миокарда понимается «выявление роста и/или падения уровня сердечных биомаркеров (предпочтительно тропонина) с, по крайней мере, одной величиной, превышающей верхний референтный предел», а достаточным свидетельством ишемии считается хотя бы одно из следующего: • Наличие симптомов ишемии; • Изменения ЭКГ, свидетельствующие о появлении ишемии (появление изменений ST-T или появление блока левой ножки пучка Гиса); • Развитие патологического зубца Q на ЭКГ; • Данные лучевой диагностики, свидетельствующие о потере жизнеспособного миокарда или появлении локального нарушения движения стенки. Почему же в лабораторной диагностике центральное место заняло измерение уровня тропонина? В таблице 1 приведены свойства идеального биомаркера инфаркта миокарда.
Таблица 1. Свойства идеального биомаркера некроза миокарда [3].
| · Абсолютная специфичность для миокарда : Биомаркера не должно быть ни в каких других тканях организма. · Специфичность для необратимого повреждения : Биомаркер должен отличать обратимое (ишемия) от необратимого повреждения (некроз). · Быстрый выход в кровь : Биомаркер должен быстро выходить в кровь после некроза. Биомаркеры с более низкой молекулярной массой обычно быстрее появляются в крови. Растворимые цитоплазматические биомаркеры – быстрее, чем структурные. · Высокая чувствительность : Биомаркер должен содержаться в миокарде в высокой концентрации, а в крови полностью отсутствовать как в норме, так и при любой патологии, кроме некроза миокарда. Выброс биомаркера при некрозе должен быть мощным. · Стабильное увеличение уровня : Для надежного измерения уровень биомаркера должен оставаться повышенным в течение часов или дней после некроза. · Предсказуемое выведение : Кинетика выведения должна быть предсказуемой, и не зависеть от сопутствующих заболеваний, таких как почечная недостаточность или поражение печени. · Полное освобождение : Некротизированные миоциты должны полностью освобождаться от биомаркера. Количество биомаркера в крови должно быть пропорционально степени некроза (размеру инфаркта). · Измерение доступными методами : Природа биомаркера должна позволять применение доступного, надежного, быстрого, точного и экономичного метода измерения. |
На сегодняшний день ни один из существующих биомаркеров не удовлетворяет всем перечисленным критериям. Наиболее близки к идеалу тропонины I и T. Их основное преимущество – уникальная специфичность для миокарда. Тропонины – белки сократительного аппарата мышц. Они входят в состав тропонин-тропомиозинового комплекса тонких миофибрилл. Этот комплекс регулирует взаимодействие сократительных белков актина и миозина и, тем самым, обеспечивает смену сокращения или расслабления мышц. Имеются три типа тропонина – C,I иT. Все они – небольшие белки с молекулярной массой 20–40 тыс. ТропонинT связывает остальные тропонины и тропомиозин в единый комплекс. В расслабленной мышце тропонин I предотвращает взаимодействие головки миозина с актином и препятствует сокращению. Возбуждение кардиомиоцита приводит к повышению внутриклеточной концентрации ионовCa2+, которые связываются с тропонином C. Конформация всего комплекса изменяется, и актин освобождается от ингибирующего влияния тропонина I – происходит сокращение мышцы. Тропонин C – один из очень консервативных белков. Так, тропонинCиз скелетных мышц человека отличается от тропонина C из сердца быка лишь одной аминокислотой [10]. Другими словами, тропониныCсердца и медленных скелетных мышц практически идентичны. Напротив, сердечные изоформы тропонинов I иTэкспрессируются только в сердце, тогда как изоформы аналогичных тропонинов быстрой и медленной скелетных мышц – это продукты других генов. Будучи частью сократительного аппарата, тропониныIиT присутствуют в клетках миокарда в высокой концентрации. В крови здоровых людей концентрация этих белков крайне мала, но в случае инфаркта миокарда она возрастает в десятки раз (рис.1), причем повышенная концентрация сохраняется в течение нескольких дней, в некоторых случаях до одной, а для тропонина T и двух недель. По общему мнению экспертов, концентрация тропонинов в крови возрастает лишь при необратимом разрушении (некрозе) кардиомиоцитов, хотя причины некроза могут быть разные. К сожалению, тропонины – структурные белки, и они появляются в крови не сразу, обычно через 4-6 часов после инфаркта. Правда, повышение чувствительности современных тестов все более сокращает это время. Кинетика выведения тропонинов неоднозначна и зависит от функции почек. Тропонины I иT содержатся в миокарде в эквимолярном количестве, они оба уникальны для сердца, и хотя это разные белки, с точки зрения диагностики инфаркта миокарда, оба тропонина I иT совершенно равнозначны, и все международные рекомендации не делают различия между ними.Если нет возможности измерить концентрацию тропонина, то международные рекомендации предлагают в качестве альтернативы измерить уровень креатинкиназы MB (по массе, а не по активности!) [7]. До недавнего времени именно этот показатель был «золотым» стандартом в лабораторной диагностике инфаркта миокарда в силу его относительной специфичности для миокарда. Креатинкиназа MB – фермент, катализирующий перенос высокоэнергетического фосфата с креатинфосфата на АТФ и участвующий в транспорте энергии от митохондрий к сократительному аппарату. Для интенсивной и непрерывной работы сердцу нужен постоянный приток энергии, поэтому этот фермент содержится к кардиомиоцитах в большом количестве. Креатинкиназа состоит из двух субъединиц и имеет молекулярную массу около 42 тыс. Известны два вида субъединиц MиB, и соответственно три изофермента MM, BB и MB. КФК-MM преобладает в скелетных мышцах, и на долю КФК-MB приходится лишь 1–3%. В миокарде основной изофермент также КФК-MM, но примерно 15% приходится на долю КФК-MB. Поэтому повышение уровня КФК-MB в крови специфично (но не абсолютно!) для поражения миокарда. Активность гена, кодирующего субъединицуB, может повышаться, например, в регенерирующей скелетной мышце, что снижает специфичность этого биомаркера. КреатинкиназаMB – менее чувствительный биомаркер, чем тропонин. Показано, что почти у 30% больных, поступивших с болью в груди, без подъема сегментаST на ЭКГ и без повышения уровня креатинкиназы КФК-MB, в действительности был инфаркт миокарда, как показало измерение уровня тропонина. Для пациентов, поступивших в течение 6 часов с начала болевого международные рекомендации предусматривают определение раннего биомаркера некроза миокарда в дополнение к сердечному тропонину [7]. Миоглобин – наиболее изученный биомаркер для этой цели. Это небольшой гем-содержащий растворимый белок скелетных мышц и миокарда (м.м. 17 500). Его основная функция – транспорт кислорода в мышцах. Благодаря высокой растворимости и небольшому размеру, миоглоблин быстро освобождается при поражении мышц и выводится почками. Основной недостаток миоглобина, как биомаркера, – низкая специфичность. Нормальный уровень миоглобина помогает исключить диагноз инфаркта миокарда. Но его повышение может быть связано и с различными поражениями скелетных мышц.Каковы же нормальные концентрации биомаркеров в крови, и что считать доказанным повышением их уровня? Согласно рекомендациям Национальной академии клинической биохимии (США) и Международной федерации клинической химии и лабораторной диагностики, для каждого биомаркера необходимо установить верхнюю границу нормальных значений на основе исследования группы здоровых людей, не имеющих заболеваний сердца в анамнезе [1,2]. Для тропонинов (T и I) и креатинкиназы MB пороговым значением для выявления поражения сердца признан 99-й процентиль результатов измерения в группе здоровых людей. Это означает, что у 99 % здоровых людей уровень соответствующего аналита в плазме оказывается ниже указанного порога. Наоборот, превышение этого порога свидетельствует о поражении миокарда. Причем для креатинкиназы MB исследования должны быть проведены отдельно для мужчин и женщин, так как у мужчин величина 99-го процентиля в 2–3 раза выше, чем у женщин. Имеются и расовые различия. Для концентрации миоглобина в качестве границы нормы принят 97,5-й процентиль. В идеале каждая лаборатория должна установить собственный референтный диапазон, но, учитывая сложность проведения такого исследования, допускается ориентироваться на цифры, приведенные производителями.В приведенном выше определении инфаркта миокарда очень важны слова «рост или падение» уровня биомаркера. То есть в идеале нужно выявить новый пик концентрации биомаркера в крови, соответствующий клинической картине. Для этого концентрацию биомаркера необходимо измерить минимум дважды, причем измерить количественно. Для большинства пациентов показано взятие проб крови при поступлении и через 6-9 часов [7]. После подтверждения диагноза инфаркта миокарда последующие измерения биомаркеров поражения миокарда (примерно раз в сутки) позволяет оценить размер инфаркта и оценить риск осложнений для данного пациента. Точная оценка риска сердечно-сосудистого заболевания исключительно важна для принятия клинического решения, поскольку для выбора наилучшего способа лечения каждого конкретного пациента необходимо взвесить преимущества, опасность и стоимость различных методов лечения [4]. Из перечисленных биомаркеров труднее всего измерить в крови концентрацию тропонина, поскольку в норме она исключительно низка. Для точного определения верхней границы нормы (99-го процентиля) аналитическая чувствительность метода измерения должна быть достаточной для определения концентрации тропонина в крови если не всех, то, по крайней мере, многих здоровых людей. На рис.2 показано «истинное» распределение концентрации тропонина I в крови у здоровых людей и больных инфарктом миокарда. Граница нормы на уровене 99-го процентиля распределения концентрации тропонина I у здоровых людей наилучшим образом позволяет отличить больных от здоровых [2]. Если метод анализа имеет предел обнаружения (1), то этот порог можно установить достаточно точно определить. Метод с пределом обнаружения (2), безусловно, выявит большинство больных с инфарктом миокарда, но истинная граница нормы остается неизвестной, а потому у части больных поражение миокарда остается недиагностированным. Согласно рекомендации Международной федерации клинической химии и лабораторной медицине (IFCC), для снижения влияния неспецифических факторов аналитическая чувствительность должна быть примерно в 5 раз ниже клинически значимого порогового уровня [9]. Кроме того, погрешность измерения на пороговом уровне должна быть достаточно низка [1]. Погрешность определяется величиной коэффициента вариации (CV), который равен: CV = SD/M*100%, где M – среднее арифметическое результатов измерения данной концентрации, а SD – стандартное отклонение. На уровне верхней границы нормы погрешность должна составлять не более 10%, иначе тест будет давать много ложно-положительных и ложно-отрицательных результатов.К сожалению, изложенные рекомендации далеко не всегда выполняются в реальной жизни. На официальном сайте Международной федерации по клинической химии и лабораторной медицине [https://www.ifcc.org/PDF/IFCC_Troponin_Web_Page_Table_of_Assays_Oct_2008.pdf] приведены аналитические характеристики для 19 тестов на тропонины IиTразных производителей (данные на октябрь 2008). Лишь у 12 из них предел обнаружения меньше верхней границы нормы, то есть для остальных тестов верхняя граница нормы (99-й процентиль) фактически не была установлена. С точностью измерения дело обстоит еще хуже. Даже на уровне, в два раза превышающем границу нормы, коэффициент вариации не превышает 10% лишь у восьми тестов. Таким образом, аналитическое качество – очень важная и до конца не решенная тема, на которую стоит обратить пристальное внимание.Все имеющиеся на сегодняшний день методы определения концентрации тропонина основаны на иммунохимической реакции, так называемом «сэндвич»-анализе. Качество получаемого результата зависит от правильности выбора антител. Тройной комплекс из тропонинов I,TиC, попадая из разрушенных кардиомиоцитов в кровь, распадается на свободный тропонин T и двойной комплекс из тропониновIиC. Это и есть основные формы тропонинов в крови. В крови под действием протеаз начинается отщепление концевых фрагментов молекул тропонина (рис. 3). Поэтому используемые для анализа антитела должны взаимодействовать с центральной, наиболее стабильной частью молекулы тропонина. Кроме того, тропонин I может быть в фосфорилированной/ дефосфорилированной, а также окисленной/ восстановленной формах. Связывание антител, выбранных для анализа, не должно зависеть от химической модификации молекулы тропонинаI. Помимо этого, центральная часть молекулы тропонина I – объект взаимодействия с аутоантителами, которые, блокируя связывание антител теста, могут приводить в ложно-отрицательным результатам анализа. Наличие аутоантител к тропонину I – достаточно распространенное явление. Они обнаружены у 5,5 % людей без признаков сердечно-сосудистых заболеваний и у 21 % больных с острым коронарным синдромом [6]. Попытки производителей преодолеть указанные трудности и подобрать наилучшее сочетание антител для анализа приводят к использованию антител к разным эпитопам. В результате использования производителями разных наборов антител в иммунохимической реакции и отсутствия четкой стандартизации концентрации биомаркеров, измеренные на разных анализаторах, часто не совпадают. При практически идеальной корреляции величин, полученных наилучшими методами измерения, абсолютная величина концентрации может различаться на порядок. Поэтому прямое сравнение абсолютных значений невозможно, а границы нормы должны быть определены отдельно для каждого анализатора. И хотя клиническая интерпретация результатов с учетом соответствующих референтных диапазонов в целом совпадает для всех тестов, эта ситуация создает очевидное неудобство. Здесь необходим вдумчивый клинико-лабораторный консилиум для выработки общих правил оценки результатов, полученных, например, на портативных анализаторах у постели больного и в центральной лаборатории, для каждой конкретной больницы. В диагностике и лечении инфаркта миокарда критическую роль играет время. Реперфузия, начатая в течение первого часа после начала инфаркта миокарда, сопровождалась 1% летальностью, тогда как то же лечение, начатое через 6 и более часов, приводило к 10% летальности [11]. По общему мнению клиницистов и врачей-лаборантов, время до получения ответа из лаборатории о концентрации сердечных биомаркеров в пробе крови не должно превышать 60 мин [7].В действительности мало где круглосуточно обеспечивается такая скорость выполнения анализов. Поэтому Национальной академией клинической биохимии (США) даны следующие четкие рекомендации [8]: · Лаборатория должна измерить сердечные биомаркеры в течение 1 часа, лучше — за 30 и менее минут. Время рассчитывается от забора пробы до сообщения результата. · Учреждения, неспособные постоянно обеспечить получение результатов измерения сердечных биомаркеров примерно за 1 час, должны использовать анализаторы у постели больного. Приближение анализаторов к больному, то есть перемещение их из лаборатории в клинические отделения, несет с собой новые проблемы. Прежде всего, необходимо обеспечить максимальную простоту работы при минимальной потребности в обслуживании. Анализатор будет использовать персонал клинического отделения, не имеющий специального лабораторного образования. Следует учитывать и текучесть кадров, часто препятствующую своевременной дополнительной подготовке персонала. При этом необходимо обеспечить лабораторное качество анализа (высокую чувствительность и точность измерения) и достаточную производительность. Оптимальной схемой считается сохранение контроля лабораторных специалистов за всеми приборами, расположенными в отделениях. Подключение анализатора к внутрибольничной информационной системе, обеспечивающей возможность удаленного доступа с лабораторного компьютерного терминала, значительно облегчает такой контроль. Примером анализатора, наиболее полно соответствующего всем указанным требованиям, служит новый иммунофлюоресцентный анализатор AQT90FLEX производства (Дания), показанный на обложке этого журнала. Это достаточно компактный настольный прибор, способный измерять все указанные биомаркеры некроза миокарда (тропонин I, креатинкиназу MB, миоглобин). Уже на будущий год к ним присоединится и тропонинT. Кроме того, можно измерить биомаркеры сердечной недостаточности (NT-proBNP), активации системы свертывания (D-димер), воспаления (СРБ) и беременности (β-субъединицу человеческого гонадотропина). Оператор может свободно выбрать необходимые параметры, измерение которых идет параллельно. Важно, что не требуется никакой предварительной обработки пробы крови. Для измерения нужно лишь вставить закрытую стандартную вакуумную пробирку с пробой в анализатор, выбрать параметры и получить результат и закрытую же пробирку. Контакт с кровью или отходами в процессе анализа исключен. Все процессы максимально автоматизированы, есть возможность подключения анализатора к информационным системам. Все это позволяет легко использовать анализатор для экспресс-диагностики непосредственно в отделении. В то же время, результат измерения соответствует самым высоким лабораторным стандартам. Врачам не придется больше уточнять диагноз, посылая пробу в центральную лабораторию. В таблице 2 приведены данные по аналитическому качеству измерения основных биомаркеров некроза миокарда. Таблица 2. Аналитическое качество измерения анализатора AQT90FLEX.
| Параметр | Предел обнаружения | Граница нормы (99-й процентиль) | 10 % CV | Диапазон |
| Тропонин I | 0,0095 мкг/л | ≤ 0,023 мкг/л | 0,039 мкг/л | 0,010-50 мкг/л |
| Креатинкина MB | 0,53 мкг/л | ≤ 7,2 мкг/л | < 5мкг/л | 2-500 мкг/л |
Результаты измерения тропонина на AQT90 FLEX практически идеально коррелируют с результатами лабораторного анализатора TnI-Ultra ADVIA Centaur (Siemens) и коэффициент корреляции R2 = 0,984. Таким образом, современные требования к лабораторной диагностике инфаркта миокарда сводятся к быстрому и точному определению биомаркеров (предпочтительно тропонина). Для этого помимо лабораторных необходимы и внелабораторные анализаторы, которые бы были просты в обращении и давали бы количественный результат, сопоставимый по точности с данными лаборатории. Применение подобных анализаторов непосредственно в отделениях скорой помощи и отделениях реанимации позволит повысить качество медицинской помощи в неотложных ситуациях. Список литературы 1. Apple FS, Jesse RL, Newby LK, Wu AH, Christenson RH. National Academy of Clinical Biochemistry and IFCC Committee for Standardization of Markers of Cardiac Damage Laboratory Medicine Practice Guidelines: Analytical issues for biochemical markers of acute coronary syndromes. Circulation. 2007 Apr 3;115(13): e352-5. 2. Apple FS, Quist HE, Doyle PJ, Otto AP, Murakami MM. Plasma 99th percentile reference limits for cardiac troponin and creatine kinase MB mass for use with European Society of Cardiology/American College of Cardiology consensus recommendations. Clin Chem. 2003 Aug;49(8): 1331-6. 3. Cardiovascular biomarkers : pathophysiology and disease management (edited by David A. Morrow).2006 Humana Press Inc. p.6. 4. Criteria for Evaluation of Novel Markers of Cardiovascular Risk. A Scientific Statement From the American Heart Association. Circulation. 2009; 119: 2408-2416. 5. Karmen A, Wroblewski F, LaDue JS. Transaminase activity in human blood. J Clin Invest 1954;34:126–133. 6. Kim Pettersson, Susann Eriksson, Saara Wittfooth, Emilia Engström, Markku Nieminen and Juha Sinisalo. Autoantibodies to Cardiac Troponin Associate with Higher Initial Concentrations and Longer Release of Troponin I in Acute Coronary Syndrome Patients. Clinical Chemistry. 2009;55:938-945. 7. Morrow DA, Cannon CP, Jesse RL, Newby LK, Ravkilde J, Storrow AB, Wu AH, Christenson RH, Apple FS, Francis G, Tang W. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines: Clinical characteristics and utilization of biochemical markers in acute coronary syndromes. Clin Chem. 2007 Apr; 53(4): 552-74. 8. National Academy of Clinical Biochemistry: Laboratory Medicine Practice Guidelines: Evidence-Based Practice for Point-of-Care Testing. (Editor James H. Nichols) AACCPress. 2006. 9. Panteghini M, Gerhardt W, Apple FS, Dati F, Ravkilde J, Wu AH. Quality specifications for cardiac troponin assays. Clin Chem Lab Med. 2001 Feb;39(2):175-9. 10. Romero-Herrera, A. E.; Castillo, O.; Lehmann, H. : Human skeletal muscle proteins: the primary structure of troponin C. J. Molec. Evol. 8: 251-270, 1976. 11. Rosalki SB, Roberts R, Katus HA, Giannitsis E, Ladenson JH, Apple FS. Cardiac biomarkers for detection of myocardial infarction: perspectives from past to present. Clin Chem. 2004 Nov;50(11): 2205-13. 12. Thygesen K, Alpert JS, White HD on behalf of Joint ESC/ACCF/AHA/WHF Task Force for the Redefinition of Myocardial Infarction. Universal definition of myocardial infarction. Circulation. 2007 Nov 27; 116(22): 2634-53.
Рисунок 1. Рост уровня маркеров в крови при инфаркте миокарда [7].
Рисунок 2. Предел обнаружения у хорошего (1) и недостаточно чувствительного теста (2) по отношению к истинной границе нормы для концентрации тропонина I.
Рисунок 3. Факторы, влияющие на выбор антител для определения тропонина I.
Новости все
06.07.2021 Х Балтийский форум » Актуальные проблемы анестезиологии и реаниматологии» 30 июня — 3 июля 2021
03.06.2021 Состоялась 7я Конференция «Лабораторная диагностика неотложных состояний 2021»
11.05.2021 Конференция «Лабораторная диагностика неотложных состояний 2021 г.» 3 июня, Новотель, Санкт-Петербург
22.01.2021 Семинар для руководителей ветеринарных клиник
09.04.2020 Производители и поставщики призвали упростить регистрацию медизделий
Журнал «Медицина неотложных состояний» 7-8 (38-39) 2011
Болезни системы кровообращения занимают ведущее место в структуре заболеваемости и общей смертности населения большинства стран мира и Украины в частности. Основной причиной кардиальной смерти являются острые коронарные синдромы, острая сердечная недостаточность, тромбоэмболии и жизнеугрожающие нарушения ритма сердца. Правильная и ранняя диагностика острых состояний позволяет своевременно назначить лечение, а определение вероятности развития осложнений — обеспечить индивидуальный подход к терапии. Большую помощь в реализации такого подхода оказывают биологические маркеры (биомаркеры). Под термином «биомаркеры» в медицине принято понимать белки крови, концентрация которых отражает наличие или выраженность того или иного патологического состояния.
Сфера применения биомаркеров при различных острых состояниях в кардиологии:
1. Острый коронарный синдром:
— диагностика острого инфаркта миокарда;
— стратификация риска;
— выбор оптимальной тактики лечения.
2. Острая сердечная недостаточность:
— идентификация пациентов с сердечной недостаточностью (скрининг);
— подтверждение степени выраженности сердечной недостаточности;
— направленный мониторинг пациентов с сердечной недостаточностью (СН);
— мониторинг терапии и ее оптимизация.
3. Тромбоэмболия легочной артерии (ТЭЛА):
— дифференциальная диагностика;
— стратификация риска.
При остром коронарном синдроме (ОКС) биомаркеры в первую очередь применяют для диагностики повреждения миокарда. В настоящее время используется целый ряд маркеров, что обусловлено характерными для каждого из них уровнями кардиоспецифичности и особенностями попадания в кровь после повреждения кардиомиоцитов, определяющими различия во времени достижения диагностического и пикового значений, длительность циркуляции маркера (рис. 1).
Миоглобин. Сложный белок мышц, связывающий переносимый гемоглобином кислород с образованием оксимиоглобина и, таким образом, обеспечивающий работающую мышцу некоторым запасом кислорода, перенося его к цитохромоксидазе мышечных митохондрий (рис. 2).
Поскольку миоглобин является довольно низкомолекулярным протеином, он легко диффундирует через мембраны поврежденных мышечных клеток и быстро появляется в периферической крови при повреждении миокарда. Содержание миоглобина при инфаркте миокарда (ИМ) повышается в сыворотке крови в пределах 2 ч после возникновения симптомов. Он в неизмененном виде выводится с мочой и уже через 24 часа с момента начала заболевания исчезает из кровотока. Диагностическим уровнем для ИМ считается повышение концентрации миоглобина до 20 нг/мл/ч. Большое содержание миоглобина в скелетной мускулатуре и зависимость его концентрации от функции почек ограничивают его применение для диагностики ИМ.
Факторы, влияющие на изменение концентрации миоглобина в крови:
— острый ИМ;
— сердечно-сосудистая операция;
— повреждение скелетной мускулатуры (в том числе при приеме статинов);
— чрезмерная физическая нагрузка;
— прогрессирующие мышечные дистрофии;
— шок;
— почечная недостаточность.
Преимущества применения миоглобина: высокая чувствительность, эффективен при ранней диагностике ИМ, полезен при исключении инфаркта миокарда, может быть маркером реперфузии. Недостатки: низкая специфичность при повреждении скелетной мускулатуры, травмах, быстро возвращается к нормальным значениям, что ограничивает возможности поздней диагностики.
Клинические рекомендации: не должен использоваться как самостоятельный диагностический маркер ввиду низкой специфичности.
МБ-фракция креатинфосфокиназы (МБ-КФК) — это гетеродимер с молекулярной массой 86 кДа. Среди традиционных маркеров именно определение активности МБ-КФК до последнего времени рассматривалось в качестве золотого стандарта в биохимической диагностике ОИМ. Изоформа МБ-КФК при ОИМ появляется в сыворотке крови через 3–4 ч после начала симптомов и достигает диагностически значимого уровня к 4–6-му часу. Повышенный уровень может сохраняться до 48–72 часов. Доля МБ-КФК среди общей КФК, превышающая 5–6 %, является специфичным признаком некроза миокарда.
При использовании MБ-КФК для диагностики ИМ необходимо неоднократное, динамическое определение концентрации этого маркера в крови, так как МБ-КФК обладает низкой чувствительностью в раннем (до 6–8 ч) и позднем (после 48 ч) периодах ИМ. Эксперты Европейского кардиологического общества считают предпочтительным расчет индекса МБ-КФК: индекс МБ-КФК = (МБ-КФК х х 100)/общая КФК.
Индекс МБ-КФК выше 3–6 % на фоне подъема общей КФК подтверждает диагноз ИМ. В настоящее время МБ-КФК разделяют на две изоформы: МБ1-КФК и МБ2-КФК. В норме соотношение МБ1-КФК : МБ2-КФК = 1 : 1. Соотношение МБ1- КФК : МБ2-КФК = 1 : 1,5 — ранний маркер повреждения миокарда: пик — 2–4 ч; возвращается к норме — 18–30 ч; нормальное соотношение МБ1- КФК : МБ2-КФК через 6 ч после приступа исключает ИМ. МБ2-КФК — тканевая форма, которая, попадая в кровоток, превращается в МБ1-КФК, поэтому соотношение МБ2-КФК/МБ1-КФК больше 1,5 через 1– 2 ч после начала болевого синдрома может свидетельствовать о развитии некроза миокарда.
Преимущества исследования МБ-КФК: быстрое, дешевое, доступное и точное определение, возможность диагностики раннего реинфаркта.
Недостатки: низкая специфичность при повреждении скелетной мускулатуры, травмах, после хирургических вмешательств, низкая чувствительность в ранние (< 6 часов) или поздние (> 36 часов) сроки от развития симптомов острого ИМ; низкая чувствительность при минимальном повреждении миокарда (положительный тест тропонина).
Клинические рекомендации: является стандартом в прошлом и в настоящее время; приемлем для большинства клинических ситуаций. Наибольшее значение имеет для диагностики реинфарктов.
Тропонины Т и I. Основная структурная сократительная единица миоцита — саркомер, который образуют упорядоченно расположенные толстые и тонкие волокна. Тонкие содержат волокна актина и тропонин-тропомиозиновый комплекс. Тропониновый регуляторный комплекс в поперечнополосатых мышцах состоит из трех полипептидов; при диагностике инфаркта миокарда определяют в крови содержание только тропонина Т и тропонина I (рис. 3).
Для экстренной диагностики инфаркта миокарда на догоспитальном этапе наиболее подходит качественный иммунологический тест для определения содержания в крови специфического миокардиального белка тропонина Т. При инфаркте миокарда наблюдаются два пика повышения его концентрации в крови. Первый начинается через 2–3 ч, достигает максимума через 8–10 ч, второй начинается через трое суток. Нормализация концентрации тропонина Т в крови при ОИМ происходит через 10–14 суток. Чувствительность теста через 3 ч — примерно 60 %, через 10 ч приближается к 100 %, специфичность близка к 100 %. С помощью этого метода удается диагностировать инфаркты миокарда с зубцом Q, а также он используется для дифференциальной диагностики инфаркта миокарда без зубца Q и острого коронарного синдрома без повреждения миокарда — нестабильной стенокардии.
Новой проблемой в диагностике поражения миокарда при острых коронарных синдромах стали ультрачувствительные тропонины. Благодаря применению новых подходов (рекомбинантные белки, нанотехнологии) нижний уровень определения кардиальных тропонинов снижен в 10–100 раз. Разработчики таких тестов называют их или ультрачувствительными (ultra sensitive), или высокочувствительными (highly sensitive). Что «чувствуют» ультрачувствительные тесты? Молекулы тропонинов, «вытекающие» из нормального миокарда? Повреждения кардиомиоцитов, связанные только с ишемией? Или начало мионекроза?
Повышенный ультрачувствительный тропонин — показатель ишемии? Повышение уровня hs-cTnI > 1,3 пг/мл — это независимый предиктор ишемии.
У 195 лиц с подозрением на ИБС вызывали экспериментальную ишемию, которую контролировали с помощью однофотонной эмиссионной компьютерной томографии. Уровни hs-TnT определяли перед стрессом, затем через 18 мин, через 4 и 24 ч. Показано, что повышение hs-TnT — это скорее следствие необратимой смерти миоцитов, нежели результат обратимой миокардиальной ишемии, наступающей после физических упражнений или после фармакологического воздействия.
Среди 50 больных с установленным ИМ без подъема ST-сегмента и с отрицательными результатами стандартных cTnI-тестов 86 и 100 % лиц имели положительный us-cTnI-тест в 0 и 2 ч после начала болевого синдрома соответственно. У лиц без ОКС и без ИМ результаты обоих тестов были отрицательными. Таким образом, us-cTnI обнаруживает повреждения миокарда у большинства пациентов, у которых, согласно текущей классификации, диагностируется нефротический синдром (НС). Это, по мнению авторов, свидетельствует о том, что ишемическая загрудинная боль без повреждения миокарда — событие довольно редкое. Более чувствительный cTn-тест повысит количество положительных результатов и позволит раннюю диагностику кардиальных нарушений, хотя и будет выявлять патологии, не связанные с ОКС. Применение ультрачувствительных тестов на тропонины повышает количество как истинноположительных, так и ложноположительных результатов при диагностике ОИМ.
Повышенный ультрачувствительный тропонин — маркер мионекроза? Для подтверждения или исключения ОИМ следует проводить серийное определение ultra cTnI, при этом его повышение на 46 % или снижение на 32 % является основанием для интерпретации результатов.
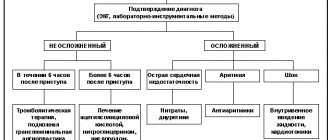
Рекомендации для использования биохимических маркеров для диагностики инфаркта миокарда
Класс I
1. Биомаркеры некроза миокарда должны быть измерены всем больным, госпитализированным с симптомами острого коронарного синдрома (уровень обоснованности C).
2. Клинические признаки (история заболевания, данные осмотра) и ЭКГ должны быть использованы вместе с биомаркерами в диагностическом обследовании при подозрении на ИМ (уровень обоснованности C).
3. Сердечный тропонин является предпочтительным маркером в диагностике ИМ. Измерение массы МБ-КФК является приемлемой альтернативой, если тропонин недоступен (уровень обоснованности A).
4. Кровь для анализа должна браться при поступлении и серийно в последующее время в зависимости от клинической ситуации. Для большинства больных — при поступлении и 6–9 часов спустя (уровень обоснованности C).
5. При наличии клинической картины, свидетельствующей в пользу острого коронарного синдрома, полученные в дальнейшем результаты считаются диагностическими в отношении некроза, сопровождающего ИМ, если (уровень обоснованности C):
а) максимальная концентрация сердечного тропонина превышает 99-й перцентиль значения в эталонной контрольной группе хотя бы однократно в течение 24 часов после клинического события (наблюдение повышения и снижения уровня полезно при установлении времени возникновения повреждения);
б) максимальная концентрация MБ-КФК — 99-й перцентиль значения в эталонной контрольной группе, адаптированной по полу больных, в двух последовательно взятых образцах (значение MБ-КФК должно повышаться и снижаться).
Класс IIb
1. У больных, госпитализированных в первые 6 часов после начала симптомов, в добавление к сердечному тропонину может быть рассмотрено использование раннего маркера некроза миокарда. Миоглобин является наиболее изученным маркером из применяющихся с этой целью (уровень обоснованности B).
2. Раннее выявление инфаркта миокарда с помощью частого взятия крови для определения маркеров некроза может быть приемлемо, если связано с лечебной стратегией (уровень обоснованности C).
Класс III
1. Общая КФК, аспатратаминотрансфераза (АсАТ), дигидроксибутиратдегидрогеназа и/или лактатдегидрогеназа не должны применяться как биомаркеры при диагностике ИМ (уровень обоснованности C).
2. У больных с диагностическими изменениями ЭКГ (например, с подъемами сегмента ST) принятие решения о диагнозе и лечении не должно откладываться из-за ожидания результатов определения биомаркеров (уровень обоснованности C).
Однако уже в настоящее время существуют и даже активно используются новые биомаркеры поражения миокарда, для некоторых даже созданы экспресс-диагностические полоски. Новые маркеры в своем большинстве являются специфичными и быстро проявляющимися маркерами поражения кардиомиоцитов: MLC-I — легкая цепь миозина I (myosin light chain I), DNAse1 — дезоксирибонуклеаза-1, S100A1 — кардиальный сенсорный белок, зависимый от кальция (cardiac-specific Ca2+-sensor protein), H-FABP — кардиальный белок, связывающий свободные жирные кислоты (heart-type fatty-acid binding protein), GP-BB — гликогенфосфорилаза BB, карбоангидраза III.
Новые биомаркеры: диагностика повреждения миокарда
Кардиальная форма белка, связывающего жирные кислоты. В последнее время внимание исследователей обращено на кардиальную форму белка, связывающего жирные кислоты (БСЖК). Впервые предложение использовать БСЖК в качестве раннего маркера ИМ было высказано J. Glatz в 1988 г. БСЖК по последовательности аминокислот идентичен БСЖК, содержащемуся в поперечнополосатой мышечной ткани, однако представлен в скелетной мускулатуре в минимальном количестве. Максимальное количество БСЖК находится в миокарде — 0,5 мг/г ткани. Специфичность БСЖК не абсолютна, небольшое его количество имеется и вне миокарда, в частности в скелетной мускулатуре, а особенно в диафрагме. БСЖК содержится также в тканях аорты, и можно предположить, что при расслаивающей аневризме аорты содержание его в крови повышается. В крови здоровых людей циркулирует небольшое количество БСЖК; у женщин уровень БСЖК статистически значимо ниже, чем у мужчин (0,7 против 1,2 мкг/л), что, по-видимому, связано с различием в мышечной массе. Кинетика содержания БСЖК в крови больных ИМ сходна с кинетикой миоглобина. Его содержание при ИМ повышается в течение первых 3 ч после появления симптомов и возвращается к нормальному значению через 12–14 часов. Несмотря на то что уровень БСЖК в миокарде меньше, чем миоглобина (0,5 против 2,5 мг/кг), минимальная определяемая концентрация БСЖК в 15 раз ниже, чем миоглобина (2 против 32 мкг/л). Этим обусловлена большая чувствительность БСЖК по сравнению с миоглобином при выявлении некроза миокарда. По данным F. Ghani и соавт., чувствительность БСЖК в диагностике ИМ составила 39 %, специфичность — 95 %, при этом чувствительность миоглобина не превышала 28 %. Однако БСЖК еще недостаточно изучен в отдельных клинических ситуациях.
Ca2+-АТФаза саркоплазматического ретикулума. В 2009 г. L. Ciobanu создана тест-система ELISA для определения Ca2+-АТФазы саркоплазматического ретикулума (СР) в качестве маркера ОИМ. При исследовании с использованием новой диагностической системы 56 больных с ОИМ, подтвержденным повышением тропонина I и МБ-КФК, повышение уровня Ca2+-АТФазы СР было выявлено у всех пациентов. Увеличение концентрации этого маркера начиналось примерно через 4–6 ч после появления симптомов, а нормализация происходила в течение 6 суток. Титр Ca2+-АТФазы СР коррелировал с массой пораженного миокарда, степенью подъема сегмента ST и наличием у больного факторов риска сердечно-сосудистого осложнения.
Легкие цепи миозина. Миозин является частью саркомера — основной составляющей контрактильного аппарата скелетной и сердечной мышцы. Молекула миозина гетерополимерна и состоит из 2 тяжелых и 2 легких цепей (рис. 6). Существуют 2 типа легких цепей миозина (ЛЦМ): ЛЦМ-1 (молекулярная масса 27 кДа) и ЛЦМ-2 (молекулярная масса 20 кДа).
Физиологическая роль ЛЦМ состоит в осуществлении взаимодействия между актином и миозином. ЛЦМ-1 появляется в крови через 3–6 ч после развития приступа болей, его высокие концентрации сохраняются в течение 4 дней, а повышенный уровень ЛЦМ-1 отмечается до 10–14 дней. Тяжесть клинических проявлений, прогноз заболевания и размер зоны инфаркта коррелируют с уровнем ЛЦМ-1 в крови. Изменение концентрации ЛЦМ-1 также коррелирует с тяжестью сердечной недостаточности и позволяет выделять группу риска среди больных с НС.
Карбоангидраза III. Растворимый белок в больших количествах определяется только в скелетной мускулатуре (мышечные волокна I типа), в небольшом количестве — в гладкой мускулатуре и миоэпителиальных клетках. Повышение уровня карбоангидразы III отмечается при нейромышечных заболеваниях и после значительной физической нагрузки. Уровень карбоангидразы III в плазме тесно коррелирует с выбросом миоглобина из скелетных мышц, а благодаря тому, что концентрация карбоангидразы III не отражает повреждения миокарда, отношение миоглобин/карбоангидраза III может использоваться для разграничения причин повышения уровня миоглобина в крови.
Гликогенфосфорилаза ВВ. Гликогенфосфорилаза катализирует расщепление гликогена в саркоплазматической сети. Она представляет собой димерный фермент с молекулярной массой 18,8 кДа (рис. 7).
Существуют 3 изомера гликогенфосфорилазы: ВВ, содержащийся в мозге и сердце, ММ — в скелетной мускулатуре, LL — в печени. В результате метаболизма гликогена в ишемизированной ткани гликогенфосфорилаза ВВ переходит из саркоплазматической сети в цитоплазму, а затем в кровь через поврежденную клеточную мембрану. Повышение концентрации гликогенфосфорилазы ВВ наблюдается через 2–4 ч после повреждения миокарда, а возвращение к норме — спустя 36 ч. В исследовании J. Mair (1998 г.) продемонстрирована высокая информативность этого маркера в диагностике повреждений миокарда после операций реваскуляризации миокарда. Ограничением использования гликогенфосфорилазы ВВ в клинической практике является отсутствие коммерческих наборов для ее определения.
Стратификация риска и выбор оптимальной тактики лечения
При стратификации риска осложнений у больных с ОКС наиболее часто используются маркеры поражения миокарда — тропонины, сердечной недостаточности — proBNP и показатели системного воспалительного процесса, наиболее адекватным и чувствительным является С-реактивный белок (ЦРБ) и его высокочувствительный компонент.
Эффективность в стратификации риска больных с ОКС по маркеру поражения миокарда была доказана во множестве исследований. Наиболее доказанным и подтверждающим свою прогностическую значимость является тест тропонина (рис. 8).
Следующим биомаркером, также эффективно предсказывающим осложненное течение ОКС, является один из лучших показателей активности воспалительного процесса в организме — ЦРБ. С-реактивный белок (англ. C-reactive protein — CRP) — белок плазмы крови, относящийся к группе белков острой фазы, концентрация которых повышается при воспалении. Играет защитную роль, связывая бактериальный полисахарид Streptococcus pneumoniae. С-реактивный белок используется в клинической диагностике наряду со скоростью оседания эритроцитов (СОЭ) как индикатор воспаления.
Предсказательную точность данного биомаркера показали во множестве исследований. Нашим исследованием была показана предсказательная точность в зависимости от выраженности повышения показателя ЦРБ. Разделяя уровни повышения ЦРБ на тертили, было показано достоверное влияние не только повышения ЦРБ на прогноз течения ОКС.
Многомаркерный подход к стратификации риска
Наиболее качественным и точным в определении вероятности развития осложнений при ОКС был многомаркерный анализ. При сопоставлении нескольких маркеров, показывающих различные процессы в организме, был достигнут наиболее точный прогноз течения болезни и ее осложнений. Комбинация маркера поражения кардиомиоцитов — тропонина, показателя системного воспалительного процесса — ЦРБ и показателя наличия и выраженности сердечной недостаточности — мозгового натрийуретического пептида (МНП, или BNP) оказалась наиболее точным предсказателем осложнений течения ОКС. В исследованиях OPUS-TIMI 16 и TACTICS-TIMI 18 у больных с ОКС регистрировали повышение уровня трех диагностических биомаркеров: тропонина I, ЦРБ и МНП. По данным исследований, при повышении только одного биомаркера 30-дневная летальность повышалась в два раза, если же все три биомаркера были повышены, то риск развития смерти в течение месяца после развития ОКС вырастал в 6 или до 13 раз. Результат исследований показал высокую прогностическую ценность многомаркерного подхода в стратификации риска неблагоприятного течения при ОКС (рис. 11).
В других исследованиях оценивалось большое количество биомаркеров. У 664 пациентов, поступивших в отделения неотложной терапии с ОКС, была проведена оценка прогностической значимости следующих маркеров: cTnT, H-FABP (БСЖК), гликогенфосфорилазы ВВ, NT-proBNP, фибриногена и D-димера, hsCRP, МПО (миелопероксидаза), ММП-9 (матриксная металлопротеиназа-9), PAPP-A, или ПБАБ-А (плазменный белок А, ассоциированный с беременностью), sCD40L (растворимый фрагмент мембранного гликопротеина CD40L). По данным исследования, наилучшей прогностической способностью обладала панель cTnT, БСЖК и NT-proBNP.
NT-proBNP, ЛП-ФЛА2, холин в цельной крови. Еще в одном исследовании наблюдали 432 пациента, также поступивших в отделение неотложной терапии с ОКС. Оценивали прогностическую значимость cTnI, наилучшей прогностической способностью обладала панель cTnT, БСЖК и NT-proBNP, hsCRP, PlGF, или ПлФР (плацентарный фактор роста), ЛП-ФЛА2 (липопротеин-ассоциированная фосфолипаза А2).
D-димер, холин в цельной крови, холин в плазме. Наилучшая комбинация: NT-proBNP, холин в цельной крови и ЛП-ФЛА2.
Стратификация рисков при острой сердечной недостаточности
Цистатин С, сTnT, NT-proBNP. Эффективно предсказывают риск неблагоприятных исходов при острой сердечной недостаточности. 138 пациентов.
Стратификация рисков при острой декомпенсированной хронической сердечной недостаточности
BNP, cTnI, hs-CRP. 577 пациентов. Чем выше уровни указанных маркеров, тем выше риск 30-дневной летальности.
Плазменные уровни B-типа натрийуретического пептида для лечения пациентов с хронической сердечной недостаточностью использовались в ряде рандомизированных контролируемых исследований. Тем не менее преимущества этого лечения были неопределенными. Поэтому был проведен метаанализ, изучающий общий эффект влияния изменения BNP под действием лекарственной терапии на сердечно-сосудистые события у пациентов с хронической СН.
Результаты восьми рандомизированных контролируемых исследований с общим количеством 1726 пациентов и средней продолжительностью 16 месяцев были включены в метаанализ. Отмечен более низкий риск смертности от всех причин (относительный риск (ОР) 0,76; 95% доверительный интервал (ДИ) 0,63–0,91; P = 0,003) в группе терапии под контролем BNP по сравнению с основной группой. В подгруппе пациентов моложе 75 лет смертность от всех причин была также значительно ниже в группе BNP (ОР 0,52; 95% ДИ 0,33–0,82; P = 0,005). Однако не было сокращения смертности у пациентов 75 лет или старше (ОР 0,94; 95% ДИ 0,71–1,25; Р = 0,70). Риск госпитализации от всех причин и выживание без каких-либо госпитализаций незначительно отличаются между группами (ОР 0,82; 95% ДИ 0,64–1,05; Р = 0,12 и ОР 1,07; 95% ДИ 0,85–1,34; P = 0,58 соответственно). Дополнительный процент пациентов, достигших целевых доз ингибиторов ангиотензинпревращающего фермента и b-блокатора в ходе этих исследований, составил в среднем 21 и 22 % в группе BNP и 11,7 и 12,5 % в основной группе соответственно.
Выводы свидетельствуют, что терапия, осуществляемая под контролем В-типа натрийуретического пептида, снижает смертность от всех причин у пациентов с хронической СН по сравнению с обычным лечением, особенно у пациентов моложе 75 лет (рис. 12).
Тромбоэмболия легочной артерии
У большинства больных с венозным тромбозом наблюдается эндогенный фибринолиз, который вызывает разрушение определенного количества фибрина с образованием продукта распада перекрестно связанного фибрина — D-димера.
Увеличение концентрации D-димера более 500 мкг/л свидетельствует о спонтанной активации фибринолитической системы крови в ответ на массивное тромбообразование в бассейне венозной системы. Этот показатель характеризуется высокой чувствительностью (95–96 %) и отрицательной предсказательной ценностью (95–99 %), однако низкой специфичностью (около 40–50 %).
В настоящее время D-димер является основополагающим биомаркером и включен во все схемы дифференциальной диагностики тромбоэмболии легочной артерии (рис. 13). D-димер применяется при диагностике ТЭЛА мелких ветвей и реже — субмассивной эмболии. Однако там, где недоступно проведение компьютерной томографии, определение D-димера может использоваться для исключения ТЭЛА, так как отрицательный тест категорически исключает развитие ТЭЛА, а позитивный предполагает дальнейшее обследование пациента с подозрением на ТЭЛА, потому что повышение его уровня может наблюдаться и при других тромботических состояниях (сепсис, острый инфаркт миокарда, злокачественные новообразования, воспаление, после оперативных вмешательств и др.).
При обследовании больных ТЭЛА с целью выявления группы высокого риска необходимо определять уровни тропонина (Тn) или белка, связывающего жирные кислоты, и мозгового натрийуретического пептида (ВNP). Вследствие ишемии миокарда ПЖ в крови определяется повышение уровней ТnІ и TnТ, которые являются чувствительными маркерами необратимо поврежденных кардиомиоцитов. Повышение уровня Тn тесно коррелирует с выраженностью дисфункции ПЖ, увеличением летальности, осложнений и рецидивов ТЭЛА. Другим важным маркером неблагоприятного прогноза является мозговой натрийуретический пептид (ВNP). В ответ на перерастяжение кардиомиоцитов ПЖ, вследствие его перегрузки и дилатации, уже через несколько часов в миокарде ПЖ начинает вырабатываться прогормон ВNP (proВNP), который индуцирует появление биологически активного ВNP и конечной части proВNP (NТ-proВNP). Повышение в крови уровня этих биомаркеров является предиктором дисфункции ПЖ, развития правожелудочковой недостаточности и увеличения летальности.
Таким образом, достаточно ярко видны необходимость и распространенность применения биомаркеров различных патологических процессов, происходящих в организме при кардиологических заболеваниях. Мы видим, насколько велик вклад исследования биомаркеров в диагностику и стратификацию риска развития осложнений у наших пациентов, что ведет к коррекции терапии, применению более агрессивных методов лечения. Биомаркеры в кардиологии играют огромную роль в определении как тактики, так и стратегии лечения данного конкретного больного. Правильное использование биомаркеров в медицине не только спасает врача от ошибок в диагностике какого-либо заболевания, но и ведет к правильному отношению к отдельно взятому больному для правильного выбора групп препаратов, необходимых пациенту, предотвращения осложнений заболевания и достаточно агрессивного лечения, чтобы не навредить, а помочь больному.