Центральное аортальное давление и жесткость сосудов: актуальность в современной кардиологии
Рост сердечно-сосудистых заболеваний, наблюдающийся во всех развитых странах мира, требует пристального внимания к вопросам профилактики и эффективного лечения заболеваний сердца и сосудов.
Данные исследований свидетельствуют, что артериальной гипертензией страдают около 65 млн американцев в возрасте 18–39 лет и 1 млрд людей во всем мире. Артериальная гипертензия (АГ) является фактором риска развития и прогрессирования атеросклероза, ишемической болезни сердца, хронической сердечной недостаточности и острых нарушений мозгового кровообращения. Изменения сосудов эластического типа (аорта, легочная артерия и отходящие от них крупные артерии) являются важным звеном патогенеза при АГ. В норме эластические свойства указанных сосудов, особенно аорты, способствуют сглаживанию периодических волн крови, производимых левым желудочком в период систолы и их преобразованию в непрерывный периферический кровоток. Эластические свойства аорты модулируют функцию левого желудочка, уменьшая посленагрузку на него и его конечный систолический и диастолический объемы. Это ведет к уменьшению напряжения стенок левого желудочка, в результате чего улучшается трофика наиболее чувствительных к гипоксии субэндокардиальных слоев миокарда и улучшается коронарный кровоток. Одной из значимых характеристик сосудов эластического типа является жесткость, которая определяет способность артериальной стенки к сопротивлению деформации. Жесткость сосудистой стенки зависит от возраста, выраженности атеросклеротических изменений, скорости и степени возрастной инволюции важнейших структурных белков эластина и фибулина, возрастного повышения жесткости коллагена, генетически обусловленных особенностей эластиновых волокон и от уровня артериального давления (АД). В ряде исследований подчеркивается роль воспаления в патогенезе жесткости крупных артерий. Классическим маркером артериальной жесткости/эластичности крупных сосудов является скорость пульсовой волны (СПВ). Величина этого показателя в значительной степени зависит от отношения толщины стенки сосудов к радиусу просвета сосуда и эластичности стенки сосуда. Чем растяжимее сосуд, тем медленнее распространяется и быстрее ослабевает пульсовая волна и наоборот – чем ригиднее и толще сосуд и меньше его радиус, тем выше СПВ. В норме СПВ в аорте равна 4–6 м/с, в менее эластичных артериях мышечного типа, в частности лучевой, – 8–12 м/с. «Золотым стандартом» оценки ригидности аорты считается СПВ между сонной и бедренной артерией.
Центральное (аортальное) и периферическое артериальное давление
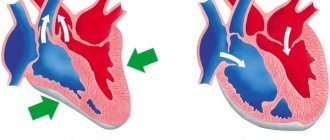
В нормальной артериальной системе после сокращения желудочка в систолу пульсовая волна направляется из места возникновения (аорта) в крупные средние, а затем мелкие сосуды с определенной скоростью. По пути прохождения пульсовая волна встречается с разными препятствиями (например, бифуркации, резистивные сосуды, стенозы), приводящими к появлению отраженных пульсовых волн, направляющихся к аорте. При достаточной эластичности крупных сосудов, прежде всего аорты, отраженная волна абсорбируется. Сумма прямой и отраженных пульсовых волн отличается на разных сосудах, в результате АД, в первую очередь – систолическое АД (САД), отличается в различных магистральных сосудах и не совпадает с измеренным на плече. Степень увеличения САД в периферических артериях относительно САД в аорте сильно варьирует у разных субъектов и определяется модулем эластичности изучаемых артерий и удаленностью места измерения. В силу этого манжеточное давление в плечевой артерии далеко не всегда соответствует давлению в нисходящей аорте. Определенный вклад в повышение АД в плечевой артерии относительно АД в аорте вносит повышение жесткости ее стенки, значит – необходимость создания большей компрессии в манжете. В отличие от периферического АД, уровень центрального АД модулируется эластическими характеристиками крупных артерий, а также структурно-функциональным состоянием артерий среднего калибра и микроциркуляторного русла и, таким образом, является показателем, косвенно отражающим состояние всего сердечно-сосудистого русла. Наибольшее прогностическое значение имеет АД в восходящей и центральной частях аорты, или центральное АД. В случае увеличения жесткости (снижении эластичности) аорты отраженная волна не абсорбируется в достаточной мере и, как правило, в связи с более высокой СПВ возвращается в период систолы, что приводит к увеличению центрального САД. Последствием усилившейся ригидности и повышения центрального АД является изменение посленагрузки на левый желудочек и нарушение коронарной перфузии, что приводит к гипертрофии левого желудочка, повышению потребности миокарда в кислороде.
В последние годы появились специальные методики (например, аппланационная тонометрия лучевой или сонной артерий), позволяющие зафиксировать такие детерминанты пульсового давления, как пульсовая (колебания артериальной стенки от сердца к резистивным сосудам) и отраженная (колебания артериальной стенки от резистивных сосудов к сердцу) волны, и с помощью компьютерной обработки при регистрации колебаний лучевой артерии рассчитать значения центрального давления в аорте (рис. 1). В течение 10 секунд выполняется регистрация кривой давления в лучевой артерии верхней конечности с помощью аппланационного тонометра. Данные обрабатываются с помощью программного обеспечения: вычисляется усредненная форма кривой, которая принятым математическим способом трансформируется в график центральное давление в аорте (ЦДА). Компьютерная обработка полученных кривых центрального давления позволяет определить параметры ЦДА: время до первого (Т1) и второго (Т2) систолических пиков волны. Давление на первом пике/изломе (Р1) принимается за давление выброса, дальнейший прирост до второго пика (ΔР) означает отраженное давление, их сумма (максимальное давление во время систолы) – систолическое ЦДА (ЦДАс) Помимо величины центрального АД существует показатель прироста давления, индекс аугментации (усиления, AIx) выражающийся в процентах, который определяется как разница давлений между первым, ранним пиком (вызванным сердечной систолой) и вторым, поздним (появляющимся в результате отражения первой пульсовой волны) систолическим пиком, деленная на центральное пульсовое давление. Таким образом, центральное аортальное давление является расчетным параметром гемодинамики, зависящим не только от сердечного выброса, периферического сосудистого сопротивления, но и от структурно-функциональных характеристик магистральных артерий (их эластических свойств). Различия между уровнем центрального и периферического САД наиболее отчетливо выражены в молодом возрасте и снижаются у пожилых людей. Показано, что центральное АД, особенно центральное пульсовое давление, и индекс аугментации коррелируют со степенью ремоделирования крупных артерий и СПВ как классического показателя жесткости сосудистой стенки.
Артериальная жесткость как фактор кардиоваскулярного риска
Изменение механических свойств крупных артерий имеет четкую патофизиологическую связь с клиническими исходами. Результаты исследований свидетельствуют о том, что СПВ – показатель артериальной жесткости – может быть лучшим предиктором последующих сердечно-сосудистых событий по сравнению с известными факторами риска, такими как возраст, уровень АД, гиперхолестеринемия и сахарный диабет. Исследования с оценкой СПВ позволили установить, что увеличение артериальной жесткости является предиктором кардиоваскулярного риска у практически здоровых лиц, пациентов с сахарным диабетом, конечной стадией почечной недостаточности и пожилых людей. Продемонстрировано, что артериальная жесткость является предиктором смертности у больных АГ. Так, в популяционном исследовании Copenhagen County population продемонстрировано, что увеличение СПВ (>12 м/с) ассоциируется с 50% увеличением риска сердечно-сосудистых событий. Кроме того, прогностическое значение СПВ выявлено в японском исследовании с периодом наблюдения в среднем 8,2 года. Установлено, что косвенные индексы аортальной жесткости и отраженной волны, такие как центральное аортальное давление и индекс аугментации, являются независимыми предикторами сердечно-сосудистых событий и смертности. Так, в исследовании, включавшем 1272 нормотензивных и нелеченных пациента с АГ, продемонстрировано, что центральное САД было независимым предиктором сердечно-сосудистой смертности после поправки на различные факторы сердечно-сосудистого риска, включая массу миокарда левого желудочка и определение толщины комплекса «интима-медиа» при ультразвуковом исследовании сонных артерий. Более того, больные с высоким аортальным давлением имеют худший кардиоваскулярный прогноз, чем больные с более эффективным контролем центрального аортального давления.
Увеличение жесткости аорты также является независимым предиктором диастолической дисфункции у пациентов с АГ (рис. 2), а также может ограничивать толерантность к физической нагрузке при дилатационной кардиомиопатии. У пациентов с сердечной недостаточностью с сохраненной фракцией выброса левого желудочка систолическая дисфункция и артериальная жесткость появляются с возрастом и/или с прогрессией АГ. Повышенная артериальная жесткость связана с дисфункцией эндотелия и снижением биодоступности оксида азота (NO). Эндотелиальная дисфункция у пациентов с высоким кардиоваскулярным риском может объяснить, почему эти состояния ассоциируются с повышенной артериальной жесткостью на ранних стадиях до манифестации атеромы. Следовательно, препараты, такие как небиволол, увеличивающие образование NO, позволяют уменьшить жесткость крупных артерий, что, в свою очередь, может вести к снижению сердечно-сосудистого риска. Таким образом, значение артериальной ригидности, оцененной по СПВ, для риска сердечно-сосудистых исходов продемонстрировано в ряде проспективных исследований как у больных АГ, так и в общей популяции. Начиная с 2007 года, оценка СПВ на каротидно-феморальном сегменте рекомендуется в качестве дополнительного метода исследования по выявлению поражения органов-мишеней при АГ.
Авторы
А.Н. Беловол, доктор медицинских наук, профессор, член-корреспондент НАМН Украины;
И.И. Ккнязькова, доктор медицинских наук, доцент
Харьковский национальный медицинский университет
Статья предоставлена WEB-сайтом «Страна Врачей»
Кровяное давление
Почему при гипер- или гипотонии человек чувствует себя неуютно: болит голова, стучит в висках, появляется слабость и т.д.?
Кровяное давление — давление внутри кровеносных сосудов (внутри артерий — артериальное давление, внутри капилляров — капиллярное и внутри вен — венозное). Оно обеспечивает возможность продвижения крови по кровеносной системе, в результате чего осуществляются обменные процессы в тканях организма.
Величина артериального давления (АД) определяется главным образом силой сердечных сокращений, количеством крови, которое выбрасывает сердце при каждом сокращении, сопротивлением, оказываемым току крови стенками кровеносных сосудов (в особенности периферических). На величину артериального давления влияют также количество циркулирующей крови, ее вязкость, колебания давления в брюшной и грудной полостях, связанные с дыхательными движениями, и другие факторы.
Максимального уровня артериальное давление достигает во время сокращения (систолы) левого желудочка сердца. При этом из сердца выталкивается 60-70 мл крови. Такое количество крови не может пройти сразу через мелкие кровеносные сосуды (особенно капилляры), поэтому эластичная аорта растягивается, а давление в ней повышается (систолическое давление). В норме оно достигает в крупных артериях 100-140 мм рт. ст.
Во время паузы между сокращениями желудочков сердца (диастолы) стенки кровеносных сосудов (аорты и крупных артерий), будучи растянутыми, начинают сокращаться и проталкивать кровь в капилляры. Давление крови постепенно падает и к концу диастолы достигает минимальной величины (70-80 мм рт. ст. в крупных артериях). Разницу в величине систолического и диастолического давления, точнее колебания в их величинах, мы воспринимаем в виде пульсовой волны, которую называют пульсом.
Давление крови в кровеносных сосудах уменьшается по мере удаления от сердца. Так, в аорте давление составляет 140/90 мм рт.ст. (первая цифра обозначает систолическое, или верхнее, давление, а вторая — диастолическое, или нижнее). В крупных артериях давление составляет в среднем 120/75 мм рт.ст. В артериолах разница в величине систолического и диастолического давления практически отсутствует, а кровяное давление равняется около 40 мм рт.ст. В капиллярах кровяное давление снижается до 10-15 мм рт.ст. При переходе крови в венозное русло кровяное давление снижается еще больше, и в наиболее крупных венах (верхняя и нижняя полые вены) кровяное давление может быть отрицательным.
В норме величина кровяного давления зависит от индивидуальных особенностей, образа жизни, рода занятий. Величина его изменяется с возрастом, возрастает при физической нагрузке, эмоциональном напряжении и т.д. Однако у лиц, систематически занимающихся тяжелым физическим трудом, а также у спортсменов величина систолического давления может уменьшаться и составлять 100-90, а диастолического — 60 и даже 50 мм рт.ст.
Нормальное артериальное давление здорового взрослого человека составляет 100-129 (верхнее) и 70-80 (нижнее). Если давление выше этих величин, но ниже 140 (верхнее) и 90 (нижнее), его называют «нормальным повышенным». У детей величина систолического давления может быть ориентировочно высчитана по формуле 80 + 2а, где а — число лет жизни ребенка.
Несмотря на значительные колебания кровяного давления (например, в зависимости от нагрузки, эмоционального состояния и т.д.), в организме существуют сложные механизмы регуляции его уровня, стремящиеся вернуть давление к норме по окончании действия этих факторов. В ряде случаев механизмы этой регуляции нарушаются, что приводит к изменению уровня кровяного давления. Стойкое изменение кровяного давления в сторону повышения называют артериальной гипертензией (гипертонией), а в сторону понижения — артериальной гипотензией. Хотя изменение кровяного давления часто играет защитно-приспособительную роль, при отклонении его от нормы лучше проконсультироваться с врачом.
Гипертоническая болезнь (эссенциальная гипертония) составляет до 90% всех случаев хронического повышения артериального давления. В экономически развитых странах 18-20 % взрослых людей страдают гипертонической болезнью, то есть имеют повторные подъемы АД до 140/90 мм рт.ст. и выше. Ориентируются на величины так называемого «случайного» давления, измеряемого после пятиминутного отдыха, в положении сидя, трижды подряд (в расчет берутся самые низкие величины). При первом осмотре больных врач измеряет давление обязательно на обеих руках, при необходимости и на ногах.
Перейти к тонометрам — приборам, предназначенным для измерения давления.
Симптомы и течение
Гипертоническая болезнь возникает обычно в возрасте 30-60 лет, протекает хронически с периодами ухудшения и улучшения.
- Стадия I (легкая) характеризуется подъемами артериального давления в пределах 160-180/95-105 мм рт. ст. Этот уровень неустойчив, во время отдыха постепенно нормализуется. Беспокоят боль и шум в голове, плохой сон, снижение умственной работоспособности. Изредка — головокружение, кровотечения из носа.
- Стадия II (средняя) — более высокий и устойчивый уровень артериального давления (180200/105-115 мм рт. ст. в покое). Нарастают головные боли и в области сердца, головокружения. Возможны гипертонические кризы (внезапные и значительные подъемы артериального давления). Появляются признаки поражения сердца, центральной нервной системы (преходящие нарушения мозгового кровообращения, инсульты), изменения на глазном дне, снижение кровотока в почках.
- Стадия III (тяжелая) — давление достигает 200-230/115-130 мм рт. ст., самостоятельной нормализации его не бывает. Такая нагрузка на сосуды вызывает необратимые изменения в деятельности сердца (стенокардию, инфаркт миокарда, сердечную недостаточность, аритмии), мозга (инсульты, энцефалопатию), глазного дна (поражение сосудов сетчатки — ретинопатию), почек (снижение кровотока, клубочковой фильтрации, хроническую почечную недостаточность).
Распознавание проводится на основании данных систематического определения артериального давления, выявления характерных изменений на глазном дне, электрокардиограмме.
Гипертоническую болезнь необходимо отличать от вторичных артериальных гипертоний (симптоматических), возникающих при заболеваниях почек, почечных сосудов, эндокринных органов (болезнь Ицепко-Кушинга, акромегалия, первичный альдостеронизм, тиреотоксикоз), расстройствах кровообращения (атеросклероз аорты, недостаточность клапанов аорты, полная предсердно-желудочковая блокада, коарктация аорты).
Лечение
Нелекарственное: снижение массы тела, ограничение потребления поваренной соли, санаторно-курортное лечение, физиотерапевтические процедуры.
Врач назначает медикаментозное лечение, которое может включать в себя разного рода препараты снижающие АД (эналаприл, метопролол и др.), мочегонные (гипотиазид, бринальдикс, триампур и др.) и т.д. При этом подбор терапии должен проводиться сугубо индивидуально.
Итак, больному гипертонией:
Нельзя:
- Курить.
- Есть соленую, острую, жирную пищу.
- Набирать лишние килограммы.
- Злоупотреблять спиртным, особенно совмещать возлияния с приемом лекарств.
- Работать ночами, спать менее 7 часов.
- Нервничать по пустякам.
- Вести малоподвижный образ жизни
- Пропускать или прекращать прием лекарств, назначенных врачом
- Испытывать на себе лекарства, которые «помогли» соседке (брату, свату и т.д.)
Нужно:
- Бросить курить.
- Ограничить потребление соли. Сделать блюда менее пресными помогут приправы из трав.
- Есть больше зелени, фруктов, продуктов, богатых калием, и не увлекаться белковой пищей.
- Питаться регулярно, особенно если к еде приурочен прием лекарств.
- Постараться сбросить лишние килограммы.
- Уметь переключаться, не зацикливаться на неприятностях.
- Больше двигаться. Особенно полезны ходьба, плавание, занятия лечебной гимнастикой.
- Регулярно измерять артериальное давление с помощью тонометра.
- Выполнять все рекомендации врача. Особенно тщательно следует прислушиваться к тому, что касается приема препаратов.
Гипотоническая болезнь (первичная хроническая гипотензия, эссенциальная гипотония) — заболевание, связанное с нарушением функций нервной системы и нейрогормональной регуляции тонуса сосудов, сопровождающееся снижением артериального давления. Исходным фоном такого состояния является астения, связанная с психотравмирующими ситуациями, хроническими инфекциями и интоксикациями (производственные вредности, злоупотребление алкоголем), неврозы.
Симптомы и течение
Больные вялы, апатичны, их одолевает крайняя слабость и утомленность по утрам, не чувствуют бодрости даже после длительного сна; ухудшается память, человек делается рассеянным, его внимание неустойчивым, понижается работоспособность, постоянно беспокоит ощущение нехватки воздуха, нарушается потенция и половое влечение у мужчин и менструальный цикл у женщин.
Преобладает эмоциональная неустойчивость, раздражительность, повышенная чувствительность к яркому свету, громкой речи. Привычная головная боль часто связана с колебаниями атмосферного давления, обильным приемом пищи, длительным пребыванием в вертикальном положении. Она протекает по типу мигрени с тошнотой и рвотой, уменьшается после прогулки на свежем воздухе или физических упражнений, растираний височных областей уксусом, прикладывания льда или холодного полотенца на голову. Бывают головокружения, пошатывание при ходьбе, обмороки. Артериальное давление обычно слегка или умеренно снижено до 90/60-50 мм рт.ст.
Распознавание проводится на основании клинических признаков и исключении заболеваний, сопровождающихся вторичной артериальной гипотонией (болезнь Аддисона, недостаточность гипофиза, болезнь Симмондса, острые и хронические инфекции, туберкулез, язвенная болезнь и др.).
Лечение
Правильный режим труда и отдыха. Лечащий врач может назначить седативные препараты и транквилизаторы (мезатон, эфедрин), средства, возбуждающие центральную нервную систему (настойку жень-шеня, китайского лимонника, заманихи, пантокрин и др). Возможно физиотерапевтическое (ванны, массаж), санаторно-курортное лечение, лечебная физкультура.
Аневризма аорты — симптомы и лечение
Лечение аневризм аорты направлено на предотвращение её разрыва. Оно бывает консервативным и хирургическим.
Консервативное лечение
Главное предназначение консервативной терапии — это снижение артериального давления и силы сокращения сердца, а также коррекция сопутствующих заболеваний, например ишемической болезни сердца, диабета, болезней почек и т. д. [1]
Хирургическое лечение
Современные хирургические методики лечения аневризм аорты делятся на эндоваскулярные и традиционные оперативные вмешательства.
Эндоваскулярный метод — дистанционная имплантация специальных трубчатых протезов (стент-графтов) в зону поражения аорты изнутри через катетер, установленный в бедренную артерию. Этот способ лечения выполняется под местной или регионарной анестезией, он малотравматичный, малоболезненный и сокращает время пребывания в стационаре, а также снижает летальность. Все чаще и чаще в практике сосудистой хирургии при лечении аневризм грудного и брюшного отдела аорты используются малоинвазивные эндоваскулярные технологии, хотя сбрасывать со счетов открытые хирургические вмешательства пока ещё рано [4].
Большие операции при грудных аневризмах относят к одним из самых сложных в медицине. Они выполняются в специализированных кардиохирургических центрах на выключенном сердце при искусственном кровообращении. Технология проведения операции заключается в замене расширенного участка аорты на специальный трубчатый протез, который вшивается на место аневризматического мешка [5][10]. Хирург делает разрез, обеспечивая доступ к аневризме, иссекает поражённую часть и замещает её протезом. Но в некоторых случаях, например после травмы, аорту можно сшить конец в конец без использования протеза.
Аневризмы брюшной аорты с диаметром более 5,5 см у мужчин и 5,2 см у женщин обладают высоким риском разрыва, поэтому требуют немедленной консультации сосудистого хирурга для определения показаний к оперативному лечению. Оно проводится в сосудистых отделениях доступом через переднюю брюшную стенку (лапаротомия) и также имеет своей целью замену поражённого сегмента аорты на протез. В некоторых медицинских центрах освоено лапароскопическое лечение аневризм, не требующее разрезов [4][7].
При оперативном лечении таких тяжелейших заболеваний (как и при других лечебных и диагностических вмешательствах) есть вероятность осложнений. Также стоит отметить, что далеко не во всех областных, краевых и республиканских медицинских центрах есть специалисты, которые работают на открытом сердце.
Сердечно-сосудистые заболевания (ССЗ) остаются одной из ведущих причин смертности населения в большинстве экономически развитых стран по данным эпидемиологических исследований [1]. И это несмотря на то что на протяжении многих лет важнейшей целью лечения больных с ССЗ являются не симптоматические эффекты фармакотерапии, а снижение риска развития фатальных и нефатальных осложнений [1-3].
Характер течения артериальной гипертонии (АГ), лежащей в основе сердечно-сосудистого континуума, в значительной степени предопределяет индивидуальный прогноз. Это обусловливает непрерывный поиск более надежных, чем измерение артериального давления (АД) на приеме у врача, индикаторов прогноза отдаленных результатов антигипертензивной терапии (АГТ). Измерение центрального артериального давления (ЦАД) у больных АГ вызывает все больший интерес в связи с тем, что может иметь существенное значение для стратификации риска развития сердечно-сосудистых осложнений (ССО) и по-иному реагирует на антигипертензивные препараты (АГП), чем АД, измеренное на плечевой артерии (ПА) [2, 4].
В соответствии с концепцией сердечно-сосудистого континуума, помимо высокого АД, сахарный диабет (СД), гиперлипидемия также влияют на прогноз и тактику ведения больных [5, 6]. В основе полиорганных изменений лежит субклинически развивающееся повышение жесткости и снижение эластичности магистральных артерий, безусловно определяющее дальнейшее течение ССЗ [7, 8]. Таким образом, изучение структурно-функциональных свойств сосудистой стенки является многообещающим направлением современной кардиологии.
Виды ригидности артериальной стенки и методики их регистрации.
Ранее структурно-функциональное состояние артерий, в частности аорты, изучали инвазивными методами. Так, упругость артериальной стенки оценивали по изменению отношения давление/диаметр с помощью вмонтированного в катетер датчика во время катетеризации сосудов. Преимуществами описанной методики являются надежность и диагностическая точность, недостатками — сложность выполнения и высокая стоимость оборудования. По понятным причинам в последние годы все большее предпочтение отдается неинвазивным методам, таким как магнитно-резонансная томография, допплерография, объемная сфигмография [9, 10].
Современные устройства косвенной (неинвазивной) оценки структурно-функциональных свойств сосудистой стенки позволяют изучить 3 вида жесткости: системную, регионарную и локальную. Системную ригидность исследуют только на моделях кровообращения, регионарную и локальную — непосредственно на различных участках артериальной системы [11].
Методика неинвазивной регистрации системной податливости проксимальных и дистальных сегментов артериального русла основана на электрической схеме, построенной по аналогии с модифицированной моделью Windkessel. При этом жесткость определяют посредством регистрации пульсации лучевой или общей сонной артерии методом аппланационной тонометрии [12, 13]. К сожалению, в проспективных исследованиях не доказано, что определяемая этими методами системная ригидность артерии имеет независимую прогностическую ценность для развития ССЗ [14].
В настоящее время наиболее широкое распространение получило определение регионарной жесткости путем измерения скорости распространения пульсовой волны (СРПВ) при проведении сфигмографии как самой простой и воспроизводимой методики [11]. Существует 2 метода и соответственно 2 группы устройств автоматической регистрации СРПВ. Первый основан на синхронной записи 2 пульсовых волн (ПВ) давления с последующим анализом корреляции между ними [11]. В основе другого способа лежит последовательное фиксирование времени распространения ПВ при условии их синхронизации относительно одновременно регистрируемой электрокардиограммы (ЭКГ) [10, 11].
Согласно европейским и российским рекомендациям (ESH, 2007; ВНОК, 2008), измерение каротидно-феморальной СРПВ является «золотым стандартом» оценки ригидности аорты. При оценке субклинического поражения у больных АГ среднего возраста за патологическую принята СРПВ более 12 м/с [2, 11].
В последнем согласительном заключении ESH (2012) пороговой величиной рекомендовано считать аортобедренную СРПВ более 10 м/с [15]. Внесенные коррективы показателя обусловлены меньшим истинным расстоянием, которое проходит ПВ на обозначенном участке артериального русла [3, 15].
Каротидно-феморальную СРПВ измеряют методом «foot-to-foot», подразумевающим синхронную графическую запись колебаний артериальной стенки сфигмодатчиками над проекциями сонной и бедренной артерий с последующим вычислением времени, на которое запаздывает момент появления одной пульсации относительно другой [10, 11]. Японскими учеными разработана методика регистрации СРПВ на плечелодыжечном сегменте, продемонстрировавшая независимую корреляцию со скоростью ПВ в аорте [16].
Другая группа устройств для определения СРПВ включает допплеровские методы с использованием специализированных ультразвуковых приборов. Время распространения, необходимое для измерения показателя, также определяют между двумя ПВ, зарегистрированными одновременно с помощью 2 датчиков или последовательно одним датчиком с синхронизацией относительно ЭКГ [11, 17].
Локальную жесткость изучают посредством определения диаметра поверхностно и глубоко залегающих артерий в систолическую и диастолическую фазы сердечного цикла. Для оценки ригидности сонной артерии используют классические двумерные ультразвуковые системы. Локальную жесткость аорты измеряют методиками ядерно-магнитного резонанса и ультразвукового эхо-трекинга. Последний представляет собой «динамическое слежение за эхоконтрастной границей» приборами с модулями для высокоточного определения диаметра артерии [10, 11, 18].
Эксперты Европейского общества кардиологов считают, что предпочтительна регистрация артериальной волны на центральном уровне, т.е. в восходящей аорте, так как именно она отражает истинную нагрузку на левый желудочек (ЛЖ) и стенки магистральных артерий [3, 11]. При этом ПВ необходимо оценивать по 3 главным параметрам: центральному систолическому АД (САД) и пульсовому АД (ПАД), а также индексу аугментации. Это обусловлено независимым прогностическим значением перечисленных параметров при прогнозировании риска смерти от всех причин у больных с конечной стадией хронической почечной недостаточности (ХПН), ССО у пациентов, подвергавшихся чрескожному коронарному вмешательству, у лиц, страдающих АГ [19-21].
Для вычисления описанных выше показателей используют запись кровотока лучевой артерии с последующим математическим преобразованием с помощью передаточной функции. Альтернативным способом является анализ центральной волны давления с общей сонной артерии. В основе регистрации пульсовых колебаний указанных выше участков артериального русла лежит методика аппланационной тонометрии [11].
ПВ в крупных артериях складывается из 2 составляющих: прямой волны, создаваемой сокращением ЛЖ, и отраженной от бифуркации аорты. Важно подчеркнуть вклад отраженной волны в процесс адекватного функционирования артериальной системы. В условиях сохраненной эластичности артерий ПВ, отражаясь, возвращается в диастолу, сглаживает колебания АД и поддерживает адекватный уровень диастолического АД (ДАД). Такая амортизация кровотока аортой способствует минимизации работы сердца. В ригидных артериях наблюдается ранний ускоренный возврат ПВ. Присоединяясь к прямой, отраженная волна давления вносит вклад в повышение систолического давления в аорте [7].
Количественная оценка ПВ возможна посредством вычисления индекса аугментации, т.е. индекса прироста систолической волны. Данный показатель позволяет оценить относительную величину отраженной волны и рассчитывается как разница между первым и вторым систолическими пиками, выраженная в процентах от ПАД с поправкой на частоту сердечных сокращений. Он напрямую зависит от жесткости аорты и периферического сосудистого сопротивления. Индекс аугментации является относительной величиной и может быть вычислен без калибровки, в то время как центральное ПАД и САД — абсолютные величины, требуют проведения калибровки для их определения.
Проводящие артерии гетерогенны по своей структуре: эластичность проксимальных сосудов постепенно снижается по мере перехода их в дистальные. Соответственно варьирует СРПВ: нарастает от центра к периферии. Так, в восходящей части аорты она составляет 4-5 м/с, а в подвздошных и бедренных артериях — 8-9 м/с [22, 23]. Наряду с увеличением СРПВ отражение ПВ в местах многочисленных ответвлений артерий вызывает увеличение («амплификацию») ПВ в дистальных участках артерий по сравнению с центральными. Таким образом, САД и ПАД на периферии, в том числе измеренное на ПА, будет выше, чем в аорте и на сонной артерии. Это имеет отношение прежде всего к лицам молодого возраста, поскольку именно у них эластичность центральных артерий значительно выше, чем периферических. У некоторых молодых здоровых мужчин повышение САД на ПА создает предпосылки для неоправданной постановки диагноза изолированной систолической артериальной гипертонии (ИСАГ), в то время как данный «феномен амплификации» связан прежде всего с выраженным градиентом жесткости в артериальной системе, а ЦАД остается нормальным. Результаты проспективных исследований не подтверждают в последующем развитие АГ у лиц данной категории [11]. Отсутствуют также доказательства возможной пользы АГТ. Следовательно, измерение ПАД на ПА, а не на аорте и сонной артерии иногда является не вполне некорректным, особенно у лиц молодого возраста [11].
В настоящее время разработаны методики суточной регистрации сосудистой ригидности, реализованные в осциллометрических и аускультативных приборах амбулаторного мониторирования АД. Аускультативный метод основан на записи промежутка времени от начала комплекса QRS
на ЭКГ до момента появления V тона Короткова, и обозначается
QKD
(
QRS
-Korotkoff Diastolic pressure delay) [24-27]. В основе осциллометрического способа лежит синхронная регистрация сфигмограмм (осциллограмм) ПА и ЭКГ. Полученный показатель является величиной, усредненной по всем кардиоциклам в пределах одного измерения АД, и идентифицируется понятием pulse transit time — РТТ [18, 28-30].
Патогенетические аспекты ремоделирования сосудов.
Различные бассейны артериального русла имеют свои особенности развития атеросклероза, что обусловлено их структурой и выполняемыми функциями. Поэтому потенциальный интерес для изучения представляют все участки сосудистого русла — от грудного и брюшного отделов аорты до ПА и артерий нижних конечностей.
Ремоделирование артерий включает функциональные нарушения (дисфункция эндотелия) и морфологическую перестройку — атеросклероз, возрастная инволюции важнейших структурных белков медиального слоя (эластина, фибулина, коллагена). Нарушение функции проведения сопряжено с уменьшением просвета артерий, что сопровождается снижением перфузии тканей в дистальных отделах. Нарушение функции демпфирования связано с потерей эластичности артериальной стенки [31-34].
Жесткость аорты определяется в первую очередь структурой средней оболочки. На аортальную стенку влияют несколько факторов, основными из них являются старение, АГ, курение, гиперхолестеринемия, СД 2-го типа [35].
Процесс старения связан с развитием артериосклероза, заключающегося во фрагментации волокон эластина, уменьшении соотношения содержания последних по сравнению с коллагеном и кальцификацией средней оболочки. Другой детерминантой артериосклероза и снижения податливости сосудов является АГ, при которой изменения в средней оболочке магистральных артерий, характерные для «физиологического» старения сосудов, развиваются преждевременно. Необходимо подчеркнуть, что ригидность аорты прогрессирует не только вследствие АГ, но и сама является патогенетическим звеном повышения АД [35].
Увеличенная ригидность аорты сопряжена с изменением функционирования сердечно-сосудистой системы. В частности, менее растяжимая аорта не может эффективно демпфировать объем крови, выбрасываемый ЛЖ, что приводит к повышению САД. В свою очередь ДАД снижается, что сопровождается нарастанием ПАД. Высокое ПАД передается мелким артериям, а это приводит к нарушению микроциркуляции, в частности мозгового и почечного кровотока. Из-за увеличенной скорости ПВ отраженные волны возвращаются ранее — в систолу, что в итоге приводит к снижению перфузии миокарда, гипертрофии ЛЖ (ГЛЖ) и его систолодиастолической дисфункции [35-37].
Механизм негативного влияния повышенного ЦАД на миокард заключается в следующем. Одной из ключевых функций сердца является перекачивание крови по артериальной системе для обеспечения метаболических потребностей органов и тканей. Эффективность сердечного выброса определяется сократительной способностью ЛЖ, эластичностью магистральных артерий, общим периферическим сопротивлением. Именно ЦАД, а не периферическое АД, определяет уровень посленагрузки на стенки ЛЖ во время систолы [22, 37].
В условиях увеличенной жесткости сосудистой стенки сердце генерирует более высокое конечное САД для данного ударного объема, что требует больших затрат энергии [22]. Увеличенное САД в аорте снижает эффективность сердечного выброса. Стабильный рост ЦАД способствует развитию ГЛЖ, которая сама является основным фактором риска развития ССО и цереброваскулярных осложнений. Тесная взаимосвязь центрального ПАД и ГЛЖ подтверждается тем, что масса ЛЖ теснее коррелирует с ПАД, чем с АД, измеренным на ПА [38].
Повышенная жесткость крупных артерий и, следовательно, центральное ПАД независимо связаны с диастолической дисфункцией у пациентов с АГ [39]. Это имеет значение в возникновении ишемии миокарда, приводя в конечном счете к диастолической сердечной недостаточности. Данная гипотеза подтверждается тем, что факторы риска развития диастолической сердечной недостаточности — АГ, атеросклероз, возраст связаны с повышенной жесткостью артерий и ЦАД.
Повышенное ЦАД негативно влияет на коронарную перфузию. Как отмечалось ранее, потеря эластичности аорты сопровождается увеличением САД, ПАД и снижением ДАД. Перфузия коронарных артерий происходит преимущественно во время диастолы. На фоне сниженного ДАД уменьшается коронарный кровоток, что особенно неблагоприятно в условиях высокой нагрузки на ЛЖ (в связи с увеличенным центральным САД). Эта ситуация может способствовать ишемии миокарда и внезапной сердечной смерти [40].
Существует и альтернативное объяснение: в ригидных артериях коронарная перфузия, как правило, происходит еще и в систолу. Соответственно при снижении работы сердца, например во время острого коронарного синдрома, кровоток в венечных артериях более чувствителен к снижению систолической функции, чем к диастолической [41].
Таким образом, независимо от того, какой из механизмов лежит в основе кровенаполнения миокарда, изменение коронарной перфузии в результате увеличенной ригидности артерий и центрального ПАД предрасполагает к ишемии ЛЖ и значительно увеличивает риск развития коронарных осложнений.
Между ЦАД и функцией эндотелия существует важная взаимосвязь. Сосудистый эндотелий играет ключевую роль в гомеостазе сердечно-сосудистой системы. Выделяемые эндотелиальными клетками биологически активные вещества, в частности эндотелин-1 и оксид азота, дают мощный сосудорасширяющий эффект. Оксид азота также оказывает антиатеросклеротическое действие, обусловленное торможением агрегации тромбоцитов, экспрессией адгезии и пролиферацией гладких мышечных клеток [42]. В условиях потери эластичности сосудов уменьшаются выброс и биодоступность оксида азота, что является пусковым механизмом формирования атеросклеротической бляшки. Это нарушение увеличивает риск развития коронарных осложнений в ряде групп пациентов ССЗ. В свою очередь уменьшение продукции оксида азота может также привести к дальнейшему увеличению жесткости артерий. Блокада синтеза активного медиатора сопровождается снижением локальной податливости сосудистой стенки [38, 43].
Прогностическая ценность параметров ригидности артерий.
Появление новых данных о высоком прогностическом значении повышения центрального САД, ПАД и показателей жесткости артерий обусловливает растущий интерес к изучению эластических свойств сосудистой стенки, оценка которых все шире используется в клинической практике. В ряде проспективных исследований продемонстрировано независимое прогностическое значение показателей центральной гемодинамики и жесткости аорты для общей и сердечно-сосудистой смертности, фатальных и нефатальных коронарных осложнений, несмертельных инсультов у пациентов с неосложненной АГ, СД 2-го типа, терминальной стадией ХПН, у пожилых больных и в общей популяции [20, 44, 45]. Жесткость аорты сохраняла свое независимое прогностическое значение после коррекции по классическим факторам риска, включая ПАД в ПА [46].
Результаты крупных исследований позволяют предположить, что изменение структурно-функционального состояния стенки аорты играет важную роль в патогенезе ССЗ. В процессе старения ремоделированию более активно подвергаются артерии эластического типа. Соответственно у пожилых людей жесткость аорты может превышать периферическую [47].
В исследовании P. Boutouyrie и соавт. [48] каротидно-феморальная СРПВ высоко достоверно коррелировала с развитием ССО у больных с АГ. Важно отметить, что показатель сохранял свою значимость при поправке на факторы риска Фрамингемской шкалы. Кроме того, СРПВ в аорте — прогностический фактор ССО, более надежный, чем показатели суточного мониторирования АД, в том числе у лиц с СД [45, 49]. Увеличение СРПВ в аорте и ПАД на ПА является главным маркером смерти от ССЗ у пациентов с терминальной стадией ХПН [20]. Исследование S. Laurent и соавт. [50] продемонстрировало, что после корректировки по уровню центрального ПАД, АД, измеренное на ПА, теряло свое прогностическое значение.
В ряде исследований показано, что ЦАД является более надежным, чем АД на ПА, прогностическим фактором смерти от ССЗ и всех причин. Исследование CAFE-ASCOT продемонстрировало, что у 64-70% пациентов с нормальными уровнями САД, измеренного на ПА, центральное САД соответствовало АГ 1-й степени [51].
Согласно результатам исследования Strong Heart между периферическим ПАД и сердечно-сосудистой смертностью существует более тесная независимая связь, чем с традиционными факторами риска — ГЛЖ, снижение фракции выброса у взрослых без ишемической болезни сердца. Кроме того, 5-летний период наблюдения за больными позволял определить центральное ПАД в качестве более надежного, чем ПАД, измеренное на ПА, прогностического фактора развития ССЗ, предположительно из-за более точного воспроизведения сосудистой нагрузки на ЛЖ. Прогностическая ценность центрального ПАД значительная, даже если принимать во внимание субклинический атеросклероз [46].
Исторически сложилось, что в качестве косвенного («суррогатного») исхода, используемого для оценки влияния АГТ, всегда применяли АД, измеренное на ПА. Однако в последние годы в центре внимания оказывается ЦАД как более важная детерминанта риска развития ССО. Причина в том, что динамика аортального АД и измеренного на ПА на фоне АГТ может существенно различаться. В частности, результаты исследований показали, что β-блокаторы по сравнению с другими группами АГП в меньшей степени влияют на сердечно-сосудистые исходы. Согласно данным исследований ASCOT, REASON и ряда сравнительных метаанализов атенолол, несмотря на равноэффективное с другими препаратами снижение периферического АД, в меньшей степени влияет на ЦАД. Выявленные различия обусловлены негативным влиянием β-блокатора атенолола на амплитуду отраженной волны и индекс аугментации, в то время как все остальные АГП улучшают эти параметры [52].
Таким образом, результаты последних крупных рандомизированных клинических исследований подтвердили закономерную связь между субклинически развивающимся ремоделированием сосудов и последующим проявлением ССЗ. Оценка показателей ЦАД и ригидности, безусловно, позволяет прогнозировать течение болезни. По результатам измерения жесткости артерий и центрального ПАД значительное число больных из группы низкого и среднего риска могут быть переведены в группы более высокого риска развития ССО [11].
Между тем эксперты рабочей группы по лечению АГ (рекомендации ESH/ESC 2013) считают, что хотя измерение ЦАД и индекса аугментации представляет большой интерес для развития неинвазивных методов анализа в патофизиологии, фармакологии и терапии, прежде, чем рекомендовать их клиническое применение, требуется дополнительное изучение этого вопроса. Исключение составляют молодые пациенты с ИСАГ: измерение ЦАД у лиц этой категории в некоторых случаях позволяет избежать неоправданного назначения гипотензивной терапии.
Тенденция тем не менее очевидна — внедрение в лечебную практику методик определения структурно-функциональных свойств магистральных артерий и в первую очередь ЦАД вопрос не столь отдаленного будущего, поскольку динамическая оценка состояния магистральных артерий существенно расширит возможности объективного анализа эффективности фармакотерапии АГ.