Предрасполагающие факторы
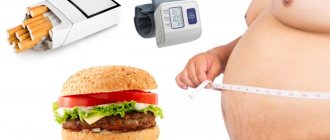
Кроме возрастного фактора, на появление атеросклероза стенозирующего вида также влияют:
- Гипертонические и ишемические болезни;
- Употребление большого количества жирной пищи животного происхождения;
- Наличие вредных привычек (алкогольная зависимость, курение, неправильный образ жизни и т.п.);
- Частые нервные перегрузки, неспокойное состояние.
Среди этих факторов самыми главными считаются вредные привычки. Именно они провоцируют развитие атеросклеротических изменений в сосудах. Второй предрасполагающий фактор – это неправильное питание, которое содержит большое количество вредного для организма холестерина. Вредный холестерин полностью не растворяется в плазме крови, он оставляет осадок, который и оседает на стенках сосудов, образуя атеросклеротические бляшки.
Больше всего подвержены атеросклеротических изменений сосуды нижних конечностей. Конечно, от стенозирующего атеросклероза страдают и другие сосудистые системы, но наиболее подвержены изменениям именно сосуды нижних конечностей. Объясняется это тем, что артерии на ногах находятся ниже всех остальных, как бы странно это все не звучало.
Наиболее пагубно на сосудах сказывается интоксикация алкоголем и никотином. Никотин, содержащийся в сигаретах, может вызывать спазмы в сосудах. Алкоголь плохо сказывается на нервной системе человека и вызывает повышение холестерина.
Кроме этого, влияет и образ жизни человека и условия его работы. Если человек ведет малоактивный образ жизни и работает в теплом уютном офисе, то через 10 лет такой жизни атеросклероз ему обеспечен практически в ста процентах случаев. Чтобы сосуды были в тонусе, человек должен проходить каждый день не менее 10 километров, а с таким образом жизни – это практически невозможно.
Также на атеросклеротические болезни нижних конечностей могут оказывать влияние местные факторы:
- Различные травмы;
- Переохлаждения;
- Удары и повреждения сосудов.
Методы лечения
При выявлении у себя симптомов болезни необходимо обратиться первым делом к терапевту, который опровергнет либо подтвердит диагноз и направит к нужному специалисту. К примеру, стенозирующий атеросклероз МАГ/сосудов нижних конечностей лечится ангиологом, атеросклероз церебральных артерий, БЦА – неврологом.
Для лечения болезни лучше отдать предпочтение консервативному подходу. Он включает в себя формирование строгого рациона питания и прием специальных препаратов, направленных на торможение разрушительного действия болезни.
Суть лечебной диеты состоит в устранении из рациона питания продуктов, богатых холестерином и животными жирами (фаст-фуд, сладости, жирные сорта мяса, жирные молочные продукты, субпродукты и пр.). А вот количество продуктов, содержащих витамин Е и антиоксиданты, наоборот, следует увеличить. Также диета включает в себя употребление большого количества фруктов и овощей (без каких-либо ограничений).
Внимание! Хорошего эффекта можно добиться, ограничив потребление соли, поскольку этот продукт имеет свойство задерживать выведение из организма жидкости, что при нарушениях кровообращения может быть чревато стойким повышением давления (дополнительная нагрузка на стенки сосудов).
Если диета не дает желаемых результатов, со временем приходится прибегать к ряду медицинских препаратов, которые способны откорректировать липидограмму.
Применяемые препараты для лечения:
- Ингибиторы (Синоприл, Лизиноприл). Поглощают холестерин, предотвращая его всасывание в кровь.
- Статины (Аторис, Затор). Снижают процесс выработки организмом холестерина и ускоряют выведение жиров и им подобных веществ из организма.
- Фибраты (Гемфиброзил, Тайколор). Повышают плотность липопротеидов, задача которых защищать стенки сосудов от холестерина.
- Секвестранты (Холестипол, Холестирамин). Эффективно и быстро выводят холестерин из организма.
Для лечения атеросклероза магистральных артерий головы со стенозированием также назначают стабилизаторы артериального давления (качественно снижают нагрузку на сосудистую систему) и антикоагулянты (разжижают кровь, облегчая ее движение даже по артериям стеноза, «засоренным» холестериновыми бляшками).
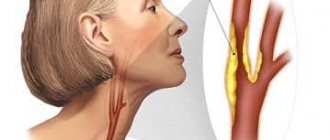
Стенозирующий атеросклероз брахиоцефального ствола и его ветвей
Метод лечения стенозирующего атеросклероза сонных артерий путем расправления стента.
Стенозирующий атеросклероз брахиоцефальных артерий возникает при перекрытии бляшкой просвета плечеголовного ствола. Чтобы понимать принцип развития симптомов, нужно знать топографическое размещение артерий. Брахиоцефальная артерия первая выходит из аортальной дуги, имеет длину около 4 см, направляется вправо и проходит позади грудинно-ключичного сустава, где разделяется на свои конечные ветви: Правая общая сонная артерия. Правая подключичная артерия. Правая позвоночная артерия, которая является ветвью подключичной артерии.
Расстройство кровообращения верхней конечности
Атеросклероз брахиоцефальных сосудов сопровождается расстройством кровообращения в правой верхней конечности. Кровоснабжение руки устроено так, что коллатерального (обходного) кровообращения она не лишена. Правая подключичная артерия является основной в кровоснабжении руки, но благодаря компенсации кровью от других ветвей ствола, процесс ишемии развивается медленно.
Вначале из-за атеросклероза брахиоцефальных артерий рука становится бледной, нарушается чувствительность, появляются парестезии, затем на правой лучевой артерии пропадает пульс, пропадает волосяной покров, мышцы предплечья слабеют, но симптомы имеют преходящий характер, чаще возникают при физической нагрузке. Далее стенозирующий атеросклероз экстракраниального отдела сопровождается образованием на руках трофических язв, некроза пальцев и всей конечности. При поражении правой подключичной артерии возникают обмороки и головокружение, снижение зрения, головные боли, из-за симптома мозгового обкрадывания, который возникает в ответ на ишемию верхней конечности.
Расстройство кровообращения в сосудах шеи и головы
Атеросклероз магистральных артерий шеи возникает при поражении общей сонной артерии, и её внутренней и наружной ветви. Учитывая, что при такой локализации холестериновых бляшек нарушается кровоснабжение лица и мозга, симптомы будут соответствующие. Пропадает чувствительность правой половины лица, появляются ощущения «ползанья мурашек».
Атеросклероз экстракраниальных сегментов магистральных артерий головы и шеи, не приводит к тяжёлым мозговым осложнениям, возникают лишь транзиторные ишемические атаки, сопровождающиеся головной болью и головокружением. Благодаря тому, что кровообращение в вышеобозначенных сегментах восполняется левой общей сонной артерией, которая не зависит от стенозирующего атеросклероза брахиоцефальных сосудов, не возникает острой мозговой недостаточности.
Левые отделы через Виллизиев круг частично компенсируют гемодинамические расстройства из правой половины. Опасным симптомом является прогрессирующее снижение зрения, которое приводит к слепоте, это говорит о нарушении компенсации кровообращения в системе сонных артерий.
Нарушение кровообращения в позвоночных артериях
Атеросклероз внечерепных отделов брахиоцефальных артерий со стенозированием также относится к вертебральным сосудам. Этот сегмент кровоснабжает задние отделы головы и шеи, при этом существует внутричерепной отдел этих артерий, который имеет собственный коллатеральный путь (круг Захарченко), не сообщающийся с системой Виллизиевого круга.
Атеросклероз магистральных артерий головного мозга из позвоночных сегментов сопровождается нарушениями координации, движения становятся несогласованными (мозжечковая атаксия), ходьба становится неуверенной, больной может упасть на ровном месте. При полном закрытии обоих вертебральных сосудов у пациента начинаются грубые расстройства функции мозжечка и затылочной коры, больной не сможет сидеть и может полностью потерять зрение. Исходом заболевания будет ишемический инсульт затылочной зоны мозга.
Нарушение мозгового кровообращения
Атеросклероз магистральных сосудов головного мозга из системы внутренней сонной артерии — самый опасный сегмент, пораженный холестериновыми бляшками. Если поражённый сегмент расположен дальше Виллизиевого круга, то при облитерации сосуда больше 70% возникает высокая вероятность ишемического инсульта кровоснабжаемой зоны.
При нарушении кровообращения в лобной доле, что соответствует передней мозговой артерии, больной теряет способность к сознательным движениям, нарушаются речевые и эмоциональные функции, полностью исчезают когнитивные (познавательные) способности, проявляются патологические рефлексы.
При нарушении кровообращения в теменной доле, что соответствует средней мозговой артерии, больной не воспринимает проекцию своего тела, путает правую и левую стороны, неспособен узнавать и описывать предметы, полностью теряет глубокую и поверхностную чувствительность.
При нарушении кровообращения височной доли из средней мозговой артерии пациент лишается способности слышать, различать звуки.
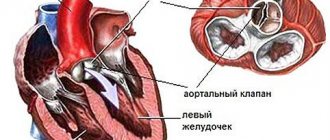
Атеросклеротическое поражение сосудов сердца
Стенозирующий атеросклероз коронарных артерий сопровождается приступами стенокардии, возникает высокий риск инфаркта миокарда. Локализация атеросклеротических бляшек в собственных артериях сердца опасна, поскольку диаметр их просвета мал и полная окклюзия сосуда развивается быстро.
За последние годы в значительной степени возрос интерес к проблеме нарушений мозгового кровообращения, обусловленных атеросклерозом с преимущественным поражением интракраниальных артерий. С одной стороны, это связано с эпидемиологическими факторами: высокой распространенностью как клинически асимптомного атеросклероза интракраниальных артерий, так и повторных ишемических нарушений мозгового кровообращения (НМК), развивающихся вследствие интракраниального атеросклероза (ИА). С другой стороны, выявление ИА в значительной степени улучшилось за последние годы на фоне интенсивного развития методик нейровизуализации.
Интракраниальный атеросклероз может протекать асимптомно, приводить к развитию как острых НМК, так и хронических форм НМК (атеросклеротическая ангиоэнцефалопатия). Рассматривая эпидемиологию ИА, следует отдельно остановиться на т.н. асимптомном интракраниальном атеросклерозе, под которым понимают выявленное при нейровизуализации атеросклеротическое поражение интракраниальных артерий у пациентов без анамнестических указаний на транзиторную ишемическую атаку (ТИА) или ишемический инсульт (ИИ). По данным J.F. Arenillas (2014), частота «асимптомного интракраниального атеросклероза» составляет от 5,9 до 24,5% у лиц с высоким риском инсульта [1]. При этом международными экспертами подчеркивается значительно более частое выявление ИА у лиц азиатского происхождения: частота «асимптомного интракраниального атеросклероза» у представителей азиатской расы достигает 54%, в несколько раз превышая таковую у представителей других рас [2–4].
Среди уточненных причин ишемических НМК ИА остается одной из наиболее частых причин во всем мире [5]. При этом, как и в отношении «асимптомного интракраниального атеросклероза», частота ТИА и ИИ, обусловленных атеросклеротическим поражением интракраниальных артерий, значительно выше у пациентов азиатской расы, достигая 50%; у представителей же европеоидной и негроидной рас этот показатель оценивается в 10 и 30% соответственно [3, 5–10].
По мнению исследователей, это обусловлено как генетической предрасположенностью к развитию заболевания у различных этнических групп, так и различиями в образе жизни и типичных факторах риска [3].
Значимость атеросклеротического поражения интракраниальных артерий определяется и высокой частотой повторных ТИА и ИИ, составляющей через один и два года после перенесенного НМК 11 и 13% соответственно у пациентов, находящихся на терапии пероральными антикоагулянтами, 12 и 15% соответственно – на терапии тромбоцитарными антиагрегантами [11]. При этом у пациентов со стенозом средней мозговой артерии (СМА) более 70% ежегодная частота инсульта на фоне антитромботической терапии возрастает до 18% в год [12]. По другим данным, частота повторных ИИ у пациентов, имевших стеноз СМА более 70% и находившихся на терапии антиагрегантами, еще выше – она составила 23,7% по окончании наблюдения на протяжении 56 месяцев. У больных со стенозами интракраниального отдела внутренней сонной артерии (ВСА) этот показатель достигал 36,1% [12].
Вероятность появления клинической симптоматики у пациентов с «асимптомным интракраниальным атеросклерозом» обусловлена рядом факторов, наиболее важные из которых локализация и степень стеноза, а также особенности строения коллатеральных сосудов [14]. Так, для атеросклеротических изменений передней мозговой (ПМА) и задней мозговой (ЗМА) артерий асимптомное течение характерно в большем количестве случаев, чем для поражения СМА, интракраниальной части ВСА и позвоночной артерии, а также базилярной артерии [8]. При этом именно атеросклеротическое поражение СМА и интракраниальной части ВСА более частое [15], реже диагностируются атеросклеротические изменения базилярной артерии и интракраниального отдела позвоночной артерии, еще реже – артерий конвекситальной поверхности мозга – ПМА и ЗМА [16].
К наиболее серьезным клиническим проявлениям ИА относятся острые НМК, симптомы которых соответствуют локализации атеросклеротического поражения интракраниальной артерии и объему повреждения мозга.
Выделяют три механизма развития инфарктов головного мозга у пациентов с интракраниальным атеросклерозом [17]:
- гипоперфузия мозга с развитием инфаркта в зонах смежного крово-снабжения, связанная с декомпенсацией процессов ауторегуляции
- мозгового кровотока (особенно в условиях нарушения системной гемодинамики);
- артерио-артериальная эмболия;
- атеростеноз в устье перфорирующих артерий, вызывающий развитие небольших инфарктов.
При этом стеноз СМА, как правило, приводит к развитию малых глубинных инфарктов или инфарктов в зоне смежного кровоснабжения; стеноз интракраниального отдела ВСА сопровождается развитием больших или обширных очагов с вовлечением серого вещества, что отражается в более выраженной неврологической симптоматике по сравнению с инфарктами на фоне стеноза СМА [18].
Течение ИА может быть стабильным или прогрессирующим [19]. При этом у пациентов с клинически симптомным ИА прогрессирование атеросклероза (т.е. нарастание степени стеноза интракраниальных артерий), по данным B. Joon Kim (2014), наблюдалось достоверно чаще, чем у больных с «асимптомным» ИА [20]. Хроническое течение ИА лежит в основе формирования атеросклеротической ангиоэнцефалопатии, характеризующейся как специфическими патоморфологическими особенностями (комплекс диффузных и очаговых изменений мозга ишемического характера, различной локализации, степени тяжести и давности [17]), так и формированием клинического синдромокомплекса (когнитивные нарушения, экстрапирамидная и пирамидная симптоматика, вестибуло-мозжечковый синдром и др.).
«Золотым» стандартом диагностики ИА является дигитальная субтракционная ангиография [21]. С одной стороны, данный метод позволяет наиболее точно определять степень стеноза интракраниальной артерии (что является ключевым прогностическим фактором ИА), с другой – является инвазивным и предполагает введение контрастного вещества, что сопряжено с определенным процентом осложнений, в т.ч. появлением стойкой или преходящей неврологической симптоматики в 0,6 и 1,8% случаев соответственно [22]. К неинвазивным методам диагностики ИА относятся транскраниальная допплерография, магнитно-резонансная (МРА) и компьютерно-томографическая (КТА) ангиография. В отношении точности диагностики ИА этими более безопасными и доступными неинвазивными методами однозначные данные отсутствуют. Так, транскраниальная допплерография в значительной степени является операторзависимой методикой, ее выполнение в ряде случаев невозможно из-за отсутствия т.н. ультразвукового окна, при этом несомненным преимуществом данного метода является возможность определения направления потока крови, а также оценка коллатерального кровотока. В силу физических основ метода визуализация стеноза интракраниальных артерий при МРА зависит от тока крови, что может приводить к искажению степени выраженности стеноза (например, критический стеноз СМА с очень низким потоком крови может выглядеть при МРА как окклюзия). В целом считается, что транскраниальная допплерография и МРА могут использоваться как скрининговые методики для исключения поражения ИА, но они недостаточно надежны для подтверждения наличия стеноза и определения степени его выраженности [23]. Компьютерно-томографическая ангиография превосходит МРА по точности диагностики [24, 25] и обладает наивысшей после дигитальной субтракционной ангиографии чувствительностью и специфичностью выявления стеноза более 50% [26]. Однако этот метод диагностики сопряжен с введением контрастного вещества и дополнительной лучевой нагрузкой.
В последние годы все чаще используются перфузионные методики КТ и МРТ, позволяющие дополнять данные о стенозе той или иной интракраниальной артерии выявлением зон гипоперфузии. Кроме того, в дополнение к «классическим» методикам визуализации ИА могут быть использованы новые технологии, позволяющие не только судить от степени стеноза, но и получать представление о структуре атеросклеротической бляшки. Так, МРТ высокого разрешения дает возможность непосредственно визуализировать тромб, кровоизлияние в бляшку и определять состав бляшки; внутрисосудистое ультразвуковое исследование также позволяет выявлять кровоизлияние в бляшку, устанавливать ее состав и протяженность [21, 27]. С учетом сложности и дороговизны вышеописанных методов диагностики более детальное ангионейровизуализационное обследование может быть рекомендовано пациентам, перенесшим ИИ или ТИА, генез которых остается неясным после проведения комплекса инструментально-лабораторного обследования и исключения патологии экстракраниальных артерий (гемодинамически значимый стеноз, диссекция и др.), гипертонического малого глубинного (лакунарного) инфаркта, кардиальной патологии (фибрилляция предсердий, постинфарктный кардиосклероз и др.), коагулопатии.
Основной целью лечения пациентов с симптомным ИА служит предотвращение повторного НМК. Направленные на это мероприятия включают контроль артериального давления (АД), т.к. систолическое АД ≥140 мм рт.ст. значимо повышает риск инсульта в соответствующем артериальном бассейне [28, 29], устранение дислипидемии (с достижением целевых значений общего холестерина ≤5,1 ммоль/л и липопротеидов низкой плотности ≤1,8 ммоль/л) [29], «агрессивную» коррекцию других факторов риска (нормализация массы тела, увеличение физической активности, отказ от курения, поддержание нормогликемии) в соответствии с рекомендациями по вторичной профилактике инсульта [30, 31] и антитромботическую терапию.
Сравнению эффективности и безопасности профилактического применения монотерапии антиагрегантами (ацетилсалициловая кислота [АСК] в дозе 1300 мг в сутки) и пероральными антикоагулянтами (варфарин с поддержанием уровня международного нормализованного отношения 2–3) было посвящено международное контролируемое рандомизированное исследование WASID. В исследование были включены более 500 пациентов с ИИ или ТИА, развившихся на фоне стенозов от 50 до 99% крупных интракраниальных артерий (СМА, интракраниального отдела ВСА, позвоночной артерии и базилярной артерии). Несмотря на отсутствие различий в эффективности между группами антиагрегантной и антикоагулянтной терапии по достижении первичной конечной точки (комбинированная конечная точка: оценка частоты развития ишемического, геморрагического инсульта, сосудистой смерти), частоте повторных ИИ через один и два года, терапия варфарином была ассоциирована с более высоким процентом геморрагических осложнений и летальных исходов, в связи с чем исследование WASID было досрочно прекращено [11].
Последовавший за этим подгрупповой анализ WASID не продемонстрировал преимуществ варфарина над АСК в отношении ни пациентов с субтотальным стенозом интракраниальных артерий, ни женщин, ни пациентов, у которых ИИ или ТИА развились на предшествующей терапии АСК [32].
Таким образом, основным выводом исследования WASID стало предпочтительное назначение монотерапии АСК (над варфарином) пациентам с симптомным ИА. Тем не менее с учетом довольно высокого процента повторных ишемических событий на фоне монотерапии АСК в дальнейшем проводились исследования, посвященные оценке эффективности и безопасности комбинированной антиагрегантной терапии ИА. Так, S.U. Kwon и соавт. (2005) продемонстрировали преимущество комбинированной антиагрегантной терапии (цилостазол 200 мг в сутки и АСК) над монотерапией АСК (100 мг в сутки): через 6 месяцев наблюдения за пациентами с симптомным стенозом СМА или базилярной артерии выявлен меньший темп прогрессирования атеросклероза по данным МРА [33]. В исследовании S.U. Kwon и соавт. (2011), проведенном на 457 пациентах с симптомным стенозом СМА или базилярной артерии, при сравнении эффективности и безопасности различных вариантов комбинированной антиагрегантной терапии: цилостазол 200 мг в сутки+АСК 75–150 мг в сутки и клопидогрел 75 мг в сутки+АСА 75–150 мг в сутки не было продемонстрировано различий между группами по темпам прогрессирования стеноза по МРА через 7 месяцев, частоте сердечно-сосудистых событий, появлению новых ишемических очагов на МРТ и развитию геморрагических осложнений [34].
В небольшом (70 пациентов) открытом мультицентровом исследовании (2013) пациентов, перенесших за 7 суток до включения ИИ или ТИА на фоне ИА, у которых при транскраниальной допплерографии были выявлены микроэмболические сигналы (МЭС), X. Wang и соавт. была продемонстрирована меньшая частота МЭС на фоне семидневной комбинированной антиагрегантной терапии (клопидогрел 75 мг в сутки+АСК 100 мг в сутки) по сравнению с монотерапией АСК [35].
В течение многих лет предпринимались попытки хирургического лечения атеросклеротического стеноза интракраниальных артерий и его последствий. Наиболее ранней и самой изученной операцией оказалось наложение экстра-интракраниального анастомоза, однако по результатам проведенных в 1980-х [13] и в 2011 г. [36] исследований ее эффективность не была доказана и в настоящее время эта операция не имеет широкого распространения.
К современным методикам хирургического лечения ИА относятся эндоваскулярные вмешательства с использованием баллонной ангиопластики, баллонной ангиопластики со стентированием и с установкой саморасправляющихся стентов. Последние характеризуются высокой частотой технического успеха и относительным удобством установки, т.к. не требуют использования баллона и могут быть доставлены в сложные для прохождения участки артериального русла. Сравнению эффективности и безопасности эндоваскулярного и консервативного лечения ИА было посвящено международное рандомизированное контролируемое исследование SAMMPRIS [37]. В исследование включены пациенты, перенесшие за 30 суток до рандомизации ИИ или ТИА на фоне ИА с формированием стеноза 70–99%. В качестве т.н. агрессивной консервативной терапии пациентам назначалась комбинированная антиагрегантная терапия (клопидогрел 75 мг в сутки и АСК 325 мг в сутки), гипотензивная терапия с поддержанием систолического АД ниже 140 мм рт.ст. (у пациентов с сахарным диабетом ниже 130 мм рт.ст.), гиполипидемическая терапия с целевыми значениями липопротеидов низкой плотности ниже 70 мг/дл, а также проводился жесткий контроль других сосудистых факторов риска (с модификацией образа жизни). В группе эндоваскулярного лечения вышеуказанная консервативная терапия дополнялась ангиопластикой со стентированием (стентом Wingspan). Исследование было досрочно остановлено на этапе включения 451 пациента в связи с отсутствием доказательств эффективности и худшими показателями безопасности стентирования: так, частота повторного инсульта в течение 30 суток в группе эндоваскулярного лечения достигла 14,7% (в трети случаев – внутримозговые кровоизлияния) по сравнению с 5,8% в группе консервативной терапии (р=0,002), а частота летальных исходов составила в группах хирургического и консервативного лечения 2,2 и 0,4% соответственно [37, 38]. Несмотря на то что среди всех пациентов, включенных в исследование SAMMPRIS, у 63% ИИ или ТИА развились на фоне проведенной ранее антиагрегантной терапии, при подгрупповом анализе данной выборки пациентов показатели эффективности (частота повторных инсультов) и безопасности (процент летальных исходов) оказались также хуже при стентировании интракраниальных артерий, чем при назначении агрессивной консервативной терапии [39].
Резюмируя приведенные выше данные доказательной медицины в отношении вторичной профилактики инсульта при ИА, следует отметить следующие ключевые позиции:
Для пациентов, перенесших ИИ или ТИА вследствие ИА с формированием стеноза 50–99%, терапия антиагрегантами (препараты АСК) имеет преимущества перед терапией варфарином (прежде всего в отношении безопасности) (класс I; уровень доказательности B в соответствии с рекомендациями AHA-ASA, 2014 [31]).
Для пациентов с более грубым стенозирующим поражением интракраниальных артерий (70–99%) в течение первых 30 суток после ИИ или ТИА добавление клопидогрела (75 мг в сутки) к терапии АСК (325 мг в сутки) на срок до 90 суток обоснованно (класс IIb; уровень доказательности B в соответствии с рекомендациями AHA-ASA, 2014 [31]). В дальнейшем прием клопидогрела целесообразно прекращать (в отсутствие других показаний к его применению) и переходить к монотерапии АСК (в дозе 325 мг в сутки), поскольку, с одной стороны, отсутствуют доказательства эффективности монотерапии клопидогрелом в качестве средства вторичной профилактики ИИ или ТИА у пациентов с ИА, с другой – более длительное лечение двумя антиагрегантными препаратами не оправданно в связи с увеличением риска геморрагических осложнений.
Для пациентов с умеренным стенозом (50–70%) крупной интракраниальной артерии или пациентов после ИИ или ТИА давностью более 30 дней (независимо от степени стеноза) целесообразна монотерапия АСК в дозе 325 мг в сутки в сочетании с интенсивной коррекцией факторов риска.
Не менее важно поддержание систолического АД ниже 140 мм рт.ст. и «агрессивная» терапия статинами (класс I; уровень доказательности B в соответствии с рекомендациями AHA-ASA, 2014 [31]).
Эффективность и безопасность комбинации адекватной антиагрегантной, гипотензивной и гиполипидемической терапии в сочетании с модификацией образа жизни и тщательным контролем сосудистых факторов риска достоверно выше, чем при проведении баллонной ангиопластики со стентированием интракраниальных артерий (класс IIb; уровень доказательности С в соответствии с рекомендациями AHA-ASA, 2014 [31]).
Как было сказано выше, прогрессирующее течение ИА лежит в основе развития атеросклеротической ангиоэнцефалопатии. В отношении данной категории пациентов наряду с описанными подходами к профилактике ишемических НМК не менее важным остается назначение патогенетически обоснованных препаратов, улучшающих качество жизни. Поскольку развитие ИА сопровождается нарушением ауторегуляции мозгового кровотока и формированием зон гипоперфузии, таким пациентам целесообразно применение препаратов, обладающих нейротрофическим, метаболическим и антигипоксическим эффектами.
В ряде зарубежных рандомизированных плацебо-контролируемых исследований показана эффективность Актовегина для пожилых пациентов с признаками легкой и умеренной сосудистой деменции [40]. Обширный опыт российских исследователей подтверждает эффективность препарата для пациентов с хронической ишемией головного мозга, сопровождающейся когнитивными расстройствами, проявляющейся как в позитивном влиянии на память и внимание (по данным нейропсихологического обследования), так и в улучшении психоэмоционального статуса пациентов (уменьшение выраженности депрессивных и астенических симптомов, улучшение сна и общего самочувствия) [41–44]. Доказанный эндотелиопротективный эффект Актовегина и позитивное влияние на микроциркуляцию, вероятно, дают дополнительные терапевтические преимущества пациентам с когнитивными расстройствами, возникшими вследствие хронической церебральной ишемии. Таким образом, включение Актовегина в схему лечения пациентов с ИА наряду с мерами по профилактике сосудистых событий может способствовать нивелированию проявлений недостаточности мозгового кровообращения и улучшению самочувствия таких пациентов.
Итак, ИА оказывает существенный вклад в развитие острых и хронических НМК, требует особого подхода к диагностике и назначению персонализированной терапии. Дальнейший прогресс в изучении данной проблемы во многом будет основываться на развитии новых методов нейро- и ангиовизуализации, накоплении доказательной базы по препаратам вторичной профилактики ИИ, а также поиске и обосновании к назначению других (терапевтических и хирургических) подходов к лечению НМК.
Стеноз сосудов нижних конечностей
Стенозирующий атеросклероз артерий нижних конечностей имеет симптомы схожие с таковыми на верхних конечностях. На первых стадиях возникает расстройство чувствительности и температуры конечностей. Затем появляется патогномический симптом для бляшек, локализованных на сосудах нижних конечностей, является перемежающаяся хромота, которая проявляется ноющими болями в ногах, появляющимися на фоне ходьбы и пропадающими при остановке и отдыхе. При запущенных формах болезни возникает фасциальный отёк мышц, который переходит в трофические нарушения конечностей, что грозит ампутацией.
Профилактические меры
Чтобы предотвратить развитие болезни и проявление ее осложнений, необходимо строго следовать предписаниям доктора. Нужно соблюдать следующие советы для предотвращения болезни:
- Строгий контроль над состоянием артериального давления.
- Осуществление регулярных (умеренных) физических нагрузок (фитнес, йога, плавание, бег, прогулки на свежем воздухе и пр.).
- Отказ от вредных привычек (если таковые присутствуют в жизни).
- Сбалансированное правильное питание, насыщенное антиоксидантами и витаминами.
- Регулярные профилактические осмотры у специалиста.
Насколько эффективно лечение заболевания народными средствами (травами), читайте здесь; а как бороться с недугом — переходите по ссылке.
Клинические проявления стенозирующего атеросклероза сосудов мозга
Распознать наличие в организме атеросклеротического процесса можно по такой клинической симптоматике:
- Болезненные ощущения в разных участках тела. Они появляются на первой стадии и свидетельствуют про ишемию тканей. У пациентов начинают болеть ноги, голова и шея.
- Парестезии. Это ощущения ползания мурашек по коже. Подобное явление возникает при закупорке мелких сосудов, питающих чувствительные клетки кожных покровов.
- Мелькание мушек перед глазами. Оно появляется, когда атеросклеротический процесс достиг сосудистых сплетений сетчатки.
- Звон в ушах и головокружение. Подобная симптоматика дебютирует, когда холестериновые бляшки появляются в артериях и венах головы, достигая вестибулярного аппарата.
- Изъязвление кожных покровов нижних конечностей. Подобные симптомы возникают, когда заболевание достигает второй, тромбонекротической стадии. В сосудистых руслах ног появляются тромбозы с омертвением участков ткани, в которых отсутствует оксигенация.
- Синюшность носогубного треугольника и дистальных участков тела. Такой симптом возникает в результате последовательного фиброзирования и склерозирования сосудов, поражающих разные органы. Кровь просто не способна достигать отдаленных участков, которые вследствие этого становятся цианотичными.
Стенозирующий атеросклероз МАГ — что это такое?
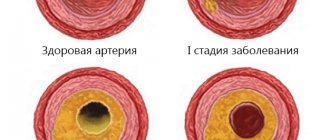
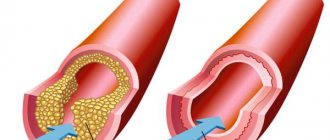
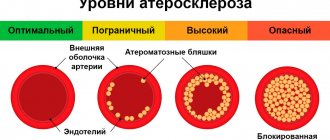
Стенозированный атеросклероз является патологией кровеносных сосудов. На внутренних стенках этих сосудов образуются жировые отложения – холестериновые бляшки.
Что немаловажно, болезнь не является внезапной. Ее развитие происходит в течение длительного периода времени, с медленным образованием бляшек.
Идет процесс с формированием кальцинатов и постепенным разрастанием соединительных тканей. Механизм возникновения и распространения болезни в организме сводится к накоплению жиров низкой плотности в крови. С течением времени они налипают на малейшие неровности внутри сосудов и образуются бляшки, которые по мере прогрессирования болезни приводят к закупорке артерий. В результате уменьшается просвет для тока крови до такой степени, что кровоснабжение полностью нарушается вплоть до ишемии органов и тканей.
Диагностика
Стенозирующий атеросклероз коронарных артерий, каротидных сосудов и других сосудистых структур диагностируется с помощью таких физикальных и инструментальных методик:
- Для определения наличия заболевания применяют аускультацию, которая помогает услышать ток крови.
- Аускультация. Она помогает выслушать характерный шум турбулентного тока крови с помощью стетофонендоскопа.
- Внешний осмотр. У пациентов с описанными поражениями часто наблюдается контурирование и пульсация сосудов на тех участках тела, где последние пролегают непосредственно под кожей.
- Допплерография. Наиболее точно определяет стенозирующий атеросклероз. Этот значимый метод позволяет выявить такие эхопризнаки, как окклюзия тромбом, бляшкой или эмболом, завихрение крови в стенозированных участках, уменьшение скорости ее течения по магистральным артериям.
- Ангиография сосудов с использованием контрастного вещества. Это рентгенологический метод, позволяющий определить локализацию и степень сужения.
Диагностика заболевания
Для диагностирования болезни применяется целый ряд медицинских приборов и процедур:
- Первоначально врач собирает анамнез болезни, узнает у больного о его образе жизни и привычках, затем приступает к визуальному осмотру.
- После получения первичных данных больной должен сдать ряд анализов (общий, биохимический и иммунологический анализы крови, анализ мочи – для выявления возможного воспалительного очага).
- Специалист делает ЭКГ и УЗИ сердца, МРТ.
Важно! УЗИ-признаки считаются наиболее точным подтверждением неприятного диагноза. Допплерографическая картина основывается на сигналах ультразвукового аппарата, которые получают во время осуществления процедуры путем отражения от элементов крови. - При получении сомнительного результата врач дополнительно назначает ангиографию для определения уровня тока крови в сосудах.
- Эхокардиография дает возможность определить наличие поражения сосудов сердца, а стресс-эхокардиография позволяет не только выявить наличие значимого атеросклероза, но и определить его локализацию.
- При необходимости врач советуется с другими специалистами в зависимости от области, пораженной стенозирующим атеросклерозом.
Особенности терапии
Лечение может быть назначено после проведения комплексной диагностики и выявления степени сужения сосудов. Терапия в зависимости от степени запущенности патологического процесса может проводиться как консервативными, так и оперативными методами.
Лекарственные препараты
На начальных стадиях заболевания подавить его позволяет использование некоторых лекарственных препаратов. Для снижения концентрации холестерина в крови назначаются статины. Кроме того, пациентам назначаются ингибиторы и секвестранты, которые способствуют нарушению всасывания жиров в кишечнике и быстрому выведению липидов. Для повышения тонуса стенок сосудов назначаются фибраты. Обязательным условием выздоровления является соблюдение специальной диеты. Могут дополнительно назначаться физиотерапевтические процедуры.
Хирургическое лечение
Хирургические методы лечения применяются при терапии поздних стадий развития заболевания, когда кровоток на пораженном участке почти отсутствует. Наиболее часто применяются следующие методики: шунтирование; стентирование; баллонная ангиопластика. В особо тяжелых случаях выполняются открытые оперативные вмешательства, предполагающие формирование анастомозов вен, и замена поврежденных участков протезами.
Типичные признаки и симптомы
Симптоматика заболеваний брахиоцефальных артерий специфична. Если вы чувствуете тревожные симптомы, но ваш врач, выслушав жалобы, ограничился беспредметными диагнозами (СХУ, ВСД и др.), непременно настаивайте на расширенной диагностике.
К симптомам заболеваний брахиоцефальных артерий относят:
- Общую усталость, слабость, снижение работоспособности и концентрации внимания;
- Резкие головные боли, возникающие при движениях головой;
- Головокружения и синкопе (кратковременные потери сознания);
- Обморочные состояния при снижении артериального давления;
- Шум или звон в ушах;
- Преходящие парезы головы и конечностей;
- Зрительные нарушения (появление пятен и мушек в поле зрения, снижение его остроты с внезапным восстановлением);
- Стенокардию;
- Ишемию (иногда бессимптомную);
- Зуд, онемение, покалывание в левых конечностях;
- Покачивание при ходьбе;
- Тошноту;
- Редкие или частые расстройства двигательных или речевых функций (оцепенение, неспособность внятно вести диалог).
Коварство атеросклероза брахиоцефальных артерий заключается в его «размытом» раннем течении. Перечисленные признаки порой вовсе не дают о себе знать, либо выражены настолько слабо, что больной не придает им должного значения. Игнорирование диагностики и лечения приводит к летальному исходу или вегетативному состоянию.
Чем опасно?
Стеноз сам по себе является нарушением анатомической и физиологической нормы строения органов. Где бы он ни появился, это всегда влечет за собой усиление ишемизации окружающих тканей. Стенозирующий атеросклероз сосудов головного мозга опасен развитием острого нарушения мозгового кровообращения. Стенозный деффект коронаров влечет к наступлению инфаркта миокарда. Атеросклеротический процесс в сосудистом русле часто становится причиной разрыва венечной артерии или аневризмы аорты. Если он активизируется в периферических артериях и венах, это оканчивается гангреной верхних или нижних конечностей. Яркие клинические признаки стенозирующего атеросклероза свидетельствуют о возможном наступлении скорого летального исхода
Последствия и осложнения
Несвоевременное выявление болезни и отсутствие должного ее лечения может привести к необратимым и очень тяжелым последствиям. К примеру, поражение сонных артерий может спровоцировать инсульт, а сильная закупорка магистральных артерий головы может привести к массивным кровоизлияниям. Существует ряд осложнений, провоцируемых стремительным прогрессированием болезни:
Острые. Развитие болезни может привести к серьезным нарушениям мозгового и сердечного кровообращения (аневризма аорты, гангрена, ишемия сердечной мышцы и т.д.).- Хронические. Недостаточное кровообращение в пораженных болезнью частях тела приводит со временем к функциональным и затем органическим (к сожалению, необратимым) изменениям. Так, если атеросклероз БЦА был обнаружен несвоевременно или вовремя не было назначено лечение, у больного со временем начнется неврологическое нарушение в мозге. На этой почве часто развивается слабоумие.