Аневризмы экстракраниального отдела ВСА являются редкой патологией. Они составляют 1-2% от всех поражений экстракраниальных отделов сонных артерий [1-4] и 0,8-4% аневризм других периферических сосудов [5, 6]. В исследовании Texas Heart Institute среди 7394 больных с аневризмами аорты и периферических артерий, которые были оперированы в этом центре с 1960 по 1995 г., у 67 (0,9%) пациентов диагностирована аневризма ВСА [7]. А.В. Гавриленко и соавт. [2], анализируя опыт оперативного лечения 1836 пациентов, выявили аневризмы экстракраниальных отделов ВСА у 31 (1,7%) больного.
Основными причинами формирования аневризм сонных артерий, по мнению большинства авторов [8-10], являются атеросклероз, фиброзно-мышечная дисплазия и травматическое повреждение артерий. Наличие аневризмы данной локализации в первую очередь угрожает развитием ишемических нарушений мозгового кровообращения (НМК) в виде ТИА и ишемического инсульта вследствие дистальной эмболии из полости аневризмы. Артерио-артериальная эмболия при данной патологии является следствием турбуленции кровотока в полости аневризмы с вымыванием тромботических масс из аневризматического мешка. Кроме того, как и в случаях с аневризмами другой локализации, возможно ее тромбирование [1, 11]. При изучении естественного течения аневризм сонных артерий у 124 пациентов, описанных до 1936 г., N. Winnslow установил, что летальность от тромбоза, дистальной эмболии и разрыва при этой патологии составляет 71%. По данным R. Busuttil и соавт. [12], эпизоды ишемических НМК наблюдались у 50% пациентов. Другие авторы [13, 14] сообщили, что их частота составляет 43-74%, причем ТИА встречаются в 2 раза чаще.
Учитывая опасность развития инсульта и высокую смертность при данной патологии, были предложены различные методы хирургических вмешательств. Основной задачей хирургического лечения являтся предотвращение тромбэмболии. Со времени первой операции, выполненной A. Cooper [7] в 1805 г., лигирование сосуда было единственным методом хирургического лечения. Эти вмешательства сопровождались развитием большого инсульта или летальными исходами в 20-40% случаев [14, 15]. В настоящее время в большинстве случаев выполняется резекция аневризмы ВСА с протезированием последней или формированием анастомоза конец в конец [1, 2, 4, 11, 14-16]. Проведение реконструктивной операции позволяет снизить развитие ОНМК и летальность до 4-10% [3, 9]. Наибольшие трудности возникают при операциях по поводу аневризм дистальных отделов ВСА. По мнению ряда авторов [17, 18], дистально расположенные аневризмы экстракраниального отдела формируются при патологической деформации сонных артерий за счет крайней формы дисплазии сосудистой стенки. Во многих случаях они осложняются наличием тромботических масс в полости аневризматического мешка. В литературе [1, 11, 17, 18] описаны единичные случаи открытых хирургических вмешательств при данном типе поражения, но при более проксимальном расположении аневризмы. Развитие в последние годы эндоваскулярной хирургии расширило возможности хирургов в выборе вариантов оперативного лечения аневризм ВСА. Однако до сих пор в литературе [19-22] встречаются лишь единичные или небольшие по числу наблюдений описания эндопротезирования при данной патологии. Применение стент-графтов в сонных артериях сопряжено с риском развития диссекции интимы и тромбоза артерии, и при выраженной извитости артерии не всегда технически выполнимо. В то же время в последние годы появились сообщения об успешном применении высокопотокового экстраанатомического шунтирования НСА-СМА (в англоязычной литературе — High-flow EC-IC bypass) при лечении сложных аневризм интракраниального отдела ВСА [23]. Имея определенный опыт такого рода операций, мы применили эту методику в лечении дистально расположенных аневризм экстракраниальной части ВСА.
В статье представлен опыт успешного хирургического лечения дистально расположенных аневризм экстракраниального отдела ВСА, сочетающихся с патологической извитостью артерии.
Материал и методы
В 2015 г. в отделении сосудистой нейрохирургии ФГБУ ФЦН Новосибирска выполнены 3 оперативных вмешательства у больных с диагнозом «Патологическая извитость ВСА с формированием мешотчатой аневризмы дистального отдела С1 сегмента». Все больные были в возрасте 62-63 года. Все они в анамнезе имели указание на нарушение мозгового кровообращения в бассейне СМА на стороне поражения ВСА: в 2 случаях — ишемический инсульт, в 1 — неоднократные ТИА. Больным была выполнена костно-пластическая краниотомия, создание высокопотокового экстраанатомического шунта между НСА и М2 сегментом СМА, проксимальное лигирование С1 сегмента ВСА.
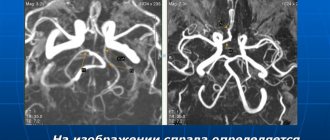
При принятии решения о выборе метода хирургического вмешательства помимо общеклинических обследований учитывались данные дуплексного сканирования брахицефальных артерий (ДС БЦА), транскраниальной допплерографии (ТКДГ), мультиспиральной компьютерной томографической ангиографии (МСКТ-ангиографии) и магнитно-резонансной томографии (МРТ) головного мозга. По результатам ДС БЦА у всех пациентов выявлено нарушение хода ВСА в виде патологической извитости различной формы с ЛСК от 150 до 230 см/с. Аневризматическое расширение по данным УЗИ выявлено только в 1 случае. Более полная информация была получена по данным МСКТ-ангиографии экстра- и интракраниальных артерий, при которой во всех случаях выявлена патологическая извитость дистального отдела ВСА различной степени выраженности. В 2 случаях на уровне атланто-аксиального сочленения определялись мешотчатые аневризмы размером 8 и 12 мм, с частичным тромбированием аневризматического мешка (рис. 1). В 1 наблюдении выше аневризмы определялся участок надрыва интимы с фузиформным расширением дистального отдела ВСА.
Рис. 1. МСКТ-3D ангиография БЦА. Стрелкой указана дистально расположенная аневризма ВСА в сочетании с патологической извитостью артерии.
Операции проводились под общей анестезией. Первым этапом стандартным доступом выделялась бифуркация общей сонной артерии (ОСА). Параллельно производился забор лучевой артерии. Средняя длина шунта была 22,5 см. Диаметр в проксимальном отрезке составил от 2,5 до 3,4 мм, в дистальном отрезке — от 2,1 до 3,1 мм. После выполнения краниотомии выделялся М2 сегмент СМА, на него накладывались временные клипсы. Затем выполнялась продольная артериотомия М2 сегмента СМА, формировался дистальный анастомоз с дистальным отделом лучевой артерии по типу конец в бок (рис. 2). Клипсы с СМА снимались. Среднее время пережатия СМА составило от 35 до 44 мин. Шунт проводили в подкожном преаурикулярном тоннеле или под скуловой дугой в рану на шее.
Рис. 2. Формирование дистального анастомоза между М2 сегментом СМА и аутоартериальным шунтом.
После пережатия НСА формировался проксимальный анастомоз по типу конец в бок между начальным отделом НСА и графтом (рис. 3). После снятия зажимов проводился контроль кровотока по шунту и СМА с помощью допплерографии, флуометрии и видеоангиографии с индоцианиновым зеленым (ICG-VA) с временным пережатием ВСА в области устья (рис. 4). При сохранении адекватного кровотока по интракраниальным артериям выполняли лигирование ВСА в устье и ушивание операционных ран. В 1-е сутки после вмешательства всем больным выполняли контрольную МСКТ-ангиографию экстра- и интракраниальных сосудов (рис. 5). В ближайшие часы после операции ВСА в экстракраниальном отделе тромбировалась до уровня отхождения глазничной артерии без развития неврологической симптоматики (рис. 6).
Рис. 3. Формирование проксимального анастомоза между НСА и аутоартериальным шунтом.
Рис. 4. Интраоперационный контроль (ICG-VA). Стрелкой указан дистальный анастомоз.
Рис. 5. МСКТ-контроль дистального анастомоза. Стрелкой указан дистальный анастомоз между М2 сегментом СМА и аутоартериальным шунтом.
Рис. 6. МСКТ-контроль после операции. Отмечается отсутствие контрастирования ВСА в экстракраниальном отделе. Стрелкой указан высокопотоковый экстраанатомический шунт НСА-СМА (High-flow EC-IC bypass).
Осложнений оперативных вмешательств не отмечено. Пациенты выписаны в удовлетворительном состоянии на 8-10-е сутки после операции, им рекомендовано проведение антиагрегантной терапии. При контрольном осмотре через 3, 6 и 9 мес у всех больных состояние удовлетворительное, неврологический статус без отрицательной динамики. По данным контрольных ДС БЦА и МСКТ-ангиографии, проходимость шунта была сохранена во всех случаях.
Лечение аневризм у больных детского возраста
Аневризмы головного мозга у детей встречаются редко и могут сочетаться с различной патологией соединительной ткани (с-м Марфана, с-м Элерса-Данлоса) и различными аномалиями развития вилизиева круга. У детей в три раза чаще, чем у взрослых, выявляются аневризмы со сложными анатомическими характеристиками. Псевдотуморозный и ишемический типы течения при «детских» аневризмах встречаются в несколько раз чаще, чем у взрослых. Случайно обнаруженные аневризмы у детей редки. Принципы хирургического лечения аневризм у детей в целом те же, что и у взрослых. Следует отметить, что компенсаторные возможности ребенка при развитии каких-либо осложнений больше, чем у взрослых, поэтому дети легче переносят выключение несущих аневризму артерий. В этой связи деконструктивные операции можно рассматривать как метод выбора в случаях сложных аневризм при невозможности выключения аневризмы с сохранением проходимости артерии.
Обсуждение
Многие авторы указывают, что аневризмы экстракраниального отдела ВСА следует оперировать независимо от наличия симптомов [2, 17]. Наибольшие сложности возникают при оперативном лечении по поводу аневризм дистальных отделов ВСА в сочетании с патологической извитостью артерии. У больных нашей небольшой серии аневризмы имели близкое расположение к входу в череп. Опираясь на собственный опыт проведения эдоваскулярных и открытых хирургических вмешательств при аневризмах экстракраниального отдела ВСА [24], мы сочли рациональным отказаться от общепринятых операций и применить другую методику хирургического лечения. При обзоре литературы нам не встретились данные о выполнении операции формирования высокопотокового экстраанатомического шунта НСА-СМА (High-flow EC-IC bypass) у пациентов с дистально расположенными аневризмами ВСА в сочетании с патологической извитостью. Имеются упоминания о применении данной операции при лечении сложных аневризм головного мозга [23, 25]. Нами проведена экстраполяция хорошо зарекомендовавшей методики, используемой при лечении сложных интракраниальных аневризм, на группу больных с дистально расположенными аневризмами экстракраниального отдела ВСА. Мы считаем эту операцию менее травматичной и безопасной для пациента, поскольку не требуется выполнения сложного доступа к измененному участку артерии, включающего пересечение грудиноключично-сосцевидной мышцы, заднего брюшка двубрюшной мышцы, резекцию шиловидного отростка, смещение нижней челюсти. Описанные в литературе модификации доступа к дистальному отделу ВСА также весьма травматичны. Так, E. Rosset и соавт. [3] для доступа к аневризмам, расположенным у основания черепа, применяют вскрытие наружного слухового прохода, резекцию шиловидного отростка, резекцию сосцевидного отростка. U. Fish и соавт. [26] описали доступ к сифону ВСА путем субтотальной петрозэктомии, перемещения вперед лицевого нерва и облитерации полости среднего уха. Однако при этом наблюдается высокая частота осложнений, в первую очередь — повреждение черепно-мозговых нервов. Использованная нами методика хирургического лечения не является рутинной. Такую операцию должны выполнять хирурги, имеющие соответствующий опыт. Необходим также тщательный отбор больных с анализом возможностей альтернативных методов лечения. Как показал наш опыт, объемный кровоток по шунту (до 250 мл/мин по данным флуометрии) в достаточной мере обеспечивает адекватное кровоснабжение головного мозга после операции. Результаты проведенных нами операций, отсутствие неврологических и местных осложнений подтвердили правильность выбора хирургического способа лечения у данных пациентов.
Микрохирургическое лечение бессимптомных аневризм
До недавнего времени бессимптомные аневризмы выявляли крайне редко. В последние годы широкое распространение и доступность неинвазивных методов нейровизуализации привели к значительному увеличению числа пациентов со случайно выявленными аневризмами. За последние 10 лет в институте оперировано около 400 пациентов с бессимптомными аневризмами. Результаты хирургического лечения в этой категории больных следует признать удовлетворительными. С учетом этих данных, а также крайне высокой вероятностью неблагоприятного исхода при разрыве аневризмы, можно утверждать, что неразорвавшиеся бессимптомные аневризмы в большинстве случаев необходимо оперировать. Следует отметить, что больной должен быть полностью информирован о характере болезни, предстоящей операции и возможных осложнениях.
Причины развития синдрома позвоночной артерии
Существует несколько основных причин развития у человека шейно-позвоночного синдрома, среди которых следует выделить:
- остеохондроз и другие дегенеративно-дистрофические нарушения в сегментах шейного отдела позвоночника;
- врожденные аномалии строения костных элементов шеи;
- последствия травм в области нахождения позвоночной артерии;
- патологические состояния, которые негативно влияют на состояние симпатического артериального сплетения;
- атеросклеротическое поражение позвоночных артерий и другие патологии сосудистой стенки;
- тонические спазмы мышц в области шеи;
- дефекты строения шейных сосудов.
Квалифицированное лечение при синдроме позвоночной артерии шейного отдела позвоночника должно проводиться вне зависимости от причин развития болезненного состояния. Его объемы и основные методы во многом зависят от природы заболевания. Поэтому при появлении симптомов патологии не стоит заниматься их самолечением, а сразу обращаться за помощью к специалистам, которые имеют опыт работы в подобных клинических ситуациях.
Диагностика
Перед тем как лечить синдром позвоночной артерии, врач направляет пациента для прохождения полноценной диагностики состояния его организма. При данном заболевании диагностические мероприятия включают в себя ряд важных методов:
- рентгенография в области шеи, которая помогает определить участки компрессии сосудов;
- ангиографическое исследование сосудов шеи для определения их проходимости, наличия мест сужения просвета, деформаций, тому подобное;
- ультразвуковое обследование шеи и диагностика состояния сосудов, мышц, определение характера кровотока, наличия зон атеросклероза;
- МРТ в области шеи с более глубоким изучением всех нюансов и нарушений;
- биохимический анализ крови с определением уровня холестерина и степени развития атеросклероза.
Симптомы
Для синдрома позвоночной артерии характерными являются следующие клинические симптомы:
- головные боли, которые при синдроме позвоночной артерии локализируются в затылочной зоне с переходом на переднюю часть головы и могут появляться после резких поворотов шеи или после сна (синдром Барре-Льеу);
- мигренозные боли базилярного характера, которые часто сопровождаются потерей сознания;
- внезапные падения с запрокидыванием головы и нарушением координации;
- потеря нормальной устойчивости и свойства держать равновесие вместе с тошнотой, рвотой, головокружением, потемнением в глазах;
- развитие транзиторных ишемических атак;
- кратковременные обморочные состояния после резких движений головы;
- боли и ощущение «песка» в глазах, нарушение функции зрительного анализатора, выпадение полей зрения, тому подобное;
- ухудшение слуха, шум в ушах;
- приливы жара с повышенной потливостью;
- иногда болевые ощущения в области сердца.
Определить симптомы синдрома позвоночной артерии для опытного специалиста не составляет проблемы. Поэтому при появлении первых признаков недомогания не стоит откладывать визит к врачу, который сможет провести качественную диагностику патологического состояния и вовремя начать лечение.