Классификация патологического состояния
Пролапс митрального клапана – это заболевание, которое может быт врожденным или приобретенным. Помимо этого, классифицируют порок на прослушивающийся и немой. В последнем случае заболевание выявляется только при обследовании у кардиолога.
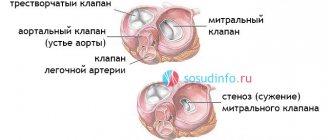
Классификация по степени выпячивания створок атриовентрикулярного клапана в полость предсердия:
- 1-я степень – до 0,5 см;
- 2-я степень – от 0,5 до 0,9 см;
- 3-я степень – более 1 см.
Заболевание наиболее часто диагностируют в возрасте 5-7 лет. За счет того, что сегодня при обследовании используют современные методы, например эхо-кардиографию, заболевание диагностируют в раннем возрасте. По проведенным исследованиям, было выявлено, что до 15% детей страдают рассматриваемым патологическим состоянием.
Пролапс митрального клапана
18.09.2014
Пролапс митрального клапана
Общие сведения о пролапсе митрального клапана, его клинике и диагностике
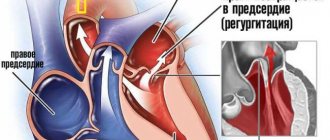
Пролапс митрального клапана – провисание (прогибание) створок митрального клапана в левое предсердие.
Синдром пролабирования митрального клапана, или синдром Барлоу, описан J. Barlow в 1963 г. и встречается крайне часто — у 5–10% людей в популяции.
Необходимо различать истинный пролапс створок и их волнообразное провисание (billowing).
Во многих случаях пролапс митрального клапана протекает асимптомно (не имеет симптомов), в ряде случаев как симптомы пролапса митрального клапана могут наблюдаться аритмии (нарушения ритма сердца), наличие характерного шума при выслушивании тонов, боли в грудной клетке, одышка. Ассоциированными с пролапсом митрального клапана признаются также эмоциональная лабильность, утомляемость и другие неспецифические клинические знаки.
Пролабирование, или провисание, одной или обеих створок митрального клапана в систолу в полость левого предсердия считается истинным только в том случае, если оно регистрируется в двух эхокардиографических позициях: апикальной четырехкамерной и парастернальной по длинной оси левого желудочка.
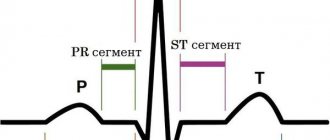
Диагностика пролапса митрального клапана осуществляется при проведении эхокардиографического исследования, проводимого в В-режиме, М-режиме, цветовом и спектральном допплеровских режимах.
В экспертной практике ультразвуковых исследований сердца только сочетание всех режимов позволяет получить целостные представления о характере процесса, наличии и выраженности гемодинамических расстройств.
В ряде стран существует правило проводить у пациентов с синдромом пролабирования любые хирургические вмешательства под прикрытием антибиотиков с целью профилактики осложнений.
В настоящее время в нашей стране присуствует гипердиагностика пролапса митрального клапана у детей и подростков.
Это может быть связано с неправильным выполнением процедуры (техники) исследования – неверным выведением апикальной позиции сердца. Кроме того, незначительное провисание основания передней створки митрального клапана у детей и подростков до 3–5 мм является вариантом нормы, если оно не сопровождается патологической регургитацией. Помимо этого, створки и хорды клапанов развиваются быстрее фиброзных колец, поэтому в детском и юношеском возрасте чаще регистрируют провисание створок.
Необходимо различать физиологический пролапс митрального клапана – без нарушения его функции, и патологический пролапс митрального клапана – с патологической митральной регургитацией.
Для синдрома пролабирования митрального клапана характерны: молодой возраст больных – как правило, 20–50 лет; преобладание женщин; наличие шума – «щелчка» при аускультации, утолщение створок и систолическое их смещение при эхокардиографии, гипотензия, а также митральная регургитация при допплеровском исследовании, степень которой превышает физиологическую.
Не редко встречается миксоматозная дегенерация (разрастание среднего слоя створки митрального клапана – спонгиозы и изменение структуры створок и хорд клапана) створок митрального клапана, признаки которой обнаруживаются у больных старшего возраста – 40–70 лет, среди которых преобладают лица мужского пола. В этих случаях обнаруживается патологическая митральная регургитация при эхокардиографии, имеются выраженные изменения створок, требующие кардиохирургической коррекции.
Миксоматозная дегенерация створок митрального клапана как одна из наиболее частых причин пролабирования митрального клапана может поразить створки всех клапанов сердца, однако чаще всего встречается поражение митрального клапана.
На протяжении последних лет во всем мире значительно возросло число людей, страдающих данной патологией. Еще 10 лет назад большинство больных с миксоматозной дегенерацией составляли больные с синдромом Марфана. В настоящее время доказана связь неблагоприятных экологических факторов и применения ряда препаратов для похудания в возникновении данной патологии. Существенно возросло число больных старше 70 лет, страдающих миксоматозной дегенерацией.
При эхокардиографическом исследовании хорошо видны фестончатые, «змеевидные», неровные, утолщенные створки митрального клапана. Они пролабируют в систолу в полость левого предсердия. На створках образуются округлые выпячивания, напоминающие маленькие опухоли — миксомы. Отсюда произошло название данной патологии. Часто можно наблюдать отрыв хорд створки.
Большинство больных с миксоматозной дегенерацией митрального клапана демонстрируют нарушения ритма сердца — мерцание предсердий или частую желудочковая экстрасистолию. Причинами аритмии служат патологическая митральная регургитация на фоне миксоматозных изменений створок клапана и, как результат, повышение давление в полости левого предсердия.
Пациенты с миксоматозной дегенерацией нуждаются в динамическом наблюдении, лица со значительной митральной регургитацией – в консультации кардиохирурга.
Характер изменений структуры створок митрального клапана и возникновение патологической митральной регургитации могут способствовать инфицированию клапана. Дифференциальный эхокардиографический диагноз в этом случае может быть затруднен.
Дифференциальный диагноз миксоматозной дегенерации створок клапана должен проводиться с инфекционным эндокардитом и разрастаниями Ламбла. Большую роль при этом играет клинико-лабораторная диагностика. Так, при миксоматозной дегенерации отсутствуют воспалительная реакция, регистрируемая при лабораторном исследовании.
Вторичный пролапс митрального клапана встречается в следующих ситуациях:
- Синдром Марфана – мезенхимальная дисплазия. Сопровождается характерным внешним видом пациента («марфаноподобный тип») – повышенной гибкостью суставов, аортоанулярной эктазией, частым развитием аневризмы аорты и отслойки интимы аорты в грудном восходящем отделе и миксоматозной дегенерацией клапанов и подклапанных структур. При этом все клапаны сердца пролабируют. Степень пролапса, как правило, значительная. Регистрируется патологическая клапанная регургитация.
- Гипертрофическая кардиомиопатия. В этом случае пролабирование митрального клапана связано с повышенным давлением в полости левого желудочка в систолу. Особенно выражен пролапс у больных с обструктивной гипертрофическй кардиомиопатией.
- Синдром Элерса–Данлоса – синдром соединительнотканной дисплазии – наследственный дефект гемостаза с повреждением коллагеновых структур. Сопровождается повышенной гибкостью суставов, повышенным растяжением кожи, кровоточивостью и пролабированием клапанов сердца
- Дисфункция папиллярной мышцы на фоне инфаркта миокарда или травмы сердца сопровождается пролабированием створки клапана и значительной митральной регургитацией.
- Отрыв хорд створки клапана на фоне инфекционного эндокардита, миксоматозной дегенерации, инфаркта миокарда, ревматического поражения и т. д. приводит к пролабированию створки и к патологической клапанной регургитации.
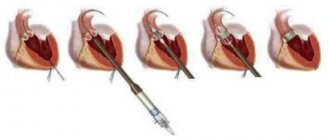
Оценка степени пролабирования митрального клапана осуществляется путем оценки выраженности провисания створок:
- Незначительный пролапс митрального клапана – 3–6 мм (пролапс митрального клапана 1 степени).
- Умеренный пролапс митрального клапана – 6–9 мм (пролапс митрального клапана 2 степени)
- Значительный пролапс митрального клапана – более 9 мм (пролапс митрального клапана 3 степени).
Необходимо помнить, что степень пролабирования и степень митральной регургитации могут не коррелировать между собой. Например, при отрыве хорд на конце створки митрального клапана можно видеть пролабирование до 3 мм и регистрировать при этом митральную регургитацию 3–4-й степени.
Пролапс митрального клапана не является сложным диагнозом, если эхокардиографическое исследование проводится опытным специалистом с использованием высокоразрешающих ультразвуковых систем.
Что при пролапсе митрального клапана предлагаем мы:
Многопрофильный профессорский медицинский предлагает Вам высокоточную диагностику малых аномалий сердца, в том числе – пролапса митрального клапана, других кардиологических и сердечно-сосудистых заболеваний только экспертного уровня.
С нами сотрудничают ведущие российские специалисты –
- профессор Седов Всеволод Парисович,
- профессор Рыбакова Марина Константиновна,
- профессор Хадзегова Алла Блаловна,
- профессор Тарасова Алла Алексеевна,
консультирующие случаи любой диагностической сложности у взрослых (В.П. Седов, М.К. Рыбакова, А.Б. Хадзегова) и у детей, включая грудничков (А.А. Тарасова). Также эхокардиографические исследования у взрослых в нашей клинике проводят доктора Герасимова Наталия Владимировна и Медведева Наталья Михайловна. Эхокардиографию на дому осуществляет Исаков Олег Евгеньевич.
Все эхокардиографические исследования в нашем центре
(исключая процедуры на дому) проводятся на одной из лучших в мире специализированных ультразвуковых системе – Acuson Sequoia – 512 (Siemens AG, США), укомплектованной всеми современными технологиями и датчиками.
Смотрите также:
- Эхокардиография для взрослых
- Эхокардиография для детей
Помимо ультразвукового исследования сердца, мы также предлагаем широкий спектр услуг, включая консультации опытных кардиологов – кандидата медицинских наук Сырова Андрея Валентиновича и кандидата медицинских наук Морозовой Ольги Владимировны, электрокардиографию, холтеровское мониторирование ЭКГ и суточное мониторирование АД, велоэргометрию, любые виды ультразвуковых и лабораторных исследований, консультаций различных специалистов.
Для Вас создан ряд специальных программ профилактики, диагностики и лечения наиболее распространенных сердечно-сосудистых заболеваний.
С более подробной информацией вы можете ознакомиться в других обзорах и статьях, а также в разделе Услуги.
Желаем Вам крепкого здоровья и будем рады видеть Вас с нашей клинике,
коллектив МПМЦ «Сосудистая клиника на Патриарших»
Этиология заболевания
Основная причина заболевания – дисгенезия соединительной ткани, которая входит в состав многих органов и, в частности, клапанного аппарата.
Недоразвитие соединительной ткани может быть вызвано по разным причинам. Это могут быть инфекции, интоксикации и производственные вредности, которые оказывали влияние на организм беременной женщины и плод. Однозначного ответа на то, из-за чего возникает заболевания, нет.
Приобретенная форма патологического заболевания возникает после перенесенного воспалительного заболевания, в частности, инфекционный эндокардит, ревматизм.
Журнал «Здоровье ребенка» 2(5) 2007
Пролапс митрального клапана (ПМК), в основе которого лежат структурно-функциональные нарушения митрального клапана сердца, приводящие к прогибанию створок клапана в полость левого предсердия в момент систолы левого желудочка, занимает ведущее место в структуре заболеваний детского возраста.
За последние годы частота встречаемости ПМК увеличилась, поэтому, несмотря на то что наиболее характерным аускультативным проявлением феномена ПМК является наличие систолических щелчков (кликов) в сочетании с систолическим шумом, при широком внедрении в практику ультразвуковых методов исследования стало ясно, что даже отсутствие у детей каких-либо жалоб, клинических симптомов и аускультативных изменений не исключает возможности его существования [1, 2].
На современном этапе убедительно доказана этиопатогенетическая гетерогенность феномена ПМК, проявляющаяся клиническим полиморфизмом и представленная такими наиболее признанными факторами, как, во-первых, врожденные микроаномалии архитектуры створок, хорд и атриовентрикулярного кольца, которые со временем из-за повторяющихся микротравм на фоне гемодинамических воздействий становятся более выраженными, сопровождаясь избыточной продукцией в строме клапана коллагена преимущественно 3-го типа, и, во-вторых, теория первичного дефекта развития соединительнотканного аппарата митрального клапана, что сочетается с повышением числа стигм дизэмбриогенеза [2, 7, 14]. На клинические проявления ПМК влияют: степень пролабирования клапана, фон, на котором выявляется ПМК, характер электрокардиографических нарушений, наличие осложнений [8–10, 13].
В настоящее время внимание клиницистов привлекают аномалии развития хорального аппарата сердца, встречающиеся у детей в среднем до 38 % случаев [1]. Частота ПМК, который тоже относится к аномалиям развития, у детей колеблется от 3–5 % в возрасте до 1 года с возрастанием к 14 годам до 22–31 % и зависит от метода диагностики [7]. Учитывая такую распространенность ПМК среди детского населения, педиатрам и кардиологам необходимо склониться в сторону большей клинической настороженности и профилактики возможных осложнений [1].
Целью настоящего исследования стало изучение эффективности комплексной терапии клинических проявлений ПМК по результатам проспективного наблюдения за детьми в условиях кардиологического отделения ДМКБ № 5 г. Запорожья.
Материал и методы
Под наблюдением находилось 703 ребенка (280 мальчиков и 423 девочки) от 3 до 18 лет. В возрасте от 3 до 7 лет наблюдалось 108 (15,36 %) детей; от 8 до 12 лет — 243 (34,57 %); от 13 до 18 лет — 352 (50,1 %) ребенка.
Всем детям проводилось комплексное клиническое обследование с учетом жалоб, анамнестических данных, результатов физикальных методов обследования, общеклинических лабораторных и инструментальных (электрокардиография, эхокардиография с допплерэхографией) методов исследования по стандартным методикам. Для диагностики сопутствующей соматической патологии дети были осмотрены отоларингологом, неврологом, офтальмологом, хирургом-ортопедом, эндокринологом, стоматологом, девочки — гинекологом. Характер сердечных нарушений оценивался согласно рекомендациям МКБ-10.
Полученные результаты были обработаны при помощи традиционных статистических методов с использованием программы Excel [4, 12].
В зависимости от клинических проявлений все наблюдавшиеся дети были разделены на 3 группы: ПМК с нарушением ритма и электрокардиографическими симптомами (синдром укороченного Р-Q, WPW-синдром, синдром удлиненного Q-T), ПМК как проявление соединительнотканной дисплазии и ПМК с клиникой дисфункции вегетативной нервной системы.
Пациентам было проведено эхокардиографическое исследование в М- и В-режимах и допплерэхографическое в постоянном волновом и импульсном режимах на аппарате Aloka SSD-630. Использовались общепринятые критерии выявления ПМК [1, 2, 7]. Также двухмерная эхокардиография позволяла обнаружить морфологические микроаномалии строения клапанного аппарата, лежащие в основе возникновения пролапса митрального клапана в виде эктопических креплений или нарушенного распределения сухожильных нитей, изменения конфигурации и положения сосочковых мышц, удлинения сухожильных нитей, избыточности (увеличения) створок клапана. При помощи допплерэхографии количественно оценивались трансмитральный кровоток и функция митрального клапана. Недостаточность митрального клапана диагностировалась по наличию турбулентного систолического потока под створками митрального клапана в левом предсердии. Были приняты следующие градации величины регургитации:
— 1-я степень (+) — систолическая регургитация в области, подлежащей митральному клапану;
— 2-я степень (++) — систолическая регургитация распространяется на 1/3 полости левого предсердия;
— 3-я степень (+++) — распространение систолической регургитации на 1/2 полости левого предсердия;
— 4-я степень (++++) — распространение регургитации более чем на 1/2 полости левого предсердия [1, 7].
Результаты и обсуждение
За последние пять лет, по нашим наблюдениям, количество детей с ПМК в динамике возросло с 18,5 % в 2002 году до 29 % в 2006 году, что объясняется как расширением возможностей ультразвуковой диагностики ПМК (ЭхоКГ), так и увеличением распространенности синдрома дисплазии соединительной ткани с проявлениями дисфункции вегетативной нервной системы у детей.
В результате проведенного исследования установлено, что у подростков ПМК диагностируется достоверно чаще, чем в других возрастных группах, с преобладанием у девочек в соотношении 2 : 1. У остальных групп исследуемых детей данная патология встречается одинаково часто как у мальчиков, так и у девочек.
Все дети независимо от степени тяжести ПМК предъявляли практически однотипные жалобы, вариабельность которых изменялась в зависимости от степени вегетативных нарушений. Отмечались боль и тяжесть в области сердца, чувство нехватки воздуха, частые глубокие вздохи. У ряда детей наблюдались пароксизмальные состояния, которые проявлялись атипичным приступом удушья, в основном после физической нагрузки и психоэмоционального напряжения. Эти состояния у детей с выраженным ПМК (как правило, это дети-ваготоники) расценивали как вегетативные кризы. Нередко у таких детей в катамнезе отмечались синкопальные состояния.
Изменения на электрокардиограмме (ЭКГ) в виде экстрасистолии, синдрома удлиненного Q-T, WPW-синдрома отмечены у 24 % детей c ПМК, ПМК в сочетании с другими проявлениями дисплазии соединительной ткани (гипермобильность суставов, миопия, высокое «готическое» небо, низкое расположение ушей, плоскостопие, астеническая конституция и др.) наблюдали у 12 % больных, у 64 % детей были диагностированы выраженные вегетативные расстройства.
Согласно данным эхокардиографического исследования, в зависимости от степени тяжести ПМК, достоверно чаще встречался ПМК 1-й степени и регистрировался у 609 обследованных (86,6 %), реже выявлялся ПМК 2-й степени — у 81 ребенка (11,5 %), 3-й степени — у 10 человек (1,5 %), 4-й степени — у 3 детей (0,4 %).
У обследованных пациентов отмечались преимущественно голосистолические и позднесистолические варианты пролапсов (98 %). У 9 больных при допплерэхографическом исследовании регистрировалась митральная регургитация 1-й степени, несмотря на наличие ПМК более 7 мм.
Морфометрические показатели сердца у обследованных детей представлены в табл. 1. Проведенное эхокардиографическое обследование выявило у детей всех возрастных групп в сравнении с контрольными только тенденцию к увеличению размера и массы миокарда левого желудочка. Полученные данные не противоречат данным литературы [1] о том, что у детей с пролапсом митрального клапана и метаболическими нарушениями миокарда конечно-диастолический объем левого желудочка увеличивается в среднем на 20 %.
Показатели насосной и сократительной функции миокарда у обследованных детей представлены в табл. 2. Проведенный анализ показал, что у детей с ПМК во всех возрастных группах показатели, которые характеризовали насосную (ФВ и %ΔД) и сократительную способность миокарда левого желудочка (н.Ск.сер. и Ск.цу.), тоже имели тенденцию к снижению в сравнении с контрольными группами, что связано с развитием метаболических нарушений в миокарде.
Показатели систолической амплитуды движения задней стенки левого желудочка и межжелудочковой перегородки, которые косвенно характеризуют состояние насосной функции левого желудочка, были снижены у детей с ПМК во всех 3 возрастных группах в сравнении с контрольными. Изменения кинетики сердечной мышцы, которые оказывались нарушением движения межжелудочковой перегородки и задней стенки левого желудочка, преимущественно регистрировались в виде гипокинезии задней стенки левого желудочка и межжелудочковой перегородки.
Таким образом, у детей с ПМК существуют структурные предпосылки для формирования гемодинамических расстройств, которые имеют важное значение в диагностике и формировании заболеваний сердечно-сосудистой системы у этого контингента больных и характеризуются пока только тенденцией к увеличению конечно-диастолического размера и массы левого желудочка со снижением показателей его сократительной способности и контрактильности.
Учитывая особенности клинических проявлений ПМК, нами были максимально индивидуализированы лечение и тактика ведения детей с учетом возраста, пола, наследственности, наличия и характера дисфункции вегетативной нервной системы, а также степени пролабирования створок митрального клапана. В зависимости от выраженности и характера клинических проявлений назначалась соответствующая медикаментозная терапия. Детям с дисфункцией вегетативной нервной системы проводилась коррекция вегетативных нарушений.
Основные аспекты рекомендуемой терапии включали нормализацию режима дня с чередованием физических и умственных нагрузок. Всем без исключения назначались лечебная гимнастика, посещение бассейна. В отделении широко использовали назначение физиотерапевтических методов лечения, в частности гальванизации по рефлекторно-сегментарной методике. В последние 2 года в отделении внедрено введение лекарственных препаратов непосредственно перед гальванизацией (за 2 часа в/м вводился тиотриазолин), что обеспечивало непосредственное влияние препарата на сердечную мышцу при метаболических изменениях. В комплексной терапии широко применялся электрофорез лекарственных веществ на верхнешейный отдел позвоночника: при ваготонических дисфункциях — с кальцием, при симпатикотонических дисфункциях — с бромом. Очень широко и успешно использовался метод дарсонвализации.
Практически всем детям назначались фитосборы, обладающие седативным действием. Детям с ваготонической направленностью назначались растительные адаптогены: настойка женьшеня, элеутерококка.
Хорошо зарекомендовали себя препараты, улучшающие метаболизм центральной нервной системы. Для улучшения микроциркуляции назначался циннаризин курсом на 2–3 недели. В случае, если у детей на реоэнцефалограмме регистрировались изменения в виде затруднения венозного оттока, сопровождающиеся частыми обострениями респираторного невроза, назначался беллатаминал в течение 2–3 недель.
Обязательно всем детям назначались курсы кардиометаболитов для профилактики и лечения метаболических изменений (рибоксин, АТФ и др.). Также в комплексном лечении больных с ПМК использовались антигомотоксические препараты.
При сочетании ПМК с синусовой тахикардией, экстрасистолией, синдромом удлиненного Q-T, синкопальными состояниями назначались бета-адреноблокаторы: атенолол, метопролол или пропранолол в индивидуально подобранной дозе (1–2 мг/кг) в течение 2–4 месяцев с последующей постепенной отменой. Рекомендовались бета-адреноблокаторы и детям с выраженной митральной регургитацией и пролабированием створок митрального клапана 3-й степени. Детям со стойкими нарушениями ритма без удлинения интервала QT на ЭКГ назначались антиаритмические препараты (кордарон). Также у детей с ПМК при нарушениях сердечного ритма применялись мозговые метаболиты (пирацетам), сосудистые препараты (циннаризин), мембраностабилизаторы (аевит), антисклеротические средства (лидаза).
Так как многие клинические проявления ПМК могут прогрессировать, все наши пациенты с наличием данной патологии госпитализировались в кардиологическое отделение два-три раза в год. Контрольное эхокардиографическое исследование с допплерэхографией через 6 месяцев после проведенного комплексного лечения выявило четкую положительную динамику в течении болезни 594 (84,5 %) детей. Среди них у 48 (8,1 %) детей ПМК более не регистрировался, у 71 (11,9 %) ребенка уменьшилась степень пролабирования, у 59 (9,9 %) больных исчезли нарушения сердечного ритма и нормализовались показатели электрокардиографического исследования, у 6 (1 %) больных более не выявлялась митральная регургитация.
Учитывая существующую возможность осложнений со стороны сердечно-сосудистой системы в виде формирования недостаточности митрального клапана, вторичного бактериального эндокардита, все пациенты с пролапсом митрального клапана в дальнейшем находились под диспансерным наблюдением участкового педиатра и кардиоревматолога, а детям с аускультативной формой ПМК, сопровождающегося регургитацией, обязательно перед стоматологическими процедурами и оперативными вмешательствами проводили антибактериальную профилактику.
Результаты комплексного обследования детей с ПМК показали, что в возникновении пролабирования створок у этих детей имело значение одновременно несколько факторов, основными из которых являлись: неполноценность соединительнотканных структур клапана, минорные аномалии клапанного аппарата, дисфункция вегетативной нервной системы, способствующая гемодинамической дизрегуляции. Своевременная диагностика ПМК и высокая вероятность развития возможных осложнений позволяют рекомендовать этому контингенту детей эффективную терапию, диспансерное наблюдение и адекватную физическую нагрузку.
Выводы
1. В последнее время отмечается рост числа детей с ПМК, особенно девочек подросткового возраста.
2. В структуре всех выявленных ПМК у детей достоверно чаще встречался ПМК 1-й степени (86,6 %), и реже — 2-й степени (11,5 %), 3-й степени (1,5 %), 4-й степени (0,4 %).
3. Синдром дисплaзии соединительной ткани сердца, представленный пролапсом митрального клапана, обусловливает наличие структурных предпосылок для формирования гемодинамических расстройств у детей.
4. В результате проведенного комплексного лечения отмечалась положительная динамика у 84,5 % детей с ПМК, среди которых ПМК более не регистрировался у 8,1 %, уменьшилась степень пролабирования створок у 11,9 % обследованных, полностью исчезли нарушения сердечного ритма у 9,9 %, а митральная регургитация — у 1 % детей.
5. Распространенность пролапса митрального клапана среди детей диктует необходимость проведения эффективных терапевтических мероприятий и диспансерного наблюдения этого контингента больных с целью предупреждения прогрессирования ПМК и возникновения осложнений.
Симптомы
К ним относятся так называемые стигмы — признаки несовершенства соединительнотканного каркаса: гипермобильность суставов, крыловидные лопатки, миопия, готическое (высокое) нёбо, нарушение прикуса, плоскостопие, высокий рост и астеническое телосложение, сколиоз, грыжи, варикозное расширение вен. Также нарушение архитектоники атриовентрикулярного кольца со смещением створок и дополнительными хордами в клапанном аппарате.
Позднее, к 7-ми годам, появляется дополнительная симптоматика: кратковременные колющие боли в области сердца психоэмоционального характера, а не за счет повреждения сердечной мышцы, приступы учащенного сердцебиения, перебои.
Дополняют признаки сосудистой дистонии головокружение, цефалгии утром, усиливающиеся после переутомления, пониженная работоспособность и повышенная утомляемость. Дети слезливы, часты страхи, депрессивные состояния, раздражительность, плохой сон. По сути, это масса микроаномалий, сочетающихся с вегетативно-сосудистой нестабильностью.
Педиатр или кардиолог прослушивает шум над областью сердца и определяет его характер — позднесистолический или в виде систолического щелчка.
Ю.М.Белозеров, Ш.М. Магомедова, И.М.Османов Московский НИИ педиатрии и детской хирургии Министерства здравоохранения и социального развития РФ
Установлено, что на долю пролапса митрального клапана (ПМК) в структуре сердечно-сосудистых заболеваний детского возраста приходится 3-5% в популяции [1]. Исследованиями последних лет показана генетическая и фенотипическая гетерогенность синдрома ПМК [2, 3]. При аутосомно-доминантном наследовании обнаружены 3 гена синдрома, которые картированы на хромосомах 16p12.1, p11.2 и 13 [4]. Другой локус обнаружен на Х хромосоме (Xq28) и обуславливает редкую форму ПМК, которую обозначают «Х сцепленной миксоматозной клапанной дистрофией» [5]. C.Yosefy, A.Ben Barak [6] выявили полиморфизм фибриллин 1 гена в эксоне 15 TT и эксоне 27 GG. Такая генетическая гетерогенность синдрома обуславливает возникновение различных форм первичного ПМК, а также широкий спектр клинических проявлений в зависимости от возраста [7]. Различные мутации перечисленных генов приводят к неполноценному функционированию соединительной ткани, особенно фибриллина, эластина, коллагена I и III типов [8]. Нарушенный фибриллогенез внеклеточного матрикса обуславливает миксоматозную инфильтрацию створок митрального клапана, дефицит фиброэластических волокон, изменение коллагена, аккумуляцию мукополисахаридов. Основываясь на «континууме переходных состояний», отечественные авторы выделяют понятие недифференцированной дисплазии соединительной ткани (НСТД) [9, 10], лежащей в основе ПМК. Согласно Фремингемскому исследованию (Framingham Heart Study) Американской Коллегии кардиологов (АСС) и Американской Ассоциации кардиологов, диагноз ПМК может быть поставлен только при наличии двух диагностических признаков: аускультативных и эхокардиографических [11].
Материал и методы Все обследованные больные были разделены на следующие группы: 1-я группа ПМК – при недифференцированной соединительнотканной дисплазии (НСТД) – 340 детей и подростков (в эту группу включены также первичный и семейный ПМК с дисплазией соединительной ткани – ДСТ); 2-я группа ПМК – при дифференцированной соединительнотканной дисплазии (ДСТД) – 65 детей и подростков (в эту группу включены больные с синдромом Марфана и Элерса-Данлоса). Контрольную группу составили 200 детей и подростков аналогичного возраста. Балльная оценка фенотипических проявлений соединительнотканной дисплазии была сделана по 1-й группе – выделены три подгруппы (340 пациентов). Изучение эластических свойств аортальной стенки было проведено у пациентов из обеих групп (64 пациента). Изучение истощаемости вегетативной нервной системы – у 200 пациентов из всех трех групп, включая контрольную.
Результаты и обсуждение Согласно анамнезу, многие дети с ПМК как с недифференцированной, так и дифференцированной ДСТ родились от матерей с неблагоприятным течением беременности и родов. Ранние и поздние гестозы наблюдались достоверно чаще у матерей, имеющих детей с ПМК на фоне ДСТД (56,9 в сравнении с 25,8% при НСТД; pЖалобы пациентов с ПМК при недифференцированной и дифференцированной ДСТ реализовались в симптомокомплекс хронического психоэмоционального напряжения, частота которого в 6 раз превышала показатель контрольной группы здоровых детей. Хроническое психоэмоциональное напряжение приводит к нейроциркуляторной нестабильности. Под нейроциркуляторной нестабильностью (neurocirculatory instability) (термин принят Европейской Ассоциацией кардиологов в 1995 г.) понимают нарушение автономной регуляции сосудистого тонуса у подростков пре- и пубертатного периода [12]. В отличие от нейроциркуляторной дистонии нейроциркуляторная нестабильность не сопровождается стойким отклонением сосудистого тонуса – артериальной гипо- и гипертензией. Подъемы артериального давления при нейроциркуляторной нестабильности носят переменный характер, артериальная гипертензия может сменяться артериальной гипотензией. Такие перепады артериального давления могут приводить к соматическим нарушениям, формированию специфического соматотипа. Достоверно чаще у детей с ДСТД в сравнении с НСТД (52,3% и 20,2%, рУ обследованных детей с ПМК на фоне ДСТ ощущение сердцебиения может быть связано с различными причинами:
• непропорциональной тахикардией при эмоциональной или физической нагрузке; • усиленной пульсацией дилатированной аорты; • торакодиафрагмальными изменениями; • нарушением ритма сердца; • нейропсихиатрической симптоматикой (панические атаки, нервозность, вегето-сосудистая дистония).
Существенное превышение частоты кардиалгий наблюдалось у детей и подростков с ПМК при недифференцированной и дифференцированной ДСТ. Боли в области сердца характеризовались как «колющие», «давящие», «ноющие» и ощущались в левой половине грудной клетки без какой-либо иррадиации. У большинства детей они продолжались в течение 5-20 мин, возникали обычно при беге, быстром подъеме по лестнице, в связи с эмоциональным напряжением и сопровождались, как правило, вегетативными нарушениями: неустойчивым настроением, похолоданием конечностей, «зябкостью», сердцебиением, потливостью, проходили самопроизвольно и после приема седативных препаратов. Отсутствие ишемических изменений в миокарде, по данным комплексного обследования, позволяет расценить кардиалгии как проявление симпаталгии, связанной с психоэмоциональными особенностями детей с ПМК («боль в сердце неотделима от личности»). По данным литературы, боли в области сердца у детей и подростков с ПМК и ДСТ могут быть обусловлены следующими причинами:
• чрезмерное натяжение хорд, приводящее к перерастяжению папиллярных мышц; • микроэмболия коронарных артерий из-за повышенной аггрегации тромбоцитов и фибринозных депозитов, расположенных в углу между левым предсердием и задней митральной створкой; • непропорциональная тахикардия во время физического и/или эмоционального стресса; • гиперадренергический статус, который увеличивает потребность миокарда в кислороде; • спазм коронарных артерий.
Обморочные состояния наблюдались только при ПМК на фоне ДСТД и были обусловлены ортостатическим падением АД. В последнее время обсуждается вопрос о нарушении нейровегетативной регуляции сердечной деятельности и сосудистого тонуса. Так, многие авторы отмечают при синдроме Марфана ортостатическую гипотензию [13], часто сопровождающуюся головными болями [14]. Генез возникающих обмороков до конца не выяснен. Наши данные подтверждают наличие ортостатической нестабильности у детей и подростков с ДСТД и ПМК, а обмороки имеют вазодепрессорный генез. Аускультативная картина при ПМК на фоне недифференцированной и дифференцированной ДСТ была практически одинакова. Чаще всего определялся аускультативный феномен сочетания щелчков с позднесистолическим шумом (53,5 и 42,9% соответственно), затем позднесистолический или голосистолический шум (13,3 и 30,8% соответственно, pНаблюдается определенный параллелизм выраженности пролабирования створок и звуковых феноменов. При изолированных щелчках прогибание створок обычно небольшое, при изолированном позднесистолическом и голосистолическом шуме – значительное. Известно, что общебиологическое значение роста состоит в достижении такого уровня развития организма, который необходим для его репродукции. У человека конечная программа роста состоит в достижении не только репродуктивного, но интеллектуального и социального совершенства [15]. Высокий уровень стигм соединительнотканного развития выявлен у детей и подростков с ДСТ, причем достоверных отличий в подгруппах с дифференцированной и недифференцированной дисплазией нами не получено, за исключением тех нарушений, которые свойственны для конкретного молекулярно-генетического заболевания (болезнь Марфана – дефект гена fibrillin-1 – 134797.0001, который картирован на хромосоме 15q21.1) или синдром Элерса-Данлоса, обусловленный мутациями в гене коллагена альфа-1(V) (COL5A1; 120215), коллагена альфа-2 A (V) (COL5A2; 120190) или коллагена альфа-1 (I) (COL1A1; 120150). С другой стороны, высокая частота стигм соединительнотканного дизэмбриогенеза при ДСТ подтверждает факт, что наряду с генетическими механизмами заболевания большое значение имеют внешние факторы, которые могут вызвать значительные индивидуальные отклонения, клинический полиморфизм ДСТ. Балльная оценка фенотипических проявлений соединительнотканной дисплазии при НСТД свидетельствует о большом разбросе изучаемых показателей в данной группе больных с ПМК. В этой связи на основании многофакторного анализа, включая анамнестические, генеалогические данные, а также результаты обследования нами выделены три подгруппы детей и подростков с ПМК на фоне НСТД:
1-я – ПМК с умеренными проявлениями НСТД (количество баллов от 23 до 49 – 82 пациента); 2-я – ПМК с выраженными проявлениями НСТД (количество баллов от 50 до 75 – 196 пациентов); 3-я – ПМК с резко выраженными проявлениями НСТД (количество баллов от 76 до 90 – 62 пациента).
При физикальном осмотре границы сердца у всех обследованных больных соответствовали нормальным значениям, за исключением детей с деформациями грудной клетки, когда происходило смещение (чаще влево) перкуторных границ абсолютной и относительной тупости сердечной тени. Довольно часто у детей с ПМК на фоне НСТД определялась дилатация легочной артерии. Следует отметить, что рентгеновское исследование позволяет выявить дилатацию легочной артерии (ЛА) и подтвердить ее выраженность при индексе Мура более 40%, но не позволяет выявить истинную причину дилатации ЛА. Нами проведено сопоставление показателя индекса Мура с уровнем стигм дизэмбриогенеза. Индекс Мура был тем больше, чем больше определялось фенотипических признаков соединительнотканного дизэмбриогенеза. Это подтверждает связь дилатации легочной артерии с неполноценностью соединительнотканного матрикса. Основные электрокардиографические нарушения, обнаруживаемые при НСТД и ДСТД, встречаются в 30% случаев и включают изменения конечной части желудочкового комплекса, нарушения сердечного ритма и проводимости, удлинение интервала QT. Аномалии реполяризации выявляются как при проведении стандартной ЭКГ и значительно чаще при суточном мониторировании электрокардиограммы [16]. Данный факт свидетельствует о наличии у детей с синдромом ПМК на фоне как дифференцированной, так и недифференцированной ДСТ скрытой миокардиальной нестабильности. Появление реполяризационных изменений в ортоположении можно объяснить увеличением натяжения папиллярных мышц за счет возникающей тахикардии, уменьшения объема левого желудочка и увеличения глубины пролабирования створок. Если раньше причину таких ST-T изменений на ЭКГ при ПМК связывали с ишемическим нарушением коронарного кровообращения или рассматривали как сочетанное проявление диспластического процесса в сердце, то в настоящее время большинство авторов видят причину реполяризационных нарушений при ПМК в гиперсимпатикотонии. Подобное утверждение обосновывается тем, что ST-T изменения при ПМК носят вариабельный характер и полностью исчезают при проведении нагрузочной фармакологической пробы с b-адреноблокатором. В единичных публикациях сообщается о возникновении миокардиальной ишемии при синдроме ПМК у детей [17]. В генезе транзиторной ишемии у таких больных могут лежать врожденные аномалии коронарных сосудов. Миокардиальная ишемия нами устанавливалась при проведении физической нагрузки, в случае если происходило ухудшение процесса реполяризации ишемического генеза, и выявлялась у единичных больных (у 2 пациентов с ПМК и НСТД и 3 пациентов с ДСТД). Нами проведено изучение малых аномалий развития сердечных структур у детей с ПМК и ДСТ. Большинство из микроаномалий имеют отношение к соединительнотканным структурам сердца. Одни малые аномалии, например нарушенное распределение хорд, могут иметь непосредственное отношение к синдрому ПМК, являясь причинным фактором. Другие аномалии, например дилатация магистральных сосудов, коронарного синуса и др., отражают неполноценность соединительнотканных структур. Особое значение имеют аномально крепящиеся сухожильные хорды подклапанного аппарата. Ряд авторов считают их причиной пролапса митрального клапана [18]. При соединительнотканной дисплазии страдает не только клапанный аппарат сердца, но и магистральные сосуды. В этой связи нами предпринято изучение эластических свойств аортальной стенки у подростков с ПМК по методу E.Michelfelder и соавт., [19]. Проводилось определение индекса растяжимости и жесткости аорты. Исследование проведено у 64 подростков в возрасте 15-18 лет (средний возраст 16,4±0,7), разделенных на 2 подгруппы: 1-я подгруппа – 48 пациентов (33 девушки и 15 юношей) с ПМК на фоне НСТД; 2-я подгруппа – 16 (10 девушек, 6 юношей) пациентов с ПМК и ДСТД. Установлено достоверное повышение индекса растяжимости аорты (аortic distensibility: контроль 0,0021±0,005 mmHg-1, ПМК и НСТД – 0,0035±0,007 mmHg-1, ПМК и ДСТД – 0,0038±0,006 mmHg-1 (pУстановлены характерные вегетативные изменения при ПМК на фоне НСТД. При увеличении степени ДСТ происходило достоверное увеличение ваготонических признаков, что может быть связано с компенсаторной реакцией на исходную симпатикотонию. Проведенное исследование состояния вегетативной нервной системы позволило установить характерный вегетативный паттерн при ДСТД, когда исходная симпатикотония сочетается с асимпатикотонической реактивностью. Данный факт свидетельствует о низкой адаптационной способности и быстрой «истощаемости» симпатического звена ВНС. У многих детей с ПМК, преимущественно в подростковом возрасте, выявляются психоэмоциональные нарушения, представленные депрессивным и астеническим симптомокомплексами. С целью оценки психологического портрета личности нами использовался сокращенный многофакторный опросник личности – СМОЛ. При определении психологического профиля (обследовано 200 подростков) личности путем тестирования СМОЛ, нами был получен ряд закономерностей. Показатели усредненного профиля СМОЛ у подростков контрольной группы не выходили за пределы условно принятой нормы: >70 и Максимальные характерологические изменения были обнаружены у подростков с ПМК на фоне НСТД. Обращали на себя внимание высокие значения по второй и седьмой шкалам, превышающие 70 баллов, что отражало выраженную психологическую дезадаптацию, а также пики профиля по третьей шкале, подчеркивающие экзальтированность поведения и эмоциональную лабильность. Кроме того, межгрупповые отличия были получены для показателей данной шкалы между группами с НСТД и ДСТД. Обращает на себя внимание и пик профиля по первой шкале (67,5 балла), приближающийся к условной границе психической нормы/патологии – 70 баллов. Это говорит о значительно выраженной склонности к аггравации, «уходу в болезнь» подростков этой группы, что сочетается с выраженной эмоциональной лабильностью. В группе подростков с ПМК и ДСТД были обнаружены достоверные повышения профиля по второй, третьей и седьмой шкалам относительно группы сравнения, что отражало сумрачный фон настроения, повышенную тревожность в сочетании с тенденцией к истерическим реакциям. Выявлено снижение качества жизни у подростков при различных вариантах ПМК, затрагивающее как психическое, так и физическое здоровье. Степень снижения качества жизни и количество затронутых шкал зависит от выраженности соединительнотканной дисплазии. Для подростков как с ПМК и ДСТД, так и ПМК и НСТД было характерно снижение качества жизни практически по всем изученным шкалам. В шкалах, характеризующих физическое функционирование, наименьшие показатели отмечались в группе лиц с ПМК и ДСТД. Что же касается психического компонента здоровья, здесь наименьшие значения отмечались в группе подростков с ПМК и НСТД, хотя у пациентов с ПМК и ДСТД они также были достоверно ниже контрольных значений. Таким образом, можно сделать вывод, что степень соединительнотканных нарушений является ведущим фактором, определяющим качество жизни подростка. Тактика ведения детей с ПМК различается в зависимости от степени соединительнотканной дисплазии, выраженности пролабирования створок, характера вегетативных и сердечно-сосудистых изменений [20]. Нами отмечен положительный результат при лечении детей с ПМК и ДСТ карнитеном и препаратами магния. У детей и подростков с ПМК и ДСТ в большинстве случаев отмечен дефицит карнитина, который подтверждается синдромом хронической усталости. Проба с карнитеном является индикатором недостаточности трофотропных механизмов в регуляции сердечной деятельности. О положительной реакции на карнитен свидетельствуют изменения ВСР в виде увеличения VLF и уменьшения HF. Всем детям с пролапсом митрального клапана показано назначение карнитена для улучшения энергетических процессов в сердечной мышце. Не вызывает сомнения, что энерготропная терапия карнитеном (на материале обследования 30 детей) является важным звеном коррекции обменных нарушений в сердечной мышце у больных с ПМК и ДСТ. С другой стороны, положительный эффект от проводимой терапии подтверждает большую роль вторичной митохондриальной недостаточности в патогенезе соединительнотканной дисплазии. Нами также проведено исследование влияния препарата Магнерот® на структуру створок митрального клапана при ПМК связанного с НСТД. В исходных значениях при ПМК выявлена достоверно большая толщина створок у мальчиков (t=5,11 pПосле 6-месячного курса терапии препаратом Магнерот® у пациентов с ПМК и НСТД установлено значительное улучшение объективной и субъективной симптоматики с полной или почти полной редукцией проявлений болезни более чем у половины больных. На фоне лечения отмечено уменьшение тяжести синдрома вегетативной дистонии, сосудистых, геморрагических и психопатологических расстройств, нарушений ритма сердца, уровня АД, а также улучшение качества жизни пациентов. Кроме того, на фоне лечения достоверно уменьшилась выраженность морфологических маркеров дисплазии соединительной ткани [10]. Таким образом, полученные данные косвенно свидетельствуют о том, что в основе диспластического развития соединительнотканных структур большое значение играют не только генетические факторы, но и патологическое «созревание», дифференцировка соединительной ткани при нарушенном фетальном развитии. При этом необходимо отметить, что развитие и созревание митрального аппарата, соединительнотканных структур и вегетативной нервной системы происходит синхронно в одно и то же время эмбриогенеза и постнатального онтогенеза.
Литература 1. Sakamoto S. Mitral valve prolapse. Nippon Rinsho. 2005 Jul; 63 (7):1195-2000. 2. Yosefy C., Levine R.A., Picard M.H. et al. Pseudodyskinesis of the inferior left ventricular wall: recognizing an echocardiographic mimic of myocardial infarction. J Am Soc Echocardiogr. 2007 Dec; 20 (12): 1374-9. 3. Martínez-Sellés M., García-Fernández M.A., Larios E. et al. Etiology and short-term prognosis of severe mitral regurgitation. Int J Cardiovasc Imaging. 2009 Feb; 25 (2): 121-6. 4. Levine R.A., Slaugenhaupt S.A. Molecular genetics of mitral valve prolapse. Curr Opin Cardiol. 2007 May; 22 (3): 171-5. 5. Grau J.B., Pirelli L., Yu P.J., Galloway A.C., Ostrer H. The genetics of mitral valve prolapse. Clin Genet. 2007 Oct; 72 (4): 288-95. 6. Yosefy C., Ben Barak A. Floppy mitral valve/mitral valve prolapse and genetics. J Heart Valve Dis. 2007 Nov; 16 (6): 590-5. 7. Romanelli P., Romanelli R., Rongioletti F. et al. Clinical significance of cutaneous proteoglycan (mucin) infiltration in patients with mitral valve prolapse. J Am Acad Dermatol. 2008 Jul; 59 (1): 168-9. 8. Gupta-Malhotra M., Dave A., Sturhan B.C. et al. Prevalence of undiagnosed congenital cardiac defects in older children. Cardiol Young. 2008 Aug; 18 (4): 392-6. 9. Мартынов А.И., Степура О.Б., Остроумова О.Д. и др. Пролапс митрального клапана. Ч. I. Фенотипические особенности и клинические проявления. Кардиология. 1998; 1: 72-80. 10. Мельник О.О., Остроумова О.Д., Степура О.Б. Пролапс митрального клапана – норма или патология? 2002; 10: 28: 1314-28. 11. Freed L.A., Levy D., Levine R.A. et al. Prevalence and clinical outcome of mitral valve prolapse. N. Engl. J. Med. 1999, 341 (1): 1-7. 12. Mochizuki Y., Okutani M., Donfeng Y. et al. Limited reproducibility of circadian variation in blood pressure dippers and nondippers. Am J Hypertens. 1998 Apr; 11 (4 Pt 1): 403-9. 13. van Dijk N., Boer M.C., Mulder B.J., van Montfrans G.A., Wieling W. Is fatigue in Marfan syndrome related to orthostatic intolerance? Clin Auton Res. 2008 Aug; 18 (4): 187-93. 14. Rosser T., Finkel J., Vezina G., Majd M. Postural headache in a child with Marfan syndrome: case report and review of the literature. J Child Neurol. 2005 Feb; 20 (2): 153-5. 15. Вельтищев Ю.Е. Рост ребенка: закономерности, нормальные вариации, соматотипы, нарушения и их коррекция. 2000; 66. 16. Digeos-Hasnier S., Copie X., Paziaud O., Abergel E., Guize L. et al. Abnormalities of ventricular repolarization in mitral valve prolapse. Ann Noninvasive Electrocardiol. 2005 Jul; 10 (3): 297-304. 17. Guthmann J.P., Rossignol A.M., Wolf J.E., Azoulay A., Bost M. Transient myocardial ischemia and isolated congenital mitral valve prolapse in an infant. Arch Mal Coeur Vaiss. 1991 May; 84 (5): 735-8. 18. Boon R., Hazekamp M., Hoohenkerk G., Rijlaarsdam M., Schoof P. et al. Artificial chordae for pediatric mitral and tricuspid valve repair. Eur J Cardiothorac Surg. 2007 Jul; 32 (1): 143-8. 19. Michelfelder E.C., Khoury P., Witt S.A., Glascock B.J., Kimball T.R. Noncircumferential myofiber function: impact on early diastolic filling in children. J Am Soc Echocardiogr. 2001 Nov; 14 (11): 1065-9. 20. Scordo K.A. Medication use and symptoms in individuals with mitral valve prolapse syndrome. Clin Nurs Res. 2007 Feb; 16 (1): 58-71.
Симптомы заболевания у младшей возрастной группы
Диагностика ПМК у детей до 3 лет проводится преимущественно при наблюдении семейным врачом. Появление жалоб чаще всего связано с высокой физической или психоэмоциональной активностью.
Физической нагрузкой для детей первого года жизни считается грудное вскармливание или плач. Признаки нарушений в сердечно-сосудистой системе: одышка, покраснение или цианоз (синюшность) кожных покровов, раздувание крыл носа или шумный вдох.
Наиболее распространенная жалоба при пролапсе митрального клапана у подростка – неспецифические («колющие», «давящие» или «ноющие») боли в левой половине грудной клетки. Характеризуются отсутствием иррадиации и длительностью от 5 до 20 минут.
Чаще всего болевые ощущения возникают при беге или быстром подъеме по лестнице и сопровождаются неустойчивым настроением, потливостью, похолоданием конечностей. Врачи связывают появление данного симптома с повышенной активностью симпатического отдела вегетативной нервной системы (усиленный выброс катехоламина способствует спазму сосудов и повышению потребности миокарда в кислороде).
Основные симптомы, возникающие у детей с ПМК:
нейроциркуляторная нестабильность, которая проявляется переменами артериального давления (поочередные подъем и снижение);- непропорциональная тахикардия (учащенное сердцебиение) во время физических нагрузок или сильных эмоциональных потрясений;
- усиленная и ускоренная пульсация сосудов;
- нарушения ритма (вторичные изменения, которые возникают при значительном ремоделировании сердца или вовлечении в процесс проводящей системы);
- нейропсихическая симптоматика (панические атаки, нервозность, вегето-сосудистая дистония).
Постановка диагноза ПМК проводится исключительно после подтверждения аномалии с помощью аускультации (выслушивается характерный систолический шум на верхушке сердца) и эхокардиографии.
Признаками патологии при ультразвуковом исследовании являются изменение толщины и выворачивание створок во время систолы в полость предсердия, а также уровень регургитации. В зависимости от выраженности обратного тока крови устанавливается степень пролапса, которая определяет прогноз и дальнейшую тактику ведения пациента.