Гипертрофическая кардиомиопатия – это наследственный недуг. Симптомы ГКМП включают обмороки, боль в груди, одышку. Лечение гипертрофической кардиомиопатии, в первую очередь, направлено на облегчение симптомов заболевания и предупреждение развития осложнений. Более подробно о методах диагностики и лечения ГКМП – читайте ниже.
Гипертрофическая кардиомиопатия (ГКМП) очень распространенное заболевание, которое может поразить человека в любом возрасте. Женщины и мужчины подвержены заболеванию в одинаковой мере. ГКМП – это самая частая причина внезапной смерти по причине остановки сердца у молодых людей, включая спортсменов.
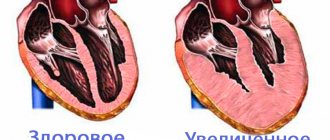
Гипертрофическая кардиомиопатия (ГКМП) – это заболевание, характеризующееся патологическим увеличением (гипертрофией) сердечной мышцы (миокарда), в результате чего сердцу становится все тяжелее перекачивать кровь.
Зачастую болезнь протекает незамеченной, поскольку клинически проявляется слабо, поэтому люди живут нормальной жизнью без существенных проблем. Однако, у незначительной части людей с ГКМП заболевание может вызывать одышку, боли в груди или нарушение сократительной способности сердца, которое может проявляться в патологическом ритме сердца (аритмии), угрожающей жизни.
Причины возникновения и развития ГКМП
Гипертрофическая кардиомиопатия чаще всего обусловлена генетическими аномалиями организме (генная мутация), которые провоцируют развитие патологического утолщения сердечной мышцы. У людей с ГКМП наблюдается беспорядочное расположение мышечных волокон в миокарде, что называется кардиомиоцитарными нарушениями. Такие нарушения могут быть причиной аритмии в некоторых случаях.
Степень гипертрофии сердечной мышцы может быть очень разной. У многих больных ГКМП наблюдается форма заболевания, при которой перегородка между нижними камерами сердца (желудочками) утолщена и создает барьер для выхода крови из сердца. Такое состояние называют обструктивной гипертрофической кардиомиопатией.
Иногда при гипертрофической кардиомиопатии нет значительного барьера для выхода крови, однако, наблюдается нарушение расслабления основной сократительной камеры сердца (левого желудочка), в результате чего снижается наполнение левого желудочка и объем перекачиваемой крови по организму с каждым сокращение сердца. Такая форма заболевания часто называется необструктивной гипертрофической кардиомиопатией.
Осложнения ГКМП
Во многих случаях нет ярко выраженных клинических проявлений гипертрофической кардиомиопатии. Однако, иногда могут наблюдаться следующие осложнения:
- Аритмия. Утолщение сердечной мышцы, так же, как и нарушение структуры сердечных волокон, могут отрицательно влиять на сократительную функцию сердца, результатом чего становится учащенное сердцебиение или аритмия. Гипертрофия сердечной мышцы может стать причиной возникновения таких нарушений ритма сердца, как мерцательная аритмия, желудочковая тахикардия и фибрилляция желудочков. Мерцательная аритмия, кроме того, увеличивает риск образования тромбов, которые, попав в сосуды мозга, могут стать причиной инсульта.
- Нарушение кровотока. Гипертрофия сердечной мышцы может стать причиной нарушения оттока крови из сердца, что вызывает одышку во время физических нагрузок, боль в груди, головокружения и обмороки.
- Дилатационная гипертрофическая кардиомиопатия. С течением времени у незначительного количества больных утолщенная сердечная мышца ослабевает и плохо выполняет свою функцию. Желудочек растягивается (дилатирует), в результате чего сила его сокращений снижается.
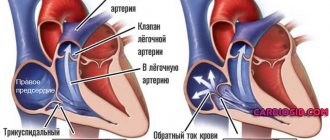
- Недостаточность митрального клапана. Утолщение сердечной мышцы может привести к тому, что просвет для протока крови заужается и поток крови вынужден проходить через сердечные клапаны под давлением, а также быстрее, чем положено. Это приводит к повышенному изнашиванию клапана между левым предсердием и левым желудочком (митральный клапан), в результате чего он не способен плотно закрываться, и кровь просачивается обратно в левое предсердье (недостаточность митрального клапана), что может стать причиной усиления интенсивности симптомов.
- Сердечная недостаточность. Со временем сердечная мышца становится ослабленной и не обеспечивает необходимого кровообращения, в результате чего сердце перестает в достаточной мере снабжать ткани и органы кровью.
- Внезапная остановка сердца. Желудочковая тахикардия и фибрилляция желудочков могут стать причиной внезапной остановки сердца. При гипертрофической кардиомиопатии возрастает риск внезапной остановки сердца, однако, это происходит крайне редко. Внезапная остановка сердца происходит у приблизительно 1% больных ГКМП ежегодно. Гипертрофическая кардиомиопатия может стать причиной смерти вследствие разных сердечно-сосудистых заболеваний у людей разного возраста, но чаще всего внезапная смерть от ГКМП наступает у людей в возрасте до 30 лет.
Гипертрофическая кирдиомиопатия
Лечение ГКМП, генетически обусловленного заболевания, обычно распознаваемого на поздней стадии, является в большей степени симптоматическим и паллиативным. Основными задачами лечебных мероприятий являются не только профилактика и коррекция основных клинических проявлений заболевания с улучшением качества жизни пациентов, но и положительное влияние на прогноз, предупреждение случаев ВС и прогрессирования заболевания. Больным ГКМП рекомендуют избегать значительных физических нагрузок, которые сопровождаются тахикардией, еще большим ухудшением диастолического наполнения ЛЖ и возрастанием внутрижелудочкового градиента давления в выносящем тракте ЛЖ.
При выборе лечебной программы оценивают риск внезапной смерти этих больных. Факторами высокого риска внезапной смерти при ГКМП являются молодой возраст (менее 14 лет); наличие у больных обмороков и тяжелых желудочковых нарушений ритма (спонтанная устойчивая желудочковая тахикардия, фибрилляция желудочков), эпизодов неустойчивой желудочковой тахикардии по результатам суточного ЭКГ мониторирования; неадекватность прироста АД в ходе нагрузочного теста; выраженная (более 3 см) гипертрофия миокарда ЛЖ; указание на ГКМП и/или внезапную смерть в семейном анамнезе. Вероятность внезапной смерти повышается при наличии у больного фибрилляции предсердий (пароксизмальной, постоянной тахиформы мерцательной аритмии), выраженной ишемии миокарда, обструкции выходного тракта ЛЖ.
Большое значение отводится обнаружению у больных с семейным характером ГКМП мутаций, ассоциированных с тяжелым прогнозом. Установление высокого риска внезпной смерти определяет необходимость более активной лечебной тактики (уточнение лекарственной терапии, использование пейсмейкеров, дефибрилляторов-кардиовертеров, проведение кархирургических операций). Наиболее адекватным лечебным мероприятием является имплантация дефибриллятора-кардиовертера с целью первичной или вторичной профилактики жизнеугрожающих аритмий и улучшения прогноза.
Консервативное лечение
Основу медикаментозной терапии ГКМП составляют препараты с отрицательным инотропным действием: b-адреноблокаторы и блокаторы кальциевых каналов (верапамил). Для лечения распространенных при этом заболевании нарушений сердечного ритма используются дизопирамид, амиодарон.
В-адреноблокаторы остаются наиболее эффективной группой лекарственных средств, применяемых в лечении ГКМП. Они оказывают хороший симптоматический эффект в отношении основных клинических проявлений: одышки и сердцебиения, болевого синдрома, включая стенокардию, не менее чем у половины больных ГКМП, что обусловлено в основном способностью этих препаратов уменьшать потребность миокарда в кислороде.
Благодаря отрицательному инотропному действию и уменьшению активации симпато-адреналовой системы при физическом и эмоциональном напряжении b-блокаторы предотвращают возникновение или повышение внутрижелудочкового градиента давления у больных с латентной и лабильной обструкцией, существенно не влияя на величину этого градиента в покое. Убедительно доказана способность b-блокаторов улучшать функциональный статус пациентов в условиях курсового и длительного применения. Хотя препараты не оказывают прямого влияния на диастолическое расслабление миокарда, они могут улучшать наполнение ЛЖ косвенно – за счет уменьшения частоты сердечных сокращений (ЧСС) и предупреждения ишемии сердечной мышцы.
В литературе имеются данные, подтверждающие способность b-блокаторов сдерживать и даже приводить к обратному развитию гипертрофии миокарда. Однако вызываемое b-блокаторами симптоматическое улучшение не сопровождается регрессией гипертрофии ЛЖ и улучшением выживаемости больных. Хотя эффект этих препаратов в отношении купирования и предупреждения желудочковых и суправентрикулярных аритмий и внезапной смерти не доказан, ряд специалистов все же считает целесообразным их профилактическое назначение больным ГКМП высокого риска, включая пациентов молодого возраста с отягощенным случаями ВС семейным анамнезом.
Предпочтение отдается b-блокаторам без внутренней симпатомиметической активности. Наибольший опыт накоплен по применению пропранолола (обзидан, анаприлин). Его назначают, начиная с 20 мг 3–4 раза в день, с постепенным увеличением дозы под контролем пульса и артериального давления (АД) до максимально переносимой, в большинстве случаев до 120–240 мг/сут. Следует стремиться к применению возможно более высоких доз препарата, потому что отсутствие эффекта терапии b-блокаторами связано с недостаточной дозировкой. Повышение дозировок существенно увеличивает риск известных побочных эффектов.
В настоящее время широко изучается возможность эффективного применения кардиоселективных b-блокаторов пролонгированного действия (атенолола, конкора). Существует точка зрения, что кардиоселективные b-блокаторы у больных ГКМП не имеют преимуществ перед неселективными, потому что в больших дозах селективность утрачивается. Рекомендуемый к применению у больных ГКМП с тяжелыми суправентрикулярными и желудочковыми аритмиями соталол сочетает в себе свойства неселективных b-блокаторов и антиаритмических средств III класса (кордароноподобный эффект).
Применение блокаторов медленных кальциевых каналов при ГКМП основано на снижении уровня свободного кальция в кардиомиоцитах и нивелировании асинхронии их сокращения, улучшении расслабления миокарда и снижении его сократимости, подавлении процессов гипертрофии миокарда. Благодаря наибольшей выраженности отрицательного инотропного действия и наиболее оптимального профиля фармакологических свойств препаратом выбора является верапамил (изоптин, финоптин).
Он обеспечивает симптоматический эффект у 65–80% больных, включая случаи рефрактерности к лечению b-блокаторами, что обусловлено способностью препарата уменьшать ишемию миокарда, в том числе безболевую и улучшать его диастолическое расслабление и податливость ЛЖ. Это свойство верапамила обеспечивает повышение толерантности больных к физической нагрузке и снижение субаортального градиента давления в покое при меньшей по сравнению с b-блокаторами способности к уменьшению внутрижелудочковой обструкции при физическом и эмоциональном напряжении и провокации изопротеренолом. Одновременно верапамил снижает периферическое сосудистое сопротивление вследствие вазодилататорного действия. Однако тяжелые осложнения фармакотерапии верапамилом развиваются у больных необструктивной ГКМП с высоким давлением в левом предсердии, у которых они обусловлены отрицательным инотропным действием препарата. Отсюда очевидна важность соблюдения осторожности при начале лечения верапамилом этой категории больных.
Назначение препарата следует начинать в условиях стационара с малых доз – 20-40 мг 3 раза в день с постепенным их повышением при хорошей переносимости до снижения ЧСС в покое до 50–60 в минуту. Клинический эффект наступает обычно при приеме не менее 160–240 мг препарата в сутки, а более удобны в условиях длительного применения пролонгированные формы (изоптин-ретард, верогалид-ретард). С учетом благоприятного влияния верапамила на диастолическую функцию и величину субаортального градиента давления в ЛЖ, доказанной способности увеличивать выживаемость больных ГКМП по сравнению с плацебо целесообразно его профилактическое назначение у асимптоматичных больных ГКМП высокого риска.
Место дилтиазема в лечении ГКМП окончательно не определено. Имеются данные, что в средней дозе 180 мг/сут за 3 приема он оказывает столь же выраженное, как 240 мг верапамила, благотворное влияние на диастолическое наполнение ЛЖ и одинаковый симптоматический эффект, однако в меньшей степени улучшает физическую работоспособность больных [53].Следует отметить, что b-адреноблокаторы (за исключением соталола) и антагонисты кальция обладают слабой антиаритмической активностью, в то время как частота опасных желудочковых и суправентрикулярных аритмий у больных ГКМП чрезвычайно велика. Поэтому актуально применение у этой категории больных антиаритмических препаратов, в ряду которых наиболее популярным и рекомендуемым ведущими специалистами является дизопирамид.
Дизопирамид (ритмилен), относящийся к антиаритмикам IA класса, обладает выраженным отрицательным инотропным эффектом, у больных ГКМП способен снижать уровень обструкции выходного тракта ЛЖ, положительно влиять на структуру диастолы. Эффективность длительного лечения дизопирамидом доказана в отношении больных ГКМП с умеренной обструкцией оттока из ЛЖ. Особенно выгодно использовать этот препарат у больных с желудочковыми аритмиями. Начальная доза обычно составляет 400 мг в сутки с постепенным увеличением до 800 мг. При этом необходимо контролировать продолжительность интервала QT по ЭКГ. Не менее эффективным средством лечения и профилактики желудочковых, суправентрикулярных аритмий при ГКМП является амиодарон (кордарон), который наряду с антиаритмической активностью несколько уменьшает гиперконтрактильность, ишемию миокарда. Показана его способность предотвращать у больных ГКМП внезапную смерть.
Лечение амиодароном начинают с насыщающих доз (600–1200 мг/сут) в течение 3–7 дней с постепенным, по мере уменьшения частоты ЧСС, снижением до поддерживающей (желательно 200 мг/сут и менее). Учитывая отложение препарата в тканях с возможным нарушением функции щитовидной железы, развитием пневмофиброза, поражения роговицы, кожи и печени, при его длительном (более 10–12 месяцев) приеме необходим регулярный контроль состояния этих «уязвимых» органов с целью раннего выявления возможных осложнении фармакотерапии.
При ГКМП возможны комбинации препаратов, обладающих отрицательным инотропным эффектом: b-блокаторов и антагонистов кальция, b-блокаторов и дизопирамида. Признаки венозного застоя в легких, включая ночные приступы сердечной астмы, при ГКМП не являются редкостью и в большинстве случаев обусловлены диастолической дисфункцией ЛЖ. Таким больным показано лечение b-блокаторами или антагонистами кальция в сочетании с осторожным применением салуретиков. Периферических вазодилататоров и сердечных гликозидов следует избегать из-за опасности ухудшения диастолического наполнения ЛЖ и резкого снижения сердечного выброса.
Мерцание и трепетание предсердий отмечаются у 10–30% больных ГКМП и обусловливают опасность возникновения или усугубления нарушений кардиогемодинамики, возникновение тромбоэмболий, а также повышенный риск развития фибрилляции желудочков. Вследствие этого у больных ГКМП пароксизмальные суправентрикулярные аритмии относят к категории потенциально фатальных, а скорейшее восстановление синусового ритма и предупреждение повторных пароксизмов приобретает особенно важное значение. Для купирования пароксизмов мерцательной аритмии используют антиаритмические препараты IА группы, амиодарон, b-блокаторы, верапамил и дигоксин. В случае их неэффективности проводят электроимпульсную терапию.
При постоянной форме мерцательной аритмии для контроля ЧСС применяют b-блокаторы или верапамил в сочетании с дигоксином. Это единственный случай, когда больным обструктивной ГКМП можно назначать сердечные гликозиды, не опасаясь повышения внутрижелудочкового градиента давления. Поскольку мерцательная аритмия у больных ГКМП связана с высоким риском системных тромбоэмболий, то после ее развития необходимо начинать терапию антикоагулянтами, которые при постоянной форме мерцания предсердий принимают неопределенно долго.
У значительного числа больных ГКМП традиционная фармакотерапия не позволяет эффективно контролировать симптоматику заболевания, а низкое качество жизни не устраивает пациентов. В таких случаях приходится решать вопрос о возможности использования иных, немедикаментозных лечебных подходов. При этом дальнейшая тактика определяется отдельно у больных с обструктивной и необструктивной формами ГКМП. Вопреки распространенному представлению нередко в далекозашедшей стадии патологического процесса (преимущественно при необструктивной форме ГКМП) развивается прогрессирующая систолическая дисфункция и тяжелая СН, ассоциированная с ремоделированием ЛЖ.
Такая эволюция заболевания наблюдается у 2-5% больных ГКМП и характеризует конечную («дилатационную») стадию тяжело и ускоренно протекающего процесса, не зависящего от возраста пациента и давности манифестации болезни. Увеличение систолического размера ЛЖ обычно опережает диастолическое расширение и преобладает над ним. Клиническими особенностями этой стадии являются выраженная, нередко рефрактерная застойная СН и исключительно плохой прогноз. Лечебная стратегия в отношении таких больных меняется и строится на общих принципах терапии застойной СН, предусматривает осторожное назначение иАПФ, блокаторов рецепторов ангиотензина II, диуретиков, сердечных гликозидов, b-блокаторов и спиронолактона. Эти пациенты являются потенциальными кандидатами для проведения трансплантации сердца.
Хирургическое лечение
При отсутствии клинического эффекта от адекватной медикаментозной терапии больным с III–IV ФК NYHA и выраженной асимметричной гипертрофией МЖП, субаортальным градиентом давления равным 50 мм. рт. ст. и более, показано хирургическое лечение. Классическая методика – это чрезаортальная септальная миэктомия, предложенная A.G. Morrow (1988). У больных молодого возраста с семейным анамнезом ГКМП с тяжелыми клиническими проявлениями, указанием на раннюю внезапную смерть у родственников показания должны быть расширены. В некоторых кардиохирургических центрах Европы и США она проводится также в случаях значительной латентной обструкции. В целом потенциальными кандидатами для проведения оперативного лечения являются не менее 5% из числа всех больных ГКМП.
Операция обеспечивает хороший симптоматический эффект с полным устранением или значительным уменьшением внутрижелудочкового градиента давления у 95% больных и значительным снижением конечно-диастолического давления в ЛЖ большинства больных. Хирургическая летальность в настоящее время значительно снизилась и составляет около 1–2%, что сопоставимо с ежегодной летальностью при медикаментозной терапии (2–5%). Хотя в большинстве случаев более ранних исследований не удавалось обнаружить существенного влияния хирургического лечения ГКМП на прогноз, тем не менее С. Seiler et al. (1989) показали улучшение 10-летней выживаемости оперированных больных до 84% по сравнению с 67% в группе лечившихся медикаментозно.
В ряде случаев при наличии дополнительных показаний для уменьшения выраженности обструкции и митральной регургитации одномоментно выполняется операция вальвулопластики или протезирования митрального клапана низкопрофильным протезом. Улучшить отдаленные результаты операции позволяет последующая длительная терапия верапамилом, как обеспечивающая улучшение диастолической функции ЛЖ, что не достигается при хирургическом лечении.
В настоящее время разработаны и успешно применяются методики, отличные от классической трансаортальной септальной миэктомии. В частности, в НЦССХ имени А.Н. Бакулева под руководством академика РАН и РАМН Л.А. Бокерия разработана оригинальная методика иссечения зоны гипертрофированной МЖП из конусной части ПЖ. Этот способ хирургической коррекции обструктивной ГКМП является высокоэффективным и может стать методом выбора в случаях одновременной обструкции выходных отделов обоих желудочков, а также в случаях среднежелудочковой обструкции ЛЖ.
В последние годы растущий интерес вызывает изучение возможности использования в качестве альтернативы хирургическому лечению больных обструктивной ГКМП последовательной двухкамерной электрокардиостимуляции с укороченной атрио-вентрикулярной задержкой. Вызываемое этим изменение последовательности распространения волны возбуждения и сокращения желудочков охватывает вначале верхушку, а затем МЖП, приводит к уменьшению субаортального градиента благодаря снижению регионарной сократимости МЖП и расширению выносящего тракта ЛЖ.
Важное значение имеет подбор наименьшей величины времени задержки нанесения желудочкового импульса после предсердного, которая обеспечивает преждевременную деполяризацию верхушки сердца, не приводя при этом к ухудшению кардиогемодинамики – снижению сердечного выброса и АД. Для этого в ряде случаев приходится прибегать к удлинению времени спонтанной атрио-вентрикулярной проводимости с помощью терапии b-блокаторами или верапамилом, иногда используют аблацию атрио-вентрикулярного узла.
Хотя первые неконтролируемые наблюдения были обнадеживающими, более поздние рандомизированные исследования показали, что достигаемые при такой электрокардиостимуляции симптоматический эффект и снижение субаортального градиента давления относительно невелики (около 25%), а существенные изменения физической работоспособности отсутствуют. Не удалось обнаружить и существенного влияния электрокардиостимуляции на частоту внезапной смерти. Поэтоиу до уточнения роли электрокардиостимуляции в лечении обструктивной ГКМП расширенное клиническое применение этого метода не рекомендуется.
Другим альтернативным методом лечения рефрактерной обструктивной ГКМП является транскатетерная алкогольная септальная аблация. Методика предполагает инфузию через баллонный катетер в перфорантную септальную ветвь 1–3 мл 95% спирта, вследствие чего возникает инфаркт гипертрофированного отдела МЖП, захватывающий от 3 до 10% массы миокарда ЛЖ (до 20% массы МЖП). Это приводит к значимому уменьшению выраженности обструкции выходного тракта и митральной недостаточности, объективной и субъективной симптоматики заболевания. При этом в 5–10% случаев возникает необходимость имплантации постоянного электрокардиостимулятора в связи с развитием атрио-вентрикулярной блокады высокой степени.
В настоящее время не доказано положительное влияние транскатетерной аблации на прогноз, а операционная смертность (1–2%) не отличается от таковой при проведении операции септальной миэктомии, считающейся на сегодняшний день «золотым стандартом» лечения больных ГКМП с выраженной симптоматикой и обструкцией выходного тракта ЛЖ, резистентных к фармакотерапии.
В запущенных случаях (при развитии митрализации порока, значительном снижении ФВ и формировании ХСН IV ФК, сопутствующем кальцинозе АК и стенки аорты) радикальная операция становится очень рискованной. В этих случаях лучше ограничиться наложением клапансодержащего шунта между верхушкой ЛЖ и аортой, называемого апико-аортальным.
Эту операцию впервые разработал и осуществил Denton Cooly в 1975 году. Он выполнял ее с искусственным кровообращением, вводя через разрез верхушки в полость ЛЖ жесткий наконечник, переходящий в клапансодержащий дакроновый шунт, имплантируемый в нисходящую аорту. В ходе операции создавался второй выход из ЛЖ и градиент на выходе из аорты уменьшался или исчезал. Отягчающим моментом в этой методике было искусственное кровообращение, которое мы исключили, разработав свой способ операции (В.П. Поляков, В.В. Горячев, А.В.Поляков, 1998).
Для этого мы разделили шунт на 2 бранши. Одна бранша из левостороннего бокового доступа в 6 межреберье анастомозировалась с нисходящей аортой над диафрагмой и пережималась. Вторая бранша оканчивалась подшитым к ней мягким тефлоновым кольцом. За это кольцо П-образными швами на прокладках шунт прочно фиксировался к бессосудистому участку верхушки ЛЖ. Затем специально разработанным резектором, введенным в просвет этой бранши, иссекался и удалялся вместе с резектором участок стенки ЛЖ (соответствующий внутреннему просвету бранши). Длина шунта рассчитывалась нами визуально. Между браншами накладывался анастомоз с фиксацией в нем дискового протеза клапана.
После снятия зажимов анастомоз начинал функционировать и сразу же градиент давления в выходном отделе резко снижался или исчезал вовсе. Таким способом в 90-х годах 20-го столетия нами прооперировано 22 больных ГКМП с ХСН III-IV ФК. Летальность в течение 10 лет наблюдения не превышала 9%. Все больные получали антикоагулянтную терапию, с нарушениями которой были связаны тромбозы шунтов у двух пациентов в течение первых 3-5 лет.
Таким образом, лечебная тактика при ГКМП достаточно сложна и предполагает индивидуальный анализ всего комплекса клинических, анамнестических, гемодинамических показателей, результатов генной диагностики и стратификации риска внезапной смерти, оценку особенностей течения заболевания и эффективности используемых вариантов лечения. В целом рациональная фармакотерапия в сочетании с хирургическим лечением и электрокардиотерапией позволяют получить хороший клинический эффект, предупредить возникновение тяжелых осложнений и улучшить прогноз у значительной части больных гипертрофической кардиомиопатией.
СИМПТОМЫ ГКМП
Многие люди с ГКМП, иногда, даже не подозревают о своем заболевании, пока оно случайно не обнаруживается при обычном медосмотре.
У молодых людей первым симптомом гипертрофической кардиомиопатии может стать внезапный коллапс и даже смерть. Это происходит по причине патологических нарушений ритма сердца (аритмия) или блокирования поступления крови от сердца ко всему организму.
К характерным симптомам относятся:
- Боль в груди;
- Головокружение;
- Обморочное состояние, особенно во время физической нагрузки;
- Слабость;
- Потемнение в глазах, нарушение равновесия, особенно в период или после физической нагрузки;
- Учащенное сердцебиение;
- Одышка при физической нагрузке или после приема положения лежа (или при изменении горизонтального положения тела на вертикальное после короткого сна).
Рекомендации
Диета
Употребление большого количества жидкости имеет очень важное значение. Выпивайте по крайней мере от 6 до 8 стаканов воды в день. В жаркую погоду, следует увеличить потребление жидкости. Жидкость и ограничения в употреблении соли, необходимы для пациентов с сердечной недостаточностью. Посоветуйтесь с вашим лечащим врачом о принципах воздействия на ваш организм конкретных жидкостей и диетических напитков, включая информацию о воздействии алкоголя и кофеина.
Физические упражнения
Ваш врач подскажет, рекомендуется ли вам заниматься спортом или нет. Большинству людей с кардиомиопатией предлагаются легкие занятия аэробикой. Тем не менее, ваш врач, основываясь на симптомах и тяжести вашей болезни, может попросить вас воздержаться от каких либо физических нагрузок. Так же, как и при дилатационной кардиомиопатии, не рекомендуется поднятие тяжестей
Регулярное посещение врача
Пациенты с ГКМП минимум раз в год должны посещать врача кардиолога и контролировать свое состояние. Посещения врача могут быть более частыми, в том случае, когда гипертрофическая кардиомиопатия была диагностирована впервые.
Медикаментозное лечение
Назначаются препараты для расслабления сердечной мышцы и снижения ритма сердца, чтобы оно могло работать эффективнее. Для этого рекомендуются бэта-адреноблокаторы, такие как метопролол (лопрессор, топрол), пропранолол (индерал, иннопран XL) или атенолол (тенормин); блокаторы кальциевых каналов, такие как верапамил (верелан, калан, ковера-XC) или дилтиазем (кардизем, тиазак, дилакор XR); или препараты для контроля сердечного ритма, такие как амиодарон (кордарон, паcерон) или дизопирамид (норпасе).
При мерцательной аритмии рекомендуется прием препаратов для разжижения крови, таких как варфарин (кумадин, янтовен), дабигатран (прадакса), ривароксабан (ксарелто) или апиксабан (эликвис) для снижения риска образования тромбов.
Септальная миоэктомия
Септальная миоэктомия – это хирургическая операция по удалению части уплотненной разросшейся перегородки между желудочками сердца. После миоэктомии кровь без труда проталкивается левым желудочком в аорту. Операция может выполняться разными методами, в зависимости от места утолщения сердечной мышцы. При необходимости, одновременно может выполняться операция по реконструкции митрального клапана.
Миоэктомия показана в том случае, если медикаментозное лечение оказалось неэффективным. Часто, после операции исчезают все симптомы заболевания. Септальная миоэктомия проводится только в медицинских центрах, которые специализируется на лечении гипертрофической кардиомиопатии.
Какие препараты используются для лечения гипертрофической кардиомиопатией?
Препараты, используемые для лечения симптомов и предотвращения дальнейшего осложнения ГКМП, снимают нагрузку с сердца и уменьшают препятствия для эффективной циркуляции крови в организме. При лечении гипертрофической кардиомиопатии используются также лекарства, в основе которых лежат бета-адреноблокаторы, способные снижать нагрузку на сердце за счет снижения давления и пульса, уменьшая гипертрофию миокарда. Также бета-блокаторы обладают антиаритмическим действием, в том числе способны уменьшить риск развития фатальных аритмий и внезапной смерти.
Врач может попросить вас избежать применения некоторых лекарственных препаратов, таких, как нитраты (они понижают кровяное давление) или дигоксин (он увеличивает силу сокращений сердца).
Ваш врач посоветует, какие лекарства вам больше всего подходят.
Хирургические процедуры, используемые для лечения гипертрофической кардиомиопатии
Хирургические методы, используемые для лечения ГКМП включают в себя:
Чрезаортальная септальная миэктомия. Данная методика предполагает уменьшение обструкции путем уменьшения толщины межжелудочковой перегородки.
Транскатетерная септальная алкогольная абляция. Введение склерозирующих веществ типа спиртовых растворов, создание в межжелудочковой перегородке зон инфаркта.
Имплантация искусственного митрального клапана сердца. Этот тип операции предлагается пациентам с высоким риском опасных для жизни аритмий и внезапной сердечной смерти. Митральный клапан постоянно отслеживает сердечный ритм. Когда он обнаруживает неправильный, очень быстрый ритм сердца, поставляя энергию в сердечную мышцу, он заставляет сердце биться в нормальном ритме.