Мозг человека не только непрерывно трудится в течение жизни человека, но и стареет вместе с ним. Под действием лет, образа жизни человека и прочих факторов начинаются различные деструктивные процессы в нем. Некоторые из них могут серьезно сказаться на жизнедеятельности в целом. Так, например, одним из неприятных вариантов является атрофия головного мозга.
Она представляет собой изменений, приводящие к истощению тканей и утрате функций органа. Как правило, когда говорят про атрофию мозга, имеют в виду, что начались процессы омертвения нервных клеток, а также присутствует разрыв нейронных связей внутри групп, связанных либо по химическим признакам, либо функционально. На фоне атрофии начинает снижаться объем мозговой ткани. Иногда такую ситуацию в народе называют усыханием мозга.
Статья по теме Ученые опровергли. Высшее образование не влияет на молодость мозга? На фоне отмирания клеток начинают проявляться серьезные осложнения. Так, например, страдают когнитивные способности, то есть человек начинает хуже говорить и мыслить, у него отмечаются проблемы с ориентацией в пространстве, ухудшается понимание и логика, страдают такие способности, как рассуждение, вычисление, обучение. Могут развиться и проблемы с движением. При этом стоит понимать, что отмирание нейронов не происходит одномоментно — нередки ситуации, когда между началом деструктивного процесса и появлением больших поврежденных участков в мозгу проходит несколько десятков лет.
Разрушение в мозге человека может быть очаговым, то есть когда затрагивается какой-то один фрагмент, а может стать и генерализованным, когда дегенеративные процессы отмечаются во всех областях. При том острая очаговая атрофия обычно расценивается специалистами как признак болезни или травмы. Бывают и врожденные проявления, которые, как правило, дают первые симптомы еще в детском возрасте.
Почему развивается
Естественно, многих интересует, каковы причины развития таких дегенеративных процессов. Риски уменьшения мозга и ухудшения ситуации с ним увеличиваются в более старшем возрасте. Триггерами для атрофии становятся:
- почечная недостаточность;
- длительно повышенное внутричерепное давление;
- злоупотребление алкоголем и приемом запрещенных препаратов;
- инфекции коры мозга, например полиомиелит, энцефалит и другие;
- черепно-мозговая травма;
- заболевания сосудов, например атеросклероз, аневризмы;
- сбои метаболизма;
- наличие психических заболеваний, в пожилом возрасте это может быть болезнь Альцгеймера, а также такое нейродегенеративное состояние — болезнь Паркинсона.
- родовые травмы, нехватка витаминов группы В и фолиевой кислоты;
- наследственность.
Отпусти и не забудь. Как организм спасает память при плохом кровоснабжении Подробнее
Биполярное расстройство изнутри: что не так с вашим мозгом и как это исправить
Поделитесь с друзьями
Мы перевели для вас главу из книги «Продуктивная жизнь с депрессией и биполярным расстройством» Джона МакМанами. Автор сам болен БАР, и при этом уверен, что успешная и осмысленная жизнь с этим диагнозом возможна. Он посвятил годы изучению болезни и способов борьбы с ней.
В этой главе автор собрал актуальные научные данные о том, как функционируют нервные клетки, что с ними не так у человека с биполярным расстройством, и как это можно исправить с помощью медикаментов. Здесь — научные ответы на вопросы: почему антидепрессанты начинают действовать через несколько недель, восстанавливаются ли нервные клетки и как именно действуют ингибиторы обратного захвата серотонина?
Материал достаточно сложный — для тех, кто действительно хочет разобраться, как все устроено. .
Перевод главы из книги «Продуктивная жизнь с депрессией и биполярным расстройством» Джона МакМанами, 2006 года. (John McManamy, Living Well with Depression and Bipolar Disorder)
Нейротрансмиттеры, нейроны и вещи, о которых не знает ваш психиатр
Введение
В 1999 г. главный врач государственной службы здравоохранения США в своём докладе о психическом здоровье заявил: «Мозг — это великий синтезатор множества биологических, психологических и социокультурных феноменов, который делает нас теми, кем мы и являемся. Это результат совместной работы наших генов и нашего опыта».
То, что Вуди Аллен называл своим «вторым самым любимым органом», является ни чем иным, как массой в 1,3 килограмма, содержащей около 100 миллиардов нервных клеток (нейронов). Они подразделяются на тысячи разных видов, каждый из которых в свою очередь образует тысячи соединений с другими нейронами (синапсов). Всего существует от 100 триллионов до квадриллиона синапсов, организованных в замысловатые сети, что является причиной бесконечной сложности и запутанности структуры головного мозга. Также за его строение ответственны более половины из 25 тысяч генов генома человека.
Так что же происходит, когда мозг получает сигнал? Вначале сигналы передаются от нейрона по участку, называемому аксоном, который может оканчиваться на нескольких конечных участках (терминалиях). Эти сигналы затем подхватываются отростками (дендритами), идущими я от других нейронов.
Сообщение между нейронами осуществляется по бесчисленным синапсам (промежуткам), отделяющим аксоны от дендритов. В этих конечных участках нейрона, посылающих импульс, образуются специальные молекулы-мессенджеры, называемые нейротрансмиттерами. Они проходят через синапс и «связываются» с рецепторами на поверхности нейрона, принимающего импульс. Задача нейротрансмиттера выполнена, когда его «сообщение» доставлено через отверстие мембраны внутрь нейрона.
Нейротрансмиттеры
В головном мозге вырабатывается около сотни нейротрансмиттеров. Три наиболее известных — серотонин, норадреналин и дофамин — по химической структуре классифицируются как моноамины. Моноаминовая гипотеза гласит, что расстройства настроения вызываются истощением одного или более нейротрансмиттеров. Но эта теория напоминает теорию «плоской земли»: ведь она не даёт никаких упоминаний о последних достижениях генетики, нейробиологии и визуализации головного мозга.
Нейротрансмиттеры — это лишь первый шаг в обеспечении взаимосвязи между биологическими процессами и настроением. В 2004 г. на лекции Американской психологической ассоциации Джек Баркас (Jack Barchas, доктор медицины Корнелльского университета), пионер в области исследований связи биохимии мозга и поведения, рассказал, как, полвека назад, ещё будучи студентом, он предложил изучать нейротрансмиттеры. Ему ответили: «Если хочешь изучить биохимию — изучай печень. Пройдут года, прежде чем будут открыты процессы, происходящие в мозге».
Психиатрия в то время была настолько далека от медицины, что его наставник оспорил эти идеи, сказав: «Как это докажет учения Фрейда?». К счастью, доктор Баркас не обратил на эти слова внимания.
Норадреналин
Норадреналин (также называемый норэпинефрином) производится в нейронах из аминокислоты тирозина. Тирозин превращается в DOPA (дигидроксифенилаланин), а затем в дофамин (см. ниже). Некоторое количество дофамина затем преобразуется в норадреналин; он «упаковывается» и хранится в «пакетах», называемых синаптическими пузырьками (везикулами). Как только норадреналин образуется благодаря действию одного фермента, он подвергается опасности разрушения другими: например, моноаминоксидазой (МАО), которая также разрушает серотонин и дофамин. Ингибиторы моноаминоксидазы (ИМАО), угнетающие этот фермент и, таким образом, предотвращающие разрушение моноаминов, стали первыми созданными антидепрессантами.
Когда нейрон функционирует нормально, он высвобождает норадреналин в синаптическую щель (пространство между двумя нейронами). Норадреналин связывается с α1—, α2— и β1—рецепторами на постсинаптической мембране — мембране нейрона по другую сторону синапса. Это связывание передаётся клетке, которая активирует определённые гены, регулирующие активность белков, которые, в свою очередь, определяют всю деятельность нейрона.
Норадреналин наиболее активен в определённой части ствола головного мозга, известной как голубое пятно (locus coeruleus). Оно «отслеживает» внешние стимулы, влияющие на организм, а также физиологические ответы на внешние раздражители (например, боль, реакцию «бей или беги» и пр.). Также считают, что норадреналин и голубое пятно играют роль в познавательных способностях, настроении, эмоциях, движениях и поддержании артериального давления. Трудности с сосредоточением внимания, усталость, апатия и депрессия — это лишь некоторые из проблем, появляющихся из-за сбоев в работе норадреналина.
После того, как норадреналин высвобождается в синапс и присоединяется к рецепторам на постсинаптической мембране, пресинаптический нейрон «всасывает» часть оставшегося нейротрансмиттера внутрь клетки через белок-переносчик обратного захвата для его дальнейшей упаковки в пузырьки и последующего повторного использования. Трициклические антидепрессанты (ТЦА) присоединяются к белкам-переносчикам обратного захвата, предотвращая «всасывание» нейротрансмиттера и продлевая его циркуляцию и действие в синапсе. Также они присоединяются к определённым рецепторам серотонина. Подобным механизмом действия обладают новые антидепрессанты — ингибиторы обратного захвата.
Серотонин
Серотонин, или 5-гидрокситриптамин (5-HT) синтезируется в нейронах из аминокислоты триптофана, которая преобразуется в 5-гидрокситриптофан (5-HTP) и затем в серотонин. Серотонин высвобождается в синаптическую щель таким же образом, как и норадреналин. Для серотонина есть 17 различных типов рецепторов, что подчёркивает его значимость как нейротрансмиттера.
Серотонин высвобождается из т.н. ядер ствола головного мозга, распространяясь к другим образованиям — базальным ганглиям, коре лобных долей, гипоталамусу, лимбической системе, спинному мозгу. Серотонин также обнаруживается в желудочно-кишечном тракте. Неудивительно, ведь этот нейротрансмиттер отвечает за множество вещей: от настроения, уровня тревоги, сна, полового влечения до пищеварения и чувства голода. К сожалению, антидепрессанты группы СИОЗС (селективные ингибиторы обратного захвата серотонина) увеличивают концентрации серотонина во всех синапсах. Они не учитывают один факт: то, что хорошо влияет на настроение, может негативно отразиться на либидо и других функциях организма. Таким образом, слово «селективные» (то есть действующие избирательно) в названии этой группы препаратов — это полное искажение истины.
Как и в случае с норадреналином, пресинаптический белок-переносчик обратного захвата «втягивает» избыток серотонина из синапса для последующего высвобождения. Как ТЦА, так и новые антидепрессанты групп СИОЗС и СИОЗСН (селективные ингибиторы обратного захвата серотонина и норадреналина) блокируют этот белок, оставляя циркулировать большее количество серотонина. Однако, если бы это было полной правдой, то антидепрессанты оказывали бы немедленный эффект. На самом деле, первые две недели они лишь «создают впечатление»; на раскрытие полного клинического эффекта требуется ещё от 2 до 6 недель постоянного приёма.
Одним из объяснений может быть то, что блокада белка обратного захвата понижает чувствительность нейронов, ослабляя нормальный выброс нейромедиаторов на 4 недели. Другая возможная причина — антидепрессанты также влияют на нисходящий каскад внутриклеточных процессов (см. далее).
Дофамин
Дофамин для головного мозга то же самое, что и атомные электростанции для электросетей. Нам всем нужна энергия, но иногда она может обернуться катастрофой. Неудивительно, что действие нескольких классов препаратов, применяемых в психиатрии и неврологии, нацелено именно на этот нейротрансмиттер.
Например, антипсихотики (нейролептики), которые работают словно огнетушители, или средства, которые «заводят мотор». Старое поколение ингибиторов МАО повышало концентрации дофамина (а также других моноаминов) не напрямую, в то время как атипичный антидепрессант бупропион достигает этого другим путём.
Дофамин образуется из норадреналина, который, в свою очередь, образуется из тирозина. В головном мозге имеется несколько дофаминергических нервных путей.
Считается, что мезолимбический путь, идущий от среднего мозга до прилежащего ядра, вовлечён в процессы удовольствия, а также ответственен за развитие бреда, психотических состояний и привыкание к наркотикам. Кокаин как раз печально известен тем, что увеличивает производство дофамина, в то время как антипсихотические средства связываются с дофаминовыми D2 рецепторами, препятствуя избыточной психопродукции (бреду, галлюцинациям). К сожалению, действие антипсихотиков не ограничивается только лишь D2 рецепторами в мезолимбическом пути, что приводит, как сказал доктор Стивен Сталь в своей книге «Essential Psychopharmacology of Antipsychotics and Mood Stabilizers», к «слишком большой расплате за ведение бизнеса».
Стимуляторы (агонисты) дофаминовых рецепторов (такие, как препарат прамипексол против болезни Паркинсона) дублируют действие естественного дофамина. Они связываются с D2 и D3 рецепторами в нигростриарном дофаминергическом пути, проходящем от чёрной субстанции ствола мозга до базальных ганглиев и полосатого тела. Вышеназванный препарат клинически испытывается у пациентов с депрессией. Новое поколение препаратов, стимулирующих D1 рецепторы, находится в разработке. Предполагается, что агонисты дофаминовых рецепторов будут противодействовать апатии и притуплению когнитивных способностей.
Глутамат
Глутамат и ГАМК (γ-аминомасляная кислота) представляют собой пару «инь-ян», как объяснил Дэррил Шопп (Darryle Schoepp, доктор философии) на собрании Американской психиатрической ассоциации в 2003 г. Оба этих нейромедиатора регулируют практически все функции синапсов во всём головном мозге, причём глутамат является «возбуждающим» нейротрансмиттером, а ГАМК — «тормозным». Считается, что стабилизаторы настроения (нормотимики) действуют либо на один, либо на другой, либо же на оба из них.
Существуют 2 типа глутаматных рецепторов — ионотропные (iGluR), которые включают NMDA-, AMPA- и каинатные рецепторы, и метаботропные (mGluR), контролирующие многочисленные химические реакции.
Когда NMDA-рецептор функционирует верно, глутамат и глицин присоединяются к нему, что «открывает» ионный канал внутри рецептора, позволяя ионам кальция попасть внутрь нейрона. Это запускает внутриклеточный каскад сигнальных реакций, необходимых для приспосабливания и выживания клетки.
Однако слишком большое количество глутамата может привести к катастрофе. Стабилизатор настроения ламотриджин, показавший эффективность при лечении биполярной депрессии, является антиглутаматным препаратом.
ГАМК
ГАМК (γ-аминомасляная кислота) формируется в головном мозге из глутамата, глюкозы и глутамина. Она присоединяется к одному из двух рецепторов на постсинаптической мембране — ГАМКA или ГАМКB.
ГАМКA-рецепторы регулируют возбудимость, тревогу, панику и стресс. Они являются точкой приложения бензодиазепиновых транквилизаторов (например, диазепама), барбитуратов, а также алкоголя. У лиц с депрессией уровень ГАМК в спинномозговой жидкости и плазме крови снижен. Жерар Санакора (Gerard Sanacora, MD Йельского университета), использовал магнитно-резонансную спектроскопию для измерения уровня ГАМК в головном мозге. Он обнаружил, что у людей с легкой депрессией низкие концентрации ГАМК в коре затылочных долей, но при этом истощение ГАМК не настолько выражено, как у лиц с атипичной депрессией. Это указывает на возможность более детализированного подхода при диагностике депрессии. Доктор Санакора также сравнил сканы «до» и «после», выявив, что у пациентов, пролеченных антидепрессантами или курсом электросудорожной терапии, уровень ГАМК значительно вырос.
Внутри нейрона
До недавних пор считалось, что в головном мозге не могут образовываться новые нейроны. С точки зрения расстройств настроения это печальный факт. Снимки головного мозга и исследования тел умерших выявили, что у людей с депрессией и БАР происходит уменьшение объёма префронтальной коры, а также атрофия нервных клеток и их гибель. В классическом исследовании в 1997 г. доктор Уэйн Древетц (Wayne Drevets, Национальный институт психического здоровья США) выявил, что подколенная область префронтальной коры была на 38% меньше нормы у пациентов с БАР и на 48% — у страдавших депрессией, вне независимости от их душевного состояния и лечения.
В экспериментах, проведённых Робертом Сапольским (Robert Sapolsky, Стэнфордский университет), воздействие на животных стрессовыми факторами привело к гибели или атрофии нейронов в гиппокампе.
Некоторые нейроны также находились под угрозой, имея больше шансов погибнуть, будучи подверженными другому стрессовому воздействию. Однин из компонентов мозга, находящийся в дефиците при стрессе — мозговой нейротрофический фактор (BDNF). Это нейропептид, играющий ключевую роль в выживании и росте нейронов.
Стресс повышает уровень кортизола, который, в свою очередь, повышает количество возбуждающего нейромедиатора — глутамата. Это увеличивает шанс попадания кальция внутрь нейрона и активирует определённые кальций-зависимые «ферменты смерти». Кортизол также может снизить способность нейрона накапливать глюкозу, поддерживающую энергетический обмен в клетке. Таким образом, у клетки может оказаться недостаточно сил, чтобы справиться с последующим кризисом.
«Проще говоря, клетка не может справиться с нагрузкой», — объяснил на лекции в 2003 г. доктор Хуссейни Манжи (Husseini Manji, глава программы по изучению тревожных расстройств и расстройств настроения Национального института психического здоровья). Следует атрофия и гибель нейронов, что снижает их способность связываться друг с другом и передавать сигналы другим клеткам.
Ещё в 1960-х гг. стало известно, что нервные клетки всё-таки восстанавливаются: при благоприятных условиях в мозге животных могут вырастать новые клетки, а сжатые, сморщенные клетки мозга могут возвращаться к своим обычным размерам и создавать новые межклеточные связи — процесс, называемый нейрогенезом. По большей части он протекает в гиппокампе. В 2000 г. Фред Гейдж (Fred Gage, PhD, Институт Солка), обнаружил, что нейрогенез может происходить также и у людей.
В 2000 г. Рон Дьюман (Ron Duman, PhD) и его команда из Йельского университета при проведении опытов на крысах открыли, что антидепрессанты способствуют росту новых клеток в гиппокампе. Годом позже он опубликовал гипотезу, что этот же эффект, возможно, проявляется и у людей. Доктор Дьюман и его коллеги первыми обнаружили, что неоднократное лечение антидепрессантами стимулирует процесс, известный как каскад cAMP-CREB. CAMP (циклический аденозинмонофосфат) — это сигнальная молекула, которая находится в ДНК-последовательности белка CREB (ближе к 5’-концу ДНК). CREB контролирует активность определённых генов, среди которых и BDNF. Важно, что CREB и BDNF играют важнейшие роли в нейропластичности — то есть, в способности головного мозга постоянно перераспределять память, «перекраивать себя» путём запоминания новой информации и её удержания.
Каскад cAMP-CREB также фигурирует в нейрогенезе. Доктор Дьюман и его команда подвергали лапки крыс ударам тока, чтобы вызвать поведенческую беспомощность, что привело к длительному угнетению нейрогенеза. Но когда животных пролечили антидепрессантами, их поведение нормализовалось. Каждый день в гиппокампе взрослого грызуна образуется приблизительно 9000 новых клеток. Из них 75–80% становятся нейронами, из которых только половина выживает спустя 4 недели. Подсчитано, что у людей скорость роста новых клеток составляет лишь 10–20% от таковой у грызунов. По словам доктора Дьюмана, этого всё ещё достаточно, чтобы воздействовать на функции гиппокампа.
Тем временем исследование, возглавленное в 2000 г. доктором Манджи, показало, что литий «значительно увеличивает общий объём серого вещества головного мозга у людей с биполярным расстройством». Используя генный микрочип (микроматрицу) — процесс, позволяющий исследователям записывать взаимодействия тысяч генов одновременно, — доктор Манджи и его коллеги стали экспериментировать с литием и вальпроатами на клетках головного мозга. К своему удивлению, они обнаружили, что два совершенно различных препарата повлияли на одни и те же клеточные сигнальные пути, связанные с выживанием клетки или её смертью. В одном эксперименте уровень защитного белка, участвующего в этих сигнальных путях (Bcl-2), повысился в два раза после назначения лития и вальпроатов. Последующие опыты на крысах выявили, что литий смягчил последствия искусственно вызванного инсульта и усилил рост новых нейронов в гиппокампе. Когда доктор Манджи попросил доктора Древетца проверить его исследование, было обнаружено, что у пациентов, принимавших литий или вальпроаты, не было признаков атрофии головного мозга.
Рост новых клеток в головном мозге — это всего лишь одна сторона монеты, и, скорее всего, не главная. «Более важной является способность защищать и восстанавливать повреждённые клетки мозга и помогать им заново создавать межклеточные связи», — сообщил доктор Манджи. Чтобы полностью оценить возможности лития, мы должны понять, что и депрессия, и биполярное расстройство являются чем-то большим, чем просто расстройства настроения. Нарушение когнитивных способностей и поведения может длиться гораздо дольше, чем обычный аффективный эпизод. Хотя большое депрессивное расстройство и БАР не относятся к «классическим» нейродегенеративным (то есть разрушающими мозг) заболеваниям, таким, как болезни Альцгеймера и Паркинсона, всё же они, сопровождаются уменьшением количества и сморщиванием клеток головного мозга.
«Впечатляет, что белок Bcl-2 защищает от воздействия свободных радикалов, которые могут повреждать клетки мозга, а также от развития болезни Паркинсона, и, возможно, разрушительного действия расстройств настроения», — проинформировал доктор Манджи на ежегодной конференции Национального альянса по психическим заболеваниям (NAMI) в 2002 г.
Доктор Манджи объяснил, что в последние три десятилетия исследования психического здоровья в первую очередь сосредотачивались на нейротрансмиттерах. Но с недавних пор учёные начали понимать, что психические расстройства более сложны, чем предполагалось. Нервные клетки соединяются друг с другом посредством нейротрансмиттеров, но они не поступают напрямую от одной клетки к другой. Точнее, они являются просто ключами, которые могут открыть путь к происходящему внутри нейронов, где и протекают все процессы.
По словам доктора Манджи, существуют ещё приблизительно 10 разных потенциальных мишеней внутри нервной клетки, о возможностях которых мы даже не подозревали 10 лет назад. Одной из возможных внутриклеточных мишеней является фермент протеинкиназа C (PKC), участвующий в сигнальном пути, отвечающем за возбудимость нейрона. Команда доктора Манджи обнаружила, что и литий, и вальпроаты оказывают схожий эффект на системы PKC и что их действие начинается спустя дни и недели. Угнетение протеинкиназы C, однако, может быть осуществлено напрямую. В одном небольшом исследовании использовался тамоксифен — противоопухолевый препарат, применяемый при раке молочной железы. Он ингибировал (подавлял) протеинкиназу C. Было обнаружено, что его применение значительно снижало выраженность мании. Планируется проведение испытаний с большей выборкой пациентов в Национальном институте психического здоровья и Гарвардском университете. «Если они окажутся успешными — сообщил доктор Манджи, — мы сможем разработать ингибитор PKC с более совершенными свойствами».
В обзорной статье доктора Манджи и его коллег из Национального института психического здоровья (журнал Biological Psychiatry май 2003 г.) говорится: главная проблема в использовании антидепрессантов — в ошибочном предположении, что наши внутриклеточные каскады не повреждены и точно перенаправят усиленную медикаментами нейротрансмиттерную активность к нужным точкам. На самом деле, обнаруживается совершенно противоположное: некоторые клетки головного мозга принимают «бомбардировку» нейротрансмиттерами за нечто вроде насилия, которое вынуждает развивать «как трофическую, так и нейрохимическую поддержку», чтобы восстановить нейрональную взаимосвязь и молекулярную передачу сигнала.
Когда-нибудь cAMP, Bcl-2, BDNF и другие мишени, возможно, станут широко известны, как в наши дни известен серотонин — не только в академических кругах, но и как точки приложения новых лекарственных препаратов, призванных улучшить наши жизни.
Другие клетки мозга
Есть две принципиально разные группы клеток мозга — нейроны и глиальные клетки (нейроглия, или попросту глия). «Мозговой клей» — так непритязательно немецкие учёные называли эту субстанцию (слово «глия» обозначает «клей» на греческом). Когда исследователи начали изучать эту структуру, медленно, но верно эти «другие клетки мозга» снискали их уважение.
История началась в ранних 1960-х гг., когда учёные открыли, что кора головного мозга крысят, живших в обогащённой (питанием, светом и пр.) среде содержала больше глиальных клеток на один нейрон, чем у крысят, росших в истощающих условиях. По всей видимости, более активные нейроны коры головного мозга требовали большей «поддерживающей сети». Как правило, мы на всю жизнь остаёмся с нейронами, с которыми родились (эти клетки не делятся). Но глия способна к этому. У людей количество глиальных клеток и нейронов находится в соотношении примерно 9 к 1. Это больше, чем у низших животных.
Спустя два десятилетия после исследований на мозге крысят, 4 образца головного мозга Альберта Эйнштейна, каждый размером с сахарный кубик, прибыли по почте к одной из исследовательниц, Мэриан Даймонд (Marian Diamond, PhD, из Калифорнийского университета в Беркли). Когда доктор Даймонд сравнивала регионы коры мозга, связанные с активными когнитивными процессами с подобными же участками 11 контрольных образцов, она обнаружила, что мозг Эйнштейна буквально до краёв «наполнен» глиальными клетками.
Передовые методы нейровизуализации подтвердили, что глию не стоило игнорировать. Наши знания были далеки от совершенства, но теперь выяснилось, что глия находится в постоянном, непрекращающемся «диалоге» с нейроном.
Астроциты представляют собой тип глии, которая окружает синапсы между нейронами. Особенно интересен нейротрансмиттер глутамат, связывающийся с рецепторами на нисходящем нейроне и открывающий каналы клеточной мембраны. Это позволяет ионам кальция проникнуть внутрь и оповестить всю «химическую популяцию» внутри клетки. Через ряд химических взаимодействий астроциты способны усилить передачу сигналов с помощью глутамата, высвобождая его из себя, либо, наоборот, ослабить её, удаляя этот нейротрансмиттер из синапса.
Глутамат (в содружестве с ГАМК) является необходимой деталью в регуляции настроения. Когда что-то идёт не по плану, глия всегда остаётся на месте. Некоторые исследования на головном мозге умерших людей, при жизни страдавших от большого депрессивного расстройства или БАР, показали, что у них уровень глии в определённых регионах мозга был ниже нормального. Без глии нейрон практически остаётся беззащитен, он неспособен сопротивляться «бомбардировке» глутаматом и последующим негативным влияниям ионов кальция.
В 2004 г. в статье журнала Neuroscientist, Бернхард Миттерауэр (Bernhard Mitterauer, MD из Зальцбургского университета) предложил гипотезу нейронально-глиального дисбаланса для объяснения биполярного аффективного расстройства. Основа гипотезы — это другой тип активности астроцитов, включающий в себя высвобождение в синапс белков определённого типа. Эти белки прикрепляются к нейротрансмиттерам, предотвращая их соединение с рецепторами. По словам доктора Миттерауэра, когда всё идёт по плану, достигается некое равновесие. Но чрезмерная или недостаточная секреция белков может привести к тому, что недостаточно или же слишком много нейротрансмиттеров достигнут своих целевых рецепторов. Это приводит к негативным последствиям. Этот феномен (пока что больше теория, чем факт) также может объяснить, почему при БАР часто нарушается цикл сна и бодрствования.
Глиальные клетки также «обслуживают» нейроны множеством других способов, увеличивая возможности нашего мозга. Кроме того, известно, что глиальные клетки «разговаривают» друг с другом, но пока остается неясным, что они «говорят». По крайней мере, спустя все эти годы, мы начинаем к ним прислушиваться.
Поделитесь с друзьями
Клиническая картина
На начальных этапах симптоматика незаметна. Однако по мере прогрессирования могут появляться крайне неприятные сигналы:
- судороги или даже эпилептические припадки;
- потеря критичности к своим поступкам;
- ухудшения речи;
- проблемы с выражением мыслей;
- проблемы с памятью;
- ухудшение психоэмоционального состояния — когда развиваются депрессии, отмечается повышенная раздражительность, заметны перепады настроения;
- утрата эмпатии к другим людям и многое другое.
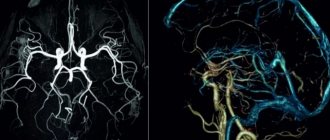
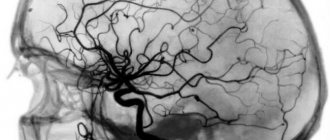
При появлении таких симптомов, которые должны насторожить если уж не самого человека, то его близких, следует обращаться к специалисту, чтобы определить причину проблемы. Так, например, проводят аппаратное обследование — чаще говорят про МРТ и КТ-диагностику, чтобы точно понять области повреждения мозга, объемы и прочие важные факторы. Кроме того, могут предложить обследование сосудов мозга и другие варианты. Далее уже принимается решение по терапии.
Принципы диагностики атрофии
Первоначальный этап предполагает сбор анамнеза, осмотр, физикальное обследование. Второй этап – клинико-инструментальные методы (УЗИ, КТ, МРТ головного мозга, сцинтиграфия, ПЭТ/КТ). Повреждение зрительного нерва подтверждается офтальмоскопией, тонометрией, контрастной КТ или МРТ-ангиографией.
Лучшим способом выявления патологии мягких тканей головного мозга является МРТ. Процедуру нужно выполнять несколько раз (с разницей через месяц), чтобы выявить атрофию разной глубины, распространенности.
Магнитно-резонасное обследование выявляет самые мелкие локальные очаги, помогает правильно установить степень прогрессирования болезни.
Лечение и профилактика
При выполнении простых правил удается облегчить симптоматику и продлить жизнь человека. Когда диагноз поставлен, больному желательно оставаться в привычной обстановке, поскольку стрессы усугубляют состояние. Человеку необходима посильная умственная и физическая нагрузка.
Важно сбалансированное питание, нужно восстановить четкий распорядок дня. Необходимо отказаться от вредных привычек. Еще нужна физическая активность, выполнение умственных упражнений. Диета при атрофии предполагает отказ от тяжелой, вредной еды, не стоит есть фастфуд, употреблять алкоголь категорически запрещается. В меню должны быть орехи, морепродукты и зелень.
Лечение атрофии головного мозга предполагает использование нейтростимуляторов, транквилизаторов, антидепрессантов и успокоительных препаратов. Это заболевание не получится полностью вылечить, терапия позволяет лишь ослабить симптомы. Выбор средства зависит от вида атрофии и типа нарушенных функций.
С повреждениями в коре мозжечка лечение требуется для восстановления движений. Еще нужно использовать препараты, которые ослабляют тремор. Временами нужна операция. Иногда применяются лекарства, которые улучшают метаболизм и мозговое кровообращение, обеспечивая хорошую циркуляцию крови и защиту от кислородного голодания.
Источник
Симптомы каждой стадии разрушительного процесса
Кортикальная церебральная атрофия проходит пять степеней развития, на каждой из которых свои симптомы и проявления:
- Начальная стадия характеризуется полным отсутствием проявлений, но ее развитие происходит стремительно и быстро переходит в следующую стадию.
- На второй стадии общение с окружающими очень быстро ухудшается. Человек не может адекватно воспринимать критику, становится раздражителен, конфликты с его участием – нормальное явление, регулярно повторяющееся. Очень часто теряется нить разговора.
- Третья стадия – больной в несколько этапов теряет контроль над своим поведением, которое становится возмутительным. Часты проявления уныния или возникновение беспричинных вспышек гнева.
- Четвертая стадия: полностью теряется осознание сути событий. Пациент не может адекватно реагировать на требования окружающих.
- Пятая стадия – больной совершенно не поснимает происходящих событий, и, соответственно, это не вызывает у него никаких эмоций.
В зависимости от кого, какая именно доля мозга была затронута атрофией, возникают еще на первых этапах некоторые нарушения речи, появляется необоснованная эйфория или равнодушие, вялость, сексуальная гиперактивность, некоторые разновидности маний.