Когда же нужно обратить внимание на свое здоровье?
Любой здоровый человек должен один раз в год проходить минимальное профилактическое обследование, в состав которого входит общий анализ в крови.
При уровне гемоглобина ниже 120 г/л нужно проконсультироваться с терапевтом.
Анемия с уровнем гемоглобина выше 100 г/л считается легкой и не представляет серьезной опасности для организма на момент выявления, однако все равно требует коррекции. При уровне гемоглобина 70-80 г/л и ниже необходимо экстренно принимать меры, т.к. такое состояние несет серьезные угрозы здоровью, а иногда и жизни!
По причинам развития анемий лидирующие позиции занимает железодефицитная анемия – каждый 12-й человек в мире страдает железодефицитной анемией, а среди всех анемий железодефицитные по частоте достигают 80%.
С чем связано развитие железодефицитной анемии? Причинами может стать элементарная недостаточность железа в пище, нарушение всасывания железа в желудочно-кишечном тракте (например, при гастритах с пониженной кислотностью) и хронические кровотечения.
Сердечно-сосудистые заболевания и анемия
Число случаев смерти от сердечно-сосудистых заболеваний (ССЗ) в мире продолжает расти. Заключение о том, что ишемическая болезнь сердца (ИБС) «…является ведущей причиной смерти во всем мире, ее уровень постоянно растет и в настоящее время достиг размеров пандемии, не знающей границ», появившееся на сайте Всемирной организации здравоохранения (ВОЗ) в 2009 г., воспринимается как все более актуальное. В 2011 г. ИБС стала причиной гибели 7,3 млн человек [1, 2].
Анемией в мире, по оценкам ВОЗ, страдает 1,62 млрд человек [3]. Частота анемии, также как ИБС, значительно увеличивается с возрастом. Признаки анемии имеют более 10% лиц старше 65 лет и до 50% пожилых пациентов с хроническими заболеваниями, проживающих в домах престарелых [4].
В практике врача терапевта и кардиолога часто встречается сочетание сердечно-сосудистой патологии с анемией. Анемия определяется у 25–40% больных с хронической сердечной недостаточностью (ХСН) и 10–20% пациентов с ИБС [5–7].
Вышедшие в последние два года европейские и американские рекомендации по ведению пациентов со стабильной стенокардией предполагают обязательное определение уровня гемоглобина у всех пациентов и рассматривают анемию как фактор, провоцирующий коронарную недостаточность [8, 9]. В последних рекомендациях по диагностике и лечению пациентов с ХСН американские и европейские эксперты отмечают, что анемия не только усиливает симптомы ХСН, ухудшает качество жизни пациентов, снижает толерантность к физической нагрузке, может являться причиной развития острой декомпенсации ХСН и увеличения частоты госпитализаций, но и является независимым негативным предиктором прогноза [10, 11]. Риск смерти при ХСН у больных с анемией в два раза выше, чем без нее даже при учете дополнительных переменных (почечная дисфункция, тяжесть ХСН и другие) [13]. Негативное влияние на прогноз при ХСН может оказывать уже латентный дефицит железа [14], что делает целесообразным определение его маркеров у всех пациентов с ХСН.
При остром коронарном синдроме наличие анемии может в четыре раза повышать вероятность смерти пациентов и рассматривается как независимый предиктор риска неблагоприятных клинических исходов [15, 16]. Даже синдром болей в груди у женщин при его сочетании с анемией оказывается более прогностически неблагоприятным (риск смерти увеличивается вдвое) [17].
Предоперационная анемия при кардиохирургических операциях определяет высокий риск последующего переливания крови и худшие результаты лечения, что делает актуальной задачи раннего выявления анемии и качественного, своевременного ее лечения [18].
Доказана роль анемии как независимого фактора риска неблагоприятного прогноза при фибрилляции предсердий у лиц пожилого и старческого возраста [19].
Как показал анализ влияния сочетания анемии и нарушения функции почек на ИБС в популяционном исследовании ARIC (The Atherosclerosis Risk in Communities Study), анемия встречается у лиц с незначительным и умеренным снижением функции почек намного чаще, чем предполагалось. А сочетание анемии и почечной дисфункции значимо повышает риск развития ИБС даже после учета таких известных факторов риска, как сахарный диабет, уровень липидов крови, артериальное давление и применение антигипертензивной терапии. В выводах подчеркивается необходимость своевременного выявления и лечения анемии для улучшения прогноза пациентов [20].
Неблагоприятное взаимное влияние ХСН, анемии и почечной дисфункции дало основание для выделения новых синдромов: «синдром кардиоренальной анемии», «кардиоренальный железодефицитный синдром» и даже «синдром кардиоренальной анемии и дефицита железа». Последние термины подчеркивают значение дефицита железа как самостоятельного фактора риска неблагоприятного прогноза при ХСН. Возможность непосредственного влияния дефицита железа на диастолическую функцию, гипертрофию, фиброз и дилатацию миокарда, уровень циркулирующего эритропоэтина, молекулярные сигнальные пути и активацию воспаления доказана в экспериментах на животных [21]. Такой широкий спектр негативных последствий дефицита железа, вероятно, связан с ролью железа в организме. Оно не только входит в состав гемоглобина и миоглобина, но и находится в ферментах, участвующих в процессах превращения аденозинтрифосфата в аденозиндифосфат, способствует транспорту электронов в митохондриальных цепях, определяет тканевой метаболизм и поглощение свободных радикалов [19]. Железо задействовано в иммунных реакциях, необходимо для миелинизации нервных волокон, синтеза ДНК [22, 23].
Анемия у лиц с сердечно-сосудистыми заболеваниями может иметь те же этиологические факторы, что и в целом в популяции. Дополнительную роль в развитии анемии при сердечно-сосудистой патологии могут играть характерные для нее более старший возраст пациентов, что само по себе связано с более низким значением гемоглобина, возрастающая частота хронической болезни почек, высокая распространенность сахарного диабета. Предполагается, что в развитие анемии при патологии сердечно-сосудистой системы вносят вклад: хронический воспалительный процесс (повышение синтеза провоспалительных цитокинов — фактора некроза опухоли альфа, интерлейкина-6), ишемическая депрессия костно-мозгового кроветворения, снижение синтеза эндогенного эритропоэтина вследствие почечной дисфункции. При ХСН в формировании анемии может играть роль гемодилюция с задержкой натрия и воды и нарушение всасывания железа и витаминов в кишечнике. Дополнительным фактором для развития анемии может быть проводимая медикаментозная терапия, вызывающая кровопотери (при приеме Аспирина, антикоагулянтов), снижение продукции эритропоэтина и чувствительности к нему костного мозга (при использовании блокаторов ренин-ангиотензин-альдостероновой системы) и т. д.
Актуальность вопроса ранней диагностики анемии у пациентов с сердечно-сосудистой патологией определяется тем, что запоздалое ее выявление приводит к задержке или отсутствию необходимого вмешательства в отношении потенциально корригируемого состояния.
Значительная часть пациентов с сердечно-сосудистой патологией имеют латентный дефицит железа, либо железодефицитную анемию (ЖДА) или сочетание этих состояний с другими видами анемий.
Клинические признаки ЖДА складываются из анемического и сидеропенического синдромов, последний определяется также при дефиците железа. Анемический синдром может включать следующие проявления: слабость, головокружение, синкопальные и ортостатические состояния, снижение памяти, эпилептические припадки, симптомы коронарной недостаточности (ангинальные боли, нарушения реполяризации на ЭКГ, аритмии), симптомы миокардиальной недостаточности, систолический шум при аускультации сердца. Сидеропенический синдром приводит к множественным нарушениям различных органов и систем. Общеизвестны поражения при дефиците железа кожного покрова, придатков кожи и слизистых (сухость, поражение волос и ногтей и т. д.). Не менее частыми проявлениями являются симптомы со стороны желудочно-кишечного тракта (снижение и извращение аппетита, дисфагия, запоры или диарея, глоссит, жжение языка, эзофагит, дистрофические изменения клеток слизистой оболочки желудка); нервной системы (повышенная утомляемость, шум в ушах, головокружение, головные боли, снижение интеллектуальных возможностей); сердечно-сосудистой системы (тахикардия, диастолическая дисфункция); мочевыделительной системы (дизурия и недержание мочи при кашле, смехе, ночной энурез).
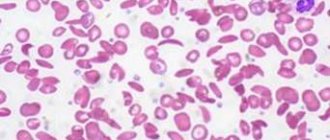
При лабораторной диагностике хронической ЖДА микроскопия мазка периферической крови выявляет микроцитарную гипохромную анемию с гипопролиферацией ретикулоцитов. Для подтверждения дефицита железа необходимо сниженное содержание железа и ферритина в сыворотке крови.
Лечение ЖДА направлено на терапию заболевания, лежащего в основе дефицита железа и собственно компенсацию дефицита железа.
Хотя пациентам с ЖДА необходимы диетические рекомендации, важно четко объяснить, что диета не является основой терапии. Наибольшее количество железа содержится в мясе (гемовое железо). Все остальные продукты содержат железа меньше, а, главное, всасывается оно из них значительно меньше (1–5% из яблок, 10–15% из яиц и рыбы при 25–30% из мяса).
В медикаментозной терапии ЖДА главным направлением было и остается применение препаратов железа. Выбор лекарственного препарата железа определяется его эффективностью (количеством и биодоступностью содержащегося в нем железа) и переносимостью. Необходимо поступление от 100 до 300 мг элементарного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Препараты железа на отечественном рынке представлены гидроксиполимальтозным комплексом, железосорбитоловым комплексом, протеин сукцинилатом железа, железосахарозным комплексом. Для пациентов с кардиальной патологией крайне важно при проведении дополнительной медикаментозной терапии ЖДА, кроме высокой эффективности, отсутствие негативных лекарственных взаимодействий и хорошая переносимость препарата. Этим требованиям отвечает препарат Мальтофер — полимальтозный комплекс железа сульфата (ІІІ). Мальтофер — неионный препарат железа. Его абсорбция обеспечивается активным транспортом, без предварительной диссоциации в кишечнике, что позволяет исключить раздражающее действие на слизистую оболочку и избежать большинства нежелательных реакций со стороны желудочно-кишечного тракта, типичных для ионизированных препаратов железа [25, 26]. Мальтофер не взаимодействует ни с пищей, ни с другими лекарственными препаратами, а форма выпуска в виде жевательных таблеток позволяет применять его в любое время и в любой обстановке [27–30]. В то же время всасывание железа из других препаратов железа может уменьшаться под влиянием содержащихся в некоторых пищевых продуктах веществ — фитинов (рис, соя), фосфатов (рыба, морепродукты), танина (чай, кофе), при одновременном приеме ряда медикаментов (тетрациклины, антациды, соли кальция и магния), что требует приема этих лекарственных средств с учетом времени употребления пищи и указанных медикаментов. Препараты солей железа содержат двухвалентное железо, которое после поступления в кровь превращается в трехвалентное для последующего его включения в молекулу гемоглобина, что может сопровождаться образованием свободных радикалов и оказывать негативное влияние на физиологические процессы в различных органах и тканях [31]. Мальтофер содержит трехвалентное железо, непосредственно использующееся для построения молекулы гемоглобина, поэтому не имеет прооксидантного действия [32]. При использовании препаратов железа в адекватных дозах уже через несколько дней может отмечаться субъективное улучшение самочувствия. Первый объективный критерий — ретикулоцитарный криз (увеличение числа ретикулоцитов в 2–10 раз по сравнению с исходным) отмечается к концу первой недели терапии. Отсутствие ретикулоцитарного криза говорит либо о неадекватной дозе препарата, либо об ошибочном назначении препарата. Повышение уровня гемоглобина и числа эритроцитов отмечается на третьей неделе терапии. После нормализации уровня гемоглобина половинную дозу препарата железа рекомендуется применять еще 4–8 недель для насыщения им депо железа.
В 2013 г. вышли первые рекомендации по лечению анемии у пациентов с сердечно-сосудистой патологией, выпущенные американским колледжем врачей [20]. Они в целом определяют тактику ведения пациента с кардиальной патологией и анемией независимо от ее этиологии. Рассматривается три стратегии лечения: использование эритропоэтин-стимулирующих агентов, переливание эритромассы и восполнение дефицита железа. Подчеркивается, что переливание эритромассы не дает пользы и может нанести вред пациентам, поэтому оно возможно только у госпитализированных тяжелых пациентов с ИБС при тяжелой анемии. Не рекомендуется применение эритропоэтин-стимулирующих средств при легкой и среднетяжелой анемии у пациентов с ХСН и ИБС из-за потенциального риска развития тромбоэмболических осложнений и отсутствия влияния терапии на прогноз и частоту госпитализаций. Положительные данные на сегодня имеются для стратегии восполнения дефицита железа введением внутривенно карбоксимальтозата железа, эта тактика улучшает толерантность к физической нагрузке, качество жизни, снижает смертность и частоту госпитализаций [33].
Таким образом, анемия является частой сопутствующей патологией при сердечно-сосудистых заболеваниях. Сегодня в кардиологии она оценивается как независимый предиктор риска неблагоприятных клинических исходов, поэтому пациенты с сердечно-сосудистой патологией нуждаются в своевременной диагностике анемии для проведения адекватной терапии.
Литература
- World Health Organization Сердечно-сосудистые заболевания // Информационный бюллетень № 317. Март 2013 г. [Электронный ресурс] — Режим доступа: https://www.who.int/mediacentre/factsheets/fs317/ru/ [Дата обращения: 10.04.2014].
- World Health Organization 10 ведущих причин смерти в мире // Информационный бюллетень № 310. Июль 2013 г. [Электронный ресурс] — Режим доступа: https://www.who.int/mediacentre/factsheets/fs310/ru/ [Дата обращения: 10.04.2014].
- Worldwide prevalence of anaemia 1993–2005. WHO Global Database on Anaemia. [Электронный ресурс] — Режим доступа: https://whqlibdoc.who.int/publications/2008/9789241596657_eng.pdf [Дата обращения: 10.04.2014].
- Bross M. H., Soch K., Smith-Knuppel T. Anemia in older persons // Am Fam Physician. 2010. Sep 1; 82 (5). P. 480–487.
- Boyd C. M., Leff B., Wolff J. L. et al. Informing clinical practice guideline development and implementation: prevalence of coexisting conditions among adults with coronary heart disease // J Am Geriatr Soc. 2011. 59. P. 797–805.
- Felker G. M., Adams K. F. Jr., Gattis W. A. et al. Anemia as a risk factor and therapeutic target in heart failure // J Am Coll Cardiol. 2004. 44. P. 959–966.
- Malyszko J., Bachorzewska-Gajewska H., Malyszko J. et al. Prevalence of chronic kidney disease and anemia in patients with coronary artery disease with normal serum creatinine undergoing percutaneous coronary interventions: relation to New York Heart Association class // Isr Med Assoc J. 2010. 12. P. 489–493.
- Stable Coronary Artery Disease (Management of). ESC Clinical Practice Guidelines. [Электронный ресурс] — Режим доступа: https://www.escardio.org/GUIDELINES-SURVEYS/ESC-GUIDELINES/Pages/GuidelinesList.aspx [Дата обращения: 10.04.2014].
- Fihn S. D., Cardin J. M., Abrams J. et al. 2012 ACCF/AHA/ACP/FCP/AATS/PCNA/SCAI/ SNS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease // J. Am. Coll. Cardiol. 2012. Vol. 60. № 24. P. e44-e164.
- 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. [Электронный ресурс] — Режим доступа: https://circ.ahajournals.org/content/128/16/e240.extract [Дата обращения: 10.04.2014].
- Acute and Chronic Heart Failure. ESC Clinical Practice Guidelines. [Электронный ресурс] — Режим доступа: https://www.escardio.org/GUIDELINES-SURVEYS/ESC-GUIDELINES/Pages/GuidelinesList.aspx [Дата обращения: 10.04.2014].
- Groenveld H. F., Januzzi J. L., Damman K. et al. Anemia and mortality in heartfailure patients a systematic review and metaanalysis // J Am Coll Cardiol. 2008. 52 (10). P. 818–827.
- Jankowska E. A., Rozentryt P., Witkowska A. et al. Iron deficiency: an ominous sign in patients with systolic chronic heart failure // Eur Heart J. 2010. 31 (15). P. 1872–1880.
- Meneveau N., Schiele F., Seronde M. F. et al. Anemia for Risk Assessment of Patients With Acute Coronary Syndromes // Am J Cardiol. 2009. Feb 15; 103 (4). P. 442–447.
- Hasin T., Sorkin A., Markiewicz W. et al. Prevalence and Prognostic Significance of Transient, Persistent, and New-Onset Anemia After Acute Myocardial Infarction // Am J Cardiol. 2009. Aug 15; 104 (4). P. 486–491.
- Arant C., Wessel T., Olson M. et al. Hemoglobin Level Is an Independent Predictor for Adverse Cardiovascular Outcomes in Women Undergoing Evaluation for Chest Pain. Results From the National Heart, Lung, and Blood Institute Women’s Ischemia Syndrome Evaluation Study // J Am Coll Cardiol. 2004. 2, Jun 2; 43 (11). P. 2009–2014.
- Muñoz M, Ariza D., Gómez-RamÍrez S. et al. Preoperative Anemia in Elective Cardiac Surgery: Prevalence, Risk Factors, and Influence on Postoperative Outcome // Transfusion Alternatives in Transfusion Medicine. 2010. 11 (2). P. 47–56.
- Sharma S., Gage B. F., Deych E. et al. Anemia: an independent predictor of death and hospitalizations among elderly patients with atrial fibrillation // Am Heart J. 2009. Jun; 157 (6). P. 1057–1063.
- Astor B. C., Coresh J., Heiss G. et al. Kidney function and anemia as risk factors for coronary heart disease and mortality: the Atherosclerosis Risk in Communities (ARIC) Study // Am Heart J. 2006. Feb; 151 (2). P. 492–500.
- Naito Y., Tsujino T., Matsumoto M. et al. Adaptive response of the heart to long-term anemia induced by iron deficiency // Am J Physiol Heart Circ Physiol. 2009. 296. P. 585–593.
- Ordway A. G., Garry D. J. Myoglobin: an essential hemoprotein in striated muscle // J Exp Biol. 2004. 20; 7. P. 3441–3446.
- Arredondo M., NbЦеz M. T. Iron and copper metabolism // Mol Aspects Med. 2005. 26. P. 313–327.
- Ortiz E., Pasquini J. M., Thompson K., Felt B. et al. Effect of manipulation of iron storage, transport, or availability on myelin composition and brain iron content in three different animal models // J Neurosci Res. 2004. 77. P. 681–689.
- Treatment of anemia in patients with heart disease: A clinical practice guideline from the American college of physicians // Annals of Internal Medicine. [Электронный ресурс] — Режим доступа: https://annals.org/article.aspx?articleid=1784292 [Дата обращения: 10.04.2014].
- Geisser P., Muller A. Pharmacokinetics of iron salts and ferric hydroxide carbohydrate complexes // Drug Research 1987. 37. P. 100–104.
- Pestaner J. P., Ishak K. G., Mullick.F. G., Centeno J. A. Ferrous Sulfate toxicity. A review of autopsy findings // Biol Trace Elem Res. 1999. 69 (3). P. 191–198.
- Andrade J. V. D., Rodrigues P. P. B., Fontoura I. B. et al. Tratamento da anemia ferropriva com hidróxido de ferro polimaltosado — Estudo multicêntrico comparativo entre tratamento ministrado com e sem alimentação concomitante // Arq bras Med (Suppl). 1992. 66. P. 253–258.
- Funk F., Canclini C., Geisser P. Interactions between iron (III)-hydroxide polymaltose complex and commonly used medications. Laboratory studies in rats // Arzneimittel-Forschung (Drug Research). 2007. 57 (6 a). P. 370–375.
- Potgieter M. A., Potgieter J. H., Venter C., Venter J. L., Geisser P. Effect of oral tetracycline on iron absorption from iron (III)-hydroxide polymaltose complex in patients with iron deficiency anemia. A single-centre randomized controlled isotope study // Arzneimittel-Forschung (Drug Research). 2007. 57 (6 a). P. 376–384.
- Burckhardt-Herold S., Klotz J., Funk F. et al. Interactions between iron (III)-hydroxide polymaltose complex and commonly used drugs. Simulations and in-vitro studies // Arzneimittel-Forschung (Drug Research). 2007. 57 (6a). P. 360–369
- Hutchinson C., Al-Ashgar W., Liu D. Y. et al. Oral ferrous sulphate leads to a marked increase in pro-oxidant nontransferrin-bound iron // Eur. J. Clin. Invest. 2004. 34. P. 782–784.
- Geisser P. Safety and Efficacy of Iron (III) hydroxide Polymaltose Complex. A review of 25 years experience. Arzneimittel-Forschung (Drug Research) 2007. 57 (6 a). P. 439–452.
- Anker S. D., Comin-Colet J., Filippatos G. et al. Ferric Carboxymaltose in Patients with Heart Failure and Iron Deficiency // N. Engl. J. Med. 2009. 361. P. 2436–2448.
Е. С. Темникова, доктор медицинских наук, профессор
ГБОУ ВПО ОмГМА МЗ РФ, Омск
Контактная информация
В чем опасность длительно существующей анемии?
Даже анемия легкой степени в случае длительного существования может нанести серьезный ущерб здоровью! Длительное кислородное голодание тканей (гипоксия) приводит к нарушению обмена веществ, накоплению токсических продуктов метаболизма, избыточной нагрузке на органы жизнеобеспечения – сердце, легкие, а также органы выделения – печень, почки.
В результате хронической гипоксии в тканях и органах развиваются склеротические процессы – нормальная, работающая ткань замещается склеротической (условно «рубцовой»), в результате чего органы начинают постепенно утрачивать свою функцию – развивается кардиосклероз с проявлениями сердечной недостаточности (одышка, отеки, снижение переносимости физических нагрузок), нарушениями сердечного ритма, дыхательная недостаточность, страдает функция печени, почек, сосудов, эндокринных органов, головного мозга. Человек, сам того не замечая, обрастает хроническими заболеваниями, теряет работоспособность, становится эмоционально лабильным, подавленным, снижается иммунитет. Помимо того, на фоне хронической анемии любое острое заболевание, будь то вирусная инфекция, ангина, либо более серьезные болезни протекают намного тяжелее, опасные осложнения развиваются намного чаще ввиду того, что компенсаторных возможностей в организме просто нет, они истощены длительным гипоксическим состоянием.
Для того чтобы избежать развития хронических заболеваний на фоне анемии, длительных, изнуряющих, а порой и дорогостоящих лечений, необходимо соблюдать простые правила:
- проходить ежегодный профилактический осмотр – для здорового человека будет достаточно сдать общий анализ крови и мочи, пройти флюорографию и посетить терапевта, гинеколога (уролога) и стоматолога.
- при выявлении симптомов хронических заболеваний, которые могут привести к развитию анемии, своевременно проводить их коррекцию.
- при наличии признаков хронических кровотечений своевременно диагностировать и лечить заболевания их вызывающие.
Особенно это касается женщин с гинекологическими проблемами. Зачастую женщины привыкли терпеть все невзгоды и длительные обильные менструации считают чуть ли не вариантом нормы! Это в корне неправильно – с одной стороны, очень часто после лечения удается достаточно легко восстановить нормальный менструальный цикл и причин для анемии просто не остается, с другой – длительные обильные месячные, особенно у женщин после 40 лет, могут быть первыми симптомами онкологических заболеваний женской сферы!
— анемию нужно лечить! Даже если у Вас анемия легкой степени, необходимо своевременно коррегировать уровень гемоглобина — иногда достаточно просто диеты и месячного курса приема препаратов железа, чтобы восстановить нормальные показатели крови и предупредить развитие неблагоприятных отдаленных последствий!
В клинике АЦМД-МЕДОКС доступны практически все необходимые методы исследования для диагностики анемий. Комфортные условия, профессиональные специалисты, современное оборудование позволит пройти необходимые исследования безболезненно и в кратчайшие сроки.
Опытные врачи нашего центра помогут Вам на ранних стадиях выявить первые признаки анемии, разобраться в причинах ее возникновения и назначить адекватную терапию выявленных патологий! Будьте здоровы!
Что такое гемоглобин и как он влияет на величину артериального давления?
Гемоглобин – сложный белок, имеющий в составе железо и циркулирующий в крови человека внутри эритроцитов. Эго основной функцией является образование связи с кислородом и его перенос в ткани и клетки организма.
Норма гемоглобина у взрослого человека:
- мужчины—130—160г/л;
- женщины—120—150г/л.
Если говорить о связи гемоглобина и АД, то она весьма значительна: с увеличением уровня белка в крови возрастает давление, с его снижением – оно уменьшается.
Встречается ли анемия у гипертоников и как с этим бороться?
Если говорить о том, возможно ли высокое давление при низком гемоглобине, нужно сказать о существовании подобного сочетания, поскольку анемия и высокое артериальное давление могут быть у одного человека, как два заболевания не имеющих отношение друг к другу. Каждая из этих патологий возникает по своей отдельной причине в большинстве случаев.
Наличие гипертензии не говорит о том, что человек застрахован от низкого уровня гемоглобина. В таком случае обязательно нужно искать причину анемии и устранять её, не забывая о контроле давления.
Причины повышенного давления при первичной гипертонии
Точную причину развития хронической гипертонии назвать трудно. Развитие болезни происходит из-за нарушений в работе механизмов регуляции артериального давления, которые возникают по различным причинам. К дефектам работы относят плохую работу почек, из-за чего в организме задерживается натрий. В организме накапливается больше жидкости, почки не реагируют на случайные повышения давления при нагрузке и стрессе.
К нарушениям АД может привести повышенная активность нервной системы. Изменения ее чувствительности могут быть обусловлены генетически или факторами окружающей среды – стрессы, хроническая усталость или боли. При повышении активности ЦНС возрастает нагрузка на сердце.
Причиной повышенного давления могут стать нарушения кровообращения в тканях – отеки из-за проблем с метаболизмом, эпителиальная дисфункция.
У пожилых людей давление повышается с возрастом. У подростков и молодых людей заболевание может быть вызвано факторами внешней среды, образом жизни или наследственностью. Фактор наследственности для эссенциальной гипертонии не оспаривается врачами. Так вероятность ее наследования составляет 30%.
К факторам риска первичной артериальной гипертензии относят:
- Переизбыток насыщенных жирных кислот в меню, в частности холестерина.
- Повышенное содержание соли в пище, например, соленья и полуфабрикатах.
- Малоподвижный образ жизни и избыток массы тела.
- Курение и алкоголь.
- Напряжение, стресс, нервные срывы.
Избыток холестерина откладывается на стенках сосудов, что сужает их просвет и мешает току крови. Структура артерий изменяется и из-за переизбытка соли. Чрезмерное ее употребление делает сосуды хрупкими и ухудшает их эластичность.
Вес, как одна из причин развития гипертонии, рассматривается в контексте ИМТ – избыточной массы тела. При значительном превышении этого показателя нужно принять меры, чтобы снизить риск развития осложнений. Риск развития артериальной гипертензии при избыточной массе возрастает в 2-6 раз, особенно при верхнем типе ожирения, когда увеличивается окружность талии.
Симптомы железодефицита
ЖДА высоко распространена у детей и взрослых по всему миру. От дефицита железа страдает почти каждый второй ребенок дошкольного возраста и половина беременных женщин. Около 9% детей до двух лет лечат от анемии. По данным ВОЗ, число людей с дефицитом железа в мире составляет не менее 600 млн человек.
Железодефицитная анемия может быть легкой, средней и тяжелой степени. В легкой степени нет клинических проявлений либо они практически не беспокоят. В умеренной степени появляются симптомы, на которые следует обратить внимание:
- быстрая утомляемость;
- слабость;
- пониженная концентрация внимания;
- бледность слизистых оболочек и ногтевых лож;
- шелушение кожи.
При тяжелой форме добавляются более выраженные симптомы:
- одышка при незначительных нагрузках;
- головокружение, шум в ушах;
- аритмия, учащенный пульс;
- нарушение сна;
- зябкость;
- ломкость ногтей;
- частые простудные заболевания.
При развитии анемической прекомы кожа и слизистые становятся бледными, появляется тахикардия, возможны галлюцинации и депрессивный синдром. Необходима срочная помощь врача. Если не нормализовать уровень железа в организме может наступить анемическая кома с потерей сознания и отсутствием рефлексов.
Сопутствует ли повышению гемоглобина рост давления?
Причины высокого гемоглобина:
курение;- употребление алкоголя;
- врождённые пороки сердца;
- легочная недостаточность;
- хроническая сердечная недостаточность;
- проблемы с кишечником;
- переизбыток витамина В12;
- поликистоз почек;
- пребывание в высокогорных районах;
- длительные физические нагрузки;
- обезвоживание;
- сахарный диабет;
- эритремия;
- онкология;
- проблемы с кишечником.
Симптомы при высоком гемоглобине:
- сонливость;
- утомляемость;
- снижение аппетита;
- нарушение зрения и мочеиспускания;
- бледность кожных покровов или покраснение;
- ломота в костях и суставах.
Повышение уровня гемоглобина приводит к сгущению крови, а это в свою очередь к росту АД, поскольку перекачивать «густую» кровь сердцу гораздо тяжелее. Но не только нестабильность давления является проблемой в подобном случае: сгущение также увеличивает риск закупорки сосудов, то есть способствует тромбообразованию. Это ухудшает транспорт кислорода, а также приводит к тромбоэмболии, инфарктам, инсультам.
Как восстановить нормальный состав крови?
Самостоятельно заниматься коррекцией не рекомендуется. Обязательно нужна консультация врача. Если гемоглобин повышен или снижен не более чем на 10 единиц, скорее всего, это не является следствием какого-то заболевания – данные отклонения говорят о функциональном состоянии, скорректировать которое можно с помощью изменения образа жизни, в частности питания.
Больным, страдающим гипертензией и повышением гемоглобина, назначают препараты для разжижения крови: курантил, кардиомагнил, аспирин.