4.1. Двухэтапная проба в пробирках с антиглобулином
4.2. Проба на совместимость на плоскости при комнатной температуре
4.3. Непрямая проба Кумбса
4.4. Проба на совместимость с применением 10% желатина
4.5. Проба на совместимость с применением 33% полиглюкина
Проба на индивидуальную совместимость позволяет убедиться в том, что у реципиента нет антител, направленных против эритроцитов донора и таким образом предотвратить трансфузию эритроцитов, несовместимых с кровью больного.
Проба на совместимость, выполняемая на плоскости при комнатной температуре, имеет целью выявить у реципиента полные групповые агглютинины системы АВ0, MNSs, Lewis и др. Проба на совместимость с применением 10% желатина, 33% полиглюкина, непрямая проба Кумбса предназначена для выявления у реципиента неполных групповых антител. Двухэтапная проба в пробирках с антиглобулином предусматривает выявление и тех и других антител, в том числе групповых гемолизинов.
Наиболее чувствительной и рекомендуемой является двухэтапная проба в пробирках с антиглобулином, затем комбинация двух проб — пробы на плоскости при комнатной температуре и непрямой пробы Кумбса. Вместо непрямой пробы Кумбса может быть применена реакция конглютинации с 10% желатином или реакция конглютинации с 33% полиглюкином. Последняя проба уступает по чувствительности первым двум, однако занимает меньше времени.
4.1. Двухэтапная проба в пробирках с антиглобулином
Первый этап.
В маркированную пробирку вносят 2 объема (200 мкл) сыворотки реципиента и 1 объем (100 мкл) 2% взвеси трижды отмытых эритроцитов донора, суспендированных в физиологической растворе или LISS (раствор низкой ионной силы). Содержимое пробирки перемешивают и центрифугируют при 2500 об/мин (около 600g) в течение 30 с. Затем оценивают наличие гемолиза в надосадочной жидкости, после чего осадок эритроцитов ресуспендируют, слегка постукивая кончиком пальца по дну пробирки, и определяют наличие агглютинации эритроцитов. При отсутствии выраженного гемолиза и/или агглютинации переходят к выполнению второго этапа пробы с использованием антиглобулиновой сыворотки.
Второй этап.
Пробирку помещают в термостат при температуре 37°С на 30 мин, после чего снова оценивают наличие гемолиза и/или агглютинации эритроцитов. Затем эритроциты трижды отмывают физиологическим раствором, добавляют 2 объема (200 мкл) антиглобулиновой сыворотки для пробы Кумбса и перемешивают. Пробирки центрифугируют в течение 30 с, осадок эритроцитов ресуспензируют и оценивают наличие агглютинации.
Учет результатов проводят невооруженным глазом или через лупу. Выраженный гемолиз и/или агглютинация эритроцитов указывает на присутствие в сыворотке реципиента групповых гемолизинов и/или агглютининов, направленных против эритроцитов донора, и свидетельствует о несовместимости крови реципиента и донора. Отсутствие гемолиза и/или агглютинации эритроцитов свидетельствует о совместимости крови реципиента и донора.
4.2. Проба на совместимость на плоскости при комнатной температуре
На пластинку наносят 2 — 3 капли сыворотки реципиента и добавляют небольшое количество эритроцитов с таким расчетом, чтобы соотношение эритроцитов и сыворотки было 1:10 (для удобства рекомендуется сначала выпустить через иглу несколько капель эритроцитов из контейнера на край пластинки, затем оттуда стеклянной палочкой перенести маленькую каплю эритроцитов в сыворотку). Далее эритроциты перемешивают с сывороткой, пластинку слегка покачивают в течение 5 мин, наблюдая за ходом реакции. По истечении указанного времени в реагирующую смесь можно добавить 1 — 2 капли физиологического раствора для снятия возможной неспецифической агрегации эритроцитов.
Учет результатов. Наличие агглютинации эритроцитов означает, что кровь донора несовместима с кровью реципиента и не должна быть ему перелита. Если по истечении 5 мин агглютинация эритроцитов отсутствует, то это означает, что кровь донора совместима с кровью реципиента по групповым агглютиногенам.
Система группы крови AB0
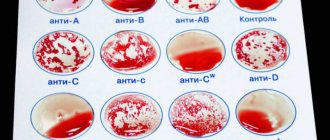
Определение группы крови по системе AB0 основано на выявлении на поверхности эритроцитов человека группоспецифических антигенов 0, A, B и изоиммунных антител анти-A (α) и анти-B (β) в сыворотке. Уникальная особенность системы AB0 заключается в наличии в плазме человека естественных антител α и β к отсутствующему антигену. Возможны шесть вариантов аллельных антигенов: 00, A0, AA, B0, BB, AB. Фенотипически выделяют четыре группы: 0(I), A(II), B(III), AB(IV) — гетеро- и гомозиготные варианты объединяют (в России используют буквенно-цифровое обозначение).
Групповая принадлежность по системе AB0
| Агглютиногены | Агглютинины |
| 0 | α и β |
| A | β |
| B | α |
| AB | нет |
- 0(I): антигены A и B отсутствуют, антитела α и β – обнаружены (35 — 40 % населения в мире);
- A(II): присутствует антиген A и антитела β (35 %);
- B(III): обнаружен агглютиноген B и агглютинин α (15 – 20 %);
- AB(IV): наличие агглютиногенов A и B, отсутствие агглютининов α и β (5 – 10 %).
По мере движения с запада на восток Евразии частота обнаружения антигена A падает, а антигена B возрастает. Антиген 0 редко встречается в Азии, но имеет широкое распространение у коренных народов Южной Америки, Полинезии и Австралии. Причина – эпидемии инфекционных заболеваний.
Результат типирования крови записывают в историю болезни или в карту донора. Врач-трансфузиолог указывает дату и ставит подпись.
В отдельных случаях во время типирования наблюдается слабовыраженная агглютинация эритроцитов. Недостаточно выраженная реакция объясняется наличием слабых вариантов антигенов A и B. Наибольшее клиническое значение представляют подгруппы A1 и A2. Впервые слабые варианты были обнаружены в 1911 году учеными Dungern и Hirszeld. Позднее в 1930 году Landsteiner и Levine предложили названия подгруппы – A1 и A2. A2 встречается до 20 % в группе A и до 35 % в группе AB. Сыворотка лиц из образцов крови A2 может содержать анти-A1-антитела: в 2 % случаев в группе A2 и в 30 % в A2B. Антитела анти-A1 представляют опасность ввиду агглютинации эритроцитов группы A.
Методика определения групп крови A2 и A2B
Частота выявления эритроцитов A2 существенно варьируется в зависимости от применяемых реагентов. Приводим сравнение результатов исследования при использовании различных методик типирования групп крови A2 и A2B.
- Анти-A1 (лектин, фитогемагглютинин). Диагностикум явно выраженно (на +++/++++) агглютинирует A1 эритроциты сразу после смешения с образцом. Не агглютинирует A2 или вызывает мелкую агглютинацию на пятой минуте и позднее.
- Стандартные изогемагглютинирующие сыворотки.
- Цоликлоны анти-A и анти-AB.
- Цоликлон анти-A слабый.
| Число проанализированных образцов | Группа крови A (II) | Группа крови AB (IV) | ||
| Число проанализированных образцов | Группа A2 (II) в % | Число проанализированных образцов | Группа A2B (IV) в % | |
| Анти-A1 (лектин, фитогемагглютинин) | 1592 | 14,7 | 357 | 23,5 |
| Цоликлоны: анти-A, анти-AB | 3599 | 2,1* | 357 | 7,03* |
| Цоликлон анти-А — слабый | 3587 | 4,5* | 357 | 11,2* |
| Стандартные изогемагглютинирующие сыворотки | 1592 | 17,4 | 344 | 34,2 |
Примечание: * — агглютинация выражена слабо, присутствуют мелкие агглютинаты на розовом фоне.
Наибольшую точность исследования обеспечивает Анти-A1 (лектин, фитогемагглютинин). Тест рекомендован для выявления подгрупп антигена A у детей младше двух лет. Причина – физиологическая незрелость эритроцитов новорожденных, влекущая ошибочные результаты исследования со стандартными изогемагглютинирующими сыворотками.
В 1930 году Landsteiner и Levine обнаружили подтип Aint: промежуточный вариант между A1 и A2. Данный антиген характерен для негроидов и достигает 8,5 % у лиц с группой крови A. У европеоидов Aint наблюдался лишь у 1 % людей со второй группой крови. В крайне редких случаях у человека отсутствуют все антигены системы AB0. Фенотип «Бомбей» обусловлен генотипом hh. При отсутствии антигена H у лиц данной категории обнаруживаются анти-A и анти-B антитела.
Методика определения групп крови
Типирование по системе AB0 осуществляют в реакции прямой агглютинации с использованием стандартных гемагглютинирующих сывороток или типирующих реагентов с моноклональными антителами. Применение цоликлонов предпочтительнее ввиду абсолютной специфичности: каждый реагент не содержит примеси других антител, балластных белков и инфекционных факторов.
Алгоритм выявления группы крови гемагглютинирующими сыворотоками
Для определения группы крови AB0 прямым методом используют две серии стандартных изогемагглютинирующих сывороток. Подготовьте две серии сывороток трех групп с титром 1:32 или выше. Для забора каждой сыворотки используйте отдельную маркированную пипетку. Подготовьте сыворотку AB(IV) для контроля.
- Обеспечьте хорошее освещение и температуру воздуха 18 – 25 °C.
- Промаркируйте планшет: 0(I) – слева, A(II) – по центру, B(III) – справа. Вверху по центру укажите фамилию донора или номер анализируемой крови.
- Нанесите в лунки 1 – 2 капли (приблизительно 0,1 мл) сывороток в два ряда в соответствии с маркировкой планшета.
- Пипеткой или стеклянной палочкой поместите по одной маленькой капле исследуемых эритроцитов рядом с каплями сыворотки. Объем сыворотки должен примерно в 10 раз превышать объем эритроцитосодержащей жидкости.
- Перемешайте капли в лунках палочкой.
- Для ускорения реакции произведите легкое покачивание планшета.
- Спустя три минуты в лунки планшета, в которых началась агглютинация, добавьте по одной капле NaCl. Подождите еще две минуты.
- Спустя пять минут оцените результаты реакции в проходящем сете. В случае невыраженной агглютинации добавьте еще по одной капле NaCl.
Результаты реакции:
- Отрицательная реакция в трех лунках свидетельствует об отсутствии антигенов на эритроцитах исследуемого образца. Кровь относится к группе 0(I).
- Агглютинация в лунках с сыворотками 0(I) и B(III) говорит о наличии агглютиногена A и принадлежности к группе A(II).
- Наступление реакции с сыворотками 0(I) и A(II) свидетельствует о присутствии антигена B и групповой принадлежности B(III).
- Результаты реакции во всех лунках указывают на присутствие агглютиногенов A и B и соответствуют четвертой группе AB(IV).
В последнем случае следует удостовериться в отсутствии неспецифической реакции: нанесите на планшет 2 – 3 капли соответствующей группе AB(IV) сыворотки и добавьте одну каплю анализируемых эритроцитов. Перемешайте жидкости и оцените результат спустя пять минут. Отсутствие агглютинации свидетельствует о принадлежности к группе AB(IV), наличие – признак неспецифической реакции. В этом случае, а также при слабовыраженной агглютинации повторите исследование с другими сериями сывороток.
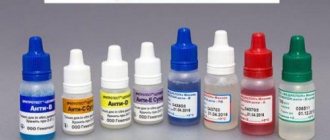
Техника определения группы крови цоликлонами
Моноклональные антитела к антигенам эритроцитов пришли на смену изогемагглютинирующих сывороток. Для каждого типирования достаточно одной серии реагентов анти-A, анти-B, анти-AB. Внедрение моноклональных реагентов позволило значительно упростить и стандартизировать методику типирования по системе AB0. Приводим краткое пошаговое руководство проведения исследования на планшете.
- Обеспечьте хорошее освещение. Работайте при комнатной температуре воздуха.
- Объект исследования – эритроцитосодержащие среды.
- Промаркируйте лунки планшета: анти-A, анти-B, анти-AB или используйте планшет с маркированной наклейкой.
- Нанесите примерно по 0,1 мл соответствующего моноклонального реагента в каждую из трех подписанных лунок.
- Добавьте приблизительно по 0,03 мл анализируемых эритроцитов рядом с каждой каплей диагностикума.
- Смешайте реагент с эритроцитами в лунках отдельными индивидуальными стеклянными палочками.
- Покачивайте планшет около трех минут.
- Проверьте наличие агглютинации в лунках.
Обычно реакция обнаруживается уже в первые секунды после смешивания. При этом слабые варианты антигенов A и B могут давать более позднюю агглютинацию.
отбор образца крови
внесение образца в лунку
планшет с внесенными образцами
добавление цоликлонов
планшет с эритроцитами и цоликлонами
смешивание исследуемых проб с реагентами
Непрямой метод типирования: алгоритм действий
Методика определения основана на взаимодействии эритроцитов от предварительно типированных лиц групп 0, A, B или смеси эритроцитов от нескольких одногруппных доноров с изогемагглютининами α и β в исследуемой сыворотке.
При работе с каждым типирующим реагентом используйте сухие чистые пипетки. Промывание палочек для перемешивания и пипеток осуществляйте в 0,9 % растворе NaCl.
- Подготовьте пластину или планшет. Обеспечьте хорошее освещение помещения.
- Выполните забор 3 – 5 мл крови без стабилизатора в пробирку. Дайте сыворотке отстояться 1,5 – 2 часа при комнатной температуре.
- Отмойте тест-эритроциты в 0,9 % физиологическом растворе. Подготовьте 5 % взвесь.
- Промаркируйте секции на планшете: 0(I), A(II), B(III).
- Поместите по 2 капли (приблизительно 0,1 мл) анализируемой плазмы в каждую из трех лунок.
- Добавьте в лунки примерно по 0,03 мл тест-эритроцитов.
- Отдельными палочками смешайте типированные эритроциты с сывороткой.
- Аккуратно покачивайте планшет в течение 5 минут.
- Проведите визуальную оценку результатов реакции агглютинации в проходящем свете.
Заключение о групповой принадлежности
| Результаты анализа плазмы со стандартными эритроцитами | Групповая принадлежность | ||
| 0(I) | A(II) | B(III) | |
| — | + | + | 0(I) |
| — | — | + | A(II) |
| — | + | — | B(III) |
| — | — | — | AB(IV) |
+ — наличие агглютинации, — — отрицательный результат реакции.
- 0(I): реакция в лунках A(II), B(III) (обнаружены антитела α и β).
- A(II): агглютинация с эритроцитами B(III) (выявлены агглютинины β).
- B(III): агглютинация в лунке A(II) (определены агглютинины α).
- AB(IV): отсутствие результатов реакции во всех лунках (антитела в плазме не обнаружены).
4.3. Непрямая проба Кумбса
В пробирку вносят одну каплю (0,02 мл) осадка трижды отмытых эритроцитов донора, для чего выдавливают из пипетки небольшую каплю эритроцитов и касаются ею дна пробирки, и добавляют 4 капли (0,2 мл) сыворотки реципиента. Содержимое пробирок перемешивают встряхиванием, после чего их помещают на 45 мин в термостат при температуре +37°С. По истечении указанного времени эритроциты вновь трижды отмывают и готовят 5% взвесь в физиологическом растворе. Далее 1 каплю (0,05 мл) взвеси эритроцитов на фарфоровую пластинку, добавляют 1 каплю (0,05 мл) антиглобулиновой сыворотки и перемешивают стеклянной палочкой. Пластинку периодически покачивают в течение 5 мин.
Учет результатов проводят невооруженным глазом или через лупу. Агглютинация эритроцитов свидетельствует о том, что кровь реципиента и донора несовместимы, отсутствие агглютинации является показателем совместимости крови донора и реципиента.
Подготовка к переливанию крови
Кроме того, что берется проба на индивидуальную совместимость, существуют определенные правила переливания. Нельзя ни в коем случае переливать холодную кровь, ее обязательно согревают около часа при комнатной температуре. Если необходимо срочно влить кровь, то все манипуляции делаются немедленно, чтобы сердце пациента не остановилось. Важно помнить, что переливание крови делается как минимум через час после приема пищи.
Перед началом гемотрансфузии обязательно обозначается группа крови донора, а также делается проверка группы крови самого реципиента. Когда используется кровь, заранее заготовленная во флаконах, то сначала срывается металлический колпачок, после чего обрабатывается спиртом резиновая пробка.
- Переливание крови по группам крови: правила. Универсальные доноры. Таблица совместимости групп крови
Именно эту пробку прокалывают толстыми иглами, которые могут иметь разную длину. К короткой игле подсоединяется система для переливания, а длинная подсоединяется к катетеру.
4.4. Проба на совместимость с применением 10% желатина
В пробирку вносят 1 небольшую каплю (0,02 — 0,03) мл эритроцитов донора, для чего выдавливают из пипетки небольшую каплю эритроцитов и касаются ею дна пробирки, добавляют 2 капли (0,1 мл) желатина и 2 капли (0,1 мл) сыворотки реципиента. Содержимое пробирок перемешивают встряхиванием, после чего их помещают в водяную баню на 15 мин или термостат на 30 мин при температуре +46 — 48°С. По истечении указанного времени в пробирки добавляют 5 — 8 мл физиологического раствора и перемешивают содержимое путем 1 — 2-кратного переворачивания пробирок.
Результат учитывают, просматривая пробирки на свет невооруженным глазом или через лупу. Агглютинация эритроцитов свидетельствует о том, что кровь реципиента и донора несовместимы, отсутствие агглютинации является показателем совместимости крови донора и реципиента.
Зачем нужна биологическая проба крови?
Биологическая проба на индивидуальную совместимость считается завершающим этапом подготовки перед самим переливанием. Как правило, вливают 15 мл крови, после этого наблюдают больного. Если у пациента не появляется никаких симптомов, таких как одышка, боли в животе и беспокойство, то снова вводят 10 мл крови, и повторяют такую операцию три раза. Если негативная реакция отсутствует, то переливание крови завершают до конца.
Если пациент все же жалуется на свое состояние, переливание крови прекращается, иначе может случиться гемотрансфузионный шок. Иногда переливание крови проводиться больному под наркозом, но тогда обязательно учитываются показатели частоты пульса, измеряется артериальное давление.
4.5. Проба на совместимость с применением 33% полиглюкина
В пробирку вносят 2 капли (0,1 мл) сыворотки реципиента 1 каплю (0,05) мл эритроцитов донора и добавляют 1 каплю (0,1 мл) 33% полиглюкина. Пробирку наклоняют до горизонтального положения, слегка потряхивая, затем медленно вращают таким образом, чтобы содержимое ее растеклось по стенкам тонким слоем. Такое растекание содержимого пробирки по стенкам делает реакцию более выраженной. Контакт эритроцитов с сывороткой больного при вращении пробирки следует продолжать не менее 3 мин. Через 3 — 5 мин в пробирку добавляют 2 — 3 мл физиологического раствора и перемешивают содержимое путем 2 — 3-х кратного перевертывания пробирки, не взбалтывая.
Результат учитывают, просматривая пробирки на свет невооруженным глазом или через лупу. Агглютинация эритроцитов свидетельствует о том, что кровь реципиента и донора несовместимы, отсутствие агглютинации является показателем совместимости крови донора и реципиента.
[/td]
Чем опасна несовместимость по группе крови и резусу родителей для будущего ребенка?
Дело в том, что большинство людей обладает положительным резус-фактором, то есть имеет в крови специфичный белок. Только одна четверть населения земли этого белка не имеет. Именно это меньшинство принадлежит к носителям крови с отрицательным резус-фактором.
Резус-фактор никак не влияет на вероятность зачатия. Но от совместимости резусов у родителей сильно зависит течение беременности.
Беременность протекает без эксцессов и ребенок рождается полноценным и здоровым, когда у родителей одинаковые резус-факторы. Угрозы для малыша не представляется и в случае, если у мамы кровь резус-положительная, а у отца резус-отрицательная, поскольку в большинстве случаев ребенок наследует материнский резус-фактор.
Но если у женщины отрицательный резус-фактор и малыш унаследует положительный резус-фактор от отца, то возникнет несовместимость крови мамы и ребенка во время беременности.
Женский организм воспримет плод как инородное тело, запустит свой защитный механизм, а иммунная система мамы начнет свою борьбу и отторгнет будущего малыша. Этот процесс получил название резус-конфликт.
Современная медицина позволяет предупредить резус-конфликт, если родители и врачи заранее знают о его возможности, благодаря чему большинство супружеских пар, несовместимых по крови, смогли стать счастливыми родителями.