Особенности строения
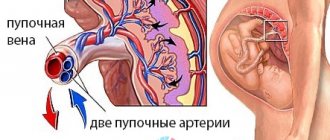
Нормальная пуповина соединяет переднюю часть брюшной стенки с плацентой (органом, необходимым для связи матери и ребенка). Правильно сформировавшаяся пуповина имеет следующие составляющие:
- Две пупочные артерии. Они переносят кровь от плода к плаценте.
- Пупочную вену. Она работает как артерии, только в обратном направлении.
- Урахус. Так называют проток, соединяющий плаценту с мочевым пузырем малыша.
- Вартонов студень. Представляет собой соединительную материю, которая защищает сосуды пуповины.
- Желточный проток. Соединяет кишечник зародыша с желточным мешком (отвечает за кроветворение и производство половых клеток).
В чем заключается патология?
Единственная артерия пуповины у плода – это патология, при которой меняется структура связующего элемента (вместо двух — один). Такое случается достаточно часто: вероятность 1:20 – при многоплодной беременности и 1:200 — при одноплодной. Риск развития патологии повышается, если у будущей матери есть диабет.
Одна артерия может отсутствовать с самого начала беременности или утратить свою функцию в любое время (например, атрофироваться). Строение пуповины хорошо просматривается на УЗИ с двадцати недель. Чаще всего единственная артерия пуповины является единичной патологией и не связана с какими-либо врожденными аномалиями (в 75 % случаев). Однако есть вероятность того, что у ребенка есть отклонения в развитии (25 %). Чаще всего проблема патология сопровождается проблемами с сердцем, почками, кишечником и костями.
Есиль-Диагностик, УЗИ в Петропавловске
Обычное УЗИ представляет собой серию двухмерных плоских изображений плода или его отдельных органов.
3D (3Д) УЗИ – это способ получения изображения, которое достигается путем сложного преобразования полученной двухмерной информации в трехмерную объемную модель. Преобразования выполняются при помощи специального трехмерного датчика и компьютерных программ, входящих в состав ультразвукового аппарата. Полученные объемы можно поворачивать и рассматривать с различных сторон.
4D(4Д) УЗИ – это получение трехмерного изображения плода и его движений в реальном времени. Таким образом, помимо объемного изображения плода добавляется четвертое измерение – время, и можно рассматривать двигательную активность и мимику плода в движении.
УЗИ в режимах 3Д и 4Д можно делать на разных сроках беременности, но результат и качество изображения в первую очередь зависит от положения плода в матке, количества околоплодных вод перед его лицом, наличия препятствий на пути движения ультразвуковой волны (миома матки, рубец на матке, подкожная клетчатка могут затруднять осмотр и ухудшать качество изображения). Так, если плод лежит вплотную к стенке матки, то получить трехмерное изображение его лица практически невозможно, как невозможно увидеть лицо человека, который уперся головой в стену. Иногда приходится подождать 15-20 минут, и продолжить исследование после изменения положения плода.
Оптимальный срок для получения изображения лица плода – 20-26 недель беременности. На этих сроках плод часто меняет свое положение, и вокруг него есть достаточное количество вод, чтобы увидеть лицо и туловище. После 30 недель беременности плод такой большой, что ему приходится хорошо сгруппироваться, чтобы уместиться в матке. При этом получение красивого трехмерного изображения лица может быть затруднено и даже невозможно – все зависит от положения плода.
Важно понимать, что УЗИ в режиме 3Д/4Д выполняется в дополнение к обычному УЗИ плода, и не может полностью заменить его. Измерение размеров плода и исключение пороков развития проводится с помощью обычного двухмерного УЗИ. Лишь при некоторых пороках развития применение трехмерного УЗИ дает врачу дополнительную информацию.
Если при ультразвуковом исследовании найдена единственная артерия пуповины (два сосуда в пуповине вместо трех)
Что такое единственная артерия пуповины?
Нормальная пуповина состоит из трех сосудов – две артерии и одна вена. Иногда вместо двух артерий в пуповине формируется только одна артерия и одна вена, таким образом, в пуповине определяется всего два сосуда. Данное состояние считается пороком развития пуповины, однако этот порок не оказывает никакого влияния на послеродовое состояние ребенка и его дальнейшее развитие.
Почему у плода может определяться единственная артерия пуповины?
— Иногда единственная артерия пуповины выявляется у абсолютно нормальных плодов; после рождения ребенка данный факт не оказывает никакого влияния на его дальнейшее развитие.
— Иногда единственная артерия пуповины сочетается с пороками сердечно-сосудистой системы плода, поэтому при выявлении единственной артерии пуповины проводится детальный осмотр анатомии плода и, в частности, сердечно-сосудистой системы. При отсутствии других пороков развития единственная артерия пуповины в состоянии обеспечить адекватный кровоток плода.
— Несколько чаще единственная артерия пуповины выявляется у плодов с синдромом Дауна и другими хромосомными болезнями. Однако этот маркер относится к «малым» маркерам синдрома Дауна, поэтому выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к проведению других диагностических процедур.
— Единственная артерия пуповины иногда приводит к возникновению задержки внутриутробного развития плода. В связи с этим при обнаружении единственной артерии пуповины рекомендуется дополнительное УЗИ в 28 недель беременности, и плановое в 32-34 недели. Если отставание размеров плода от срока беременности или нарушение кровотока в сосудах плода и матки не выявлено, то диагноз задержки развития плода исключен.
Что делать при выявлении единственной артерии пуповины у плода?
— выявление только единственной артерии пуповины не повышает риск наличия синдрома Дауна и не является показанием к консультации генетика и проведению других диагностических процедур.
— контрольное УЗИ в 28 и 32 недели беременности для оценки темпов роста плода и его функционального состояния.
Если при ультразвуковом исследовании найдены кисты сосудистых сплетений у плода
Что такое сосудистые сплетения?
Сосудистые сплетения — одна из первых структур, которая появляется в головном мозге плода. Это сложная структура, и присутствие обоих сосудистых сплетений подтверждает, что в мозге развиваются обе половины. Сосудистое сплетение производит жидкость, питающую головной и спинной мозг.
Иногда жидкость образует скопления внутри сосудистых сплетений, которые при УЗИ имеют вид «кисты».
Кисты сосудистых сплетений иногда могут быть найдены при ультразвуковом исследовании в сроках 18-22 недели беременности. Наличие кист не оказывает влияния на развитие и функцию головного мозга. Большинство кист самопроизвольно исчезает к 24-28 неделям беременности.
Часто ли встречаются кисты сосудистых сплетений?
в 1-2 % всех нормальных беременностей плоды имеет КСС,
в 50 % случаев обнаруживаются двусторонние кисты сосудистых сплетений,
в 90 % случаев кисты самопроизвольно исчезают к 26-ой неделе беременности,
число, размер, и форма кист могут варьировать,
кисты также найдены у здоровых детей и взрослых.
Несколько чаще кисты сосудистых сплетений выявляются у плодов с хромосомными болезнями, в частности, с синдромом Эдвардса (трисомия 18, лишняя 18 хромосома). Однако, при данном заболевании у плода всегда будут обнаруживаться множественные пороки развития, поэтому выявление только кист сосудистого сплетения не повышает риск наличия трисомии 18 и не является показанием к проведению других диагностических процедур.
При болезни Дауна кисты сосудистых сплетений, как правило, не выявляются. Риск синдрома Эдварда при обнаружении КСС не зависит от размеров кист и их одностороннего или двустороннего расположения. Большинство кист рассасывается к 24-28 неделям, поэтому в 28 недель проводится контрольное УЗИ. Однако, если кисты сосудистых сплетений не исчезают к 28-30 неделям, это никак не влияет на дальнейшее развитие ребенка.
Если при ультразвуковом исследовании найдены маркеры хромосомной патологии плода
Если при ультразвуковом исследовании были найдены маркеры (признаки) хромосомной патологии плода, то это еще не означает, что у плода есть хромосомная патология, и надо обязательно прерывать беременность. Всем женщинам, у которых были найдены ультразвуковые маркеры хромосомной патологии плода, предлагается инвазивная пренатальная диагностика – хорионбиопсия/плацентобиопсия с целью взятия клеток плода и их тонкого микроскопического анализа.
Хорионбиопсия – это взятие нескольких ворсинок из хориона плода под ультразвуковым контролем и подсчет количества хромосом в его клетках. Хорион – орган плода, из которого потом образуется плацента. Его клетки идентичны клеткам плода. Поэтому если количество и структура хромосом в клетках хориона нормальны, то хромосомные болезни у плода исключаются с вероятностью более 99%.
Тонкой иглой через переднюю брюшную стенку делается укол, игла проходит в хорион и в нее попадает несколько ворсинок хориона. Процедура проводится в амбулаторных условиях, используются одноразовые перчатки и стерильные иглы, поэтому риск инфицирования во время процедуры практически отсутствует.
Любая процедура, даже простейший анализ крови, имеет риск осложнений. При проведении хорионбиопсии тоже есть риск – риск прерывания беременности. Однако, при соблюдении всех правил проведения процедуры этот риск не превышает 1%. Поэтому в тех случаях, когда индивидуальный риск хромосомной патологии плода достаточно высок, должна быть выполнена эта процедура. На сегодняшний день в мире не разработано другого метода, позволяющего получить для исследования клетки плода, не выполняя внутриматочного вмешательства. В то же самое время, исключить или подтвердить диагноз болезни Дауна или другой хромосомной патологии можно только при исследовании клеток плода, которые были получены при внутриматочном вмешательстве.
Хорионбиопсия выполняется до 14 недель беременности, после этого срока на месте хориона образуется плацента и тогда проводится уже плацентобиопсия. Техника выполнения и риск при плацентобиопсии принципиально не отличаются от хорионбиопсии. Мы надеемся, что эта информация поможет Вам лучше понять, для чего мы проводим эти исследования, и преодолеть тот естественный страх перед процедурой, который вызывает неизвестность и те непрофессиональные сведения, которые иногда печатаются в немедицинских источниках.
Диагностика
Чтобы родить здорового малыша, любая беременная должна постоянно наблюдаться у врача и проходить все исследования. При любых подозрениях нужно тщательно обследовать будущего ребенка на различные пороки развития и маркеры генетических заболеваний. Не стоит бояться всех этих исследований, ведь нет ничего важнее здоровья.
Помочь с выявлением единственной артерии пуповины при беременности помогут следующие методы:
- УЗИ (ультразвуковое исследование). Перед прохождением мочевой пузырь должен быть наполнен.
- Допплерометрия. Определяет наличие и скорость кровотока.
- Осмотр гинеколога. С помощью специальных инструментов врач может прослушать сердцебиение малыша и при любых подозрениях назначить дополнительные обследования.
Если была обнаружена патология, то врачи предложат пройти кариотипирование плода. Данная процедура подразумевает забор околоплодных вод или ворсин хориона, а также детальное УЗИ и ЭХО-кардиографию.
Единственную артерию пуповины при беременности можно увидеть на УЗИ при поперечном сканировании, при котором лучше всего виден просвет сосудов. Диагностика патологии возможна с конца первого триместра. На более ранних сроках пуповина визуализируется не четко, поэтому поставить точный диагноз не получится. Также трудности могут возникнуть, если у женщины маловодие, ожирение или многоплодная беременность.
Результаты популяционных исследований иЕАП
В канадском популяционном исследовании 725 случаев иЕАП среди 196 752 одноплодных беременностей на сроке более 20 нед. за 23 года было установлено увеличение риска неблагоприятного фетального исхода с 95% доверительным интервалом (ДИ) отношения шансов (ОШ) от 1,09 до 5,94 [2]. Наибольшая величина последнего зарегистрирована для внутриутробной/перинатальной смерти (95% ДИ ОШ 1,97–5,82), которая статистически значимо отличалась от таковой для индуцированной беременностью артериальной гипертензии, кесарева сечения по поводу дистресса плода, преждевременных родов после разрыва плодных оболочек (95% ДИ ОШ 1,09–1,74). Кроме того, определено увеличение риска (95% ДИ ОШ 1,21–5,94) смерти в первый год жизни, гестационного возраста менее 37 нед. или менее 34 нед., массы тела при рождении меньше 3-го процентиля или меньше 10-го процентиля, оценки по шкале Апгар ≤3 баллов на 1-й мин или на 5-й мин жизни ребенка, интенсивной неонатологической помощи, слабости родовой деятельности, индукции в роды, кесарева сечения, плацентарных аномалий, амниоцентеза, многоводия, гестационного сахарного диабета.
В норвежском популяционном исследовании 3777 случаев иЕАП среди 918 933 одноплодных беременностей на сроке от 16 нед. до 45 нед. за 16 лет 95% ДИ ОШ неблагоприятных фетальных исходов составил 1,1–6,7 [3]. Наибольшее увеличение риска среди последних отмечено для внутриутробной/перинатальной смерти (95% ДИ ОШ 4,3–6,7), который статистически значимо отличался от такового спонтанных преждевременных родов, преждевременных родов после разрыва плодных оболочек, интенсивной неонатологической помощи, массы тела при рождении ниже 5-го процентиля, кесарева сечения (95% ДИ ОШ 1,1–1,9). Масса плода выше 95-го процентиля, масса плаценты выше 95-го процентиля, длина пуповины меньше 5-го процентиля, преэклампсия не были связаны с иЕАП.
В представленных популяционных исследованиях главными неблагоприятными исходами для плода выступали внутриутробная и перинатальная смерть. Следует подчеркнуть, что мощность исследования в Норвегии превышает таковую в Канаде в 5 раз. В обоих исследованиях изучались сходные или одинаковые фетальные исходы: преждевременные роды и недоношенность/незрелость, необходимость интенсивной неонатологической помощи для выживания ребенка, родоразрешение путем кесарева сечения, масса тела при рождении ниже 5-го и 3-го/10-го процентиля. Причем при сохранении сопоставимости величин 95% ДИ ОШ по указанным исходам они находятся в отношении непересекающихся множеств с 95% ДИ ОШ внутриматочной/перинатальной смерти. Другими словами, при увеличении мощности исследования увеличение риска внутриутробной и перинатальной смерти плода уже статистически значимо отличается от всех остальных фетальных исходов. По отношению к последним первое выступает как увеличение риска неблагоприятного исхода более высокого уровня за счет увеличения уровня значимости связи с иЕАП.
С другой стороны, обращает на себя внимание тот факт, что увеличение вероятности такого исхода беременности при иЕАП, как достоверное увеличение риска индуцированной беременностью гипертензии (95% ДИ ОШ 1,09–1,7), которое наблюдалось в Канаде, становится незначимым при комбинации его с клинически значимой протеинурией в Норвегии (95% ДИ ОШ 0,8–1,6).
Таким образом, по результатам представленных популяционных исследований наибольшее увеличение риска при иЕАП характерно для внутриутробной и перинатальной смерти, наименьшее — для замедления развития и недоношенности плода, возможности быть рожденным путем кесарева сечения, потребности ребенка в интенсивной неонатологической помощи.
Для удобства восприятия и наглядности результаты исследования [3] мы конвертировали в порядковую шкалу. Для этого 95% ДИ увеличения риска неблагоприятного исхода беременности для плода от 1,1 до 6,7 разделили на три равные части (низкое при 1,1–2,96, умеренное при 2,97–4,82, высокое при 4,83–6,7). При нахождении 95% ДИ увеличения риска какого-либо неблагоприятного фетального исхода на двух уровнях его принадлежность к одному из них устанавливали тогда, когда на нем находилась большая часть 95% ДИ.
В группу низкого
(в среднем двукратного) увеличения риска неблагоприятного исхода беременности для ребенка попали спонтанные преждевременные роды, преждевременные роды после разрыва плодных оболочек, интенсивная неонатологическая помощь, масса тела при рождении ниже 5-го процентиля, кесарево сечение, оценка меньше 7 баллов по шкале Апгар на 5-й минуте жизни ребенка, масса плаценты меньше 5-го процентиля и длина пуповины больше 95-го процентиля, краевая фиксация пуповины на плаценте, предлежание и отслойка плаценты, кюретаж после родов, истинный узел пуповины и кровотечение более 500 мл после родов. В группу
умеренного
(в среднем трехкратного) увеличения риска неблагоприятного фетального исхода вошли плевистая фиксация пуповины, ручное отделение и выделение последа. В группе
высокого
(в среднем пятикратного) увеличения риска неблагоприятного фетального исхода оказались внутриутробная и перинатальная смерть ребенка. При последующей беременности определена статистическая значимость увеличения риска повторения иЕАП и краевой фиксации пуповины на плаценте.
Результаты двух наиболее крупных популяционных исследований неблагоприятных фетальных исходов при иЕАП позволяют сделать вывод о том, что последняя выступает самостоятельным фактором гибели плода/новорожденного. Кроме того, с помощью множественной логистической регрессии с контролем кофаундинг-эффекта было показано, что иЕАП является независимым фактором увеличения риска задержки развития и маленького к сроку гестации плода, его очень раннего преждевременного рождения [6]. Отсюда следует, что плоды с иЕАП требуют тщательного контроля их развития и состояния.
При отсутствии клинических рекомендаций по ведению беременности и родов при иЕАП наиболее близкими по цели наблюдения за плодом выступают таковые при замедлении развития плода (ЗРП), которое занимает лидирующее место среди факторов, приводящих к мертворождению [7], в 5,4% случаев выступая причиной перинатальной смертности, особенно на сроке 28–31 нед. беременности [8]. Причем в рандомизированных контролируемых исследованиях недостаточно данных, позволяющих получить информацию о наилучших схемах наблюдения за плодом, отстающим в развитии [9]. Кроме того, используемые для этого методы, режим наблюдения и сроки родоразрешения отличаются в сообществах акушеров-гинекологов разных стран [10]. В связи с этим при отсутствии российских федеральных и региональных клинических рекомендаций по наблюдению за плодом, отстающим в развитии, каждый врач для своей практической работы в праве выбрать позицию любого из них.
Исходя из личных предпочтений, в своей работе мы используем рекомендации наблюдения за плодом, у которого повышен риск внутриутробной смерти в 8 раз [11] (больше такового при иЕАП), принятые Немецким обществом гинекологии и акушерства и основанные не только на фактических данных, но и на максимальном консенсусе экспертов, когда 95% из них согласны с выбором результатов исследований, на которых они основаны [12].
В связи с тем что ни один отдельно взятый метод мониторинга не обеспечивает достоверного неблагоприятного фетального прогноза, рекомендуется сочетание различных диагностических процедур: клиническое обследование, сонография (фетометрия и оценка амниотической жидкости), допплерометрия (пуповинная и средняя мозговая артерии, церебро-плацентарное отношение — ЦПО), кардиотокография (КТГ), в т. ч. анализ Dawes — Redman, биофизический профиль. Прогностическая ценность допплерометрии скорости кровотока (ДСК) в маточных артериях в III триместре беременности неясна. ДСК в аорте плода, пуповинной и нижней полой венах в настоящее время рекомендуется только в том случае, если она проводится в рамках научных исследований, поскольку доказательств ее полезности по-прежнему недостаточно [12].
Следует проводить клинический мониторинг состояния матери для выявления ранних признаков преэклампсии при ЗРП, вызванном плацентарной недостаточностью [12]. При этом иЕАП, независимо от наличия или отсутствия ЗРП, выступает фактором увеличения риска его перинатальной гибели. В связи с этим клинический мониторинг состояния плода посредством измерения высоты дна матки и аускультации сердцебиения плода должен сочетаться с выявлением других нозологических форм и патологических синдромов, которые способствуют нарушению не только маточно-плацентарного, но и фетально-плацентарного кровотока, особенно при плевистой фиксации пуповины и отслойке нормально расположенной плаценты, выступающих как факторами риска ЗРП [9], так и неблагоприятными фетальными исходами при иЕАП [3].
Серия сонографических исследований с проведением фетометрии и оценкой объема околоплодных вод по их самому глубокому карману с интервалом не менее 2 нед. должна сопровождать развитие плода не только при подозрении на ЗРП [12], но и при иЕАП.
Принимая во внимание то, что результаты ДСК в артерии пуповины (АП) связаны с неблагоприятным или благоприятным фетальным исходом при ЗРП, соответственно когда выявляется нулевой диастолический/отрицательный (реверсный) или нормальный кровоток, при нормальных результатах ДСК в АП достаточно повторных контрольных сканирований каждые 2 нед., а при патологических результатах, когда имеют место пульсационный индекс (ПИ) >95-го процентиля или реверсный кровоток, контроль следует проводить не реже одного раза в неделю. В последнем случае дополнительно необходима ДСК средней мозговой артерии (СМА) и венозного протока (ВП). ПИ СМА <5-го процентиля увеличивает риск кесарева сечения и плохого перинатального исхода. С последним также связано низкое ЦПО, равное частному от деления ПИ СМА на ПИ АП. Отсутствие или обратный кровоток при ДСК в ВП указывает на выраженную ацидемию и риск смерти плода [12].
Следует подчеркнуть, что ЦПО используется как инструмент оценки состояния плода в III триместре — как маленького, так и соответствующего сроку гестации, независимо от результатов отдельных измерений ПИ АП и ПИ СМА. Причем уменьшение ЦПО связано с более низким гестационным возрастом и низкой массой тела при рождении, с более высокой частотой кесарева сечения при дистрессе плода при родах, оценкой по шкале Апгар на 5-й мин жизни ребенка менее 7 баллов, ацидозом новорожденных, госпитализацией в отделение интенсивной неонатологической помощи, неблагоприятными исходами у новорожденных и перинатальной смертью [13]. Именно эти исходы имеют место при иЕАП [2, 3], поэтому ЦПО можно признать определяющим в оценке состояния плода при иЕАП в III триместре беременности.
Корреляция ЦПО и рН пуповинной крови плода оказалась более выраженной при сравнении с корреляцией ЦПО и низкой массы плода при рождении. У плодов, соответствующих сроку гестации, с низким и нормальным ЦПО установлены значения рН крови пуповины соответственно более низкие у первых относительно вторых. Причем при рождении в срок и досрочно наблюдалась соответственно слабая и сильная корреляция неблагоприятных исходов и массы плода [14]. В последнем случае у плодов определялись ПИ СМА и ПИ АП, непосредственно связанные с их перинатальной смертностью и заболеваемостью [15]. В гестационном возрасте до 32 нед. результат измерения ДСК СМА имел чувствительность 95,5% и прогностическую ценность отрицательного результата 97,7% для основных неблагоприятных перинатальных исходов, включающих внутриутробную и неонатальную смерть, неврологические осложнения и некротический энтероколит. Однако среди плодов старше 36 нед. с неблагоприятными исходами только в 44% случаев прослеживался ПИ СМА меньше 5-го процентиля. Причем независимо от гестационного возраста при перераспределении кровотока в головной мозг были равномерно представлены нормальные и ненормальные (>95-го процентиля) ПИ АП [16]. Патологическое снижение ЦПО опережает таковое ПИ СМА и может быть стандартизировано как 0,6765 МОМ (multiple of median, степень отклонения уровня числового признака от медианы) для заданного срока беременности c целью помочь в идентификации плацентарной недостаточности, гипоксии и ЗРП [17].
Проведено исследование плодов старше 34 нед. за 7 дней до родов с предполагаемой массой к сроку гестации <10-го процентиля (подтвержденной после рождения) при нормальных результатах ДСК АП. Плоды были разделены на группы по наличию и отсутствию патоморфологических признаков мальперфузии/воспаления плаценты, которые не отличались по частоте индукции в роды, массе и гестационному возрасту плодов и плацент. Оказалось, что при сопоставимых средних величинах ПИ СМА и ПИ ЦПО уменьшение их величины меньше 5-го процентиля, увеличение среднего ПИ маточных артерий больше 95-го процентиля, снижение нормализованной скорости кровотока в вене пуповины меньше 5-го процентиля оказались характерными для мальперфузии плаценты (материнской в 64,5% и фетальной в 15,5%) и ее воспаления (в 20%) [18].
Для комплексного мониторинга состояния плода, отстающего в развитии, используется КТГ, но исследование биофизического профиля нецелесообразно [12]. Патологические паттерны КТГ становятся вместе с такими признаками плацентарной гипоперфузии, как повышение среднего ПИ и снижение фетального кровотока в ВП, у плодов с нормальной предполагаемой массой тела показаниями для проведения родоразрешения [18].
В результате анализа накопленных в литературе данных по использованию ультразвуковой фетометрии и ДСК в сосудах плода и матери стало очевидным, что снижение ЦПО в большей степени связано с ацидозом плода, опережает снижение ПИ СМА, независимо от наличия или отсутствия ЗРП. Они вместе с показателями снижения скорости кровотока в ВП и маточных артериях при предполагаемой массе плода <10-го процентиля в гестационном возрасте >34 нед. свидетельствуют в пользу материнской/фетальной мальперфузии или воспаления плаценты. Дополняют этот комплекс показателей паттерны КТГ и результаты оценки объема околоплодной жидкости, которые имеют самостоятельное значение как предикторы фетального исхода, а также поздние клинические эквиваленты патологии фетоплацентарного комплекса. Исключать из обследования плода ДСК ВП нецелесообразно, равно как пренебрегать использованием модифицированного биофизического профиля плода, успешность использования которого была продемонстрирована при ЗРП с 28 нед. беременности: в прогнозировании перинатального исхода (по шкале Апгар на 5-й мин жизни ребенка <7 баллов) он был лучше ЦПО с чувствительностью 94,7%, специфичностью 52%, прогностической ценностью отрицательного результата (ПЦОР) 96,5%, также опередив по чувствительности и ПЦОР отрицательный и реверсный кровоток в АП [19].
Таким образом, для оценки состояния плода с иЕАП принесут пользу серии УЗИ с фетометрией и оценкой количества околоплодной жидкости и ДСК маточных артерий, АП, ВП после 22 нед. каждые 2 нед., к которым присоединяются в III триместре ДСК СМА и оценка ЦПО, КТГ (при наличии вариабельности частоты сердцебиения можно использовать раньше). При патологических значениях хотя бы одного параметра состояния плода весь комплекс диагностических исследований можно повторять еженедельно или чаще.
Рекомендации по медикаментозному влиянию на плод, месту и сроку родоразрешения при ожидании его преждевременного рождения сохраняют свою актуальность не только при ЗРП, но и при иЕАП. Кортикостероиды следует вводить один раз в сроке беременности от 24 нед. до 34 нед. при ожидании родов в течение 7 дней, сульфат магния для нейропротекции плода можно назначать перед родами до 32 нед. Родоразрешение должно проводиться в перинатальном центре с отделением интенсивной терапии для новорожденных и опытной командой, чтобы при необходимости обеспечить немедленную помощь. При досрочном родоразрешении сопоставляются риски гибели ребенка вне и внутри утробы матери, так как его гестационный возраст выступает фактором, влияющим на выживаемость [12].
При раннем и позднем ЗРП ухудшение состояния плода отражается в патологических отклонениях соответственно венозных и церебральных допплеровских параметров [12].
Необходимо рассмотреть возможность родоразрешения в следующих акушерских ситуациях: при патологической КТГ (с момента регистрации), ПИ ВП >95-го процентиля (в зависимости от гестационного возраста), отсутствии или реверсе А-волны в ВП, отрицательном или нулевом кровотоке в АП (не позднее 32 нед.), ПИ АП >95-го процентиля (после 37 нед.), ПИ СМА <5-го процентиля (не позднее 37 нед.), снижении ЦПО (37 нед.), нормальных результатах ДСК и изолированном ЗРП без дополнительных рисков (38 нед.) [12]. Дополнительно при иЕАП и предполагаемой массе плода <10-го процентиля с 34 нед. беременности, когда выявляются допплерометрические признаки материнской/фетальной мальперфузии или воспаления плаценты и патологическая КТГ, целесообразно решить вопрос о родоразрешении путем кесарева сечения. Целесообразно также это сделать и при иЕАП с ЗРП, ПИ СМА <5-го процентиля и патологической КТГ в сроке до 32 нед., при иЕАП независимо от наличия или отсутствия ЗРП, снижении ЦПО при повторных исследованиях с 32 нед., сопровождающемся появлением патологической КТГ. При иЕАП и предлежании плаценты целесообразно плановое кесарево сечение, а при установлении врастания последней при ультразвуковом и допплерометрическом исследовании или магнитно-резонансной томографии — иссечение участка врастания плаценты в пределах интактной ткани миометрия. При иЕАП в сочетании с отслойкой плаценты и живом плоде требуется немедленное абдоминальное родоразрешение.
При ЗРП кесарево сечение не является обязательным способом родоразрешения, и в случае нормальных результатов ДСК или ПИ АП >95-го процентиля возможна индукция в роды с учетом более высокого риска осложнений и необходимостью постоянного интранатального мониторинга частоты сердцебиения плода [12]. Кроме того, при иЕАП в плане ведения родов следует учесть выраженное увеличение риска ручного отделения и выделения последа, послеродового кровотечения и предусмотреть алгоритм действий в соответствии с действующими клиническими рекомендациями [20]. При иЕАП, особенно в сочетании с плевистой/краевой фиксацией пуповины на плаценте, регистрация патологической КТГ в родах служит основанием для их оперативного окончания.
Прекращение употребления никотина должно быть рекомендовано всем беременным женщинам. В силу отсутствия или недостаточности доказательств полезности при ЗРП не рекомендуются к использованию препараты кальция, прогестерон, ингаляции кислорода, увеличение объема плазмы, аспирин в низких дозах, силденафил, пентаэритритила тетранитрат, сосудорасширяющие вещества, низкомолекулярный гепарин. Известно, что β-адреноблокаторы способствуют задержке внутриутробного развития, поэтому их применения следует избегать [9].
Таким образом, представленная акушерская тактика полностью перекрывает все возможные неблагоприятные фетальные исходы, установленные в популяционных исследованиях [2, 3].
Факторами риска иЕАП выступают: низкая масса плода при предшествующей беременности, многоплодие, курение, неврологические заболевания матери [2], иЕАП при предшествующей беременности [3], высокий паритет беременности (4+), сахарный диабет, эпилепсия, хроническая артериальная гипертензия, предшествующее кесарево сечение у матери и беременность, возникшая с помощью вспомогательных репродуктивных технологий (ВРТ) [21].
Отсюда следует, что для профилактики иЕАП следует рекомендовать беременной бросить курить, соблюдать оптимальные для нее диету и двигательный режим, компенсировать сахарный диабет, стабилизировать артериальное давление. На фоне приема противоэпилептических препаратов, при рубце на матке, многоплодии, рождении маловесного к сроку гестации ребенка и иЕАП при предыдущей беременности, высоком паритете текущей беременности, возникновении беременности после ВРТ необходимо прицельно искать иЕАП в процессе второго УЗ-скрининга.
На заключительном этапе анализа с целью построения рейтинга рисков аномалий плода с 95% ДИ от 1,2 до 39,1, наблюдающихся при ЕАП, мы разделили величину существенной связи между ними на 3 и получили низкое (95% ДИ 1,2–13,83), умеренное (95% ДИ 13,84–26,46) и высокое (95% ДИ 26,47–39,1) увеличение риска их развития. При ЕАП увеличение риска аномалий плода определено как высокое для атрезии пищевода и аноректальной области, умеренное — для стеноза пищевода и аноректальной области, трисомии 13 и 18, низкое — для агенезии почек, врожденных пороков сердца, диафрагмальной грыжи, укорочения конечностей, расщелины губы и неба, трисомии 21.
ЕАП наиболее тесно связана с атрезиями желудочно-кишечного тракта, ассоциированными с трисомией 13 и 18, что указывает на общие механизмы их развития. Если после рождения у ребенка из ротовой полости и носовых ходов появляется пенистая слизь, нужно заподозрить атрезию пищевода и в родильном зале провести пробу с желудочным зондом и пробу элефанта [22]. Если отсутствует анус, то следует ставить вопрос о переводе ребенка в хирургический стационар [23]. Выраженная связь ЕАП с трисомией 13 и 18 требует от акушера готовности к их определению после рождения плода. Низко посаженные уши, расщелина губы и неба, полидактилия и микрофтальмия у родившегося плода позволяют подозревать синдром Патау, а выдающийся затылок, перекрывающиеся пальцы, искривленные нижние конечности, микрогнатия, низко посаженные уши, короткая шея, пороки развития сердца и почек — синдром Эдвардса.
При ЕАП врач-акушер должен быть нацелен на поиск основных связанных с ней мальформаций плода, чтобы своевременно их заподозрить и рекомендовать беременной исследование кариотипа ребенка (после первого или второго скрининга на пороки развития при беременности или после рождения). Управление факторами риска доступно через отказ от употребления никотина, соблюдение диеты при сахарном диабете, нормализацию артериального давления при хронической артериальной гипертензии, принятие и ведение здорового образа жизни.
Причины
Проблемы с сосудами пуповины до конца не изучены, но чаще всего их связывают с:
- инфекционными заболеваниями, которые беременная перенесла в первом триместре;
- интоксикацией;
- вредными привычками (алкоголь, курение, наркотики или сильнодействующие препараты);
- сахарным диабетом;
- радиационным облучением, плохой экологией, вредным производством;
- многоплодной беременностью;
- хромосомными нарушениями.
Самый опасный период беременности — 6-9 неделя. На этом сроке повышается риск патологий сосудов, плаценты и кровотока. Атрофию артерии (одна из них перестает функционировать) могут вызвать: тромбозы, опухоли, гематомы или узлы (на одной из артерий). Следует помнить, что такие состояния возникают довольно редко, но требуют постоянно наблюдения.
Состояние здоровья женщины может тоже привести к тому, что сформируется единственная артерия пуповины при беременности. Причинами могут стать: сахарный диабет, многоплодная беременность, болезни почек, сердца.
Единственная артерия пуповины. Задержка роста плода. ЕАП и ЗРП. Моя история
Вообще этот пост планировался на год малышки. Но там много девочек пишут в лс, что решила написать сейчас. Надеюсь, пост будет полезным (но вообще ещё больше надеюсь, что он никому не пригодится).
Я думаю, в отдельных сообществах историю моей беременности, родов и первых месяцев материнства уже знают наизусть.
Но после родов в разные соцсети мне стали писать испуганные девочки, у которых тоже обнаружена эта патология. Как оказалась, она не такая редкая.
Поэтому хотелось бы расписать и оставить подробный пост о том, как я столкнулась с единственной артерией пуповины, что я делала, что с ребёнком.
Сразу скажу — это история о сложной беременности и больших трудностях, через которые мы прошли. Но я считаю, что лучше знать, что и такие сценарии возможны. Если не готовы столкнуться с реальностью — лучше не читайте. Для пугливых — в целом мы отделались малой кровью.
Первый платный скрининг в 11 недель.
«У вас тут в пуповине одна артерия…Должно быть две…Это не страшно само по себе, но ЕАП маркер хромосомных аномалий (ХА), но малый…У вас больше ничего нет, поэтому это скорее всего норма, но я напишу это в заключении»
Я пожала плечами — ну ладно. В соседнем кабинете сдала кровь.
В интернете почитала про эту ЕАП — многие писали, что на втором скрининге артерия находилась. Поэтому временно я успокоилась.
Позже пришла кровь риски низкий, но бета-хгч высоковат (3,53 по норме до 2), что в тандеме с ЕАП меня напугало.
Для перестраховки сдала НИПТ на 5 синдромов — все отрицательно.
Первый скрининг в ЖК, УЗИ в 15-16 недель, второй скрининг в ЖК — везде ЕАП. Все успокаивают: «такое бывает в норме». Но дальше…
УЗИ 24 недели — «укорочение трубчатых костей».
УЗИ 26 недель — «ну у вас срок точно не 26 недель, недели на две меньше, наверно в ЖК ошиблись».
УЗИ 32 недели — «задержка роста плода l степени, вес 1620 гр».
Я знаю причину ЗРП!
Детально изучаю информацию о ЕАП, ищу в соцсетях девочек, которые с этим столкнулись. Составлю личную статистику:
- 2-3% случаев генетических аномалий (но на УЗИ было виден целый букет патологий)
- 10% случаев ЗРП
- 15% случаев пороков развития (больше всего ВПС, также проблемы с почками, желудочно-кишечным трактом) — надо сказать, что в целом почти все операбельно без страшных последствий
- 70% случаев — все хорошо, рождаются пупсы 3500 грамм/ 50 см