Перипартальная кардиомиопатия (Кардиомиопатия Мидоуса, Перипартальная болезнь)
Консервативная терапия
После подтверждения диагноза больных обязательно госпитализируют в кардиологический стационар. При тяжелой недостаточности кровообращения показан перевод в отделение реанимации и интенсивной терапии для проведения внутриаортальной балонной контрпульсации. Несмотря на быстропрогрессирующее течение, почти у половины пациенток наблюдается спонтанное выздоровление.
Немедикаментозное лечение включает ограничение приема жидкости до 2 литров в сутки и поваренной соли до 3-4 граммов в сутки. При назначении лекарственной терапии беременным необходимо учитывать потенциальный нежелательный эффект некоторых медикаментов на плод. Рекомендованы:
- Агонисты дофаминовых рецепторов.
Препараты действуют на главное патогенетическое звено ПКМП. Подавляя выработку пролактина, они снижают образование его кардиотоксического фрагмента (16кДа). У беременных применяется бромокриптин, после родов возможен перевод на каберголин или хинаголид. - Ингибиторы АПФ.
Основные лекарственные средства, замедляющие прогрессирование сердечной недостаточности. - Бета-адреноблокаторы.
Назначаются как альтернатива ингибиторам АПФ беременным женщинам, а также при наличии тахиаритмий. - Вазодилататоры.
Сосудорасширяющие медикаменты используются для снятия вазоспазма при систолическом давлении более 110 мм рт. ст. - Диуретики.
С целью уменьшения застойных явлений в легких и выведения жидкости применяются тиазидные и петлевые мочегонные препараты. - Сердечные гликозиды.
Для поддержания адекватного сердечного выброса при артериальной гипотензии показаны дигоксин, левосимендан. - Антикоагулянты.
Так как дилатация сердечных полостей сопровождается высоким риском тромбообразования, пациенткам рекомендован прием антикоагулянтов (варфарина, ривароксабана). Беременным разрешен только гепарин.
Хирургическое лечение
При выраженной ХСН (фракция выброса левого желудочка достигает менее 40%), развившейся у беременных, требуется прерывание беременности путем кесарева сечения. Крайне тяжелая, резистентная к консервативной терапии перипартальная кардиомиопатия служит показанием к трансплантации сердца. При устойчивых тахиаритмиях, сопровождающихся грубыми гемодинамическими нарушениями (критическое падение артериального давления), прибегают к имплантации кардиовертера-дефибриллятора.
Введение
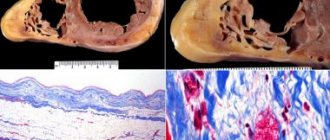
Дилатационная кардиомиопатия, как и миокардиты, относится к числу сложных с диагностической точки зрения заболеваний, окончательная верификация которых базируется на эндомиокардиальной биопсии и магнитно-резонансной томографии, пока еще недоступных для обычных кардиологических клиник [1, 2], поэтому накопленный клинический опыт ведения таких пациентов представляется интересным и может быть полезным для кардиологов и врачей других специальностей в их практической деятельности.
Перипартальная кардиомиопатия (ПКМ) как один из вариантов дилатационной кардиомиопатии развивается у женщин в последние месяцы беременности либо в течение 5 месяцев после родоразрешения. С момента появления в кардиологии понятия ПКМ, описанной впервые в 1971 г. Demakis et al. [3], произошло накопление достаточно большого объема информации. Определены диагностические критерии ПКМ [4, 5], получены результаты отдаленного наблюдения за пациентками и выработаны рекомендации по эффективной и безопасной терапии [5]. Статистические данные по ПКМ в России отсутствуют. Согласно мировой статистике, патология встречается менее чем у 0,1% беременных женщин [6], однако частота неблагоприятных исходов при ПКМ достаточно высока (5–32%) [6]. Прогноз заболевания предсказать достаточно сложно – от полного выздоровления с восстановлением сократительной способности миокарда до летальных исходов на фоне прогрессирующей сердечной недостаточности [7], противоречивыми остаются сведения об этиологии и патогенезе ПКМ.
Ниже представлен клинический случай пациентки П. 37 лет, которая наблюдается в отделении кардиологии № 1 Областной клинической больницы (ОКБ) города Саратова в течение 10 лет.
Клинический случай
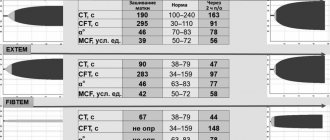
В декабре 2007 г. на 20-й неделе беременности пациентка П. (на тот момент 28 лет) отметила появление одышки смешанного характера при ходьбе до 20 м, сердцебиение, утомляемость. Данные симптомы связала с присоединением ОРВИ (отмечала субфебрилитет, гриппоподобный синдром). Лечилась самостоятельно (по образованию врач-лаборант), в основном народными средствами. Однако впоследствии, несмотря на нормализацию температуры тела, симптомы сохранились, а к 34-й неделе беременности одышка стала беспокоить уже в покое, ночью и в горизонтальном положении, усиливалась при незначительной физической активности, появились сухой кашель, отеки нижних конечностей, продолжалось сердцебиение. Госпитализирована в перинатальный центр Саратова, где проведено родоразрешение путем кесарева сечения. Данные трансторакальной эхокардиографии (ЭхоКГ), выполненной в перинатальном центре, представлены в первом столбце таблицы. Через 13 суток после кесарева сечения пациентка переведена для дальнейшей диагностики и лечения в кардиологическое отделение № 1 ОКБ Саратова, где и продолжает наблюдаться в динамике.
Данные объективного осмотра пациентки: рост – 163 см, вес – 68 кг, индекс масса тела – 26 кг/м2. Температура тела – 36,6°C. Отеков на нижних конечностях нет. Одышка смешанного характера при ходьбе на 20 метров. Перкуторно определялось смещение левой границы сердца на 1,5 см кнаружи от срединно-ключичной линии. При аускультации тоны сердца ослабленные, систолический шум на верхушке, связанный с I тоном, убывающий, занимает 2/3 систолы, усиливается на выдохе, проводится в подмышечную область, акцент II тона над легочной артерией. Частота сердечных сокращений – 120 в минуту. Арте-риальное давление – 100 и 80 мм рт.ст.
Оценка клинических проявлений и результатов ЭхоКГ, а также хронология развития выявленных гемодинамических нарушений на фоне беременности отчетливо продемонстрировали, что, согласно полученным данным, соответствовавшим диагностическим критериям ПКМ [4, 5], у пациентки выявлена именно эта патология. Внимание кардиологов привлекали высокие величины некоторых острофазовых показателей (ревматоидный фактор – РФ, С-реактивный белок – СРБ), при этом маркеры некроза миокарда были в норме (КФК – 18,3 ЕД/л, КФК-МВ – 8,1 ЕД/л, тропонины – I,T отрицательные). Повышение показателей СРБ и РФ вызывало сомнение в правильности постановки диагноза, т.к. могло свидетельствовать об инфекционном либо ревматическом процессе. При этом отрицательные маркеры некроза миокарда, повышение уровня которых в большинстве случаев сопровождает миокардиты, вызывали сомнения в плане воспалительного характера поражения миокарда и в большей степени свидетельствовали в пользу наличия кардиомиопатии. Для исключения ревматического процесса дополнительно были исследованы следующие показатели: антистрептолизин О, LE-клетки, антитела к ДНК (класс IgG), циркулирующие иммунные комплексы (ЦИК), результаты оценки которых были отрицательными. В ходе консилиума в составе ревматологов диагноз ревматического поражения сердца был исключен.
Следует отметить, что, по данным, накопленным в литературе к настоящему времени, значительная роль в патогенезе ПКМ у пациенток с данной патологией отводится воспалительному компоненту, что подтверждается повышением таких показателей, как фактор некроза опухоли α, интерферон γ, интерлейкин-6, apo-1, СРБ [8]. Таким образом, в нашем клиническом случае повышение ряда острофазовых показателей укладывалось в клиническую картину ПКМ.
Определенный интерес представляют взаимоотношения ПКМ и миокардита. После исключения у пациентки ревматического процесса у кардиологов оставалась версия об инфекционном миокардите, который мог развиться на фоне ОРВИ, указание на которую имеется в анамнезе пациентки.
Клинические и патогенетические взаимоотношения ПКМ и миокардита не до конца ясны и служат предметом дальнейшего изучения. С одной стороны, у больных ПКМ описана патоморфологическая картина некроза кардиомио-цитов на фоне интерстициального и периваскулярного воспаления [9]. Есть данные, что миокардит часто предшествует развитию ПКМ [10] и имеет высокую распространенность среди пациенток на фоне этого заболевания (от 29 до 100%) [11]. Другие авторы указывают на достаточно редкое сочетание ПКМ и миокардита [12, 13]. В случае нашей пациентки судить о первичном развитии миокардита, предшествовавшего ПКМ, сложно, для этого необходимы высокоинформативные визуализирующие методы обследования.
В любом случае наблюдение пациентки П. в динамике демонстрирует сохранение стойкой дисфункции миокарда левого желудочка и в развитии хронической сердечной недостаточности, требующей соответствующей симптоматической терапии.
Объем терапии, проведенной пациентке в стационаре: торасемид 10 мг в сутки, спиронолактон 100 мг в сутки, периндоприл 4 мг в сутки, карведилол 12,5 мг в сутки, ивабрадин 10 мг в сутки. На амбулаторный этап больная была выписана с рекомендациями продолжить данную терапию в полном объеме.
Спустя 3 месяца (март 2008 г.) пациентка поступила в отделение кардиологии № 1 повторно. Отмечена нормализация всех острофазовых показателей, которые оставались в пределах нормы и при последующих госпитализациях, при этом сохранялась систолическая дисфункция миокарда по данным ЭхоКГ.
С 2009 по 2021 г. пациентка ежегодно проходила обследование и лечение в кардиологическом отделении № 1 ОКБ Саратова. На рисунке представлен анализ жалоб и симптомов пациентки по некоторым годам госпитализаций. Остановиться следует на присоединении с 2008 г. перебоев в работе сердца, которые, по результатам ЭКГ и холтеровского мониторирования ЭКГ, были обусловлены частыми полиморфными желудочковыми экстрасистолами. Сохранение экстрасистолии в динамике на фоне постоянного приема β-адреноблокаторов потребовало усиления антиаритмической терапии, назначался амиодарон, эффект от которого был положительным, однако у пациентки были выявлены его побочные эффекты в виде фотосенсибилизации, кожной сыпи, в связи с чем в дальнейшем пациентке был назначен этацизин 100 мг/сут. С 2011 г. у больной регистрируется дислипидемия (общий холестерин до 5,5 ммоль/л, липопротеиды низкой плотности 4,0 ммоль/л, липопротеиды высокой плотности – 1,8 ммоль/л, триглицериды – 0,7 ммоль/л, индекс атерогенности – 3,4). Рекомендована гипохолестериновая диета, которой пациентка старалась придерживаться около 5 лет, в настоящее время рассматривается вопрос о назначении статинов. Динамика данных ЭхоКГ представлена в таблице.
Основные симптомы и данные ЭхоКГ на момент последней плановой госпитализации пациентки П. (37 лет) в августе 2021 г. представлены в таблице и на рисунке. Пациентка продолжает постоянный прием ингибиторов ангиотензинпревращающего фермента (периндоприл 2,5 мг в сутки), β-адреноблокаторов (карведилол 25 мг в сутки), спиронолактона 50 мг в сутки, этацизина 100 мг в сутки. Продолжает свою трудовую деятельность. Инвалид 3-й группы. Одышка беспокоит только при ходьбе на 300–400 метров. Перебои в работе сердца беспокоят значительно реже (по данным холтеровского мониторирования ЭКГ: редкие наджелудочковые и желудочковые экстрасистолы). Госпитализируется в отделение кардиологии 1 раз в год. Следует отметить, что, будучи медицинским работником, пациентка демонстрирует высокую приверженность проводимой терапии, что является немаловажным фактором в достижении определенных положительных результатов лечения.
Обсуждение
ПКМ остается редкой, но вызывающей серьезные опасения экстрагенитальной патологией. Выздоровление при ПК, согласно данным литературы, определяется как восстановление фракции выброса левого желудочка (ФВ ЛЖ), по данным ЭхоКГ – до ≥50%, или повышение ее более чем на 20% по сравнению с исходным значением [14]. Восстановление сократительной способности миокарда у пациенток с ПКМ обычно происходит в сроки от 3 до 6 месяцев, но может затянуться на несколько лет [15]. Ряд факторов обусловливает задержку восстановления миокарда при ПКМ: отсроченная диагностика, высокий класс недостаточности кровообращения по NYHA, принадлежность к негроидной расе, тромбы в полости левого желудочка, мультипаритет, сопутствующая патология [16–18].
В двухлетнем когортном исследовании 123 пациенток с ПКМ ФВ ЛЖ возросла с 28 до 46%, около половины больных достигли значений >50,5% [19]. Прирост сократительной способности миокарда был наибольшим при базовом уровне ФВ ЛЖ >30%, и наименьшим при конечном диастолическом размере ЛЖ (КДР ЛЖ) >5,6 см [19]. Худший прогноз в плане восстановления миокарда отмечен у пациенток с исходным повышением уровней тропонинов и СРБ [8]. Пациенткам с ПКМ не рекомендована повторная беременность даже при полном восстановлении миокарда, т.к. патология имеет тенденцию к рецидивам [14].
Исходное значение КДР ЛЖ, составившее у нашей пациентки 6,54 см, высокий уровень СРБ, одышка в покое в дебюте заболевания ассоциированы с худшим прогнозом в плане восстановления насосной функции миокарда. Действительно, в приведенном нами клиническом наблюдении прирост сократительной способности миокарда левого желудочка происходил медленно – в течение 5–8 лет (см. рисунок). Не исключено, что определенное негативное влияние на темпы восстановления сердечной мышцы оказало развитие нарушения ритма – полиморфной желудочковой экстрасистолии и последующее присоединение гипотонии, приведшее к снижению эффективных доз препаратов, влияющих на ремоделирование миокарда.
Пациентку П. невозможно отнести к категории полностью выздоровевших от ПКМ, т.к. ФВ ЛЖ не достигла 50%, а прирост ее в динамике составил 15%. Однако, несмотря на предикторы неблагоприятного исхода, развитие нарушения ритма и гипотонии, приведенный клинический случай можно считать примером успешного ведения больной с данной патологией. На фоне проведенной медикаментозной терапии достигнуты стабилизация гемодинамики, существенное увеличение ФВ ЛЖ, уменьшение размеров полостей сердца.
Заключение
В настоящее время некоронарогенные заболевания миокарда продолжают привлекать внимание исследователей и остаются одними из наиболее сложно диагностируемых патологий в кардиологии. Дальнейшее изучение и накопление данных о ПКМ должно способствовать разработке унифицированных, доступных для большинства клиник стратегий диагностики и лечения этого заболевания и поможет спасти жизни многим пациенткам.
Послеродовая (перипартальная) кардиомиопатия
Предыдущая | Содержание | следующая Послеродовая, или перипартальная, кардиомиопатия, согласно определению специальной экспертной группы ВОЗ (1980), обозначает беспричинную застойную сердечную недостаточность, развившуюся в III триместре беременности или в первые 2 мес после родов у ранее здоровых женщин.
Заболеваемость перипартальной кардиомиопатией в Европе и Северной Америке относительно невелика — 1 случай на 1300—4000 родов ( J . Pierce и соавт., 1963, и др.), она значительно выше в странах Африки, где достигает 1 %
( I . Вгос- kington , G . Eolington , 1972).
Патогенез поражения миокарда неизвестен. Как показали многочисленные исследования, по своему морфологическому субстрату и характеру изменений кардиогемодинамики (по данным эхо- и ангиокардиографии) послеродовая кардиомиопатия неотличима от идиопатической дилатационной. Эндо-миокардиальная биопсия позволяет обнаружить признаки заживающего миокардита у 33—78 %
таких больных ( J . San ^
derson и соавт., 1986; M . Medei и соавт., 1990, и др.), т. е. чаще, чем при идиопатической дилатационной кардиомиопатии. У ряда женщин отмечаются также серологические признаки перенесенной вирусной инфекции и изменения со стороны им-мунорегуляторных субпоггуляций Т-лимфоцитов — увеличение в крови соотношения хелперов к супрессорам ( J . Sanderson и соавт., 1986). Имеются отдельные наблюдения о заметном положительном эффекте иммуносупрессивной терапии азатио-прином, когда исчезали признаки хронического воспаления в миокарде. Таким образом, есть основания предполагать связь части случаев послеродовой кардиомиопатии с протекающей субклинически вирусной инфекцией с развитием миокардита. При этом вызываемая беременностью и родами повышенная нагрузка на миокард способствует более глубокому, чем можно было бы ожидать при иных обстоятельствах, его поражению, имеющему, вероятно, аутоиммунный патогенез. Однако необходимо отметить, что более чем у половины больных послеродовой кардиомиопатией не удается обнаружить связь заболевания с миокардитом, и характер повреждающего миокард фактора (или факторов) остается неясным.
Клиника. К факторам повышенного риска послеродовой кардиомиопатии относятся негроидная раса, возраст старше 30 лет, наличие более чем 3 родов в анамнезе, а также много-плодная беременность и поздний гестоз (М. Lampert , R . Lang , 1955, и др.).
Начало заболевания подострое. Симптомы и признаки, обусловленные бивентрикулярной застойной сердечной недостаточностью, кардиомегалией, аритмиями и тромбоэмболиями, такие же, как при идиопатической дилатационной кардиомиопатии. Однако течение и прогноз послеродовой кардиомиопатии более благоприятны. Более чем у 50 % больных после общепринятого симптоматического лечения застойной сердечной недостаточности через 3—б мес наблюдается стойкое клиническое улучшение и даже выздоровление с нормализацией размеров и функции сердца (М. Rolfe и соавт., 1992; G . Cloatre и соавт., 1996, и др.). При этом последующие беременности сопряжены с повышенным риском рецидивирова-ния заболевания, и материнская смертность в таких случаях достигает 10 %.
При стойком сохранении кардиомегалии и признаков сердечной недостаточности в течение 6 мес и более прогноз для выздоровления неблагоприятный и не отличим от такового при идиопатической дилатационной кардиомиопатии.
Факторы, определяющие характер течения заболевания, неизвестны. Возможно, механизмы повреждения миокарда и его причины неодинаковы, что и определяет различный прогноз.
Лечение симптоматическое. Его проводят так же, как при идиопатической дилатационной кардиомиопатии. При возникновении в период беременности сердечной недостаточности, не уступающей медикаментозной терапии, необходимо прерывание беременности. Важным средством вторичной профилактики является исключение повторных беременностей и родов.
Беременность у пациентов с кардиомиопатией/СН: согласительный документ HFA, ESC
Беременность – состояние, сопровождающееся повышенной нагрузкой на организм женщины. В связи с чем очевидно, что ее наступление может способствовать декомпенсации каких-либо хронических заболеваний, в том числе заболеваний сердца. Кроме этого, и сама по себе беременность может быть фактором одной из форм дилатационной кардиомиопатии – перипортальной кардиомиопатии. В связи с чем эксперты Ассоциации сердечной недостаточности Европейского общества кардиологов приняли решение о необходимости создания консенсусного документа, посвященного стратификации риска и ведению женщин с кардиомиопатиями/заболеваниями сердца, планирующих беременность или беременных. Прежде всего, в документе освещаются общие подходы ведения беременных и кормящих пациенток с сердечной недостаточностью. Подчеркивается, что по-возможности следует пролонгировать беременность до 32 недель. Предпочтительным методом родоразрешения, как и у здоровых беременных женщин, являются вагинальные роды, сопровождающиеся адекватным обезболиванием. В то же время отмечено, что в большинстве случаев при наличии сердечной недостаточности родоразрешение возможно лишь путем операции кесарева сечения. Далее рассматриваются общие вопросы ведения беременных пациенток как с врожденными формами кардиомиопатий (гипертрофическая, аритмогенная дисплазия правого желудочка), так и с приобретенными (перипортальная, дилатационная, синдром такоцубо). Особо актуальным представляется раздел, в котором обсуждаются некоторые аспекты ведения беременных, перенесших ранее лечение по поводу онкологического заболевания, у которых в процессе беременности развилась сердечная недостаточность. Определены факторы риска развития сердечной недостаточности у таких пациенток. Ими являются: снижение фракции выброса левого желудочка <50%, химиотерапия и лучевая терапия онкологического заболевания, диагноз онкологического заболевания в очень молодом возрасте <10 лет, время от момента онкологического заболевания до беременности >15 лет. В целом же очевидно, что какие-либо исследования в этой области практически полностью отсутствуют. В связи с чем решение об оптимальном методе лечения должно приниматься командой специалистов, включающих акушеров-гинекологов и кардиологов. Кроме этого, важным является подробное консультирование таких пациенток при планировании беременности.
Источник:
Sliwa K, et al. Eur J Heart Fail. 2021. doi: 10.1002/ejhf.2133.
Причины
Существует три группы основных причин развития первичной кардиомиопатии: врожденная, смешанная, и приобретенная. К вторичным относятся кардиомиопатии вследствие какого-либо заболевания.
Врождённая патология сердца развивается вследствие нарушения закладки тканей миокарда во время эмбриогенеза. Причин очень много, начиная от вредных привычек будущей матери и заканчивая стрессами и неправильным питанием. Так же известны кардиомиопатии беременных и воспалительные кардиомиопатии, которые по существу можно назвать миокардитом.
К вторичным формам относятся следующие виды:
- Кардиомиопатия накопленная или инфильтративная. Для нее характерно накопление между клетками или в клетках патологических включений.
- Токсическая кардиомиопатия.
- Эндокринная кардиомиопатия (метаболическая кардиомиопатия, дисметаболическая кардиомиопатия) возникает вследствие нарушения обмена веществ в сердечной мышце.
- Алиментарная кардиомиопатия образуется в результате нарушения питания, а в частности при длительных диетах с ограничением мясных продуктов или голодании.
Проявления ГКМП многообразны и зависят от ряда факторов: степени гипертрофии миокарда, наличия и величины градиента давления, недостаточности митрального клапана, нередко встречающейся у больных, степени уменьшения полости левого желудочка и тяжести нарушения насосной и диастолической функций сердца и др. Жалобы часто отсутствуют.
Различают 3 группы КМП:
Гипертрофическую. Дилатационную (застойную). Рестриктивную.
Симптомы дилатационной кардиомиопатии:
- Нарастающая сердечная недостаточность.
- Одышка при физической нагрузке.
- Быстрая утомляемость.
- Отеки на ногах.
- Бледность кожи.
- Посинение кончиков пальцев.
Симптомы гипертрофической кардиомиопатии:
- Одышка.
- Боли в грудной клетке.
- Склонность к обморокам, сердцебиению.
Симптомы рестриктивной кардиомиопатии:
- Отеки.
- Одышка.
Основным инструментальным методом диагностики всех видов кардиомиопатий является УЗИ сердца.
Суточное холтеровское мониторирование электрокардиограммы позволяет оценить частоту и выраженность нарушений ритма сердца и внутрисердечных блокад, а так же эффективность проводимого лечения. Лабораторная диагностика важна для контроля эффективности проводимой терапии в оценке состояния водно-солевого баланса, для исключения некоторых побочных эффектов препаратов, а также для выявления вторичных причин поражения сердца.