Комбинированная терапия артериальной гипертонии
В России у 40% мужчин и женщин старше 18 лет отмечаются повышенные показатели артериального давления
(АД) [5]. Важнейшим условием эффективной антигипертензивной терапии является адекватный контроль АД, т. е. достижение его целевого уровня, за который принимают АД<140/90 мм рт.ст. у всех больных АГ. В случае хорошей переносимости назначенной терапии полезным считается снижение АД и до более низких значений. При сочетании АГ с сахарным диабетом или поражением почек рекомендуется снижение АД до уровня менее 130/80 мм рт.ст. [6]. Вместе с тем в России только у 5,7% мужчин и 17,5% женщин с АГ достигаются целевые уровни АД. Только 59% женщин и 37% мужчин знают о существовании у них АГ, лечатся только 46% женщин и 21% мужчин, но целевые значения АД достигаются лишь у 17,5% женщин и 5,7% мужчин [7,8]. Таким образом, современная антигипертензивная терапия должна воздействовать на различные системы, с помощью которых происходит регуляция АД в организме человека: симпато–адреналовую систему, ренин–ангиотензин–альдостероновую систему (РААС), обмен кальция, натрий–объем [9]. Влияние на любую из них позволяет добиться уменьшения АД. Согласно результатам мета–анализа
BPLTTC–2003
(Blood Pressure Lowering Treatment Trialist Collaboration) четыре класса антигипертензивных препаратов, воздействующих на различные системы – ингибиторы ангиотензинпревращающего фермента (ингибиторы АПФ), диуретики, β–адреноблокаторы, блокаторы кальциевых каналов показали одинаковую эффективность в отношении профилактики развития сердечно–сосудистых событий.
В настоящее время возможно использование двух стратегий терапии АГ для достижения целевого АД: монотерапии и комбинированного лечения. Однако результаты множества проспективных клинических испытаний антигипертензивной терапии убедительно показывают, что в подавляющем большинстве случаев невозможно достичь целевых значений АД с помощью монотерапии. Каждый из этих подходов имеет свои достоинства и недостатки. Преимущество монотерапии состоит в том, что в случае удачного подбора лекарственного средства больному не понадобится дополнительно принимать еще один препарат. Однако, как правило, при монотерапии удается достигнуть целевого АД в среднем только у 30–40% больных АГ. Это вполне естественно, поскольку один класс препаратов не в состоянии контролировать все патогенетические механизмы повышения АД: активность симпатической нервной системы и ренин–ангиотензин–альдостероновой системы, объемзависимые механизмы. В частности, в исследовании HOT
на момент включения в исследование 59% пациентов получали монотерапию, тогда как через 3,2 года единственный антигипертензивный препарат принимали лишь 32% пациентов. При этом отмечалась четкая зависимость между величиной целевого ДАД и частотой комбинированной терапии. Для достижения ДАД<90 мм рт.ст. комбинированная терапия потребовалась в 63% случаев, ДАД<85 мм рт.ст. – в 68%, а для ДАД<80 мм рт.ст. – в 74 % (причем среднее ДАД в этой группе составило 81 мм рт.ст., т. е. цель так и не была достигнута) [10]. Частота назначения двух и более антигипертензивных препаратов в других исследованиях также оказалась велика: в исследовании SHEP – 45,0%, MAPHY – 48,5%, ALLHAT – 62,0%, STOP–Hypertension – 66,0%, IPPPSH – 70,0%, INVEST – 84,0%, LIFE – 92,0%, COOPE – 93,0%, а в исследовании VA комбинация потребовалась всем пациентам.
Недостатком комбинированной терапии является неудобство, связанное с тем, что больному приходится дополнительно принимать еще один, а иногда и несколько препаратов. Однако в большинстве случаев назначение антигипертензивных средств с различными механизмами действия позволяет, с одной стороны, добиваться целевого АД, а с другой – минимизировать количество побочных эффектов. Комбинированная терапия дает также возможность подавлять контррегуляторные механизмы повышения АД. Использование комбинации гипотензивных препаратов становится неоспоримым, особенно при лечении АГ высокого риска, у больных с поражением почек, у страдающих сахарным диабетом, для которых целевые значения АД ниже. Начало лечения с комбинации препаратов наиболее предпочтительно у больных с более низкими целевыми значениями АД, при АГ высокого и очень высокого риска, а также при выраженном повышении АД (160/100 мм рт.ст. и выше). В последнем случае необходимость назначения комбинации препаратов в большинстве случаев поддерживается и американскими рекомендациями (доклад Объединенного комитета, 2003 г.).
Существуют различные комбинации антигипертензивных средств. Cреди комбинаций двух препаратов эффективными и безопасными считаются:
диуретик + β–адреноблокатор; диуретик + ингибитор АПФ; диуретик + антагонист рецепторов к ангиотензину II (АРА); антагонист кальция дигидропиридинового ряда + β–адреноблокатор; антагонист кальция + инигибитор АПФ; антагонист кальция + диуретик; α–адреноблокатор + β–адреноблокатор; препарат центрального действия + диуретик. Кроме того, возможны комбинации ингибитора АПФ, антагониста кальция, АРА и диуретика с агонистом I1 имидазолиновых рецепторов. Наиболее популярной в России является комбинация ингибитора АПФ и диуретика. Как показывают результаты исследования
ПИФАГОР
, почти треть врачей в России отдает предпочтение сочетанию именно этих препаратов [11]. К преимуществам комбинированной терапии относятся: усиление антигипертензивного действия за счет взаимного потенцирования эффекта отдельных препаратов. Это происходит вследствие подавления различных прессорных систем, а также нейтрализации контррегуляторных механизмов, уменьшающих эффективность отдельных препаратов. Снижение частоты нежелательных явлений: во–первых, взаимное потенцирование антигипертензивного эффекта позволяет использовать в комбинациях более низкие дозы препаратов, что снижает частоту побочных эффектов; во–вторых, большинство рациональных комбинаций обеспечивает взаимную нейтрализацию побочных действий отдельных препаратов. Повышение частоты ответа на лечение и частоты достижения целевых уровней АД. Комбинация лекарственных средств, обеспечивающая блокирование нескольких механизмов поддержания повышенного АД, увеличивает вероятность воздействия на прессорную систему, наиболее активную у данного конкретного пациента. Назначение комбинированной терапии в 2 раза увеличивает вероятность ответа на лечение. При этом обеспечивается более эффективная защита органов–мишеней АГ и, следовательно, более выраженное снижение риска осложнений.
Комбинация ингибитора АПФ и диуретика является одной из наиболее обоснованных и удобных
. Сегодня доказано, что ингибиторы АПФ и диуретик действуют синергично и эффект от такой комбинации выше, чем у каждого из этих препаратов в отдельности. Диуретики, уменьшая объем циркулирующей крови, приводят к компенсаторной активации ренин–ангиотензин–альдостероновой системы (РААС), что ограничивает их эффективность. Добавление ингибиторов АПФ позволяет преодолеть активацию РААС и тем самым усиливает эффект диуретика. С другой стороны, известно, что ингибиторы АПФ менее эффективны при низкорениновой форме АГ. Добавление диуретика в данной ситуации увеличивает активность РААС и обеспечивает повышение эффективности ингибиторов АПФ. Совместное использование ингибитора АПФ и диуретика позволяет взаимно нивелировать побочные эффекты обоих препаратов. Диуретики приводят к повышению экскреции калия, тогда как ингибиторы АПФ способствуют задержке калия; соответственно комбинация обеспечивает предотвращение как гипокалиемии, индуцированной мочегонным препаратом, так и гиперкалиемии, вызванной ингибиторами АПФ. Предотвращение гипокалиемии может иметь существенное значение не только в плане повышения переносимости терапии. В исследовании
SHEP
у больных с гипокалиемией не отмечено снижения частоты неблагоприятных сердечно–сосудистых событий по сравнению с пациентами, имевшими нормокалиемию, несмотря на одинаковое снижение АД [12]. Известно, что тиазидные диуретики, помимо гипокалиемии, вызывают гиперурикемию, ингибиторы АПФ же способствуют ее уменьшению, т.к. усиливают кровоток в кортикальном слое почек, что приводит к повышению экскреции мочевой кислоты. Существенным недостатком тиазидных диуретиков является их неблагоприятное влияние на обмен липидов и глюкозы. Комбинирование мочегонных с ингибиторами АПФ позволяет ослабить эти нежелательные эффекты, однако зачастую мешает полностью их преодолеть.
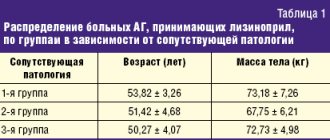
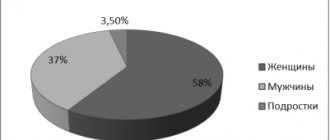
Так, в Российском исследовании ЭПИГРАФ
[13] оценивалась эффективность нефиксированной комбинации ингибитора АПФ эналаприла и тиазидного диуретика индапамида. В исследовании принимали участие 30 центров, которые включили 550 больных, страдавших гипертонической болезнью или вторичной АГ почечного генеза с уровнем АД выше 160 и 90 мм рт.ст. Средний возраст обследованных составил 55,3±0,4 лет, среди наблюдавшихся было 319 (58%) женщин и 231 (42%) мужчина. Исходные значения АД составили в среднем 174,1 и 100,6 мм рт.ст., АГ II ст. отмечалась у 452 (82%), АГ III ст. – у 98 (18%) пациентов. Симптоматическая почечная АГ (на фоне пиело– или гломерулонефрита) регистрировалась у 198 (36,8%) пациентов. Всем больным назначали индапамид в дозе 2,5 мг/сут. Затем всех больных в зависимости от САД разделили на три группы. В 1–й группе (124 пациента) САД составило 160–170 мм рт.ст., во 2–й (328 больных) – 170–180 мм рт.ст., в 3–й (98 больных) >180 мм рт.ст. Пациентам 1–й группы назначали эналаприл в дозе 5 мг/сут, 2–й – 10, в 3–й – 20 мг/сут. При недостижении целевых уровней АД дозы эналаприла увеличивались, что потребовалось у 121 (22%) больного. В итоге средняя суточная дозировка эналаприла к концу исследования составила 15,2 мг в комбинации с индапамидом в дозе 2,5 мг. В ходе исследования в целом по группе САД снизилось со 174,1±19,6 до 137,3 мм рт.ст., величина снижения составила 38,8 мм рт.ст., что соответствует 20,4% от исходного (р<0,001). ДАД также достоверно снизилось со 100,6±11,6 до 83,1±7,4 мм рт.ст., величина снижения составляла 17,5 мм рт.ст., что соответствует 14,7% от исходного (р<0,001). Целевой уровень АД был достигнут у 385 из 550 больных, т.е. в 70% случаев. Суммарный показатель контроля АД, включавший достижение целевых значений в сумме со снижением АД на 20/10 мм рт.ст. без достижения целевого уровня, составил 77,1% (424 из 550 пациентов). При этом отмечена хорошо известная закономерность: снижение ДАД ниже 90 мм рт. ст. достигалось у 521 (94,7%) больного, тогда как САД ниже 140 мм рт.ст. – лишь у 372 (67,7%). Комбинированная терапия эналаприлом и индапамидом хорошо переносилась: побочные явления выявлены у 45 (8,1%) больных, причем преобладали симптомы, связанные с чрезмерным снижением АД (5,4%), и лишь у 15 (2,7%) пациентов отмечен сухой кашель, вызванный приемом эналаприла. Таким образом, была отмечена
высокая эффективность комбинации эналаприла с индапамидом, хорошая переносимость лечения
. При этом установлено, что эффективность комбинированной терапии эналаприлом и индапамидом существенно не зависит от пола и возраста, а также от типа АГ (эссенциальной или симптоматической). Предложенные дозировки эналаприла и индапамида в целом обеспечивали достаточную степень эффективности при АГ различной тяжести.
На основе проведенного исследования был создан препарат Энзикс
– нефиксированная комбинация эналаприла и индапамида. Существуют три вида препарата Энзикс: Энзикс – 10 мг эналаприла и 2,5 мг индапамида (однократный прием утром) для больных АГ I степени;
Энизикс Дуо
– 10 мг эналаприла и 2,5 мг индапамида (утром) + 10 мг эналаприла (вечером) для больных АГ II степени;
Энзикс Дуо Форте
– 20 мг эналаприла и 2,5 мг индапамида (утром) + 20 мг эналаприла (вечером). Эффективность и безопасность Энзикса оценивалась в исследовании
ЭПИГРАФ–2
, которое по дизайну являлось сравнительным рандомизированным многоцентровым, включавшим девять центров в России и один – в Сербии [14]. Всего в исследование было включено 313 больных, рандомизированных в две группы. В группу Энзикса вошли 211 пациентов, в группу контроля – 102 больных. В контрольной группе проводилось лечение другими классами антигипертензивных препаратов (кроме иАПФ и диуретиков). Общая длительность лечения составила 14 недель. Все пациенты, рандомизированные в группу Энзикса, были разделены на две подгруппы в зависимости от исходного уровня АД. В первой подгруппе 118 пациентам с АГ I степени и исходным систолическим АД 140–160 мм рт.ст. была назначена комбинация 10 мг эналаприла и 2,5 мг индапамида (Энзикс). В процессе лечения 88 (74,6%) из них продолжали принимать первоначальную дозу, а у 26 (22,1%) пациентов доза эналаприла была удвоена (10 мг утром + 10 мг вечером) при сохранявшейся дозе индапамида (2,5 мг утром), что соответствовало Энзикс Дуо. Только одному больному с АГ I степени потребовалось назначение комбинации 40 мг эналаприла (20 мг утром + 20 мг вечером) и 2,5 мг индапамида, что соответствовало Энзикс Дуо Форте. Трое пациентов не завершили исследование. Во второй подгруппе 93 пациентам с АГ II степени и систолическим АД 160–180 мм рт.ст. терапия начиналась с 20 мг эналаприла (по 10 мг утром и вечером) и 2,5 мг индапамида (Энзикс Дуо). В процессе лечения у 46 пациентов эта дозировка была сохранена, а у 45 больных доза эналаприла была увеличена до 40 мг/сут. (20 мг утром + 20 мг вечером) при неизменной дозе индапамида 2,5 мг, что соответствовало Энзикс Дуо Форте. Еще двум больным исходная доза эналаприла была уменьшена до 10 мг при сохранении исходной дозы 2,5 мг индапамида, что соответствовало Энзикс.
При анализе числа больных, у которых в результате лечения произошла нормализация уровня АД, некоторые преимущества имела группа пациентов, получавших Энзикс (72,5%), в сравнении с группой контроля (66,7%). И это несмотря на то, что систолическое АД в «опытной» группе было исходно на 2,7 мм рт.ст. выше, чем в контрольной. Если же суммировать общее число больных, положительно отреагировавших на лечение (число пациентов с нормализацией АД или снижением систолического АД более чем на 20 мм рт.ст. от исходного уровня), то к концу лечения оно достигло 82,4% в среднем по группе, принимавшей Энзикс, причем среди пациентов с АГ I степени эта величина составляла 89,8%, а у больных с АГ II степени – 77,2%. Таким образом, раннее начало лечения больных с АГ I–II степеней нефиксированной комбинацией эналаприла и индапамида (Энзикс) в сравнении с рутинной антигипертензивной терапией позволяет чаще достигать нормализации уровня АД. Кроме того, в группе Энзикса удалось достоверно уменьшить число пациентов с гипертрофией левого желудочка и протеинурией, улучшить качество жизни, снизить количество госпитализаций и дополнительных визитов к врачу.
Известно, что фиксированным комбинациям наряду с такими преимуществами, как удобство приема и повышение приверженности к лечению, присущи и недостатки. В частности, врач не может варьировать дозы препаратов, входящих в фиксированную комбинацию, что не позволяет индивидуализировать лечение. При появлении побочных реакций, связанных с одним из действующих начал, приходится отменять комбинацию в целом. Наличие нескольких лекарственных форм с различными дозировками позволяет преодолеть эти недостатки лишь частично. В результате были созданы препараты Энзикс, которые выпускаются компанией Hemofarm A.D. и содержат в одном блистере таблетки индапамида и эналаприла. Комбинация препаратов в одном блистере имеет ряд преимуществ: возможность титрования дозы эналаприла в различных клинических ситуациях, простота отмены препарата или уменьшения дозы при развитии нежелательных явлений, возможность повышения дозы для усиления антигипертензивного эффекта путем замены такой же формой препарата с большей дозировкой эналаприла, что не влечет за собой уменьшения приверженности лечению. Также несомненно важным остается экономический аспект лечения. Таким образом препарат Энзикс с нефиксированной комбинацией эналаприла и индапамида зарекомендовал себя, как высокоэффективный и безопасный препарат для лечения артериальной гипертонии у различных групп больных.
Литература 1. Chobanian AV, Bakris GL, Black HR, et al. Seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure. Hypertension 2003;42:1206–52. 2. Шальнова С.А., Баланова Ю.А., Константинов В.В. и др. Артериальная гипертония: распространенность, осведомленность, прием антигипертензивных препаратов и эффективность лечения среди населения Российской Федерации // Российский кардиологический журнал. 2006. № 4. С. 45–50. как в национальном, так и в мировом масштабе 3. Ezzati M, Lopez AD, Rodgers A, et al. Selected major risk factors and global and regional burden of disease. Lancet 2002;360(9343):1347–60. Распространенность АГ в экономически развитых странах достигает 25 % [1]. 1. Kaplan N, Schachter M. New frontiers in hypertension. Lippincatt Williams and Wilking 2002. 4. Lewington S, Clarke R, Qizilbash N, et al. Prospective Studies Collaboration. Age–specific relevance of usual blood pressure to vascular mortality: a meta–analysis of individual data for one million adults in 61 prospective studies. Lancet 2002;360:1903–13. 5. Оганов Р.Г. Профилактика сердечно–сосудистых заболеваний: возможности практического здравоохранения // Кардиоваскулярная терапия и профилактика. 2002. № 1. С. 5–9. 6. Второй пересмотр рекомендаций ВНОК по профилактике, диагностике и лечению артериальной гипертензии // Кардиоваскулярная терапия и профилактика. 2004. Т. 3. № 3. Ч. 1. С. 105–120. 7. Ратова Л.Г., Чазова И.Е. Нефропротективный эффект антигипертензивной терапии: исследование ИРИС. Consilium Medicum 2004; Приложение, выпуск 2; 3–7. 8. Фофанова Т.В., Агеев Ф.Т. Ингибиторы АПФ плюс низкие дозы тиазидных диуретиков: идеальная комбинация для лечения артериальной гипертонии. Сердце 2004; 3; 99–103. 9. Бойцов С.А. Комбинированная терапия артериальной гипертензии с позиций профилактики сердечно–сосудистых осложнений и патогенеза. Consilium Medicum 2004; Приложение, выпуск 2; 23–26. 10. Hansson L, Zanchetti A, Carruthers SG, et al. Effects of intensive blood–pressure lowering and low–dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. Lancet 1998;351:1755–62. 11. Леонова М.В., Белоусов Ю.Б., Белоусов Д.Ю. и др. Результаты фармакоэпидемиологичяеского исследования больных артериальной гипертонией в России // Качественная клиническая практика. 2004. № 1. С. 17–27. 12.Savage PJ, Pressel SL, Curb JD, et al. Influence of long–term, low–dose, diuretic–based, antihypertensive therapy on glucose, lipid, uric acid, and potassium levels in older men and women with isolated systolic hypertension: The Systolic Hypertension in the Elderly Program. Arch Intern Med 1998;158:741–51. 13. Беленков Ю.Н., Мареев В.Ю. от имени рабочей группы исследования ЭПИГРАФ. Эналаприл Плюс Индапамид в лечении стабильной артериальной ипертонии: оценка эффективности и безопасности РАциональной комбинированной Фармакотерапии (ЭПИГРАФ). Первые результаты Российского многоцентрового исследования // Сердце. 2003. Т. 2. № 4. C. 3–7. 14. Беленков Ю.Н. и рабочая группа исследования ЭПИГРАФ–2. Эналаприл Плюс Индапамид в лечении АГ: оценка эффективности и безопасности Рациональной Фармакотерапии. Применение нефиксированной комбинации Эналаприла и Индапамида (Энзикс). Дизайн и основные результаты исследования ЭПИГРАФ–2 // Сердце. 2005. Т. 4. № 5. С. 277–286.
Венскевич Ф.Е., медицинский , г. Минск
Аппаратно-программный комплекс – КМСД позволяет проводить дифференциальную диагностику многих заболеваний различных органов и систем.
Методика работы на КМСД и подходы к оценке маркеров изложены в методических материалах [1] и на сайте.
В процессе уточнения причины артериальной гипертензии всегда возникает потребность в проведения дифференциальной диагностики. Кратко напомним классификацию вторичных (симптоматических) артериальных гипертензий (АГ)
[4]:
- нефрогенная АГ (при хронических заболеваниях почек);
- вазоренальная АГ (связана с поражением почечных артерий)
- эндокринные АГ
- АГ, обусловленные поражением крупных артериальных сосудов
- нейрогенные или центральные АГ
- лекарственные средства и экзогенные вещества, способные вызвать АГ
Нефрогенная артериальная гипертензия
наблюдается при: хронических гломерулонефритах и пиелонефритах, поликистозной болезни почек, диабетической нефропатии, врожденных аномалиях почек и др. Состояние паренхимы почек определяется путем анализа маркеров в разделе «почки и заболевания» в базах
«Мужская мочеполовая система»
и
«Женская мочеполовая система»
соответственно для мужчин и женщин.
Основной задачей диагностики почечной АГ с помощью КМСД является определение величины сходства (в %) и уровня патологического соответствия (в баллах) маркеров: нефрит, гломерулонефрит, пиелонефрит, гипернефроидная почка (онко), гипернефроидная почка(1,2), киста почек, сморщенная почка, почечная лоханка (1,2), почка (1,2) и др. При проведении диагностики следует учитывать маркеры, указывающие и на воспалительный, и на дегенеративные процессы, т.к. эти процессы в равной степени могут способствовать повышению артериального давления (АД).
Вазоренальные артериальные гипертензии
(составляют 2-5% всех АГ), бывают врожденные (фиброзно-мышечная дисплазия и др.) и приобретенные (атеросклероз или неспецифический аортоартериит и др.). Для диагностики на КМСД используется база
«Сердечно-сосудистая система»
, разделы «сердечнососудистая система (органы и заболевания)», «артерии», «холестерин». Маркеры: почечная артерия (1,2), холестерин D60, атеросклероз D4, гиперхолестеринемия D4.
Эндокринные артериальные гипертензии
чаще всего обусловлены: поражение коры надпочечников: гиперсекреция минералокортикоидов (первичный и идиопатический альдостеронизм, семейная форма гиперальдостеронизма типа I); гиперсекреция глюкокортикоидов (синдром Иценко-Кушинга); поражение мозгового вещества надпочечников: гиперсекреция катехоламинов (феохромоцитома); нарушение функции щитовидной и паращитовидной желез: гипотиреоз, гипертиреоз, гиперпаратиреоз; при поражении гипофиза: болезнь Иценко-Кушинга, акромегалия.
В базе «Эндокринология»
используют разделы «эндокринология (органы и заболевания)», «гормоны общая», либо «гормоны надпочечников» — глюкокортикоиды, адреналин коры надпочечников, адреналин мозгового вещества надпочечников, кортизол; «гормоны гипофиза» — антидиуретический, соматотропин, адренокортикотропный, тиреотропин; «гормоны гипоталамуса»- тиреотропин-релизинг гормон Д-6, «гормоны щитовидной железы» — тироксин Т4, триодтиронинТ3. Указанные гормоны-маркеры на КМСД определяются качественно.
В разделе «Онко (Эндокринология) общая» необходимо учитывать все активные маркеры этого раздела, в неразрывной связи с имеющейся клиникой АГ.
Артериальные гипертензии обусловленные поражением крупных артериальных сосудов
возникают за счет изменения гемодинамики, в основном за счет механических факторов. Основные причины: атеросклероз аорты, недостаточность клапанов аорты, коарктация аорты и др. Для диагностики на КМСД используется база
«Сердечно-сосудистая система»
, разделы: «сердечнососудистая система (органы и заболевания)», «сердце», «аорта», «артерии», «холестерин». Маркеры: аортальный клапан(1,2), аорта(1,2), аорта (грудной отдел), брюшная часть аорты Д3, дуга аорты Д3(1),грудная часть аорты Д3, холестерин D60, атеросклероз D4, гиперхолестеринемия D4.
Нейрогенные артериальные гипертензии
(около 0,5% всех АГ) возникают при очаговых повреждениях и заболеваниях головного и спинного мозга (опухолях, энцефалите, травмах головного мозга и др.)
База «Неврология»
разделы «неврология органы и заболевания» и «заболевания нервной системы» маркеры: энцефалит, энцефалит (D60, D32, D26, D15, D4), энцефалит японский, энцефалит клещевой (1,2), лейкоэнцефалит, энцефаломиеломаляция. В разделе «Структуры головного мозга» ствол мозга (D3), продолговатый мозг (1,2), ретикулярная формация (1,2), промежуточный мозг (1,2), гипоталамус (1,2), промежуточный мозг (1,2).
В разделе «Онко (Неврология) общая» необходимо учитывать все активные маркеры этого раздела, но в неразрывной связи с имеющейся клиникой АГ.
В базе «Сердечно-сосудистая система»
, оценивают маркеры из раздела «Сосуды головного мозга и шеи»: сосуды головного мозга, позвоночная артерия (1,2), артерии и вены глаза (1,2), внутренняя сонная артерия(D4), и специальный маркер для тестирования нарушений мозгового кровообращения — гломус каротис (D32).
Таким образом
, одно из основных направлений применения КМСД дифференциальная диагностика заболеваний.
Уникальность метода не только в принципиально новой технологии диагностики [2], но и в её практической эффективности — огромный объем диагностической информации, получаемый за максимально короткое время (10-30 минут), что важно для пациента и не менее важно для здравоохранения [3]. Экономическая эффективность заключается в снижении затрат на проведение дополнительного обследования. Так для уточнения причины АГ при условии соблюдения принципов качества медицинской помощи, на что претендует каждый пациент, необходимо проводить полное обследование перечисленных выше систем органов. После проведения ФСД диагностики уточняющее обследование проводится по
установленному
конкретному направлению.