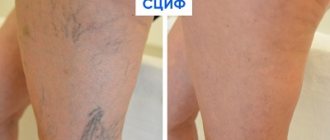
Имеются противопоказания. Необходима консультация специалиста.
Формы заболевания Причины развития Симптоматика Кто в группе риска? Классификация Что будет, если не лечить? Диагностика Методы и техники лечения Профилактика
Хроническая венозная недостаточность, как и острая ее форма, связана с нарушением тока крови. Благодаря системе клапанов, а также мускулатуре тела, кровь из нижних конечностей поступает к сердцу, преодолевая силу гравитации. Поэтому каждому человеку рекомендованы умеренные физические нагрузки, гимнастика при сидячей работе, регулярные прогулки. Если же по причине неправильного образа жизни или плохой наследственности появляется варикоз или просвет сосуда закупоривается тромбом, начинает развиваться венозная недостаточность ног. Сначала расширяется пораженная вена, затем нарушается функция клапанов (они не до конца смыкаются), и в результате получается рефлюкс, то есть обратный ток крови – она поступает не только к сердцу, но и обратно в ноги. Из-за скопления крови человек чувствует тяжесть в ногах, появляются отеки. Эти симптомы не стоит списывать на усталость, нужно срочно обратиться к флебологу, иначе разовьется хроническая венозная недостаточность.
Важно! Варикоз и венозная недостаточность – это не одно и то же. Варикозное расширение вен – только один из признаков недостаточности, хотя и наиболее распространенный.
Формы венозной недостаточности
Протекание и лечение венозной недостаточности зависят от того, какая форма заболевания присутствует у пациента. В «СМ-Клиника» работают одни из лучших флебологов СПб, имеется передовое диагностическое оборудование. Благодаря этому, уже при первых симптомах мы оказываем квалифицированную помощь.
Острая венозная недостаточность (ОВН)
Появляется из-за резкого нарушения кровотока в глубоко расположенных сосудах. Например, из-за закупорки вены тромбом. Также ее причины – это особенности свертываемости крови, различные заболевания, интоксикация при приеме некоторых лекарств.
Болезнь развивается стремительно, сразу видны ее признаки: синюшная кожа, быстрый и сильный отек ног, визуально без труда заметный венозный рисунок. Кроме этого, человек ощущает боль в ногах. Стадий у ОВН нет.
Хроническая венозная недостаточность (ХВН)
Развивается медленно, вначале даже не дает симптомов, однако постепенно приводит к серьезным нарушениям. Может быть следствием варикоза, оставшегося без лечения. Приводит к трофическим язвам и различным осложнениям, включая инфицирование конечности.
Имеет несколько стадий:
- На нулевой нет неприятных симптомов, только видны сосудистые «звездочки». К сожалению, к врачу люди на этой стадии обращаются крайне редко.
- На первой человек к вечеру чувствует тяжесть в ногах, замечает отечность. Это вызвано небольшими поражениями поверхностно расположенных вен.
- На второй появляются пигментные пятна, отечность не проходит после ночного отдыха, возникает экзема (ее участки).
- На третьей стадии на месте экземы появляются трофические язвы – мокнущие незаживающие раны.
ХВН при высокой степени развития сопровождают кровотечения, тромбофлебит, закупорка тромбами глубоко расположенных вен.
Факторы риска ХВН
При ряде факторов существенно возрастает риск развития хронической венозной недостаточности, к ним относятся:
- Генетическая предрасположенность, включающая патологии соединительной ткани и слабости сосудистой стенки.
- Прием гормонсодержащих средств, в том числе гормональных контрацептивов.
- Малая двигательная активность, сидячий образ жизни, постоянный подъем тяжестей, лишний вес.
- Хронические запоры.
ХВН чаще диагностируют у женщин, поскольку на формирование венозной недостаточности влияет высокая концентрация эстрогенов (женские стероидные половые гормоны). Оказывают негативное влияние период беременности и родов, прием гормональных контрацептивов. С возрастом вероятность развития заболевания вырастает у обоих полов в связи с длительным воздействием неблагоприятных факторов.
Каковы причины возникновения венозной недостаточности?
Все причины развития заболевания можно условно разделить на группы:
- Негативная наследственность. Сюда можно отнести особенности строения сосудов, недостаточность сосудистой стенки и клапанного аппарата.
- Нарушения кровотока: варикоз, тромбоз, последствия травм, посттромбофлебитический синдром, постоянно высокое давление в нижних конечностях, флебит, беременность.
- Образ жизни: ожирение, отсутствие физической активности, избыточные силовые нагрузки (как бесконтрольное поднятие весов в зале, так и, например, работа грузчиком), сидячий образ жизни или стоячая работа.
- Гормональный статус: женщины болеют венозной недостаточностью чаще мужчин, сюда также относится прием ОК (оральных контрацептивов), гормональная терапия.
- Возрастной фактор: чем старше пациент, тем выше вероятность заболевания.
Механизм зарождения и развития болезни
Под воздействие силы тяжести кровь в сосудах спускается в нижние конечности, организму приходится прилагать усилия для ее подъема. Препятствуют оттоку крови вниз венозные клапаны, которым активно помогает в этом физическая активность, сокращение мышц и сгибание колен. Совокупность этих факторов обеспечивает нормальный кровоток.
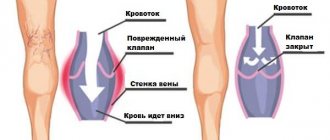
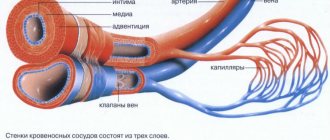
Поддержание постоянного сопротивления силы тяжести возможно из-за физиологического изменения просвета сосудов при смене положения тела, работе клапанного аппарата и тонусу (эластичности) венозной стенки. Если один из этих составляющих механизмов нарушается, патологические процессы начинают затрагивать всю систему в целом. Потеря эластичности участка вены ниже клапана, и ее расширение приводит к клапанной несостоятельности, невозможности удерживать кровоток для последующего подъема. Застой жидкости приводит к повышению давления для продвижения крови вверх. Но, с течением времени повышенное давление увеличивает объем части вены, потерявшей эластичность.
К патологическому процессу может присоединиться венозный рефлюкс (обратный ток крови сверху вниз). Жидкость начинает застаиваться, давить на стенки сосуда. В результате плазма крови просачивается в окружающие ткани, вызывая отек. Аналогично ситуация развивается при изначальной клапанной недостаточности.
Одновременно с недостаточностью кровообращения перегружается и лимфатическая система. Нарушения трофики способствуют образованию трофических язв. Трофические язвы — это долго незаживающие раны (от 6 месяцев и более) затрагивающие кожу и ткани. Образуются на голени, окружены зоной воспаления, имеют высокий риск инфицирования.
Симптоматика заболевания
Сначала рассмотрим общие симптомы. Следует помнить, что на начальных стадиях болезни они проявляются по одному и часто «смазаны». Чем более прогрессирует заболевание, тем ярче выражены симптомы, и проявляются они чаще всего группами. Итак:
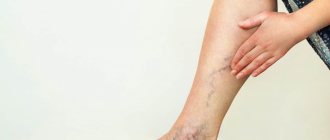
- боль в ногах, ощущение тяжести, распирания;
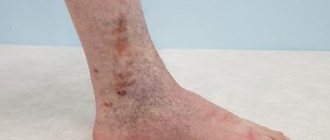
- сосудистые «звездочки»;
- отеки – сначала проходящие после отдыха, потом постоянные;
- ночные судороги в голенях;
- сухость, нездоровый блеск кожи, пигментные пятна или участки обесцвечивания;
- трофические язвы на запущенной стадии.
Консультация хирурга: когда обращаться, как проходит приём?
Симптомы ХВН по стадиям
| Стадия | Описание |
| 0 | Человек трудоспособен, симптомов нет, они не появляются после занятий спортом и других нагрузок. |
| 1 | Небольшая боль, тяжесть в ногах и отеки в конце дня, которые проходят к утру, легкие судороги. Человек не ограничен в двигательной активности, может работать в прежнем темпе. |
| 2 | Проявления венозной недостаточности становятся выраженными. Это пигментация кожи, дерматологические заболевания, сильные отеки, некроз кожи на некоторых участках. Человеку становится сложно работать физически, заниматься спортом. |
| 3 | Появляются трофические язвы, в тканях полностью нарушен обмен веществ. Человек теряют трудоспособность. |
Симптомы ОВН
Признаки болезни более выражены и проявляются гораздо быстрее, по сравнению с ХВН:
- усиливающиеся при движении боли в ногах;
- чуть ниже места закупорки вены – большой отек;
- трудности при любых физических действиях;
- бледность либо синюшность кожного покрова;
- в месте патологии температура кожи снижается на 2-3℃;
- температура тела может подниматься до 40℃;
- усиление боли до нестерпимой;
- «отдавание» боли в область паха и малого таза.
Важно! Чтобы снизить вероятность отрыва тромба с последующей тромбоэмболией, пациенту нужно ограничить движения. Рекомендован постельный режим до 10 дней, больная нога при этом должна находиться выше тела.
Виды рефлюкса вен
В зависимости от того, как происходит распределение крови, выделяют 2 типа рефлюкса:
- Вертикальный.
Может развиваться в глубоких и поверхностных сосудах. При данном виде рефлюкса кровь движется по направлению вниз. В глубоких венах возникает при посттромбофлебитическом синдроме и провоцирует тяжелую венозную недостаточность.
На ранних стадиях выявить данное заболевание очень сложно. Даже комплексная терапия не гарантирует полного выздоровления, а поэтому пациентам с этим заболеванием необходимо регулярно проверяться у врача.
- Горизонтальный.
В данном случае кровь поступает из глубоких вен в поверхностные. Горизонтальный рефлюкс считается основной причиной развития варикоза. Диагностируется на начальных стадиях развития.
Классификация заболевания
Острая венозная недостаточность не имеет классификации по стадиям. Рассмотрим степени и стадии хронической формы заболевания. Чтобы полностью описать диагноз пациента, врачи используют классификацию СЕАР, то есть присвоение своеобразного «кода», например: C4a, S, Eс, Ad, Pr, 8, 10, 11, 17. Он расшифровывается на основании следующих классификационных признаков.
C – класс патологии:
- С0 – без видимых симптомов;
- С1 – сосудистые «звездочки»;
- С2 – расширенные вены от 3 мм;
- С3 – отечность в зонах голеней и лодыжек;
- С4a – дерматит, пигментация и другие поражения кожного покрова;
- С4b – усиление пигментации, уплотнение кожи;
- С5 – заживающие самостоятельно кожные раны;
- С6 – незаживающие трофические язвы.
Следующий индекс говорит о наличии жалоб у пациента: А – без симптомов и жалоб, S – жалобы есть.
Е – причина болезни:
- Ес – врожденная;
- Ер – этиология неизвестна;
- Еs – причина известна.
А – локализация:
- As – подкожные вены;
- Ар – сосуды, которые соединяют глубокие вены и подкожные;
- Аd – глубокие вены;
- Аn – нет патологий венозной системы.
Р – тип патологии:
- Po – прекращение движения крови по венам;
- Рr – клапанная недостаточность;
- Pr,o – и то, и другое;
- Рn – не выявлено нарушений движения крови по венам.
Цифра – это участок венозной системы, где обнаружена патология: от 1 до 18.
Причины ХВН
Чаще всего венозная недостаточность возникает при варикозном расширении вен, а также на фоне таких заболеваний и патологических состояний, как:
- врожденная патология венозной системы;
- врожденная аплазия и гипоаплазия глубоких вен;
- врожденные артериовенозные свищи;
- врожденный остеогипертрофический невус с варикозными венами;
- перенесенный острый тромбоз магистральных вен;
- синдром Клиппель-Треноне;
- перенесенный флеботромбоз.
В последние годы появилась новая причина развития хронической венозной недостаточности, которую все чаще выявляют — это флебопатия. Под этим названием понимают состояние венозного застоя при отсутствии клинических признаков патологии. В редких случаях ХВН начинает развиваться после перенесенной травмы (ушиба, разрыва, глубоких ожогов или переохлаждения).
Лечение ХВН
Для лечения патологии применяют консервативный метод, если он возможен, и оперативный.
Консервативная методика
Такая терапия возможна, когда еще нет необратимых изменений в венах. Лечение в первую очередь включает ношение компрессионного белья (трикотажа), создающего каркас для пораженных вен и предотвращающего их перерастяжение. Также оно усиливает кровоток по венам, предупреждая формирование тромбов.
Компрессионный трикотаж – это гольфы, гетры, чулки, колготки. Он различается по силе компрессии. Выбор оптимального варианта в индивидуальном порядке – задача врача-флеболога.
Также больным рекомендуется сбросить вес, если присутствует его избыток и тем более ожирение. Снижение массы тела – это разгрузка вен. При назначении диеты уделяют внимание и профилактике запоров, чтобы профилактировать постоянно повышенное венозное давление.
Пациенту обязательно назначают лечебную гимнастику или ЛФК. Особенно полезно плавание.
Кроме того, проводится медикаментозная терапия следующими видами препаратов:
- ангиопротекторы;
- биофлавоноиды;
- антикоагулянты;
- местные анестетики;
- глюкокортикостероиды.
Дополнительная мера – наружные средства, то есть гели и мази на основе гепарина.
Хирургическое лечение
Радикальная методика лечения хронической венозной недостаточности. Показания к операции – это выраженная симптоматика, патологические рефлюксы, прогрессирование трофических язв, малая эффективность консервативного лечения, выраженное прогрессирование ХВН.
Основные методики:
- лазерная;
- хирургическая;
- абляционная;
- шунтирование;
- флебэктомия, эндоскопическая флебэктомия.
Подготовка к операции
Пациент проходит дуплексное сканирование вен, а также стандартное обследование, которое включает:
- ЭКГ;
- флюорографию;
- коагулограмму;
- общий и биохимический анализы крови;
- общий анализ мочи;
- анализы крови на инфекции, группу и резус-фактор.
Результаты анализов предоставляются терапевту. Также нужна консультация с анестезиологом.
Перед процедурой пациенту следует удалить волосы из предполагаемой зоны вмешательства. Последний прием пищи – за 4-6 часов.
Ход операции
- Лазерная методика. Позволяет устранять варикозную сетку и значительно расширенные вены. Пораженный сосуд изнутри облучается лазером под высокой температурой. В результате его стенки «склеиваются», постепенно он полностью исчезает. Разрезов не нужно – только проколы. Процедура проводится под контролем УЗИ.
- Хирургия. Для доступа к пораженным венам делается несколько небольших разрезов на коже и мягких тканях. Хирург либо полностью удаляет поврежденный сосуд, либо перевязывает вены, которые соединяют глубокие и поверхностные (в зоне голеней). Хирургическое вмешательство проводится, когда имеют место значительно расширенные вены.
- Флебэктомия. Удаление вен малого диаметра. На коже под местной анестезией делается несколько маленьких разрезов, через которые врач получает доступ к пораженному сосуду и удаляет его.
- Эндоскопическая флебэктомия. В сосуд вводится микрокамера, благодаря чему врач проводит удаление пораженной вены под визуальным контролем. Метод применим, когда присутствуют язвы.
- Абляция. В вену вводится гибкий катетер. Нагревающие электроды, которые находятся на его конце, термально воздействуют на венозную стенку, разрушая ее.
- Шунтирование. Применяется искусственный сосуд, который соединяет вены так, чтобы пустить кровоток в обход поврежденного участка. Обычно проводится при развитии ХВН и тяжелых венозных повреждениях.
Реабилитация
В первые дни возможны отеки, гематомы и уплотнения в зоне воздействия. Если накладывались швы, их снимают на 7-10 день.
От 1 до 2 месяцев нужно постоянно носить компрессионное белье, а затем – на рекомендованный врачом срок – только днем. Также пациенту, в зависимости от типа и масштаба вмешательства назначают лекарственные препараты (в первую очередь обезболивающие), физиотерапию, ЛФК. Рекомендована ходьба в спокойном темпе.
Примерно на 2 месяца полностью исключают перегрев зоны вмешательства, тяжелые физические нагрузки. Во время сна ноги нужно укладывать на небольшом возвышении – около 15 см.
Классификация ХВН
- 1 степень:
выражается в чувстве тяжести, ноющих болях, проходящей, незначительной отечности и ночных судорогах.
- 2 степень:
не проходящая отечность, гиперпигментация (потемнение участков кожи пораженной конечности), липодерматосклероза (дистрофические изменения жировой клетчатки), сухая и мокнущая экзема (серозное воспаление дермы).
- 3 степень:
к вышеперечисленным признакам 2 стадии добавляются трофические язвы, текущие или уже зажитые.
- Существует еще и 0 степень
, когда пациент не наблюдает изменений, жалобы отсутствуют, тем не менее патологические процессы уже запущены. Методика лечения больных с нулевой степенью ХВН отличается от терапии пациентов остальных стадий.
В международной практике хроническую венозную недостаточность по клиническим проявлениям делят на 6 степеней, включая нулевую (система CEAP). Также заболевание имеет этиологическую классификацию по причинам возникновения:
- EC — патология врожденного характера.
- ES — приобретенная форма в следствии тромбоза, варикоза, травмы.
- EP — неясная причина развития венозной недостаточности.
Существует также анатомическая классификация по месту локализации, с учетом патофизиологии, шкалы снижения трудоспособности и по ряду других факторов.
Профилактика венозной недостаточности
Профилактические меры:
- отказ от обуви на высоком каблуке;
- ношение удобной одежды, не сдавливающей тело;
- умеренный загар;
- крайне редкое посещение сауны, бани;
- поддержание нормальной массы тела;
- правильное питание;
- обильное питье (1,5-2 л воды, несладкого чая в день);
- отказ от алкоголя и курения;
- активный образ жизни;
- регулярная гимнастика при сидячей или стоячей работе;
- при сидячей работе – ставить ноги на не очень высокую подставку.
Запишитесь на прием к флебологу «СМ-Клиника» на сайте или по телефону. Цены на услуги указаны на сайте.
Диагностические методы в отделении сосудистой хирургии
Для диагностики применяется несколько вариантов исследования:
· Допплеровское УЗИ: оценка кровотока в венах без оценки структуры вен.
· Допплеровское ультразвуковое ангиосканирование (цветное картирование кровотока) — лучший диагностический метод для всесторонней оценки состояния венозной системы.
· Флебосцинтиграфия: исследование с помощью введения в вену препарата, который помечен радиоактивным изотопом, отличающимся малым периодом полураспада.
· Эмиссионная КТ, выполняющаяся для оценки венозной патологии.
· Флебография: рентгенологическое исследование с использованием контрастного вещества.
Профилактика
Необходимо бороться с избыточным весом, правильно питаться, избегать продолжительных статических нагрузок, много двигаться, носить обувь на небольшом каблуке, заниматься спортом (плавать, кататься на велосипеде, на лыжах).
При невозможности убрать провоцирующие факторы (наследственность либо работа, отличающаяся продолжительными статическими нагрузками) врачи рекомендуют прибегнуть к профилактическому компрессионному трикотажу, а беременным – к лечебному.
Профилактические меры способствуют устранению факторов риска ХВН.
Варикозная болезнь нижних конечностей (ВБНК) — самое распространенное заболевание венозной системы. Частота выявления этой патологии составляет 10-20% у мужчин и 25-33% у женщин [1, 2]. В России, по некоторым данным, ее частота достигает 60% [3, 4].
Ведущим звеном в развитии заболевания служит формирование патологического вено-венозного рефлюкса, приводящего к варикозной трансформации вен, венозному застою и повреждению тканей. Основное значение придают сбросу крови по стволам магистральных (большой и малой) подкожных вен и перфорантным венам (ПВ) [5-12]. При этом рефлюксу по перфорантам придается крайне важное значение — сброс крови по ним, как считают, приводит к перегрузке связанных с ними притоков магистральных подкожных вен, их варикозной трансформации и соответственно манифестации заболевания («восходящая форма варикозной болезни»).
Такой взгляд на патогенез ВБНК привел к формированию единой, признанной большинством хирургов мира, хирургической концепции: операция при варикозной болезни должна носить патогенетический характер, т.е. в первую очередь устранять ее причину — стволовой и перфорантный рефлюкс [11, 13-16]. Согласно этой концепции и развивается ныне флебохирургия: предлагают новые способы стволовой флебэктомии, изучают альтернативные методы термической облитерации стволов, оттачивают технику вмешательств на перфорантах, исследуют возможности их склерозирования или термооблитерации.
Вместе с тем в описанной выше общей схеме патогенеза можно обнаружить весьма существенный недостаток. Внимательный, непредвзятый взгляд на роль перфорантного рефлюкса в патогенезе показывает, что неоспоримых доказательств значения несостоятельности ПВ практически нет. Мы хотим представить и проанализировать как хорошо известные, так и относительно недавно опубликованные данные, касающиеся этой проблемы.
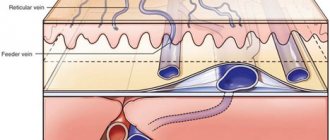
История изучения, анатомические и функциональные особенности перфорантных вен
Первым ученым, продемонстрировавшим наличие ПВ на нижних конечностях, был Х.И. Лодер, российский анатом [17]. Вслед за ним на протяжении полутора столетий изучением анатомии ПВ занимались десятки исследователей, подробно описавших их морфологические характеристики [18-24]. ПВ соединяют поверхностные и глубокие вены нижних конечностей и в норме направляют ток крови из первых в последние. Они называются перфорантными, так как перфорируют мышечную фасцию. ПВ часто дублируются. Параллельно с ПВ проходит маленькая артерия [25]. Перфоранты обладают клапанами (от 1 до 4), которые располагаются главным образом в субфасциальном отрезке сосуда [22]. Количество перфорантов на каждой нижней конечности весьма велико. Одной из первых и наиболее полных работ по этой проблеме является исследование, проведенное отечественным хирургом И.А. Костромовым [26]. Он обнаруживал до 112 перфорантов на одной нижней конечности. Эти данные были подтверждены и другими работами [27].
Локализация ПВ является достаточно постоянной, что нашло свое отражение в длительно существовавших наименованиях наиболее значимых из них по именам авторов, подробно описавших их месторасположение. Вместе с тем современными согласительными документами не рекомендовано использование в практике именных названий этих сосудов [28]. В основу нынешней классификации ПВ положен территориально-анатомический принцип. Согласно ему, ПВ нижних конечностей могут быть разделены на шесть групп: ПВ стопы, области голеностопного сустава, голени, области коленного сустава, бедра и околоягодичной зоны [29].
С клинической точки зрения наибольшее значение имеют перфоранты, располагающиеся на голени, в подколенной ямке и на бедре [30]. Самыми известными для клиницистов являются ПВ медиального отдела голени, которые долгие годы называли перфорантами Коккетта. К ним относят четыре вены, имеющие весьма постоянную локализацию и соединяющие притоки большой подкожной вены (БПВ) с задними большеберцовыми венами. Именно рефлюкс по данным ПВ традиционно признается одной из основных причин варикозного расширения вен и последующих трофических расстройств, в связи с чем большинство хирургических методик предназначено для ликвидации этих сосудов [20].
В верхней трети голени по медиальной поверхности расположены паратибиальные ПВ, также называемые венами Шермана и Бойда. Они соединяют БПВ с задними большеберцовыми венами. Появление в этой зоне варикозно-расширенных вен также зачастую связывают с перфорантным рефлюксом [30].
На бедре с клинической точки зрения интересны прежде всего перфоранты бедренного канала (также называемые ПВ Додда или Хантера), соединяющие БПВ с поверхностной бедренной веной. У некоторых пациентов эти ПВ не имеют связи с БПВ [31].
В функциональном отношении ПВ играют важную роль в направлении крови из поверхностной венозной сети в глубокие вены с помощью своих клапанов [32]. При сокращении мышц (мышечная систола), когда происходит быстрое значительное увеличение давления, клапаны в ПВ закрываются, что предотвращает ток крови из глубокой в поверхностную систему. Во время мышечного расслабления (диастола) давление снижается и клапаны в ПВ открываются, обеспечивая дренаж крови из поверхностной в глубокую систему. Ток крови в интактной ПВ в направлении от поверхностных вен к глубоким долгое время считался аксиомой. И.А. Костромов в 1951 г. сообщил о том, что от 3 до 10% исследованных им интактных ПВ на бедре и голени были бесклапанными, а значит кровоток по ним мог осуществляться в обоих направлениях. Вместе с тем автор [26] также отметил, что при наличии клапанов в ПВ они всегда были ориентированы таким образом, чтобы ток крови происходил в направлении глубоких вен. В исследованиях R. Bjordal [33, 34] также продемонстрировано наличие двунаправленного тока крови в ПВ, но уже у пациентов с первичным варикозным расширением вен. Появление в клинической практике ультразвуковой визуализации позволило наблюдать двунаправленный ток крови по ПВ в реальном масштабе времени как у пациентов с венозной патологией [35, 36], так и у здоровых лиц [36, 37]. Тем не менее есть исследователи, которые не считают возможным существование подобного кровотока по перфорантам в норме [35].
Недостаточность перфорантных вен
Первым ученым, высказавшим мнение о патогенетическом значении недостаточности перфорантных вен, по-видимому, стал R. Linton [23]. Он обследовал больных с трофическими расстройствами и сделал вывод, что в их развитии важная роль принадлежит горизонтальному венозному рефлюксу. Следует сказать, что исследования R. Linton были посвящены посттромботической болезни. Тем не менее идея была подхвачена специалистами из многих стран мира и в результате перфорантный рефлюкс был признан причиной не только трофических расстройств при посттромботической болезни, но и первичного варикозного расширения вен [12, 26, 38, 39]. Опубликованы десятки работ, посвященные перфорантному рефлюксу. Основными проблемами, интересовавшими специалистов, стали методы выявления и критерии несостоятельности ПВ, а также поиск эффективных способов ликвидации перфорантного сброса.
Клиническая диагностика несостоятельности ПВ.
Патогномоничных клинических признаков, позволяющих установить факт рефлюкса по ПВ и точно ее локализовать, не найдено. Ориентация на расположение конгломератов расширенных вен и данные функциональных проб (трехжгутовая Шейниса, Тальмана, Пратта-2) [40] долгое время были основными диагностическими критериями, но, с позиций современных требований к научным данным, эти способы не имеют доказательной базы.
Еще одним методом выявления перфорантного рефлюкса служила пальпация дефектов фасции голени, сопровождающаяся болезненными для пациента ощущениями при наличии недостаточной ПВ [14, 26, 41]. Вместе с тем доказательств точности этого способа также не существует [42, 43], в частности не было проведено сравнительных исследований с наиболее точным способом локализации ПВ, которым служит ультразвуковое сканирование.
Рентгеноконтрастная флебография в диагностике несостоятельности ПВ.
Восходящая флебография и варикография были первыми инструментальными методами обнаружения перфорантного рефлюкса, который проявляется проникновением контраста из глубокой системы в поверхностную. По данным ряда авторов [44-47], с помощью рентгеноконтрастного исследования можно выявить от 65 до 90% имеющихся несостоятельных ПВ.
Ультразвуковое ангиосканирование в диагностике несостоятельности ПВ.
В последние годы этот метод стал ведущим в диагностике перфорантного рефлюкса. С его помощью могут быть визуализированы ПВ, измерен диаметр вен и описано направление кровотока [36]. Единственные затруднения возникают при визуализации и определении тока крови в ПВ диаметром менее 1 мм, хотя до конца неизвестно, являются ли ПВ этого размера клинически или гемодинамически значимыми. Точность диагностики перфорантного рефлюкса по наиболее гемодинамически значимым ПВ медиальной группы соизмерима с флебографией [48]. E. Pierik и соавт. [49] обследовали 42 пациента с венозными язвами и сообщили о 100% специфичности и 79% чувствительности дуплексного исследования.
Радиоизотопная флебосцинтиграфия в диагностике несостоятельности ПВ.
В арсенале современной флебологии имеется еще один малоинвазивный, безопасный и высокоинформативый метод выявления нарушений венозного кровообращения — радионуклидная флебосцинтиграфия. Метод получил развитие в работах клиники В.С. Савельева [50], показавших огромное значение методики в выявлении несостоятельных ПВ. Достоинством радиофлебографии служит возможность регистрации движения изотопа с естественным кровотоком в момент имитации пациентом ходьбы. Это позволяет выявлять и локализовывать перфорантный сброс.
Критерии несостоятельности ПВ.
Этот вопрос во многом является ключевым, поскольку имеет непосредственное влияние как на формирование взглядов на развитие варикозной болезни, так и на хирургическую тактику. В доультразвуковую эру, когда ведущим диагностическим методом была рентгеновская флебография, критерием считали визуализацию ПВ и связанное с движением крови по ним контрастирование подкожных вен. Аналогичный критерий используют и при проведении радиоизотопной флебографии [51]. Значительные надежды возлагались на появившееся в арсенале флебологов в конце 80-х годов прошлого столетия ультразвуковое ангиосканирование, которое позволяет визуализировать ПВ и определить направление движения крови по ней. Тем не менее, несмотря на многолетнюю историю изучения анатомии и функции ПВ, ученым так и не удалось прийти к общему мнению о том, на основании каких признаков можно считать несостоятельной ПВ [36, 37, 52-54].
Наиболее часто используют три критерия — наличие рефлюкса, его продолжительность и диаметр сосуда. Поскольку сегодня доминирующее положение среди диагностических методов во флебологии занимает ультразвуковое ангиосканирование, то оценка упомянутых признаков происходит в момент проведения этого исследования.
Наличие рефлюкса, на первый взгляд, является наиболее достоверным критерием недостаточности ПВ. Показано, что количество ПВ с рефлюксом увеличивается при прогрессировании хронического заболевания вен [35, 37, 55].
Продолжительность рефлюкса как критерий недостаточности варьирует от 0,3 с [56] до 1 с [57], однако большинство авторов [55, 58-61] считают признаком несостоятельности ПВ рефлюкс более 0,5 с.
Что касается диаметра, то некоторые авторы [23, 36, 37, 53, 59] считают определенный диаметр признаком несостоятельности ПВ. К тому же в ряде исследований [35, 55, 59] показано, что несостоятельные ПВ имеют больший диаметр по сравнению с интактными сосудами. Вместе с тем многие специалисты [57, 62] обоснованно полагают, что диаметр не может служить критерием несостоятельности ПВ, указывая как на определенную субъективность оценки диаметра вены, так и на тот факт, что ПВ большого диаметра (0,6-0,7 см) зачастую компетентны, а вены небольшого диаметра (0,2-0,3 см) могут быть недостаточными.
Предложены также другие критерии, характеризующие недостаточность ПВ: в проспективном исследовании 265 ПВ на 90 конечностях с помощью ультразвукового дуплексного сканирования K. Delis [55] заключил, что критериями определения недостаточности перфорантов являются не только диаметр и наличие рефлюкса, но и максимальная и средняя скорость, объем потока, время до достижения максимальной скорости и венозный объем, перемещенный в поверхностную систему. Подобные критерии не нашли сторонников в силу громоздкости и заметной субъективности такой оценки.
Частота выявления несостоятельности ПВ.
Данные о том, насколько часто у пациентов с ВБНК обнаруживают несостоятельность ПВ, заметно различаются в разные исторические периоды. В эпоху, когда «золотым» диагностическим стандартом признавали рентгенофлебографию, недостаточные перфоранты выявляли у подавляющего (80-90% и более) большинства пациентов [63]. С внедрением в практику ультразвукового ангиосканирования ситуация поменялась, несостоятельность ПВ стали фиксировать реже — от 3,3% при клиническом классе С1 до 30% при классе С2 [7, 8, 62].
Исследования [35, 37, 55] последних лет продемонстрировали, что с нарастанием тяжести заболевания увеличивается и частота выявления недостаточных ПВ. По данным Ю.А. Белькова и соавт. [64], частота гемодинамически значимого рефлюкса в ПВ при различных клинических классах хронических заболеваний вен составляет от 33 до 85%. Исследование, проведенное сотрудниками клиники В.С. Савельева [62], показало, что у пациентов с трофическими расстройствами (классы С4-С5) при ВБНК частота выявления несостоятельных ПВ достигает 100%, но, с другой стороны, при неосложненном течении заболевания (класс С2) перфорантный рефлюкс фиксируется только в 28% случаев.
Недостатки и ограничения инструментальных методов диагностики несостоятельности ПВ.
Нельзя не упомянуть о принципиальных недостатках ультразвукового ангиосканирования, которые имеют существенное значение при оценке состояния ПВ. При исследовании проводится оценка кровотока лишь на небольшом отрезке венозного русла и на протяжении незначительного промежутка времени [62]. Таким образом, при получении достаточно детальной анатомической информации о ПВ интегративная оценка ее функции практически невозможна. Предлагаемая техника сканирования ПВ в вертикальном положении пациента во время сокращения-расслабления им икроножных мышц (имитация ходьбы) в некоторой степени нивелирует указанный недостаток ультразвукового сканирования [62, 65], и все же при этом более точно фиксируется лишь факт двунаправленного кровотока по ПВ. Гемодинамическое значение же перфорантного рефлюкса с помощью ультразвукового ангиосканирования установить невозможно.
В равной степени этот недостаток присущ и рентгеноконтрастной флебографии — она фиксирует несостоятельность ПВ лишь в отдельный промежуток времени. Кроме того, это исследование [14] травматично, сопровождается значительным количеством осложнений и в настоящее время практически исключено из диагностического арсенала при хронических заболеваниях вен.
В отличие от этих двух способов радиофлебография позволяет фиксировать именно функцию ПВ, поскольку во время исследования происходит регистрация движения изотопа с кровотоком на протяжении довольно длительного промежутка времени в процессе практически точной имитации пациентом ходьбы [50]. Вместе с тем условия, в которых проводят исследования, нельзя назвать в полной мере физиологическими — над лодыжкой пациента накладывают жгут, изменяя тем самым условия гемодинамики в исследуемом сегменте (голень). Кроме того, с помощью радиофлебографии сложно точно локализовать несостоятельные ПВ, что затрудняет использование метода для картирования перфорантов в хирургической практике.
Методы коррекции недостаточности перфорантных вен
Разработка методов хирургической коррекции несостоятельности ПВ связана с именем R. Linton [23], который предложил проводить их диссекцию через продольный разрез большой длины по медиальной поверхности голени. Это вмешательство получило его имя [14, 66-68]. D. Felder и соавт. [69] в 1955 г. модифицировали вмешательство, предложив выполнять перевязку ПВ из доступа по задней поверхности голени. Этот вариант за счет удаления разреза от трофически измененных тканей позволил уменьшить частоту гнойно-некротических осложнений [66]. Операция Линтона в модификации Фельдера широко применялась во многих флебологических и хирургических центрах мира и стала одной из самых известных во флебохирургии [14, 68]. Вместе с тем высокая частота тяжелых гнойно-некротических осложнений привела к постепенному отказу от ее применения [70].
F. Cockett [20] предложил выполнять не суб-, а надфасциальную перевязку ПВ в нижней и средней трети голени по внутренней поверхности. Однако поиск ПВ в подкожной клетчатке при выраженных трофических изменениях травматичен, вызывает значительные технические трудности, поэтому нередко сопровождался послеоперационным некрозом краев раны и ее нагноением [9, 66], в связи с чем от применения этого вмешательства также пришлось отказаться. Тем не менее, претерпев определенную трансформацию, оно осталось в хирургической практике в виде надфасциального лигирования перфорантов из отдельных небольших разрезов и по-прежнему используется многими врачами. Именно такой вариант известен отечественным хирургам как операция Коккетта, хотя это и не совсем точное наименование.
В 1985 г. G. Hauer [71] впервые опубликовал работу, посвященную эндоскопической диссекции ПВ
. Он использовал медиастиноскоп или жесткий проктоскоп для введения инструментов под собственную фасцию голени. Позднее методика была усовершенствована, разработаны специальные эндоскопы и инструменты для выделения и пересечения ПВ [72, 73]. Преимуществами способа являются значимо меньшее количество осложнений, рубцы небольшого размера и более короткий период пребывания больного в стационаре [56, 58, 74, 75]. Частота раневых осложнений составляет 4-26% [76, 77]. Послеоперационный тромбоз глубоких вен возникает редко [74]. Могут также развиться боль (1,5%) и парестезии (6%) после операции, особенно при использовании электрокоагуляции в субфасциальном пространстве [78]. Сообщалось о единичных случаях ятрогенных язв [79] и артериовенозных фистул [80].
Эндоскопическая диссекция ПВ считается эффективной у больных с венозными трофическими язвами (от 84 до 100% заживления язв и 0-22% рецидивов в течение 2 лет) [56, 81-84].
Методы эндовазальной лазерной и радиочастотной облитерации
появились в клинической практике в конце 90-х годов прошлого века. Они представляют собой миниинвазивные амбулаторные процедуры, требующие только местной анестезии. Первоначальной областью их применения стало устранение рефлюкса по большой или малой подкожным венам [85-89].
В последние годы появились сообщения о возможности применения лазерной и радиочастотной методик для облитерации ПВ. Для этого производителями были разработаны дополнительные аксессуары, которые позволяют пунктировать и облитерировать сосуды небольшого калибра и длины, т.е. ПВ [90]. Преимуществом такого подхода считают отсутствие необходимости выполнения какого-либо разреза вообще (требуется только чрескожная пункция), что сводит травматичность до минимума. Тем не менее вмешательство пока не получило распространения, возможно, из-за технической его сложности (не всегда удается быстро, легко и, главное, точно пунктировать столь малый сосуд, как ПВ) и необходимости использования дорогостоящего оборудования и расходных средств. Помимо этого, существует еще менее травматичный и значительно более экономичный альтернативный метод облитерации ПВ — склеротерапия.
Флебосклерозирование
давно используют многие врачи для ликвидации несостоятельных ПВ [31, 91-93], но к настоящему времени отсутствует общая точка зрения на эффективность и роль этой методики [93-95].
Одним из пионеров склерозирования перфорантов стал W. Fegan [96], разработавший технику «пустой» вены, заключавшуюся в том числе и в облитерации несостоятельных перфорантов, локализация которых определялась исключительно визуально и пальпаторно. Опыт автора был огромен, а авторитет непререкаем, тем не менее следует признать, что с научной точки зрения его данные недостаточно обоснованы — судить о точности инъекций в ПВ без ультразвукового контроля невозможно, так же как и оценить отдаленные результаты.
Оценивая эффективность склерозирования ПВ, нужно признать, что качественных исследований [28, 61, 97], посвященных этой проблеме, крайне мало. Было проведено два проспективных исследования склеротерапии несостоятельных ПВ под ультразвуковым контролем. P. Thibault и W. Lewis [98] склерозировали ПВ у 36 пациентов 0,5-1,0 мл 3% тетрадецилсульфата натрия. В 15% случаев возникла необходимость в проведении повторных инъекций. Компрессию применяли в течение 4 нед. Через 6 мес от 73 до 100% перфорантов были облитерированы. Наилучшие результаты были достигнуты при инъекции в недостаточные ПВ голени. Авторы сделали вывод, что требуются дальнейшее усовершенствование технически сложной процедуры и разработка устройства для игольного проводникового зонда, позволяющего достичь точной локализации конца иглы на глубине от 0,5 до 3 см. Осложнений (тромбоз глубоких вен, легочная эмболия или внутриартериальное введение) не отметили.
В другом открытом проспективном исследовании, выполненном M. Schadeck [99], 3% тетрадецилсульфат натрия использовали у 51 пациента. В первую очередь склерозировали подкожные вены. Наблюдение в срок от 1 до 7 мес показало 92% благоприятных исходов при одном проведенном сеансе. Компрессию не применяли. В 40% случаев наблюдали такие осложнения, как покраснение, боль или уплотнение. Не отмечено ни одной интраартериальной инъекции, венозного тромбоза или повреждений нервов.
J.-J. Guex [100] сообщил о достижении окклюзии ПВ в 90% случаев при трех или менее сеансах терапии. Вены с диаметром более 8 мм, по его мнению, устойчивы к склерозирующему воздействию. По мнению J.-J. Guex, дальнейшие исследования должны включать измерения диаметра и длительности рефлюкса до и после процедуры, плетизмографическую оценку терапии.
Осложнения склеротерапии ПВ идентичны таковым при облитерации подкожных вен: гиперпигментация, флебит, некроз, аллергические реакции, интраартериальные инъекции [101]. Вопреки упоминаемой многими авторами [102] опасности попадания в сопровождающую перфорант артерию такие осложнения при склерозировании ПВ более редки.
Очевидно, что возможности склерозирования ПВ нуждаются в тщательном дальнейшем изучении. Неизвестны отдаленные результаты этих манипуляций [100], поскольку большинство исследователей [103] сообщают лишь о коротких периодах наблюдения.
Что касается отдаленных результатов
хирургического устранения недостаточных ПВ, то если оставить в стороне склеротерапию, которая принципиально не может обеспечить стойких отдаленных результатов, и современные методики термооблитерации, которые с этой целью используются редко и не так давно, то можно рассмотреть эффективность только традиционных или эндоскопических вмешательств. Однако при анализе данных литературы обращает на себя внимание их крайняя скудость. Как правило, оценивается результат лечения в целом, либо, если идет речь о рецидивах заболевания, то авторы сообщают, что некоторый процент случаев был связан с перфорантным рефлюксом. Это не позволяет прийти ни к каким корректным выводам, поскольку обычно не сообщается об исходной частоте выявления недостаточности ПВ. Лишь в исследованиях, посвященных эндоскопической субфасциальной диссекции ПВ, можно обнаружить сведения, подходящие для анализа, — этот способ применяют лишь при несомненно имеющемся перфорантном рефлюксе. J. Sybrandy и соавт. [56] обнаружили большое количество новообразованных ПВ спустя 4 года после эндоскопической диссекции. Это может показаться достаточно необычным, так как более логичным объяснением были бы погрешности операции — вены не обнаружили и не лигировали. Тем не менее такую точку зрения подтверждают А.Г. Хитарьян и соавт., обнаружившие новообразование ПВ после классических вмешательств Линтона-Фельдера [104]. Ряд авторов [105] объясняют сохранение и выявление ПВ в отдаленном периоде после эндоскопического вмешательства, помимо возможных технических ошибок, также расширением состоятельных на момент операции, а следовательно, и не лигированных вен. А.И. Кириенко и соавт. отметили любопытный факт — несмотря на формально не вполне удовлетворительные результаты (несостоятельные ПВ нашли на 50% оперированных конечностей), клинические результаты лечения были в большинстве наблюдений хорошими. О похожем сообщает А.В. Андрияшкин [106], который выявил несостоятельные ПВ более чем у 90% больных с рецидивом ВБНК перед операцией, а спустя 1 год после нее, при очевидных успешных результатах, ПВ обнаружили при контрольном ультразвуковом исследовании в 38% случаев.
Подобные наблюдения заставляют задуматься, во-первых, о возможностях хирургического устранения ПВ, а, во-вторых, о патогенетической обоснованности и целесообразности этих вмешательств.
Противоречия в теории патогенетического значения перфорантного сброса при варикозной болезни
Уже в конце 80-х — начале 90-х годов прошлого века многие ученые стали задаваться вопросом о том, насколько соответствует мнение о патогенетической значимости несостоятельности ПВ действительному положению вещей. При этом под сомнение ставится не сам факт наличия перфорантного сброса — несостоятельность ПВ у больных с варикозной болезнью несомненно развивается. Речь идет о том, может ли перфорантный рефлюкс быть причиной варикозной болезни или это лишь ее следствие, а значит, нужно ли проводить хирургические вмешательства на ПВ [53, 107].
У сторонников последней версии, считающих, что расширение ПВ — компенсаторный механизм [108], обеспечивающий возврат нарастающих при варикозной трансформации объемов крови в глубокую венозную систему, есть несколько весьма серьезных аргументов.
Первый — нет доказательств того, что лигирование ПВ способствует улучшению результатов хирургического лечения. Поскольку операция при варикозной болезни включает помимо перевязки ПВ устранение несостоятельных стволов и их притоков, то говорить о том, что устранение перфорантного сброса привело к более благоприятным результатам лечения, нельзя [41, 70, 109-111].
Выходом могло бы стать проведение изолированной диссекции ПВ у больных с ВБНК с последующей оценкой эффекта, но, очевидно, что такой эксперимент вряд ли решится поставить кто-либо из клиницистов, дорожащих своей репутацией, — совершенно ясно, что невозможно выполнить вмешательство, оставив у пациента с ВБНК несостоятельный ствол и притоки. Тем не менее в ряде исследований были получены данные, свидетельствующие, что селективное лигирование ПВ при отсутствии глубокого венозного рефлюкса не улучшает венозную гемодинамику [12, 113], что в определенной степени ставит под сомнение патогенетическую значимость ПВ. Некоторые работы [87, 114-116] показали отсутствие статистически значимого улучшения венозной функции после лигирования перфорантов у пациентов с посттромботической болезнью, хотя это также может служить лишь косвенным подтверждением первого аргумента.
Поскольку упомянутый выше дизайн исследования принципиально невозможен, специалисты, стремившиеся определить истинную роль несостоятельности ПВ, пошли «от обратного», получив в результате в свои руки второй важный аргумент — изолированное удаление патологически измененных подкожных вен приводит к исчезновению рефлюкса в бывших на момент операции несостоятельными, но оставшихся неперевязанными перфорантах [109, 117-120]. Устранение патологической венозной емкости снижает гемодинамическую нагрузку на ПВ, которые в результате возвращаются к своему нормальному состоянию.
Рассудить сторонников и противников теории «виновности» перфорантов, если смотреть с позиций современной доказательной медицины, могут рандомизированные исследования, в которых одним пациентам будут лигировать ПВ, другим — нет. Такую работу провели R. Fitridge и соавт. [112]. Они обследовали 38 конечностей пациентов ВБНК с недостаточностью БПВ и перфорантов голени, но без признаков недостаточности глубоких вен. Проводили перевязку сафенофеморального соустья, экстирпацию БПВ и удаление всех видимых варикозно-расширенных вен. Пациентам рандомизированно проводили перевязку несостоятельных перфорантов или они оставлялись интактными. Гемодинамическую функцию оценивали с помощью воздушной плетизмографии перед операцией и через 2 мес после нее. Не было показано никаких значимых гемодинамических различий между двумя группами. Исследователи сделали вывод о том, что нет никакого дополнительного гемодинамического преимущества перевязки перфорантов у пациентов с неосложненной варикозной болезнью за период последующего наблюдения, равный 3 мес. Следует отметить, что количество включенных в исследование пациентов было небольшим, а период последующего наблюдения — коротким.
И, наконец, третьим аргументом служит тот факт, что частота выявления несостоятельных ПВ увеличивается с нарастанием клинического класса заболевания [62, 64]. По мнению исследователей, получивших такие данные, это свидетельствует о вторичности изменений перфорантов — чем более выражена варикозная трансформация подкожных вен, тем большая гемодинамическая нагрузка ложится на ПВ, которые в результате расширяются и закономерно становятся несостоятельными.
Безусловно, все приведенные аргументы могут служить лишь косвенным свидетельством того, что несостоятельность ПВ при варикозной болезни не имеет того значения, которое ей принято придавать. Тем не менее эти данные нельзя игнорировать.
Завершая обзор данных литературы о недостаточности ПВ, необходимо сказать, что в этой, казалось бы, полностью изученной области флебологии вопросов сохраняется больше, чем ответов, и проблема кажется очень далекой от своего разрешения. Прежде всего отсутствуют веские доказательства патогенетического значения несостоятельности ПВ при варикозной болезни, а появляющиеся косвенные свидетельства говорят скорее об обратном — об отсутствии такого значения. Эффективность вмешательств, направленных на ликвидацию несостоятельности ПВ, невысока, а целесообразность выполнения их все чаще ставится под сомнение. Назрела насущная необходимость прицельного исследования данной проблемы с позиций наших сегодняшних знаний о ПВ и их физиологии и с учетом возможностей современной инструментальной диагностики.