Учитывая то, что сегодня, по статистике, заболевания сердечно-сосудистой системы лидируют среди причин летального исхода в цивилизованных странах, не удивительно, что повышенный интерес вызывает не только основные их разновидности, а также любая терминология, касающаяся данной темы, и все патологические процессы, происходящие в сердечной мышце. Относится к таким вопросам и гипертрофия миокарда левого желудочка, в особенности: от чего начинается ее развитие и возможно ли остановить патологический процесс?
Общие сведения о патологии
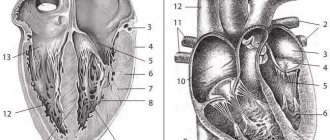
По сути, гипертрофия миокарда левого желудочка сердца — это патология, характеризующаяся увеличением массы сердечной мышцы в результате постоянно повышенного давления у пациента (можно сказать, что это «дополнительный недуг гипертоников»).
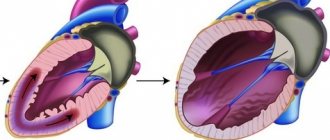
Интересно, что изначально, это не заболевание, а просто защитная реакция организма на слишком частое повышение артериального давления. Затем, гипертрофия приводит к утолщению массы стенок желудочков, а также, к видоизменению перегородки. В связи с этим происходит снижение эластичности стенки, а утолщение может касаться как определенных участков, так и проходить равномерно.
Для более наглядного представления, такой процесс можно рассмотреть на примере рук: мышцы, реагируя на постоянно повышающуюся нагрузку, постепенно утолщаются и увеличиваются в размерах. То же самое происходит и с сердечной мышцей, но только, если для бицепсов этот процесс желателен и полезен, то для миокарда – наоборот. Проблема в том, что сосуды не способны расти также быстро, и, следовательно, они не смогут обеспечить клеткам достаточное количество кислорода и питательных веществ, что впоследствии приведет к кислородному голоданию.
Хочу уточнить стоимость лечения
Симптомы
Как правило, данная патология обнаруживается случайно, в процессе проведения ЭКГ или Эхо-КГ. Специалисты выделяют такие основные признаки гипертрофии миокарда:
- стенокардию;
- мерцательную аритмию;
- повышенное артериальное давление;
- общую слабость, плохое самочувствие.
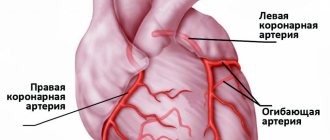
Развитие стенокардии происходит в результате сжатия сосудов, обеспечивающих необходимым питанием сердечную мышцу. В конечном итоге происходит увеличение мышцы в размерах. Она начинает потреблять больше кислорода в комплексе с питательными веществами. У пациентов, страдающих от гипертрофии миокарда сердца, также может возникать состояние, в процессе которого замирает сердце на несколько мгновений (не бьется вообще). В этом случае человек теряет сознание.
Получить бесплатную консультацию Консультация ни к чему Вас не обязывает
Диагностика
Как правило, заболевание выявляется при ультразвуковом исследовании. МРТ сердца считается наиболее простым, информативным методом. В определенных случаях заболевание диагностируют при помощи ЭКГ. К дополнительным исследованиям относят: вентрикулографию, коронарографию, а также радиоизотопное исследование.
Профилактика
К числу эффективных профилактических действий по предотвращению развития заболевания относят:
- изменение образа жизни: отказ от курения, употребления алкогольных напитков;
- борьбу с факторами риска: нормализацию массы тела, артериального давления;
- контроль препаратами иперлипидемии и гипертонии (если при коррекции образа жизни отсутствует результат).
В случае контроля препаратами удается поддерживать нормальный уровень сахара, а также контролировать остальные факторы риска, возникающие при сахарном диабете. Соблюдение таких профилактических мер позволяет избегать развития гипертрофии миокарда сердца.
Виды гипертрофии
В зависимости от соотношения индекса массы желудочка и относительной толщины его стенок, гипертрофические изменения разделены на следующие виды (классификация A.Ganau):
- эксцентрическая гипертрофия миокарда левого желудочка (ей характерна нормальная толщина стенки и увеличенный индекс массы желудочка);
- концентрическая гипертрофия миокарда левого желудочка(оба показателя увеличены);
- концентрическое ремоделирование левого желудочка (толщина стенки увеличена, при этом индекс массы желудочка остается нормальным);
- нормальный размер желудочка.
Следующее разделение происходит по формам, согласно чему может быть симметричная гипертрофия миокарда левого желудочка (она же концентрическая) и ассиметричная (в левом желудочке гипертрофирована нижняя, средняя или верхняя часть, перегородка).
Как приехать на лечение
Гипертрофия левого желудочка неясной этиологии
С.В. Моисеев. Гипертрофия левого желудочка (ГЛЖ) часто встречается в практике кардиолога. Она может быть заподозрена на основании ЭКГ, однако более надежными методами оценки массы миокарда являются эхокардиография и особенно магнитно-резонансная томография (МРТ). При эхокардиографии критерием ГЛЖ считают увеличение индекса массы миокарда левого желудочка, соответственно, >115 г/м2 у мужчин и >95 г/м2 у женщин (с поправкой на площадь поверхности тела) или >50 г/м2,7 у мужчин и >47 г/м2,7 у женщин (с поправкой на рост) [1], а при МРТ – >85 г/м2 у мужчин и >81 г/м2 у женщин [2]. В зависимости от относительной толщины стенки (ОТС) левого желудочка [(2 × толщина задней стенки)/ конечный диастолический размер левого желудочка] выделяют концентрическую (ОТС≥0,43) и эксцентрическую (ОТС<0,43) ГЛЖ. Учитывая возможную неоднородность утолщения левого желудочка, в частности асимметричное увеличение толщины межжелудочковой перегородки или верхушки левого желудочка, при диагностике ГЛЖ следует учитывать увеличение толщины перегородки или стенки ≥12 мм.
У подавляющего большинства пациентов причиной ГЛЖ является перегрузка сердца давлением или объемом при артериальной гипертонии или пороках сердца, прежде всего аортальных, однако у части больных очевидные причины ГЛЖ отсутствуют. Распространенность необъяснимой ГЛЖ у взрослых в общей популяции составляет 0,02-0,23% [3]. Отсутствие явных причин гипертрофии миокарда обычно служит основанием для установления диагноза гипертрофической кардиомиопатии (ГКМП), хотя у 5-10% пациентов ГЛЖ неясной этиологии обусловлена другими генетическими и негенетическими заболеваниями, в том числе лизосомными болезнями накопления (болезни Фабри, Данона, Помпе), ATTR- и AL-амилоидозом, нейромышечными заболеваниями (атаксия Фридрейха), митохондриальными кардиомиопатиями и др. Своевременная диагностика некоторых из них, в частности болезней Фабри и Помпе, AL- и ATTR-амилоидоза, имеет важное практическое значение, учитывая возмож ность патогенетического лечения. При проведении дифференциального диагноза следует учитывать возраст пациента, выраженность ГЛЖ и клинических симптомов, наличие семейного анамнеза и различных экстракардиальных проявлений. Некоторые генетические заболевания, например, болезнь Фабри и ATTR-амилоидоз, иногда удается диагностировать только с помощью скрининговых исследований. Ниже будут рассмотрены наиболее распространенные причины ГЛЖ неясной этиологии.
Е.В. Привалова. ГКМП – это наследственное заболевание, которое передается по аутосомно-доминантному типу [4]. В соответствии с рекомендациями Евро пейского общества кардиологов 2014 г., ГКМП может быть диагностирована при наличии гипертрофии миокарда ≥15 мм по крайней мере в одном сегменте левого желудочка, которую нельзя объяснить другими причинами, а у родственников пациента с установленным диагнозом – при наличии гипертрофии миокарда ≥13 мм [3]. Гипертрофия миокарда при ГКМП может быть как асимметричной (рис. 1), так и симметричной. У 4060% пациентов с ГКМП определяются мутации генов, кодирующих белки саркомеров сердца, прежде всего тяжелой цепи бета-миозина (MYH7) и миозин-связывающего белка С (MYBPC3). Реже встречаются мутации генов, кодирующих тропонины I и T (TNNI3, TNNT2), α1-цепи тропомиозина (TPM1) и легкой цепи миозина 3 (MYL3). В целом у пациентов с мутациями генов саркомерных белков выше частота семейного анамнеза ГКМП и внезапной смерти и отмечаются более выраженные ГЛЖ и миокардиальный фиброз, чем у пациентов без мутаций [5]. При обследовании пациента важно оценить наличие обструкции выносящего тракта левого желудочка [6]. Критерием ее является градиент давления в выносящем тракте, который измеряют допплеровским методом, ≥30 мм рт. ст. в покое или после провокационных проб (проба Вальсальвы, физическая нагрузка). Гемодинамически значимым считают увеличение этого показателя ≥50 мм рт. ст. [3].
Рис. 1. Выраженнаяасимметричная гипертрофия межжелудочковой перегородки при ГКМП
В.Ю. Каплунова. Пациент К., 45 лет, обследован в клинике госпитальной терапии имени А.А. Остроумова в октябре 2021 г. Старший брат пациента внезапно умер в возрасте 54 лет. ГКМП была диагностирована у другого брата, умершего в возрасте 54 лет, и 29-летней дочери пациента. С 18-летнего возраста у больного выслушивался систолический шум по левому краю грудины при отсутствии клинических проявлений и хорошей переносимости физической нагрузки. В возрасте 27 лет появились одышка, сердцебиение, перебои в работе сердца, головокружение и дурнота, дискомфорт в области сердца при умеренной физической нагрузке. В возрасте 33 лет обнаружена асимметричная ГЛЖ (толщина межжелудочковой перегородки – 20 мм, задней стенки – 12 мм) с признаками обструкции выносящего тракта левого желудочка и градиентом давления в покое 45 мм рт. ст. Диагностирована обструктивная форма ГКМП. С 44-летнего возраста отмечает пароксизмы фибрилляции предсердий с последующим переходом аритмии в постоянную форму. При эхокардиографии было выявлено нарастание гипертрофии межжелудочковой перегородки до 31 мм и увеличение градиента давления до 94 мм рт. ст. в покое. В Научном центре сердечно-сосудистой хирургии им. А.Н. Баку ле ва выполнена миэктомия доступом из правого желудочка, которая привела к уменьшению степени обструкции выносящего тракта левого желудочка и диастолической дисфункции. При молекулярно-генетическом исследовании у пробанда и его дочери выявлена миссенс мутация в 22 экзоне гена, кодирующего тяжелую цепь β миозина (MYHT A870C).
Представленное наблюдение иллюстрирует типичные проявления и течение ГКМП: асимметричная гипертрофия межжелудочковой перегородки, которая была выявлена в молодом возрасте, медленно нарастала и длительное время не сопровождалась клиническими симптомами, в частности застойной сердечной недостаточностью, обструкция выносящего тракта левого желудочка с высоким градиентом давления в его полости, семейный анамнез (диагноз ГКМП и/или случаи внезапной сердечной смерти у близких родственников), мутация гена, кодирующего саркомерный белок, которая была обнаружена как у пробанда, так и его дочери. Лечение ГКМП обычно начинают с β-адреноблокаторов, не обладающих вазодилатирующей активностью, которые уменьшают градиент давления в полости левого желудочка и клинические симптомы. При их неэффективности могут быть использованы дизопирамид или верапамил. При выраженной гипертрофии межжелудочковой перегородки и высоком градиенте давления в левом желудочке может быть выполнена миэктомия, которая более чем в 90% случаев позволяет ликвидировать или значительно уменьшить обструкцию выносящего тракта, улучшить переносимость физической нагрузки и выживаемость [7].
Е.В. Привалова. Дифференциальная диагностика ГКМП с другими заболеваниями, сопровождающимися ГЛЖ, может представлять трудности, например, при наличии умеренной гипертрофии миокарда, особенно симметричной, не сопровождающейся обструкцией выносящего тракта левого желудочка, и при отсутствии семейного анамнеза. Мутации генов саркомерных белков определяются не у всех пациентов с ГКМП, а у части больных с необъяснимой ГЛЖ молекулярно-генетическое исследование не проводится по экономическим причинам. Следует учитывать, что асимметричная гипертрофия межжелудочковой перегородки, характерная для ГКМП, встречается и при других заболеваниях, в том числе вторичной гипертрофии миокарда при артериальной гипертонии. Причиной ГЛЖ могут быть не только перегрузка левого желудочка давлением, но и физические тренировки, хотя в крупном исследовании увеличение толщины стенки левого желудочка более 12 мм было выявлено всего у 1,7% из 947 спортсменов, занимающихся различными видами спорта, а толщина стенки не превышала 16 мм. Более частым эхокардиографическим признаком “сердца спортсмена» была дилатация полости левого желудочка, которая определялась в 38% случаев [8]. Важное значение для диагностики некоторых заболеваний, сопровождающихся ГЛЖ, имеет тщательный анализ клинической картины, позволяющий выявить те или иные экстракардиальные проявления болезни, которые отсутствуют при ГКМП. Проведение биопсии миокарда для подтверждения диагноза ГКМП не требуется, однако гистологическое исследование может быть обоснованным для исключения инфильтративных заболеваний, сопровождающихся утолщением стенки левого желудочка.
Е.А. Каровайкина. Болезнь Фабри – это редкое заболевание, которое характеризуется нарушением обмена гликофосфолипидов вследствие недостаточности или отсутствия лизосомного фермента – α-галактозидазы А [9]. Причиной дефицита этого фермента являются мутации гена GLA, расположенного на Х-хромосоме, поэтому типичные клинические проявления болезни Фабри наблюдаются чаще и более выражены у гемизиготных мужчин, однако они нередко встречаются и у гетерозиготных женщин. При классическом фенотипе болезни Фабри первые симптомы, в частности нейропатическая боль (эпизоды жгучей боли в кистях и стопах, возникающей при лихорадке, физической нагрузке, стрессе и быстрых изменениях температуры окружающей среды), ангиокератомы (поверхностные ангиомы, локализующиеся на передней брюшной стенке, в частности внутри или вокруг пупка, в паховой области, на ягодицах, верхних конечностях, губах; рис. 2), снижение или отсутствие потоотделения, желудочно-кишечные нарушения, появляются в детском или подростковом возрасте, а в возрасте 20-40 лет развивается поражение внутренних органов, в том числе сердца, почек (протеинурия и прогрессирующее снижение скорости клубочковой фильтрации) и центральной нервной системы (транзиторные ишемические атаки и инсульт). При атипичном “кардиальном» варианте заболевания ГЛЖ развивается в возрасте 40-50 лет и старше при отсутствии ранних симптомов. Результаты нескольких крупных скрининговых исследований свидетельствуют о том, что патогенные мутации гена GLA, ассоциирующиеся с развитием болезни Фабри, могут быть обнаружены у 0,5-1% пациентов с диагнозом ГКМП [10].
Рис. 2. Ангиокератомы в области пупка у пациента с болезнью Фабри
А.С. Моисеев. Иллюстрацией ГЛЖ, обусловленной болезнью Фабри, могут служить следующие два наблюдения. Пациент Л., 48 лет, был обследован в клинике им. Е.М. Тареева в октябре 2021 года. С 19 лет выраженная лимфедема нижних конечностей и снижение потоотделения. В возрасте 47 лет появились редкие боли за грудиной, не связанные с физической нагрузкой, а при эхокардиографии выявлено утолщение межжелудочковой перегородки и стенки левого желудочка до 14 мм при отсутствии дилатации камер сердца и нарушений систолической функции. Наблюдался у кардиолога с диагнозом ГКМП. Через 1 год при скрининге обнаружено снижение активности α-галактозидазы А в высушенных пятнах крови, увеличение уровня глобо триазилсфингозина (Lyso-GL3) до 117 нг/мл (в норме <1,8) и мутация в гене GLA (с.145C>G), которые позволили установить диагноз болезни Фабри. На ЭКГ отмечались признаки ГЛЖ (рис. 3). При МРТ сердца наблюдались увеличение индекса массы миокарда левого желудочка до 123 г/м2 и признаки интрамиокардиального фиброза. Кроме того, имелись симптомы поражения почек – снижение расчетной скорости клубочковой фильтрации до 62 мл/мин/1,73 м2 при отсутствии протеинурии.
Рис. 3. ЭКГ признаки гипертрофии миокарда у пациента с болезнью Фабри
Одновременно мы обследовали 67-летнюю мать пациента, у которой за 2 года до госпитализации в клинику также была выявлена необъяснимая ГЛЖ, сопровождавшаяся постоянной формой фибрилляции предсердий, частой желудочковой экстрасистолией и сердечной недостаточностью, в связи с чем принимала β-адреноблокаторы, мочегонные средства, дигоксин, антикоагулянты. При МРТ сердца определялись утолщение межжелудочковой перегородки (19 мм) и задней стенки левого желудочка (12 мм), увеличение индекса массы миокарда левого желудочка до 141 г/м2 и участки интрамиокардиального фиброза. При МРТ головного мозга выявлены многочисленные очаги в белом веществе, а при осмотре окулистом – воронковидная кератопатия, характерная для болезни Фабри, диагноз которой подтверждался результатами молекулярногенетического исследования (мутация с.145C>G), повышением уровня Lyso-GL3 до 23 нг/мл и снижением активности α-галактозидазы А. Пациент и его мать в течение 1,5 лет получают ферментозаместительную терапию.
Представленные наблюдения демонстрируют важность скрининга в диагностике болезни Фабри у пациентов с необъяснимой ГЛЖ, так как клинически заподозрить правильный диагноз было сложно в связи с отсутствием типичных ранних симптомов – нейропатической боли и ангиокератом. С целью диагностики болезни Фабри у мужчин необходимо определять активность α-галактозидазы А и/или уровень Lyso-GL3 в высушенных пятнах крови. У женщин активность фермента нередко остается нормальной или снижается незначительно, поэтому более информативным считают определение уровня Lyso-GL3. Для подтверждения диагноза проводят молекулярно-генетическое исследование с целью выявления патогенной мутации гена GLA (в Российской Федерации все эти исследования выполняются бесплатно).
Н.Р. Носова. При анализе клинической картины обращали на себя внимание позднее развитие ГЛЖ и наличие ее не только у пробанда, но и его матери. Как указано выше, поражение внутренних органов при болезни Фабри, в отличие от некоторых других наследственных болезней, у мужчин обычно отмечается в возрасте 30-40 лет, а у женщин – в более старшем возрасте. Наследование болезни Фабри сцеплено с Х-хромосомой, поэтому у матери пациента обычно наблюдаются те или иные проявления заболевания, хотя фенотип его может отличаться. У пробанда с 18-летнего возраста отмечались снижение потоотделения, которое встречается у большинства мужчин с болезнью Фабри, и лимфедема. По данным регистра Fabry Outcomes Survey (n=714), частота лимфедемы при этом заболевании составила 16% у мужчин и 6% у женщин [11]. У матери пробанда была выявлена вихревидная кератопатия (коричнево-золотистые отложения в роговице в виде волнообразных линий, исходящих из одной центральной точки), которая является одним из клинических критериев диагноза болезни Фабри. По нашим данным, частота вихревидной кератопатии у 69 взрослых пациентов с болезнью Фабри составила 65,2%, в том числе 56,4% у мужчин и 76,7% у женщин [12]. В отличие от ГКМП, гипертрофия миокарда как у пробанда, так и его матери была выражена умеренно и не сопровождалась обструкцией выносящего тракта левого желудочка. У взрослых пациентов с болезнью Фабри обычно наблюдается поражение не только сердца, но и почек (альбуминурия/протеинурия, снижение скорости клубочковой фильтрации) и головного мозга (очаговые изменения в белом веществе при МРТ, транзиторные ишемические атаки/инсульт).
Е.А. Каровайкина. При болезни Фабри проводят заместительную терапию рекомбинантными препаратами α-галактозидазы А (агалсидазой альфа в дозе 0,2 мг/кг или агалсидазой бета в дозе 1 мг/кг), которые вызывают регресс ГЛЖ или по крайней мере замедляют прогрессирование кардиомиопатии. По данным D. Ger main и соавт., у пациентов с болезнью Фабри, начавших лечение в более молодом возрасте (18-30 лет), средняя масса миокарда левого желудочка снижалась на 3,6 г в год, в то время как без лечения у мужчин того же возраста она увеличивалась на 9,5 г в год (р<0,0001) [13].
В.В. Рамеев. Причиной утолщения стенок сердца мо жет быть не только гипертрофия кардиомиоцитов, но и инфильтрация миокарда нерастворимым фибриллярным гликопротеидом – амилоидом. В настоящее время известно около 30 амилоидогенных белков, однако более 95% случаев амилоидоза сердца обусловлены ALамилоидозом или реже транстиретиновым (ATTR) амилоидозом. AL-амилоидоз развивается при отложении моноклональных иммуноглобулинов у больных лимфоплазмаклеточными дискразиями, в том числе множественной миеломой. ATTR-амилоид (мутантный и дикого типа) образуется из транстиретина, синтезируемого в основном печенью и выполняющего функции транспортного белка тироксина и витамина А. Причи ной развития ATTR-амилоидоза дикого типа (стар ческого) считают возрастное снижение активности ферментных систем гепатоцитов, что приводит к пре имущественнои секреции нестабильных мономерных форм транстиретина, которые легко агрегируют в тканях с образованием амилоида. В основе наследственного ATTR-амилоидоза лежат мутации в гене TTR, сопровождающиеся синтезом транстиретина, который не способен образовывать тетрамеры и обладает очень высокой амилоидогенностью.
А.С. Рамеева. Пациентка Б., 50 лет, впервые обследована в клинике им. Е.М. Тареева в январе 2015 года. В течение года беспокоили боли в области сердца и нарастающая сердечная недостаточность. При эхокардиографии выявлено утолщение межжелудочковой перегородки и задней стенки левого желудочка до 14 мм, нарушение диастолической функции по рестриктивному типу. При коронарографии обнаружен умеренный стеноз правой коронарной артерии (50%). При обследовании в российском кардиологическом научном центре в декабре 2014 года определялись небольшая протеинурия (0,14 г/л), снижение вольтажа зубцов ЭКГ (рис. 4), увеличение толщины межжелудочковой перегородки и задней стенки левого желудочка до 18 мм, дилатация левого предсердия при отсутствии дилатации левого желудочка и снижения фракции выброса, при МРТ сердца – диффузное неравномерное субэндокардиальное накопление контрастного вещества. Выс ка зано предположение об амилоидозе, диагноз которого был подтвержден при биопсии миокарда. При исследовании крови методом Freelite отмечено резкое увеличение концентрации свободных легких цепей лямбда типа до 1383 мг/л (в норме 5,7-26,3 мг/л), указывавшее на наличие AL-амилоидоза. При трепанобиопсии диагностирована множественная миелома (увеличение числа плазматических клеток до 20%). Пациентке проводилась терапия бортезомибом, мелфаланом и дексаметазоном, на фоне которой нормализовалась концентрация свободных легких цепей лямбда типа и достигнута компенсация сердечной недостаточности.
Рис. 4. Низкий вольтаж комплексов QRS в грудных отведенияхприамилоидозесердца
В.В. Рамеев. Таким образом, у пациентки был диагностирован AL-амилоидоз с поражением сердца в рамках множественной миеломы. Заподозрить амилоидоз сердца позволяли возраст пациентки, быстрое развитие тяжелой сердечной недостаточности, которая плохо поддавалась симптоматической терапии, эхокардиографические признаки рестриктивного поражения сердца (увеличение левого предсердия при отсутствии дилатации левого желудочка и снижения фракции выброса), симметричное утолщение межжелудочковой перегородки и стенки левого желудочка без обструкции выносящего тракта, снижение вольтажа зубцов комплекса QRS на ЭКГ. Последний признак отличает амилоидоз сердца от ГЛЖ, хотя истинное снижение амплитуды QRS (менее 5 мм в отведениях от конечностей и менее 10 мм в грудных отведениях) наблюдается только у половины больных AL-амилоидозом сердца [14]. Однако даже при отсутствии низкого вольтажа комплексов QRS следует учитывать возможное его несоответствие степени ГЛЖ при эхокардиографии. Важное диагностическое значение имеют результаты МРТ сердца, которая позволяет не только измерить массу миокарда левого желудочка, но и выявить диффузное накопление гадолиния в субэндокарде [15].
В представленном наблюдении диагноз был подтвержден при биопсии миокарда, хотя для гистологического исследования могут быть использованы и другие ткани, более доступные для биопсии, в том числе слизистая оболочка прямой или двенадцатиперстной кишки, подкожно-жировая клетчатка, почка. На наличие AL-амилоидоза указывала моноклональная секреция лямбда-цепей иммуноглобулинов, выявленная с помощью метода Freelite, а также снижение отношения каппа- и лямбда-цепей до 0,01 (для AL-амилоидоза характерна величина этого показателя <0,26 или >1,65). У 7-10% больных AL-амилоидоз развивается в рамках множественной миеломы, для исключения которой всем пациентам следует проводить биопсию костного мозга.
Данный случай демонстрирует возможность “изолированного» поражения сердца при AL-амилоидозе, хотя у большинства пациентов наблюдаются и другие проявления, в том числе протеинурия/нефротический синдром, увеличение печени и селезенки, макроглоссия, периорбитальная пурпура, диарея, невропатия и/или ортостатическая гипотензия. У пациентки имелась небольшая протеинурия, однако она могла быть связана с застоем крови по большому кругу кровообращения.
Современная химиотерапия, включающая в себя ингибитор протеасом бортезомиб, позволяет добиться полного или частичного гематологического ответа у значительной части больных AL-амилоидозом, предупредить отложение амилоида в других органах и прогрессирование сердечной недостаточности.
П.П. Тао. Пациент В., 65 лет, русский, был обследован в клинике им. Е.М. Тареева в декабре 2015 года. В течение трех лет отмечается нарастающее снижение болевой, температурной и тактильной чувствительности в области кистей и стоп по типу “перчаток» и “носков», а в течение одного года – прогрессирующая застойная сердечная недостаточность. При электромиографии выявлены грубые аксонально-демиелинизирующие нарушения, наиболее выраженные в малоберцовых нервах, а при эхокардиографии – картина рестриктивного поражения сердца: дилатация левого предсердия, утолщение стенок левого желудочка, зоны гипокинезии в межжелудочковой перегородке, уплотнение эндокарда, нормальная фракция выброса левого желудочка. Уровень мозгового натрийуретического пропептида был повышен в 30 раз по сравнению с верхней границей нормы. При коронарографии обнаружен стеноз передней межжелудочковой ветви (65%) и правой коронарной артерии (75%). Проведены чрескожная коронарная ангиопластика и стентирование правой коронарной артерии, однако после вмешательства сердечная недостаточность сохранялась, появилась ортостатическая артериальная гипотензия. По данным эхокардиографии, толщина межжелудочковой перегородки достигла 22 мм, определялись множественные очаги зернистости в миокарде, фракция выброса левого желудочка снизилась с 57% до 45%. При МРТ сердца с контрастированием гадолинием на фоне выраженного утолщения стенок левого желудочка отмечено циркулярное субэндокардиальное диффузное накопление контрастного вещества в миокарде левого и передней стенки правого желудочков (рис. 5). Проводилась повторная биопсия слизистой оболочки прямой кишки, однако амилоид выявить не удалось. При иммунохимическом исследовании исключена моноклональная секреция легких цепей иммуноглобулинов, характерная для AL-амилоидоза. При молекулярно-генетическом исследовании обнаружена мутация гена TTR (Val30Met), подтверждающая диагноз наследственного ATTR-амилоидоза. При сцинтиграфии миокарда с 99mTcPYP выявлено накопление радиоизотопного препарата 2 степени, в связи с чем от биопсии миокарда было решено воздержаться. С целью восстановления тетрамерной структуры мутантного транстиретина пациент в течение 2 лет получает тафамидис 20 мг/сут. Переносимость лечения удовлетворительная, существенного прогрессирования амилоидоза не произошло.
Рис. 5. Симметричное утолщение стенки сердца и накопление гадолиния в субэндокарде при МРТ у пациента с ATTRамилоидозом
В.В. Рамеев. Как и в предыдущем наблюдении, заподозрить амилоидоз у 65-летнего пациента позволяло типичное рестриктивное поражение левого желудочка, характеризующееся развитием тяжелой сердечной недостаточности при отсутствии дилатации и существенного снижения фракции выброса левого желудочка. При эхокардиографии определялись множественные очаги зернистости, которые нередко выявляют у пациентов с амилоидной инфильтрацией миокарда, а при МРТ сердца – диффузное накопление гадолиния в субэндокарде. В пользу системного амилоидоза свидетельствовала и периферическая полиневропатия, которая встречается как при AL-, так и семейном ATTR-амилоидозе и может предшествовать поражению сердца. В большинстве случаев развивается неуклонно прогрессирующая, симметричная дистальная невропатия, начинающаяся с сенсорных расстройств, в первую очередь болевой и температурной чувствительности, с последующим присоединением нарушений вибрационной и позиционной чувствительности и двигательных нарушений. Ранними симптомами невропатии бывают парестезии или мучительные дизестезии. Часто встречается синдром запястного канала, проявляющийся болями и парестезиями в I-III пальцах кисти с постепенной атрофией мышц тенара и обусловленный сдавлением срединного нерва в запястном канале амилоидом, откладывающимся в связках запястья [16].
Учитывая отсутствие моноклональной секреции легких цепей иммуноглобулинов и наличие мутации гена TTR, был установлен диагноз наследственного ATTRамилоидоза [17]. Диагноз амилоидоза должен быть подтвержден при гистологическом исследовании, однако результаты повторной биопсии прямой кишки оказались отрицательными. Тем не менее, наличие ATTRамилоидоза не вызывало сомнения с учетом типичной клинической картины и результатов молекулярно-генетического исследования. Кроме того, при сцинтиграфии было выявлено накопление 99mTcPYP в миокарде 2 степени (т.е. умеренное накопление, соответствующее таковому в костной ткани). В 2021 году в многоцентровом исследовании было показано, что накопление в миокарде 99mTcPYP 2-3 степени (рис. 6) при отсутствии моноклональной гаммапатии обладает 100% специфичностью в диагностике ATTR-амилоидоза сердца и фактически позволяет отказаться от биопсии миокарда [18]. Более того, сцинтиграфия с 99mTcPYP дает возможность дифференцировать ATTR-амилоидоз от AL-амилоидоза, при котором накопление радиоактивного препарата в миокарде отсутствует или не превышает 1 степени.
Рис. 6. Накопление 99mTcPYPв миокарде 3 степени при ATTR-амилоидозе
С середины 90-х годов ХХ века для лечения ATTRамилоидоза применяли трансплантацию печени, позволяющую восстановить синтез нормального транс тиретина. В последние годы более перспективной тактикой лечения считают медикаментозную стабилизацию тетрамерной структуры транстиретина и предотвращение образования амилоидогенных мономеров белка. Первый такой препарат – тафамидис – уже применяется в Европе и в Российской Федерации.
С.В. Моисеев. Представленные наблюдения иллюстрируют широкий спектр причин ГЛЖ неясной этиологии, которые включают в себя не только истинную гипертрофию миокарда, но и некоторые инфильтративные заболевания, такие как системный амилоидоз, имитирующие ГКМП. Разработать четкий алгоритм дифференциальной диагностики ГКМП достаточно сложно, учитывая вариабельность течения заболеваний, сопровождающихся ГЛЖ. Например, некоторые тяжелые генетические заболевания, такие как болезнь Помпе (гликогеноз II типа, связанный с дефицитом фермента кислой α-глюкозидазы в лизосомах), могут проявиться в возрасте 40-50 лет и старше, в то время как при системных заболеваниях, в том числе болезни Фабри или амилоидозе, экстракардиальные симптомы иногда отсутствуют. Ключевую роль в диагностике наследственных заболеваний, таких как ГКМП, ATTRамилоидоз, болезни Фабри, Помпе, Данона и др., играют изучение семейного анамнеза и молекулярногенетическое исследование.
Какими последствиями может грозить патология?
Гипертрофированная сердечная мышца грозит многими осложнениями, среди них следует отметить:
- аритмию (нарушения сердечного ритма);
- ишемическую болезнь (нарушение кровоснабжения миокарда);
- стенокардию (недостаточное поступление в сердце кислорода и питательных веществ, т.е. кислородное голодание);
- сердечную недостаточность (состояние, при котором сердечная мышца не успевает пропускать необходимый объем крови);
- сердечный приступ (остановка кровоснабжения);
- остановку сердца.
Внимание! Несмотря на огромное количество опасных последствий, с заболеванием живут не один десяток лет. При постановке данного диагноза паниковать – не надо, просто следует соблюдать профилактические меры и тогда сердце не подведет.
ТИПЫ ГИПЕРТРОФИИ СКЕЛЕТНЫХ МЫШЦ ЧЕЛОВЕКА
Самсонова А.В. Типы гипертрофии скелетных мышцы человека // Труды кафедры биомеханики университета П.Ф. Лесгафта, 2021.- Вып. 14.- С. 32-39
Аннотация
В статье дается классификация различных видов гипертрофии скелетных мышц человека на основе ряда классификационных признаков: времени проявления и длительности сохранения; направленности тренировочного воздействия; специфике воздействия на миофибриллы. По времени проявления и длительности сохранения тренировочного эффекта различают кратковременную и долговременную гипертрофию скелетных мышц. По направленности тренировочного воздействия различают миофибриллярную и саркоплазматическую гипертрофию. По специфике воздействия на миофибриллы предлагается различать поперечную и продольную миофибриллярную гипертрофию.
Ключевые слова
скелетные мышцы, гипертрофия
Причины, приводящие к недугу
Причинами гипертрофии миокарда считаются следующие заболевания и состояния:
- артериальная гипертензия;
- порок сердца;
- идиопатическая гипертрофия;
- чрезмерные физические нагрузки;
- апноэ сна (или иначе – храп). Это обусловлено непроизвольной остановкой дыхания на несколько секунд во время сна и задержкой поступления кислорода.
Записаться на консультацию
Развитие гипертрофии миокарда лж обычно происходит на фоне гипертонии, но может стать следствием чрезмерных физических нагрузок на организм. Поэтому, причинами развития гипертрофии называют тяжелые профессии (каменщики, грузчики).
Внимание! В группу особого риска попадают активные курильщики, и те люди, которые ведут малоподвижный образ жизни.
TYPES OF HUMAN SKELETAL MUSCLE HYPERTROPHY
Alla V. Samsonova, Doctor of pedagogical sciences, Professor, Head of Department
Lesgaft National State University of Physical Culture, Sports and Health, St. Petersburg, Department of Biomechanics
Abstract
This article classifies various types of human skeletal muscle hypertrophy on the basis of a number of features: the time of occurring and the retention time; the type of training effect and the specifics of impact on myofibrils. There are short-term and long-term hypertrophy based on a time of occurrence and a retention time. Myofibrillar and sarcoplasmic hypertrophy are distinguished by the type of the training effect. It is proposed to distinguish between transverse and longitudinal hypertrophy on a difference in impact on a myofibrils.
Key words
skeletal muscle, hypertrophy
ВВЕДЕНИЕ
Под гипертрофией скелетных мышц понимается увеличение их объёма под воздействием различных факторов. Такими факторами могут выступать повреждение и механическое напряжение скелетных мышц, а также метаболический стресс [17]. Несмотря на достаточно пристальное внимание исследователей к этому вопросу, до настоящего времени отсутствует полная классификация видов гипертрофии скелетных мышц. В большинстве публикаций указывается на существование миофибриллярной и саркоплазматической гипертрофии [5, 6, 9, 19; 17; 8].
ЦЕЛЬЮ настоящей статьи является разработка классификации гипертрофии скелетных мышц и объяснение механизмов, лежащих в ее основе.
Более подробно строение и функции мышц описаны в моих книгах:
- Гипертрофия скелетных мышц человека
- Биомеханика опорно-двигательного аппарата человека
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Предлагается классификация гипертрофии скелетных мышц человека по следующим классификационным признакам: времени проявления и длительности сохранения тренировочного эффекта; направленности тренировочного воздействия (силовая тренировка или тренировка на выносливость), специфике воздействия на миофибриллы.
- По времени проявления и длительности сохранения тренировочного эффекта предлагается различать кратковременную и долговременную гипертрофию скелетных мышц.
- По направленности тренировочного воздействия различают миофибриллярную и саркоплазматическую гипертрофию [5, 6, 9, 19, 17; 8].
- По специфике воздействия на миофибриллы предлагается различать поперечную и продольную миофибриллярную гипертрофию (рис.1).
Рис. 1. Типы гипертрофии скелетных мышц человека
КРАТКОВРЕМЕННАЯ И ДОЛГОВРЕМЕННАЯ ГИПЕРТРОФИЯ СКЕЛЕТНЫХ МЫШЦ
Характеристика кратковременной гипертрофии и механизмов, лежащих в ее основе
Чаще всего гипертрофию скелетных мышц человека рассматривают как их долговременную адаптацию к физическим нагрузкам различной направленности. Однако бывает и кратковременная гипертрофия скелетных мышц – то есть изменение объёма мышцы в результате одного тренировочного занятия. Спортсмены, выступающие в соревнованиях по бодибилдингу или бодифитнесу, хорошо знают, что объём мышц можно немного увеличить, если использовать специальную методику тренировки – пампинг.
Пампингом (от англ. pump – помпа, насос) называется методика силовой тренировки, при которой выполняется большое количество повторений упражнения в одном подходе (более 15) с небольшим отягощением. Паузы отдыха между подходами составляют приблизительно 1 минуту. После применения пампинга субъективные ощущения спортсмена можно описать как «распирание» мышц, «жжение» в мышцах или что «мышцы стали тяжелее».
Считается, что основная причина кратковременной гипертрофии мышц состоит в наполнении кровью капилляров, окружающих мышечные волокна. Из-за коротких пауз отдыха между подходами отток крови от мышц сильно затруднен. Однако существуют и другие причины, вызывающие кратковременную гипертрофию скелетных мышц.
Известно [1], что при выполнении физических упражнений в скелетных мышцах возникает рабочая гиперемия, при которой часть кровеносных капилляров, не активных в состоянии покоя, начинает функционировать. В результате увеличения количества функционирующих капилляров кратковременно возрастает объём скелетной мышцы, то есть возникает ее гипертрофия.
Существенной причиной, вызывающей кратковременную гипертрофию, является гипоксия скелетных мышц. Короткие паузы отдыха (до одной минуты) приводят к недостаточному поступлению кислорода в мышечные волокна, то есть к их гипоксии[1]. Гипоксия способствует накоплению в саркоплазме мышечных волокон молочной кислоты, которая достаточно быстро превращается в лактат. Выделяющиеся при этой реакции ионы водорода повреждают сарколемму мышечных волокон. Вследствие этого в мышечные волокна через каналы аквапорин-4 поступает вода. Возникающий «отёк» мышечных волокон приводит к увеличению их объёма (кратковременной гипертрофии мышечных волокон), что вызывает еще большее сдавливание кровеносных капилляров и проявлению гипоксии. Спортсмен ощущает это как «жжение» и «распирание мышц».
Следует отметить, что к изменению осмотического давления более чувствительны мышечные волокна типа II, так как в них более выражены транспортные каналы аквапорин-4 [17].
После прекращения выполнения силовых упражнений, кровоток восстанавливается. Раскрывшиеся во время работы кровеносные капилляры снова «слипаются». Поэтому эффект от применения пампинга длится недолго: от 5 до 10 минут. Этого времени, однако, вполне достаточно, чтобы спортсмены на помосте выглядели более эффектно.
Более подробно этот вопрос освещен в видеоролике «Почему болят мышцы на тренировке? Нужно ли делать кардио после тренировки?» на моем канале на YouTube.
Характеристика долговременной гипертрофии и механизмов, лежащих в ее основе
Доказано, что гипертрофия скелетных мышц как долговременная адаптация скелетных мышц к различным факторам, проявляется после воздействия этих факторов не сразу, а через определенный промежуток времени (рис. 2). Этот промежуток может достигать 12 недель [14].
Рис. 2. Взаимоотношение между различными механизмами увеличения мышечной силы (J. Hoffman, 2002)
Первоначальное увеличение уровня силы ученые связывают с нервными влияниями на скелетные мышцы. Отставленное проявление гипертрофии скелетных мышц вызвано процессами, протекающими в мышечных волокнах, которые приводят к увеличению количества миоядер. Это существенно влияет на повышение синтеза белка в мышечных волокнах [10]. Факторами, которые инициируют эти процессы являются: повреждение и механическое напряжение мышцы, а также изменение гормонального фона [17].
МИОФИБРИЛЛЯРНАЯ И САРКОПЛАЗМАТИЧЕСКАЯ ГИПЕРТРОФИЯ
Достаточно давно установлено, что долговременная гипертрофия скелетных мышц имеет две разновидности: миофибриллярную и саркоплазматическую гипертрофию [5, 6, 9, 19, 17; 8].
Миофибриллярная гипертрофия скелетных мышц проявляется в их долговременной адаптации к нагрузкам силовой направленности. Саркоплазматическая гипертрофия проявляется как адаптация мышц к тренировке на выносливость. При этом типе гипертрофии скелетных мышц возрастает объём саркоплазмы в мышечном волокне (рис. 3).
Рис.3. Схема, отражающая изменения площади поперечного сечения мышечного волокна в зависимости от вида гипертрофии
Показано [8], что на объём мышечного волокна (Vмв) могут влиять следующие факторы:
Vмв = Sмф · lмф · nмф + Vсарк (1),
где: Sмф — площадь поперечного сечения миофибриллы; lмф — длина миофибриллы; nмф – количество миофибрилл; Vсарк – объём саркоплазмы.
Если возрастают площадь поперечного сечения миофибриллы ( Sмф), длина миофибриллы (lмф ) и количество миофибрилл (nмф) имеется проявление миофибриллярной гипертрофии, наоборот, если возрастает объём саркоплазмы (Vсарк) – имеется проявление саркоплазматической гипертрофии.
Характеристика миофибриллярной гипертрофии и механизмов, лежащих в её основе
Изменение объёма скелетной мышцы при миофибриллярной гипертрофии может протекать по-разному, в зависимости от того, какие воздействия на скелетную мышцу оказываются.
Если представить миофибриллу в виде цилиндра, то её объём может увеличиваться за счет возрастания двух факторов: площади её поперечного сечения и длины .
Предлагается назвать разновидность миофибриллярной гипертрофии, которая происходит за счет увеличения площади поперечного сечения миофибрилл поперечной. Возрастание площади поперечного сечения миофибрилл происходит за счет добавления толстых и тонких филаментов на их периферии [3, 16]. Увеличение площади поперечного сечения миофибрилл приводит к возрастанию объёма мышечных волокон и мышцы в целом. Также увеличивается сила мышцы.
Предлагается назвать разновидность миофибриллярной гипертрофии, которая происходит за счет увеличения длины миофибрилл продольной. Увеличение длины миофибрилл возникает, если мышца находится в постоянном растяжении.
У человека это возможно в следующих случаях:
- Увеличения длины конечностей
Изучение миофибриллогенеза в детском возрасте показало, что миофибриллы «растут» с увеличением длины конечности [16]. В этом случае скелетные мышцы находятся в постоянном растяжении, так как расстояние между местами прикрепления мышц увеличивается.
Продольный тип миофибриллярной гипертрофии будет также наблюдаться у больных, длина конечностей которых увеличивается посредством применения аппарата Илизарова.
- Растягивания мышцы после её укорочения
Чтобы восстановить первоначальную длину мышцы после её укорочения в результате фиксации конечности после перелома, необходимо постоянно её растягивать. В результате этого длина миофибрилл, мышечных волокон и всей мышцы увеличивается. Доказано, что возрастание длины миофибрилл происходит за счет добавления саркомеров на их концах [7].
- При выполнении силовых упражнений
Продольный тип миофибриллярной гипертрофии наблюдается также при выполнении силовых упражнений в динамическом режиме. Доказано [4], что при преимущественной работе в этом режиме длина мышечных волокон немного увеличивается, а длина сухожилия – уменьшается.
Третьим фактором, влияющим на увеличение площади поперечного сечения мышечного волокна, является гиперплазия миофибрилл, то есть увеличения показателя lмф. Г. Голдспинком [12] было доказано, что миофибриллы могут продольно расщепляться. Им было также показано, что миофибриллы, которые расщеплялись, были примерно в два раза больше по сравнению с миофибриллами, которые не расщеплялись. Расщепление миофибрилл может приводить к увеличению их количества.
В основе миофибриллярной гипертрофии лежит повреждение и механическое напряжение скелетных мышц, а также метаболический стресс [17]. Повреждение мышечных волокон приводит к активации клеток-сателлитов, их делению и увеличению в мышечных волокнах количества ядер. Возрастание количества ядер приводит к увеличению синтеза белка [7]. Механическое напряжение скелетных мышц активирует большое количество сигнальных путей, повышающих синтез белков [17]. Помимо повреждения и механического напряжения скелетных мышц при силовой тренировке в крови повышается концентрация различных гормонов [15], таких как соматотропный гормон (гормон роста), тестостерон, инсулиноподобный фактор роста (ИФР-1), кортизол и др. Изменение метаболического фона приводит к повышенному синтезу белков, а также их катаболизму в различные временные периоды после тренировочного воздействия.
Как происходит лечение и как повысить его эффективность?
В обязательном порядке лечение гипертрофии миокарда левого желудочка включает в себя устранение гипертонии с помощью антигипертензивных препаратов. Также, в курс терапии входят: бета-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента, тиазидные диуретики. Эффективные также антагонисты кальция (кстати, они рассчитаны на длительный курс терапии).
Получить больше информации
При опасных стадиях развития гипертрофии (мышцы растут, увеличивается толщина стенки лж, сдавливая при этом коронарную артерию миокарда), что приводит к ишемическим изменениям и инфаркту, пациенту может быть проведено лечение с помощью оперативного вмешательства.
Помочь себе остановить развитие патологии можно, если полностью изменить привычный образ жизни и уделять внимание периодическим осмотрам (УЗИ и электрокардиограмму нужно делать 1-2 раза в год). Обязательными должны стать пешие прогулки на свежем воздухе, спортивные занятия (бег или другое), отказ от вредных привычек, снижение употребления соли, профилактика стрессов.
Лечение гипертрофии миокарда
Для проведения квалифицированного лечения необходимо продиагностировать заболевание, а также определить его характер, особенности течения. На основе этих данных подбирается оптимальный способ лечения. В большинстве случаев лечение гипертрофии миокарда состоит в приеме препарата верампила с бета-блокаторами. Комплексное применение лекарств позволяет снизить симптоматику заболевания, а также нормализовать общее состояние больного. В роли дополнительной терапии необходимо соблюдать назначенную диету, а также отказаться от курения, приема алкоголя. Кроме того, необходимо сокращение количества соли, потребляемых продуктов с максимально высоким содержанием жиров. При лечении физические нагрузки должны быть умеренными.
В особо тяжелых случаях требуется хирургическое вмешательство. В этом случае специалист удаляет гипертрофированную часть мышцы. В процессе лечения состояние пациента отслеживается при помощи ЭКГ.
Реабилитация
Как известно, после проведенного лечения, операционного вмешательства требуется полноценная реабилитация. Лечебная диета является неотъемлемой составляющей реабилитационного процесса. В таком случае питаться необходимо до 6 раз в день небольшими порциями. Мучные изделия при этом нужно ограничить, жирные, копченые блюда также исключаются из рациона. Уровень физических нагрузок необходимо снизить. Полноценная реабилитация позволяет пациенту намного оперативнее восстановиться после проведенного лечения.
Записаться на приём Запишитесь на приём и получите профессиональное обследование в нашем центре