Фиброзное кольцо – это внешняя оболочек межпозвоночного диска, отвечающая в принципе за его целостность. Состоит из плотных хрящевых волокон, способных быстро адаптироваться к любым амортизационным нагрузкам. Очень эластичное и выносливое. При развитии остеохондроза в первую очередь патологические изменения затрагивают фиброзное кольцо – оно начинает растрескиваться, покрываться отложениями солей кальция, утрачивает способность получать достаточное количество жидкости и питательных веществ при диффузном обмене с окружающими паравертебральным мышцами.
В результате этого возникают различные повреждения фиброзного кольца, большую часть из которых рассмотрим в предлагаемом материале. Здесь рассказано о том, как устроено фиброзное кольцо и какие основные функции оно выполняет. Даны сведения о потенциальных причинах разрушения его тканей. Рассказано про характерные клинические симптомы, при появлении которых следует незамедлительно обратиться к врачу для проведения обследования и дифференциальной диагностики. В статье вы узнаете о современных эффективных методах восстановления целостности хрящевой ткани фиброзного кольца.
Если у вас есть симптомы и признаки, которые описаны в материале, то рекомендуем вам как можно быстрее обратиться на прием к неврологу или вертебрологу. Эти доктора обладают достаточной компетенцией для того, чтобы проводить эффективное и безопасное лечение дегенеративных дистрофических изменений в межпозвонковых дисках.
В Москве можно записаться на бесплатную консультацию к вертебрологу или неврологу в нашей клинике мануальной терапии. Прием ведут опытные доктора. Они устанавливают предварительный диагноз, по мере необходимости назначают дополнительные обследования. Дают индивидуальные рекомендации по проведению лечения и изменению образа жизни таким образом, чтобы позвоночный столб вновь обрел утраченное здоровье.
Записаться на бесплатный прием можно с помощью специальной формы, которая располагается в конце этой страницы. Также вы можете позвонить нашему администратору и согласовать удобное для визита время.
Фиброзное кольцо межпозвоночного диска
Чтобы разобраться в потенциальных причинах дегенеративных дистрофических изменений в хрящевых тканях позвоночного столба, нужно ознакомиться хотя бы с базовыми сведениями по анатомии и физиологии. Позвоночный столб – это полая трубка, состоящая из отдельных тел позвонков, в совокупности с дугообразными отростками формирующими внутренний спинномозговой канал.
Между телами позвонков располагаются межпозвоночные диски. Они отвечают за равномерное распределение амортизационной нагрузки в процессе движений и статичного положения тела. Также межпозвоночные диски обеспечивают надежную защиту корешковых нервов, отходящих от спинного мозга через боковые фораминальные отверстия в позвонках от давления с их стороны.
Межпозвоночные диски состоят из плотной хрящевой оболочки (фиброзное кольцо) и внутреннего студенистого тела (пульпозное ядро). У этой структуры полностью отсутствует собственная кровеносная сеть. Питание осуществляется исключительно диффузным методом. Для этого существуют:
- замыкательные пластинки, разделяются поверхность фиброзного кольца и тела позвонка
- окружающие позвоночник паравертебральные мышцы;
- мелкие капилляры, пронизывающие соединительные ткани вокруг фиброзного кольца межпозвоночного диска.
Фиброзное кольцо межпозвоночного диска обладает высокой степенью выносливости, но только в том случае, если в его структуре находится достаточное количество жидкости. Она придает ему эластичность и пластичность. Основное питание в межпозвоночный диск поступает при диффузном обмене с замыкательной пластинкой. Она буквально испещрена мелкими кровеносными сосудами, откуда поступает питание также в костную ткань позвонка.
Если на позвоночник оказывается избыточная физическая и амортизационная нагрузка (лишний вес, тяжелый труд, подъем тяжестей, нарушение осанки и т.д.), то в замыкательных пластинках начинается процесс склерозирования кровеносных сосудов на фоне постоянной компрессии. Это приводит к тому, что они прекращают осуществлять диффузное питание фиброзного кольца.
В меньшей степени жидкость и питательные вещества поступают в хрящевые ткани позвоночного столба из окружающих паравертебральных мышц. Когда мышцы сокращаются, они выделяют некоторое количество жидкости, обогащенной кислородом, питательными веществами и глюкозой. При расправлении межпозвоночный диск усваивает эту жидкость, а при сжатии выделяет другую, которая насыщена метаболитами, углекислым газом и продуктами обмена. Эта жидкость частично усваивается мышцами и направляется в венозное русло, но большая её часть поступает в лимфатическую систему для очистки и деактивации метаболитов.
Фиброзные кольца позвоночника – это наружные оболочки, которые отвечают за баланс жидкости во всей структуре диска. Через него жидкость поступает в ткани пульпозного ядра. Это студенистое тело, которое призвано поддерживать физиологическую высоту межпозвоночного диска и равномерно распределяет амортизационную нагрузку.
Нарушение процесса диффузного питания – это основная причина повреждений фиброзного кольца. Обычно даже при экстремальных физических нагрузках межпозвоночный диск сохраняет свою целостность и быстро восстанавливается. Исключение составляют ранения (огнестрельные и ножевые). Также при оскольчатом переломе тела позвонка может быть нарушена целостность фиброзного кольца межпозвоночного диска. Во всех остальных ситуациях повреждение – это следствие длительно протекающего остеохондроза (дегенеративного дистрофического изменения хрящевых тканей межпозвоночного диска).
Потенциальные причины, которые могут привести к дегенеративному дистрофическому поражению и нарушению целостности фиброзного кольца межпозвоночного диска – это:
- нарушение обменных процессов в организме человека, например, сахарный диабет и развивающаяся при нем диабетическая ангиопатия;
- избыточная масса тела, создающая дополнительную амортизационную и физическую нагрузку на замыкательные пластинки и межпозвоночные диски, в результате чего они быстро разрушаются и подвергаются склерозированию;
- ведение малоподвижного сидячего образа жизни, при котором практически отсутствуют регулярные и достаточные по интенсивности физические нагрузки на мышечный каркас спины;
- неправильное питание, при котором в рационе преобладают быстрые углеводы и наблюдается дефицит витаминов и минералов;
- нарушение осанки и искривление позвоночного столба – создаются предпосылки для неравномерного распределения амортизационной нагрузки по телу позвонков;
- неправильная постановка стопы в виде плоскостопия или косолапости;
- неправильная организация спального и рабочего места;
- возрастные изменения в организме человека (фактор оказывает негативное воздействие при достижении возрасте в 45 и более лет);
- тяжелый физический труд, сопряженный с переносом и подъемом грузов или с длительным статическим напряжением мышц спины и воротниковой зоны;
- курение и употребление алкогольных напитков – меняется процесс гемодинамики и в области позвоночника постоянно провоцируется ишемия тканей.
Эти и многие другие причины разрушения хрящевой ткани фиброзного кольца межпозвоночного диска следует исключать в процессе проведения лечения. В нашей клинике мануальной терапии доктор в ходе первичного осмотра пациента дает ему индивидуальные практические рекомендации, которые позволяют создать благоприятные условия для восстановления целостности хрящевых тканей позвоночного столба.
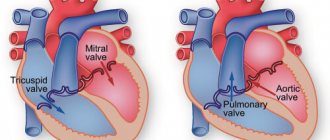
Фиброзные кольца клапанов сердца при недифференцированной дисплазии соединительной ткани
Библиографическое описание:
Кузнецова, В. В. Фиброзные кольца клапанов сердца при недифференцированной дисплазии соединительной ткани / В. В. Кузнецова. — Текст : непосредственный // Медицина и здравоохранение : материалы I Междунар. науч. конф. (г. Чита, ноябрь 2012 г.). — Чита : Издательство Молодой ученый, 2012. — С. 26-36. — URL: https://moluch.ru/conf/med/archive/62/2893/ (дата обращения: 27.11.2021).
В литературных источниках имеются сообщения о диаметре митрального и аортального фиброзных колец при дисплазии соединительной ткани. По данным исследования Яковлева В.М. и соавт. [5], увеличение диаметра митрального фиброзного кольца в обе фазы сердечного цикла может служить критерием соединительнотканной дисплазии митрального клапана с нарушением его функции. В этой работе было выявлено статистически достоверное увеличение диаметра митрального фиброзного кольца в обе фазы сердечного цикла в группе пациентов с пролапсом митрального клапана с наличием митральной регургитации в сравнении с контрольной группой (пациенты без дисплазии соединительной ткани) и внутри опытной группы (пациенты с пролапсом митрального клапана без митральной регургитации). В работе Малеева Э.Г и соавт. [1] пациенты с пролапсом митрального клапана также имели больший диаметр митрального фиброзного кольца по сравнению с контрольной группой.
В работе J.R. Matos-Souza et al. [6] было обследовано 627 человек с изолированным пролапсом митрального клапана и сопоставимых с ними по возрасту, полу и индексу массы тела 627 человек без пролапса митрального клапана; всего 454 мужчины и 800 женщин в возрасте 37,9 ± 0,3 с индексом массы тела 23,7 ± 0,1 кг/м2. Лица с пролапсом митрального клапана имели достоверно больший диаметр аортального фиброзного кольца по сравнению с контролем (30,4 ± 0,1 против 29,5 ± 0,1 мм). Кроме этого, многофакторный анализ продемонстрировал независимую ассоциацию между пролапсом митрального клапана и размером аортального кольца на модели, включающей вмешивающиеся переменные – возраст, пол, индекс массы тела, площадь поверхности тела, уровень кровяного давления и индекс массы миокарда левого желудочка [6].
Относительно диаметра двух других фиброзных колец сердца при дисплазии соединительной ткани в доступной литературе данных не обнаружено.
Цель исследования:
изучение диаметра фиброзных колец клапанов сердца при дисплазии соединительной ткани и их взаимосвязи с антропометрическими показателями и морфо-функциональными показателями сердца.
Материал и методы.
В основу исследования положены данные, полученные при обследовании 60 пациентов с ДСТ в возрасте от 18 до 44 лет (средний возраст — 25,9±6,8 года) и 27 пациентов без признаков ДСТ. Объективное исследование проводилось по общепринятой методике. Во время физикального исследования проводились следующие измерения: рост, вес, окружность грудной клетки (ОГК), окружность талии (ОТ), размах рук, рост сидя, длина кисти, длина стопы. На основании полученных данных рассчитывались ИМТ, площадь поверхности тела (ППТ), индексы пропорциональности (ИП между ОГК и ростом стоя, ИП между длиной ног и длиной туловища, индекс Пинье). У пациентов определялись САД, ДАД и ЧСС.
Наличие дисплазии соединительной ткани у пациентов устанавливалось по совокупности признаков [3]. Эходопплеркардиография проводилась на ультразвуковом сканере экспертного класса с цветным допплеровским картированием VIVID-3 фирмы General Electric (США). Ультразвуковое исследование сердца выполнено в соответствии с рекомендациями Европейской и Американской ассоциаций эхокардиографии для проведения измерений, расчетов и оценки камер сердца и магистральных сосудов (2006 г.). Локация проводилась в парастернальной позиции (III-IV межреберье по левому краю грудины) в горизонтальном положении больного с приподнятым головным концом путем изменения угла наклона датчика для последовательного изображения различных отделов сердца. Для получения структурной характеристики сердца оценивали конечные диастолический и систолический диаметры (КДР ЛЖ, КСР ЛЖ, см), объемы (КДО, КСО, мл) ЛЖ, толщину задней стенки ЛЖ (ТЗСЛЖ, см) в систолу и в диастолу, толщину межжелудочковой перегородки (ТМЖП, см) в систолу и в диастолу, индексированные показатели объемов ЛЖ (ИКСО, ИКДО, мл/м2), массу миокарда ЛЖ (ММЛЖ, г). Структурно-геометрические изменения определяли по индексу ММЛЖ (ИММЛЖ, г/м2), относительной толщине стенок левого желудочка и миокардиальному стрессу. Объемные показатели левого желудочка и фракцию выброса левого желудочка рассчитывали по формулам Teichholz [4]. Показатели систолической функции левого желудочка включали: фракцию выброса (ФВ, %), фракцию укорочения передне-заднего диаметра ЛЖ в систолу (ФУ, %), скорость циркулярного укорочения волокон миокарда (Vcf, c-1). При оценке состояния центральной и периферической гемодинамики учитывали значения ударного (УО, мл) и минутного (МО, л/мин) объемов, ударный (мл/м2) и сердечный (л/мин/м2) индексы, общее периферическое сосудистое сопротивление (ОПСС, дин*с*см-5). Диастолическую функцию левого желудочка изучали по временным и скоростным параметрам трансмитрального диастолического потока: время изоволюметрического расслабления (ВИР, с), время ускорения раннего трансмитрального диастолического потока(АТ, с), замедления раннего трансмитрального диастолического потока (ДТ, с), период изгнания (ЕТ, с), пиковые скорости быстрого (Е, м/с) и медленного (А, м/с) диастолического наполнения, их соотношение (Е/А) [4].
Статистическая обработка данных проводилась с помощью пакета прикладных программ Statistica 6.0 фирмы StatSoft и MIX для Windows, а также возможностей Microsoft Excel. Анализ данных на нормальность распределения проводился с помощью теста Колмогорова-Смирнова. В качестве нулевой гипотезы принималась гипотеза о нормальном распределении количественного признака. Так как распределение всех признаков было отлично от нормального распределения, то признаки описаны медианой и интерквартильным размахом (25 и 75 процентили). Сравнение двух независимых групп выполнялось с помощью U-теста Манна-Уитни. Оценка зависимости между двумя переменными проводилась с применением коэффициента корреляции Спирмена. Уровень принятия или отклонения нулевой гипотезы составлял ниже 0,05.
Результаты и обсуждение.
Общая характеристика сравниваемых групп. Пациенты с ДСТ (табл.1) имели достоверно большую длину тела по сравнению с группой контроля (p=0,0001) и достоверно меньшую массу тела (p=0,0004), что является отражением общих свойств популяции пациентов с дисплазией соединительной ткани. При этом ИМТ и ППТ у пациентов с ДСТ были статистически значимо ниже, чем у пациентов группы контроля (p<0,0001 и p=0,02). ОТ и ОГК у пациентов с ДСТ были статистически значимо меньше, чем у пациентов группы контроля (p=0,00001 и p=0,0005). Рост сидя, длина кисти, стопы и размах рук статистически значимо не различались между группами. САД, ДАД и ЧСС у пациентов с ДСТ оказались статистически значимо снижены по сравнению с группой контроля (p=0,007, p=0,03 и p=0,02 соответственно).
Таблица 1
Общая характеристика пациентов в исследуемых группах, Ме (Р25-Р75)
| Показатель | Пациенты с ДСТ (n=149) | Контрольная группа (n=55) | p |
| Рост, см | 176 (170-183) | 170 (161-177) | 0,0001 |
| Рост сидя, см | 92 (90-96) | 93 (90,5-96,5) | 0,5 |
| ОГК, см | 79 (73-86) | 86 (80-94) | 0,0005 |
| ОТ, см | 70 (67-76) | 79 (75,5-88) | 0,00001 |
| Размах рук, см | 179 (173-186) | 181 (171-186,5) | 0,8 |
| Кисть, см | 20 (19-21) | 20 (19-21) | 0,77 |
| Стопа, см | 27(26-29) | 28 (25,5-29) | 0,79 |
| Вес, кг | 60 (53-68) | 66 (57-76) | 0,0004 |
| ИМТ, кг/м2 | 19,3 (17,7-21,2) | 22,8 (21,2-25,6) | <0,00001 |
| ППТ, м2 | 1,76 (1,62-1,89) | 1,81 (1,72-1,94) | 0,02 |
| САД, мм рт ст | 100 (90-110) | 110 (100-120) | 0,007 |
| ДАД, мм рт ст | 60 (55-70) | 65 (60-80) | 0,03 |
| ЧСС, уд/мин | 70 (64-75) | 77 (69-84) | 0,02 |
Таким образом, пациенты с ДСТ антропометрически достоверно отличались от группы контроля. Пациенты с ДСТ характеризовались достоверно большим ростом, меньшими массой тела, ИМТ, площадью поверхности тела, ОГК, ОТ, что свойственно популяции данных пациентов в целом.
При сопоставлении структурно-геометрических параметров сердца у пациентов с ДСТ и лиц контрольной группы выявлен ряд отличий (табл.2).
Размеры всех полостей сердца, измеренные в диастолу, у пациентов с ДСТ оказались достоверно меньше, чем у пациентов группы контроля (p<0,05), что объясняется меньшими размерами тела у пациентов с ДСТ. КДО ЛЖ и индексированный показатель КДО ЛЖ у пациентов с ДСТ были также достоверно занижены по сравнению с контрольными показателями (p=0,008 и p=0,03). Таким образом, при одной и той же площади поверхности тела пациенты с ДСТ характеризовались меньшим КДО ЛЖ. При этом отсутствовало достоверное уменьшение КСР ЛЖ (p=0,44), КСО (p=0,32) и ИКСО ЛЖ (p=0,89). По толщине МЖП и ЗСЛЖ в диастолу группы достоверно не различались между собой (p= 0,32 и p=0,19), в систолу толщина МЖП и ЗСЛЖ была достоверно меньше у пациентов с ДСТ (p=0,02 и p=0,002). Относительная толщина стенки левого желудочка не различалась между группами (p=0,37). ММЛЖ и ИММЛЖ были достоверно меньше в группе с ДСТ (p=0,03 и p=0,045). Диаметр нижней полой вены в группе с ДСТ был занижен по сравнению с показателем группы контроля (p=0,04). По величине КСМС существенных различий в сравниваемых группах не обнаружено (p=0,21).
Таблица 2
Структурно-геометрическая характеристика сердца пациентов с ДСТ и группы контроля, Ме (Р25-Р75)
| Показатель | Пациенты с ДСТ (n=60) | Контрольная группа (n=27) | p |
| КДР ЛЖ, см | 4,5(4,23-4,82) | 4,8(4,5-5,0) | 0,009 |
| КСР ЛЖ, см | 3,0(2,7-3,19) | 3,1(2,8-3,2) | 0,44 |
| МЖП с, см | 1,17(1,01-1,27) | 1,25(1,15-1,35) | 0,02 |
| МЖП д, см | 0,82(0,7-0,92) | 0,85(0,8-0,91) | 0,32 |
| ЗСЛЖ с, см | 1,29(1,2-1,4) | 1,4(1,3-1,5) | 0,002 |
| ЗСЛЖ д, см | 0,82(0,75-0,93) | 0,86(0,8-0,96) | 0,19 |
| Отн. толщина стенки ЛЖ | 0,35 (0,32 -0,39) | 0,34 (0,33-0,38) | 0,37 |
| ЛП, см | 2,9(2,6-3,18) | 3,3(3,0-3,5) | 0,0004 |
| ПП, см | 3,18(2,9-3,46) | 3,4(3,27-3,6) | 0,003 |
| НПВ, см | 1,06(0,81-1,85) | 1,8(1,43-2,0) | 0,04 |
| ПЖ,см | 2,1(1,9-2,38) | 2,4(2,0-2,63) | 0,02 |
| ММЛЖ, г | 119,7(95,29-146) | 135,5(117,1-151) | 0,03 |
| КДО ЛЖ, мл | 92,75 (79-108,5) | 108 (92,84-118) | 0,008 |
| КСО ЛЖ, мл | 35 (27,27-39,66) | 38 (30-41) | 0,32 |
| ИКДО ЛЖ, мл/м2 | 53,65(48,88-61,9) | 58,06(52,45-67,05) | 0,03 |
| ИКСО ЛЖ, мл/м2 | 20,31(16,08-22,54) | 20,03(17,2-22,68) | 0,89 |
| ИММЛЖ, г/м2 | 72,29(59,67-82,38) | 74,86(69,9-87,68) | 0,045 |
| КСМС ЛЖ, дин*см2 | 109,56(95,13-123,99) | 112,92(106,02-122,38) | 0,21 |
По данным литературы, различные показатели состояния трансаортального и транспульмонального кровотока дают представление о систолической функции левого и правого желудочков[2]. В то же время показатели трансмитрального и транстрикуспидального диастолического кровотока отражают диастолическую функцию левого и правого желудочков (табл.3).
Пиковая трансаортальная скорость и пиковый трансаортальный градиент давления в группе пациентов с ДСТ были статистически значимо меньше, чем в группе контроля (p=0,005 и p=0,004). Пиковая трансмитральная скорость и пиковый трансмитральный градиент давления не различались между группами (p=0,51 и p=0,39). Также не было выявлено статистически значимых различий по показателям пиковой транстрикуспидальной скорости и пикового транстрикуспидального градиента давления (p= 0,97 и p=0,97). Пиковая транспульмональная скорость и пиковый транспульмональный градиент давления в группе с ДСТ был достоверно занижен по сравнению с контрольными показателями (p=0,006 и p=0,007).
Таблица 3
Трансклапанные пиковые градиенты скорости и давления пациентов с ДСТ и группы контроля, Ме (Р25-Р75)
| Показатели | Пациенты с ДСТ(n=60) | Контрольная группа (n=27) | p |
| Пиковая трансаортальная скорость, м/с | 1,07(0,95-1,18) | 1,17(1,03-1,3) | 0,005 |
| Пиковый трансаортальный градиент давления, мм рт. ст. | 4,5(3,63-5,6) | 5,48(4,24-6,76) | 0,004 |
| Пиковая трансмитральная скорость, м/с | 0,79(0,72-0,9) | 0,8(0,76-0,9) | 0,51 |
| Пиковый трансмитральный градиент давления, мм рт. ст. | 2,51(2,05-3,24) | 2,56(2,31-3,24) | 0,39 |
| Пиковая транспульмональная скорость, м/с | 0,89(0,77-0,99) | 0,95(0,9-1,16) | 0,006 |
| Пиковый транспульмональный градиент давления, мм рт. ст. | 3,14(2,39-3,92) | 3,61(3,21-5,38) | 0,007 |
| Пиковая транстрикуспидальная скорость, м/с | 0,71(0,62-0,78) | 0,7(0,63-0,77) | 0,97 |
| Пиковый транстрикуспидальный градиент давления, мм рт. ст. | 1,96(1,55-2,45) | 1,96(1,59-2,37) | 0,97 |
При изучении сократительной функции левого желудочка у пациентов с ДСТ и контрольной группы также были выявлены закономерные различия (табл. 4).
ФВ и ФУ ЛЖ были снижены у пациентов с ДСТ по сравнению с контрольной группой, однако различия не были статистически значимы (p=0,18 и p=0,09 соответственно). Тем не менее можно отметить тенденцию к снижению фракции укорочения левого желудочка у пациентов с ДСТ. Скорость циркулярного укорочения волокон миокарда у пациентов с ДСТ была достоверно ниже, чем у лиц группы контроля (p=0,0007). Процент систолического укорочения МЖП и ЗСЛЖ статистически значимо не различался между группами (p=0,30 и p=0,7).
Таблица 4
Показатели систолической функции ЛЖ у пациентов с ДСТ и группы контроля, Ме (Р25-Р75)
| Показатели | Пациенты с ДСТ (n=60) | Контрольная группа (n=27) | p |
| ФВ, % | 64,18 (60,28-68,01) | 65,4 (62-72) | 0,18 |
| ФУ, % | 34,82 (31,74-37,78) | 36,36(33,33-41,67) | 0,09 |
| Скорость циркулярного укорочения волокон миокарда, с-1 | 0,11 (0,10-0,13) | 0,13 (0,12 -0,15 ) | 0,0007 |
| % систолического укорочения МЖП | 41,33 (29,47-55,56) | 46,34 (30,53-60) | 0,39 |
| % систолического укорочения МЖП | 56,17 (40,91-73,33) | 60 (50,52-66,67) | 0,7 |
Основными интегративными показателями, характеризующими работу сердца, являются УО и МО желудочков. У лиц с ДСТ важнейшие параметры насосной функции миокарда были занижены по сравнению с контрольными показателями (табл.5).
Таблица 5
Состояние центральной и периферической гемодинамики у пациентов с ДСТ и группы контроля, Ме (Р25-Р75)
| Показатели | Пациенты с ДСТ (n=60) | Контрольная группа (n=27) | p |
| УО, мл | 57,2 (52-69,34) | 70 (61-81) | 0,003 |
| МОК, л/мин | 4,08 (3,4-4,82) | 5,46 (4,31-6,24) | 0,0001 |
| УИ, мл/м2 | 34,62 (30,87-39,27) | 38,1 (34,78-45,25) | 0,01 |
| СИ, л/м2*мин | 2,38 (2,03-2,9) | 3,03 (2,55-3,33) | 0,0006 |
| ОПСС, дин*с*см-5 | 1483,15(1275,5-1789,42) | 1224,39(1103,17-1534,85) | 0,01 |
У лиц с ДСТ оказались достоверно уменьшены все показатели, характеризующие работу левого желудочка: УО (p=0,003), МОК (p=0,0001), УИ (p=0,01), СИ (p=0,0006). ОПСС в группе с ДСТ достоверно превышало контрольные значения (p=0,01), что можно объяснить компенсаторной реакцией на снижение сердечного выброса.
Таким образом, сократительный процесс левого желудочка у пациентов в нашей выборке по сравнению с контрольной группой характеризовался снижением скорости циркулярного сокращения волокон миокарда, пиковой трансаортальной скорости и определяющего ее градиента давления, УО, МОК, УИ, СИ. Компенсаторные реакции со стороны периферической гемодинамики характеризовались повышением ОПСС.
В последние годы внимание многих исследователей сердечной гемодинамики приковано к диастолической функции, изменения которой являются наиболее ранними в патофизиологии нарушений сердечной гемодинамики (табл.6).
У пациентов с ДСТ ВИР ЛЖ (IVRT) оказалось достоверно уменьшенным по сравнению с группой контроля (p=0,01). Время ускорения раннего трансмитрального диастолического потока AT у пациентов с ДСТ было статистически значимо меньше чем в группе контроля (p=0,001). Время замедления раннего трансмитрального диастолического потока DT, реагирующее на изменение жесткости миокарда, не различалось в группах, хотя и имелась тенденция к его увеличению в группе пациентов с ДСТ (p=0,07). Общее время раннего и позднего диастолического потока оказалось статистически значимо больше в группе пациентов с ДСТ (p=0,002) за счет удлинения времени позднего диастолического потока. Время раннего диастолического потока статистически значимо не различалось между группами (p=0,38). Таким образом, у пациентов с ДСТ увеличение продолжительности диастолы происходило за счет фазы систолы предсердия, то есть диастола была более энергоемкой. Отличия по скоростным показателям диастолической функции ЛЖ у лиц с ДСТ были представлены снижением предсердного компонента трансмитрального диастолического потока(p=0,01), что повлекло увеличение соотношения скоростных потоков (p=0,075). Таким образом, пациенты в нашей выборке характеризовались нарушением диастолического наполнения левого желудочка, которое было обусловлено ускорением релаксации, увеличением периода позднего диастолического наполнения и относительным укорочением периода раннего диастолического наполнения.
Таблица 6
Диастолическая функция левого желудочка у пациентов с ДСТ и группы контроля, Ме (Р25-Р75)
| Показатели | Пациенты с ДСТ (n=60) | Контрольная группа (n=27) | p |
| IVRT, мс | 72 (64-80) | 80 (73-88) | 0,01 |
| AT, мс | 72 (60-87) | 88 (80-104) | 0,001 |
| DT, мс | 150(57-192) | 111(44-136) | 0,07 |
| Время раннего и позднего диастолического наполнения, мс | 501 (444-589) | 430 (358-494) | 0,002 |
| Время раннего трансмитрального диастолического потока, мс | 225,5(132-284) | 199 (159-236) | 0,38 |
| Скорость раннего диастолического наполнения, м/с | 0,79(0,72-0,90) | 0,8 (0,76-0,9) | 0,51 |
| Скорость позднего диастолического наполнения, м/с | 0,48(0,43-0,58) | 0,6(0,47-0,63) | 0,01 |
| E/A | 1,56(1,38-1,89) | 1,4(1,23-1,73) | 0,08 |
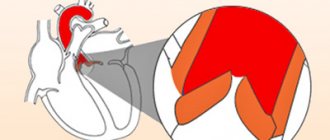
Фиброзный скелет сердца образован четырьмя кольцами, соединенными между собой соединительной тканью. Предсердия, желудочки, клапаны, легочный артериальный ствол и аорта плотно прикрепляются к этому соединительно-тканному каркасу. У пациентов с ДСТ АФК было достоверно меньше, чем у пациентов группы контроля (p=0,002), что можно объяснить меньшими размерами тела и, соответственно, сердца пациентов с ДСТ (табл.7). В то же время у пациентов с ДСТ наблюдалось патологическое расширение МФК, превышающее контрольные показатели (p=0,007). По данным, приведенным в работе [6], этот показатель может служить критерием соединительнотканной дисплазии митрального клапана с нарушением его функции. Трикуспидальное и пульмональное фиброзные кольца не различались между группами (p=0,46 и p=0,8).
Таблица 7
Диаметр фиброзных колец клапанов пациентов с ДСТ и группы контроля, Ме (Р25-Р75)
| Показатели | Пациенты с ДСТ (n=60) | Контрольная группа (n=27) | p |
| АФК, см | 1,86 (1,73-2,05) | 2,01(1,9-2,3) | 0,002 |
| МФК, см | 3,57 (3,27-3,81) | 3,2(3,0-3,45) | 0,007 |
| ТФК, см | 2,7 (2,5-3,2) | 2,9(2,8-3,0) | 0,46 |
| ПФК, см | 2,1 (1,9-2,25) | 2,05(1,9-2,25) | 0,8 |
Для АФК получены положительные корреляционные связи средней силы с размерами тела (весом (r=0,41, p=0,001), ИМТ (r=0,38, p=0,003), площадью поверхности тела (r=0,36, p=0,005), ОГК (r=0,34, p=0,009), ОТ (r=0,4, p=0,002), индексом пропорциональности ОГК/рост (r=0,3, p=0,02)), показателями преднагрузки (КДО ЛЖ (r=0,46, p=0,0003), ИКДО ЛЖ (r=0,41, p=0,001)), показателями центральной гемодинамики (УО ЛЖ (r=0,51, p=0,00005), МОК (r=0,50, p=0,00007)), ММЛЖ (r=0,43, p=0,0008), показателями систолической функции ЛЖ (толщиной МЖП в систолу (r=0,43, p=0,0008), толщиной ЗСЛЖ в систолу (r=0,42, p=0,001). Отрицательные корреляционные связи умеренной силы получены для АФК и ОПСС (r=-0,41, p=0,002), индекса Пинье (r=-0,38, p=0,005 ).
Были выявлены положительные корреляционные связи средней силы между диаметром МФК и размерами тела (ростом (r=0,31, p=0,02), весом (r=0,33, p=0,02), площадью поверхности тела (r=0,37, p=0,007)), временем изгнания из левого желудочка (r=0,48, p=0,0004), общим временем раннего и позднего трансмитрального диастолического потока (r=0,34, p=0,01), отрицательные корреляционные связи средней силы между диаметром МФК и показателями систолической (ФВ ЛЖ (r=-0,42, p=0,002), скоростью систолического укорочения волокон миокарда (r=-0,54, p=0,00005), % систолического укорочения МЖП (r=-0,29, p=0,04), % систолического укорочения волокон ЗСЛЖ (r=-0,37, p=0,007)) и диастолической функции ЛЖ (временем ускорения раннего трансмитрального диастолического потока (r=-0,52, p=0,0001), пиковой скоростью трансмитрального диастолического потока (r=-0,49, p=0,0003) и ее градиентом (r=-0,48, p=0,0004)).
Наши сведения о патологическом расширении МФК при ДСТ согласуются с данными других авторов [1; 5]. В то же время в литературных источниках мы не встретили сведений о сужении АФК при ДСТ. Уменьшение АФК у наших пациентов можно объяснить уменьшением объема ЛЖ в диастолу (r=0,46, p=0,0003), уменьшением УО ЛЖ (r=0,51, p=0,00005). В работе [6] лица с ПМК имели достоверно больший диаметр аортального фиброзного кольца по сравнению с контролем (30,4 ± 0,1 против 29,5 ± 0,1 мм). Это может быть связано с тем, что в этом исследовании пациенты были старше (средний возраст 37,9 ± 0,3 лет) и не отличались от группы контроля по ИМТ (23,7 ± 0,1 кг/м2). В нашей выборке средний возраст пациентов с ДСТ составил 25,9±6,8 года, средний возраст контрольной группы 25,2± 5,4 года; пациенты достоверно отличались по ИМТ. В группе с ДСТ медиана ИМТ 19,3 кг/м2 (квартили 17,7-21,2), в контрольной группе соответственно 22,8 (21,2-25,6) кг/м2 (p<0,00001).
В нашей выборке получены достоверные корреляции диаметра АФК с ИМТ (r=0,38, p=0,003), а также с индексом Пинье (r=-0,38, p=0,005). Таким образом, более вероятно, что меньший диаметр АФК связан с меньшими размерами тела пациентов с ДСТ и меньшими размерами камер сердца. Однако при меньших размерах камер сердца у пациентов с ДСТ диаметры ТФК и ПФК не отличались между группами.
Литература:
- Анализ деформации миокарда левого желудочка при пролапсе митрального клапана / Э.Г. Малеев [и др.] // Вестн. Санкт-Петерб. мед. акад. последиплом. образования. – 2011. – № 2. – С. 134-142.
- Достижения и перспективы исследования фазовой структуры сердечного цикла с помощью допплерэхокардиографии. Возможности применения в педиатрии [Электронный ресурс]. – Режим доступа: https://crawfordcountyredcross.org/kardiologiya/dostizgeniya_i_ perspektivy. html. – [Дата обращения: 21.02.12].
- Нечаева Г.И. Дисплазия соединительной ткани: терминология, диагностика, тактика ведения пациентов / Г.И. Нечаева, И.А. Викторова. – Омск : ООО Типография БЛАНКОМ, 2007. – 188 с.
- Рыбакова М.К. Практическое руководство по ультразвуковой диагностике. Эхокардиография / М.К. Рыбакова, М.Н. Алехин, В.В. Митьков. – М. : Видар-М, 2008. – 512 с.
- Яковлев В.М. Соединительнотканная дисплазия митрального клапана / В.М. Яковлев, Р.С. Карпов, Е.В. Швецова. – Томск : Сиб. Издат. Дом, 2004. – 144 с.
- Isolated mitral valve prolapse is an independent predictor of aortic root size in a general population / J.R. Matos-Souza // Eur. J. Echocardiogr. – 2010. – Vol. 11, № 3. – P. 302-305.
Уплотнение, кальциноз и трещина фиброзного кольца
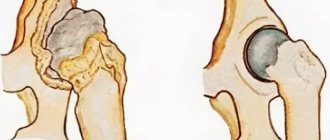
На начальном этапе развития остеохондроза происходит постепенное уплотнение фиброзного кольца – этот процесс опытному вертебрологу говорит о том, что хрящевые ткани не получают в достаточном количестве жидкость. Уплотнение фиброзного кольца не дает никаких клинических симптомов и может обнаруживаться случайным образом при проведении обследований позвоночного столба с помощью МРТ.
Трещина фиброзного кольца – это следующая стадия остеохондроза. Если жидкости поступает мало, то уплотненная хрящевая ткань не может в полной мере справляться с оказываемыми на неё амортизационными нагрузками. Она утрачивает свою эластичность и пластичность. Появляются сеточка из мелких трещин, которые не нарушают полностью целостности фиброзного кольца.
На фоне нарушенного диффузного питания единственной возможностью восстановлять целостность потрескавшейся поверхности межпозвоночной диска организм видит оседание солей кальция. Вторичный кальциноз фиброзного кольца – это серьезная патология, которая значительно сокращает способность хрящевых тканей усваивать жидкость, выделяемую замыкательной пластинкой и паравертебральным мышцами. При его развитии остеохондроз начинает стремительно разрушать межпозвоночный диск.
Фиброз сердца и печени. Ренин-ангиотензин-альдостероновая система и фиброз
00:00
Драпкина Оксана Михайловна, исполнительный директор Интернет Сессии, секретарь межведомственного совета по терапии РАМН:
— Следующую лекцию сделаю я. Она будет называться «Фиброз сердца и печени: что общего».
Уважаемые коллеги, тема фиброза, на мой взгляд, очень актуальная. Она дает нам возможность, если получится, сделать так, что наши ткани (соединительная, паренхиматозная, мышечная клетка, любая другая ткань) будет жить дольше. Фиброз – это естественное старение организма. Фиброз любого органа (еще раз хочу подчеркнуть), любой клетки (это может быть клетка эндотелия, клетка сосуда, печени). Механизмы развития фиброза во многом схожи.
Я сегодня попытаюсь начать наш образовательный курс, который мы надеемся сделать непрерывным. В эту проблему будут вовлечены не только кардиологи. В нее обязательно будут вовлечены гепатологи. В частности, профессор Павлов, который работает в нашей клинике. Он очень серьезно занимается проблемой, касающейся печени. Пульмонологи и так далее.
Моя задача сегодня рассказать о возможных параллелях между формированием фиброза сердца и печени. Есть ли такие параллели или это выдуманные попытки связать воедино разные процессы.
Мне бы хотелось уделить внимание роли ренин-ангиотензин-альдостероновой системы в патогенезе формирования фиброза. Мы сегодня уже видели этот вездесущий ангиотензин-2, который взаимодействует с рецепторами ангиотензина первого типа. Он опосведует все неблагоприятные влияния (в частности, влияя на инсулинорезистентность, повышает давление тучному гипертонику).
Сейчас посмотрим на него несколько с другой стороны. С позиции развития фиброза.
Что это такое. Определение. Фиброз – это уплотнение соединительной ткани с появлением рубцовых изменений. Мы хорошо знакомы с участками фиброза после, например, перенесенного инфаркта миокарда.
Эти рубцовые изменения могут быть в различных органах. Они возникают, как правило, на месте хронического воспаления: атрофии или дистрофии.
Можно дать молекулярное определение. Мы можем сказать, что фиброз – это чрезмерное накопление в тканях фибробластов и протеинов внеклеточного матрикса, включая коллаген.
Сегодня мы в течение 20-ти минут должны проследить судьбу коллагена, который является основной структурной единицей фиброза ткани.
История изучения вопроса восходит своими корнями к 1872-му году, когда Вильям Галл и Генри Саттон описывают артериокапиллярный фиброз, который развивается при болезнях почек.
1930-е годы ХХ века уже поработали нобелевские лауреаты. Они работали над тем, чтобы раскрыть структуру коллагена. Она была раскрыта.
03:22
В 1960-е годы Джон Росс и Юджин Браунвальд начинают изучать влияние ангиотензина на функцию сердца. Тогда появляются первые работы о взаимосвязи сахарного диабета и фиброза миокарда. Или гипертрофированного левого желудочка вследствие артериальной гипертензии фиброза миокарда.
Раньше Георгий Федорович Ланг, непререкаемый авторитет русской медицинской школы, уже находил «нежный фиброз» (как он говорил) в сердцах пациентов, страдающих артериальной гипертензией.
Совсем недавно становится возможной количественная и качественная оценка фиброза. Конечно, мы стремимся в своих диагностических возможностях развивать все больше такие методы, которые будут неинвазивными. Безусловно, биопсия печени, биопсия миокарда не всегда доступны.
Биопсия печени доступна – а биопсия миокарда выполнима трудно. Сейчас бьются над тем, какой из методов будет сравним по своей чувствительности и специфичности с морфологическим.
Основные действующие лица – кого мы должны знать в лицо, говоря о фиброзе. Это фибробласты, коллаген. Причем здесь нас интересует коллаген первого и третьего типа. Это компоненты внеклеточного матрикса. В основном здесь речь пойдет о протеогликанах.
Сами по себе матриксные металлопротеиназы и их ингибитиры (то есть соотношение матриксных металлопротеиназ, которые отвечают за деградацию коллагена, и ингибиторов матриксных металлопротеиназ) будут теми мишенями, на которые можно воздействовать различными терапевтическими агентами для того, чтобы либо увеличить синтез коллагена, либо больше повлиять на его деградацию.
Профибротические маркеры. Самые знаменитые – это, конечно, TGF beta (маркер роста).
05:28
Что из себя представляет коллаген. Коллаген – это тройная спираль. Эта тройная спираль коллагена – это 1/3 всех белков тела человека. Она образована белковыми цепями. Когда эти тройные спирали коллагена, которые вытянуты белковыми цепями, сходятся, сшиваются вместе, то образуются стержнеобразные молекулы коллагена. Они образуют очень прочные нерастяжимые коллагеновые фибриллы. Их прочность сравнима с прочностью стали.
Вы понимаете, насколько трудно, например, обратить вспять фиброз. На мой взгляд, лучше сделать все возможное для того, чтобы фиброз не сформировался.
Как происходит синтез коллагена. Синтез коллагена – это процесс, который требует клеточного и внеклеточного синтеза. Предшественник коллагена синтезируется на рибосомах, на поверхности эндоплазматического ритикулума. Он называется препроколлаген. Затем происходит посттранквилизационная модификация в комплексе Гольджи. Отщепляются некоторые сигнальные пептиды.
Появляется проколлаген, который все еще несет на одном своем конце длинный пропептид. Дальше следует гидроксилирование и гликозилирование. Окисление остатков цистоина приводит к образованию межмолекулярных дисульфидных связей.
Самый последний этап – конденсация с образованием внутри- и межмолекулярных связей. Когда все эти этапы пройдены, мы получаем коллаген.
(Демонстрация слайда).
Срез миокарда левого желудочка любого пациента. Важно, что соединительно-тканный каркас миокарда состоит из трех основных составляющих: эпимизии, эндомизии, перимизии. Эндомизии окружают большое мышечное волокно. Это плотные пучки коллагена, которые составляют соединительно-тканную прослойку, окружающую весь миокард. Эпимизии входят в состав эпикарда и эндокарда.
Эндомизии – это коллагеновые волокна, которые, окружая каждое мышечное волокно, формируют сетчатый футляр. Вокруг этих мышечных волокон располагаются еще и капилляры. Это тоже очень важно. Межличностные отношения между мышечным волокном и капилляром.
08:48
Эндомизии и эпимизии соединяют перимизии. Роль перимизии чрезвычайно важна в процессах расслабления. Перимизии представляют из себя довольно толстые пучки. Они утолщаются, укорачиваются во время систолы и удлиняются, практически переходя в сплошную ленту при диастоле. Насколько будет эластичен перимизий, настолько будет эластичным наше сердце.
Таким образом, в процессе фиброза миокарда, о котором мы сегодня будем больше говорить, эти три пучка играют большое значение. Эпимизии, эндомизии, перимизии.
(Демонстрация слайда).
Ультраструктурный уровень. Слева находится электронная микрофотография фрагмента левого предсердия. Мы видим, как коллаген-волокна располагаются между фибробластом и капилляром. Скорее всего, здесь речь идет именно об эндомизии.
Рядом показано, как кардиомиоцит отделен от капилляра тонкой пластинкой роста фибробластов. Если фибробласт будет активироваться (мы чуть ниже еще раз вспомним, какими агентами он может активизироваться), это приведет к тому, что отросток фибробласта постепенно будет заменен соединительной тканью.
Сделаем сложное простым. Спросим себя: что такое процесс образования коллагена. Или что такое фиброз. Фиброз – это преобладание синтеза коллагена над его распадом.
Синтез коллагена и его превращение требует активности лизил-оксидазы. Затем в работу вступает металлопротеиназа. Ингибиторы металлопротеиназ будут уменьшать действие последних металлопротеиназ. Происходит деградация коллагена.
Нельзя путать то, что мы видим (фибробласт). Надо понимать, что это не просто преобладание синтеза коллагена над его распадом. Это еще процесс оструктурирования коллагена. Только структурированный коллаген имеет значение в развитии фиброза, а не просто пучки коллагена, которые будут разбросаны по миокардам.
11:27
Мы прекрасно знаем различные типы фиброза, которые говорят о том, по какому пути: по пути апоптоза или некроза пойдет ткань. Нормальная ткань представляет собой кардиомиоциты, которые соединяются друг с другом конец в конец.
Если вдруг произошел инфаркт миокарда и на месте рубца происходит образование репаративного фиброза, то нормальные клетки начинают чередоваться с клетками – участками соединительной ткани. Такой репаративный фиброз возникает на месте дистрофических изменений. Здесь артрофия и дистрофия ткани лежит в основе этого типа фиброза.
Реактивный фиброз – это то, с чем мы встречаемся гораздо чаще. Это все гипертоники (многие, во всяком случае) с длительным стажем артериальной гипертензии (АГ), с плохо леченной АГ. Реактивный фиброз. Здесь происходит увеличение межклеточного матрикса. Коллагеновые пучки становятся более толстыми.
Владимир Леонидович сегодня говорил об аритмиях. Мое глубокое убеждение в том, что, по-видимому, в аритмиях (особенно в суправентрикулярных) повинны процессы фиброза. В частности, может быть, в предсердиях.
У нас будет 20 минут дискуссии. Я думаю, что каждый сможет высказаться по этому поводу.
Во многих экспериментальных исследованиях было доказано, что фиброз может служить основой для развития тахиаритмии. Наиболее аритмогенной зоной служит зона устья легочных вен. Эту зону пытаются ограничить во время малых оперативных вмешательств по поводу нарушений ритма.
(Демонстрация слайда).
При тахиаритмиях срезы приобретают такие очертания. Белое – это участки фиброза. Чем больше фиброза, тем больше предуготованность такого предсердия будет к такиаритмии.
13:51
Мы здесь видим дезорганизованные пучки рукавов миокарда. Они очень густо окутывают устья легочных вен. Соответственно, есть даже работы, которые говорят о том, что проявления фиброза и его распространенность и локализация могут иметь прогностическое значение для выбора тактики ведения пациента с аритмией.
Что влияет на фиброз. Что нам выгодно, наоборот, простимулировать для того, чтобы не допустить развитие фиброза. Нас интересует стимуляторы и ингибиторы фиброгенеза.
К стимуляторам фиброгенеза относится ангиотензин-2. Есть интимные связи между ангиотензинном-2 и TGF beta. Эти связи не до конца раскрыты. Мы сегодня попытаемся еще раз про них поговорить.
Другие факторы роста. Второй хорошо знакомый нам персонаж – альдостерон. Чем больше ангиотензина-2 и альдостерона в плазме или тканевой системе нашего пациента, тем больше у него способность иметь фиброз сердца и (как я покажу дальше) печени.
Эндотелины, катехоламины, молекулы адгезии, галектин-3. Сейчас очень много ведется работ по поводу роли и специфичности галектина-3, который повышается в процессе фиброза. С другой стороны, увеличение синтеза оксида азота, увеличение и активность натрийуретических пептидов, брадикинина, простагландинов приводит к тому, что фиброз у таких пациентов (если активность этих агентов будет высока) будет наступать в меньшей степени.
Хорошо известные нам гормоны (гормон роста, тироксин, ангиотензин-2 и альдостерон). Если сравнить их влияние на несколько стадий в развитии фиброза (на синтез коллагена, на деградацию коллагена и аккумуляцию коллагена), обратите внимание, что гормоны роста и тироксин влияют на синтез и на деградацию коллагена. В этих равнонаправленных практически процессах не создаются условия для того, чтобы происходила аккумуляция коллагена и накапливалась соединительная ткань.
Напротив, влияние ангиотензина-2 и альдостерона преобладает на синтез коллагена. Ангиотензин еще и снижает деградацию коллагена, что сказывается на очень выраженном влиянии на аккумуляцию коллагена. Альдостерон в основном действует на синтез коллагена, не действуя на деградацию коллагена. Соответственно, аккумуляция тоже происходит, но в гораздо меньшей степени.
16:59
(Демонстрация слайда).
Хорошо известная схема была опубликована в 2008-м году. Кардиомиоциты и фибробласты. В мышечном волокне есть кардиомиоциты и фибробласты. Кардиомиоциты изображены розовым цветом. Фибробласты изображены уродливыми формами синим цветом с ядром.
В ответ на механическое растяжение (например, повышение давления в левом желудочке за счет того, что повышается системное артериальное давление (АД) или по каким-то другим причинам), повышается давление внутри желудочка. По градиенту давления будет повышение в системе, например, левого предсердия. Это приводит к механическому растяжению, что стимулирует активность TGF beta.
В то же самое время ангиотензин-2, влияя на те же механизмы и на механизмы, которые происходят в фибробластах, также активизируют активность TGF beta. Все это приводит к тому, что происходит и увеличивается организация коллагена и других белков межклеточного матрикса и возникает фиброз.
Что может подействовать на фиброз. Что-то, что может блокировать ренин-ангиотензин-альдостероновую систему. Было много искроментальных моделей, которые показали, что ингибиторы ангиотензин-превращающего фермента приводят к достоверному снижению фиброза.
Я сегодня буду больше останавливаться на «Лизиноприле» («Lisinopril»), поскольку в этот фиброз я внесла еще и фиброз печени.
Если говорить о фиброзах печени, то механизм был сходный. Опять видим на арене TGF beta, который будет активизироваться ангиотензинном-2. Вы вправе меня спросить: откуда возьмется ангиотензин-2 в печени. Ткань печени (как и любая ткань) снабжена сосудами. Сосудов много. Именно с процессов изменения сосудов начинает происходить процессы фиброгенеза в печени. Я это покажу несколько позже.
Есть определенные параллели в развитии фиброза печени и сердца. Эти параллели кроются в одинаковых клинических предикторах развития фиброза и цирроза печени и цирроза и фиброза сердца.
Во-первых, это возраст. Во-вторых, это повышенный индекс массы тела. В-третьих, это такие комарбидные состояния, как, например, инсулинорезистентность и сахарный диабет. Мы сегодня тоже говорили, как ангиотензин-2 действует на инсулинорезистентность. Это изменение уровня трансаминаз и повышение уровня триглицеридов.
20:08
В сердце реактивный фиброз отмечается при АГ и абдоминальном ожирении. Эпикардиальный жир, который является висцеральным жиром и плацдармом для секреции адипокинов и более быстрого фиброза миокарда, который тоже сначала ассоциируется с нарушенной диастолой. Значит, с фиброобразованием, которое у таких пациентов увеличивается.
Таким образом, мы можем с определенной долей достоверности сказать, что эпикардиальный жир – это новый маркер сердечно-сосудистых заболеваний (ССЗ). Он коррелирует как с висцеральным количеством жира, так и с субклиническим атеросклерозом, с исходом острого коронарного синдрома (ОКС) и, наконец, с установлением диагноза метаболического синдрома.
Еще несколько слов о фиброзе печени и сердца. Общность патофизиологии. Надо остановиться на очень интересном агенте галектин-3. Сейчас есть очень много работ, которые показывают, что галектин-3 увеличивается при фиброзе печени.
Персональное внимание уделяется пероральному ингибитору каспаз и ингибитору апоптоза. Эти исследования пока в ходе.
Я обещала доказать, что печень и сосуды – вещи отнюдь не взаимоисключающие. Печень пронизана сосудами. Именно с калилляризации синусоиды начинаются процессы фиброобразования. Если в норме базальная мембрана представляет собой мембрану с выраженными пространствами Диссе (то есть между синусоидами, выявляются фенестрации), то при механическом повреждении синусоиды теряют фенестрации. Обмен с капилляром, с кровотоком изменяется. Так формируется фиброз.
Иначе ингибиторам АПФ есть на что подействовать и в печени такого пациента.
Последняя составляющая – фиброз сосудов. Фиброз сосудов – это процесс, который обязателен у пожилого человека. Он увеличивается с возрастом. Это главная причина повышения и жесткости при АГ. Можно нарисовать логическую связку, что стабильное повышение АД ведет к активации фибробластов, к снижению активности металлопротеиназ.
12:47
Единственное, что непонятно – что инициирует процесс фиброза. Возможно, роль иммунных клеток или иммунные клетки, которые инфильтрируют сосудистую стенку, выполняют эту неприятную роль.
Периваскулярный фиброз на фоне сахарного диабета. Таких пациентов масса.
Уважаемые коллеги, вспомните свой вчерашний рабочий день, сегодняшний рабочий день. Наверное, вы вспомните пациентов с сахарным диабетом, которые приходят с болью за грудиной. При коронарографии у них чистые коронарные артерии. В чем же тут дело.
Дело в том, что этот ангинозный статус может быть следствием экстравазальной компрессии коронарных артерий, потому что глюкоза способствует образованию «сшивок» коллагена. У пациентов с сахарным диабетом очень сильно выражен периваскулярный фиброз.
Эффекты блокаторов, ингибирующих ренин-ангиотензин-альдостероновую систему, патогенетически обоснованны для профилактики фиброза, как в сердце, так и в печени. Они действуют на TGF beta, на активность некоторых металлопротеиназ. Например, металлопротеиназы первого типа.
Все это подтверждает термин: что хорошо для сердца, хорошо и для печени. В этом уже нет никакого сомнения. Я коротко на этом остановлюсь.
Неалкогольная жировая болезнь печени. Казалось бы, совершенно безопасное, безобидное состояние. Но не столь уж безобидное. Эти пациенты имеют возможность умереть от ССЗ во много раз чаще, чем без такого страдания.
Повышен риск каротидного атеросклероза. Изменяется кинетика тромба. Неалкогольная жировая болезнь печени служит предиктором ССЗ, независимо от других факторов риска. Пути применения и коррекции этого состояния, на первый взгляд, безобидного, меняются.
Если мы говорим о фиброзе, то ингибиторы АПФ, статины, блокаторы ренин-ангиотензиновых рецепторов необходимо применять у такого пациента.
25:14
Что выбрать. Что назначить тучному гипертонику с позиции того, что фиброз есть и в сердце и в печени. Наверное, здесь на первый план выходят препараты, которые не требуют дополнительной метаболизации в печени, которые циркулируют в плазменном звене ренин-ангиотензин-альдостероновой системы.
Очень неплохо с этой точки зрения зарекомендовал себя «Лизиноприл». Мы пользуемся в своей практике препаратом «Диротон» («Diroton»). Когда спрашиваешь врачей, есть ли оригинальный препарат «Лизиноприл», они все отвечают, что это «Диротон». Настолько он себя хорошо зарекомендовал. Подкупает его метаболическая нейтральность и отсутствие трансформации в печени.
Очень часто пациенту, у которого есть фиброз (это пациент высокого риска), нужна комбинированная терапия. Мы сегодня очень много говорили об этой комбинации (крайне интересной, метаболически нейтральной). Антагонисты кальция и то, что блокирует ренин-ангиотензин-альдостероновую систему.
Есть комбинация «Экватор», которая состоит из «Лизиноприла» и горячо всеми любимого «Амлодипина» («Amlodipine»), которой мы тоже пользуемся у пациентов.
В связи с этим хотела вспомнить и сослаться на результаты исследования, которое мы проводили раньше. Попытались посмотреть, что сделает «Лизиноприл» у пациента с сопутствующей патологией печени.
Взяли пациентов с АГ (мягкой и умеренной). Было 25 пациентов. Посмотрели за ними 12 недель. Титровали дозу «Лизиноприла» от 5 мг до 20 мг в сутки. Оказалось, что во время планового обследования…
Было 4 визита, на каждом визите детально обследовался клинический статус пациента: электрокардиограмма, эхокардиограмма, проводилось титрование дозы и мониторирование АД. Пациенты были распределены таким образом. В основном это были пациенты с умеренной АГ. Стаж был не очень большой. Стаж превалировал от одного до пяти лет.
По сопутствующему заболеванию печени пациенты распределились таким образом: в основном вошли пациенты, которые имели алкогольное поражение печени. На третьем визите уже отмечалось достоверное снижение уровня АД на фоне «Лизиноприла». Это все сопровождалось снижением уровня трансаминаз, глютаминтранспептидазы и щелочной фосфотазы.
Все пациенты продемонстрировали прекрасную переносимость. Один пациент закончил прием «Лизиноприла» в этом исследовании в связи с тем, что у него отмечалась головная боль.
28:14
Таким образом, что мы можем сказать по поводу фиброза печени и сердца. Первое – эта проблема актуальна. Второе – эти два процесса в двух совершенно разных органах (сюда же надо присовокупить сосуды) имеют очень много схожих показателей. Это делает возможным и необходимым применение препаратов, которые себя хорошо зарекомендовали с точки зрения воздействия на сердечно-сосудистую систему и на печень.
Принцип: что хорошо для сердца, хорошо и для печени.
Последний вывод: уменьшение фиброза – процесс, который сейчас очень сильно развивается. Нам необходимо читать, смотреть, понимать, что такие препараты как «Релаксин» («Relaxin»), статины, ингибиторы ренин-ангиотензин-альдостероновой системы. Хороший опыт накоплен в отношении «Диротона». Разрушитель поперечных «сшивок» белков. Ингибиторы оксидазы, которая мешает организации коллагена. Ингибиторы фосфолипазы D. Генетическая терапия. Особенно микро-RNK. Думаю, что это поможет в ближайшие 100 лет разрешить проблему фиброза.
Спасибо за внимание.
Протрузия фиброзных колец
По своей сути протрузия фиброзных колец – это вторая стадия течения остеохондроза. Дегенеративные дистрофические изменения в межпозвоночных дисках выходят на следующий уровень. Фиброзное кольцо, не в состоянии усваивать жидкость извне, начинает забирать влагу из структуры пульпозного ядра. Оно быстро уменьшается в объеме и уже не может обеспечивать поддержку нормальной высоты диска.
При этом происходит увеличение занимаемой диском площади. Он начинает выходить за пределы тел позвонков, которые он разделяет между собой. Так начинает оказываться раздражающее давление на окружающие мягкие ткани. Появляется стойкий болевой синдром, который с трудом купируется нестероидными противовоспалительными средствами.
Протрузия с разрывом фиброзного кольца называется экструзией. Если в процессе нарушения целостности фиброзного кольца выпала часть пульпозного ядра, то это грыжа диска. Экструзия – это третья стадия течения остеохондроза.
Разрыв фиброзного кольца межпозвоночного диска
Разрыв фиброзного кольца может происходить только в момент оказания на него серьезного травматического воздействия. Чаще всего при длительно протекающем остеохондрозе разрыв фиброзного кольца диска происходит в момент подъема тяжести, падения на ягодичную область, резкого разворота туловища или головы и т.д.
Если просто сидеть или лежать, то разрыв фиброзного кольца межпозвоночного диска произойти в этот момент не может. Поэтому пациентам с серьезными дегенеративными дистрофическими изменениями в межпозвоночных дисках настоятельно рекомендуют избегать экстремальных физических нагрузок, резких движений и падений.
Разрыв фиброзного кольца позвоночника может быть полным, в результате чего появляется доступ к пульпозному ядру. Частичный разрыв фиброзного кольца – это нарушение целостности только наружной оболочки, но слишком глубокое для трещины.
Грыжа – это разрыв фиброзного кольца с частичным выходом пульпозного ядра наружу. Его студенистое тело состоит из специфических белков, способных притягивать и удерживать жидкость в большом количестве. При выходе за пределы фиброзного кольца белки пульпозного ядра начинают оказывать сильнейшее раздражающее воздействие на окружающие позвоночник ткани. Это провоцирует сильнейшую воспалительную реакцию. Появляется стойкий болевой синдром. Грыжа может оказывать компрессионное воздействие на корешковые нервы и их ответвления. В этом случае клиническая картина дополняется так называемыми неврологическими симптомами:
- иррадиация боли в верхние и нижние конечности, по передней брюшной стенке, между лопаток, имитация сердечного приступа и т.д.;
- онемение и парестезии на тех участках кожи, за которые отвечает пораженная нервная структура;
- слабость в мышцах и снижение их двигательной активности;
- снижение кожной чувствительности;
- ослабевание сухожильных рефлексов и т.д.
При разрыве фиброзного кольца требуется незамедлительное лечение. Если у вас присутствует острая боль с неврологическими признаками, срочно обратитесь на прием к врачу неврологу или вертебрологу.
Хирургическая тактика при узком фиброзном кольце аортального клапана
Назад к программе
Россейкин Е.В., Кобзев Е. Е., Бабуков Р. М., Батраков П. А., Евдокимов М. Е., Гебгардт Т. В., Базылев В. В.
ФГБУ ФЦССХ Минздрава России;
Протезирование аортального клапана (АК) у пациентов с узким фиброзным кольцом остается сложной проблемой. Имплантация протезов небольшого размера нередко приводит к высоким трансклапанным градиентам, несмотря на нормально функционирующий клапан. Пациенты с узким фиброзным кольцом АК, особенно с большой площадью поверхности тела, подвергаются более высокому риску пациент-протезного несоответствия, что связано с худшими клиническими результатами и уменьшением выживаемости.
ЦЕЛЬ:
сравнить 3 хирургических подхода по ранним гемодинамическим и клиническим результатам у пациентов с узким фиброзным кольцом АК (≤21 мм).
МЕТОДЫ.
В ретроспективное исследование включено 177 пациентов с выраженным аортальным стенозом и узким фиброзным кольцом (≤21 мм), которые были прооперированы с января 2010 по июнь 2021 года. Пациенты были разделены на 3 группы: пациентам группа 1 (n=21) было выполнено стандартное протезирование АК каркасным биопротезом; пациентам группы 2 (n=33) в дополнении к протезированию АК выполнялось расширение корня аорты ксеноперикардиальной заплатой по Nicks-Nunez; пациентам группы 3 (n=123) — реконструкция аортального клапана с использованием аутологичного перикарда (операция Ozaki). Эхокардиографические параметры после операции и перед выпиской из стационара.
РЕЗУЛЬТАТЫ.
30-ти дневная летальность в группе 1 составила 4,8% (1 пациент), в группе 2 3,3% (1 пациент), в группе 3 1,6% (2 пациента). У пациентов групп 2 и 3 по сравнению с группой 1 отмечалось более длительное время искусственного кровообращения (150,9±36,1 мин. и 131,2±48,5 мин. против 115,1±56,9 мин.; р=0,0002) и ишемии миокарда (114,1±24,5 мин. и 95,5±30,2 мин. против 80,2±36,4 мин.; р
ВЫВОДЫ.
У пациентов с узким фиброзным кольцом АК (≤21 мм) после операции Ozaki по сравнению с каркасными биологическими протезами и расширением корня аорты отмечаются более низкие пиковый и средний градиенты давления, большая площадь эффективного отверстия и ее индекс. Операцию Ozaki можно рассматривать как одну из опций при узком фиброзном кольце АК, особенно у пациентов с высоким риском возникновения пациент-протезного несоответствия при использовании каркасного биологического протеза.
Как восстановить фиброзное кольцо
В настоящее время лечение разрыва фиброзного кольца может производиться консервативными методами. Но не существует фармаколочгеиские препаратов, которые были бы способны быстро и безопасно восстановить целостность хрящевой ткани.
Как правило, восстановление фиброзного кольца проводится с помощью методов мануальной терапии, лечебной гимнастики, кинезиотерапии, массажа, остеопатии и т.д.
- Перед тем, как восстановить фиброзное кольцо, нужно создать благоприятные условия для регенеративного процесса:
- отказаться от вредных привычек и пересмотреть свой повседневный рацион питания;
- начать вести активный образ жизни;
- обустроить свое спальное и рабочее место с учетом требований эргономики;
- провести несколько сеансов ручного вытяжения позвоночного столба, чтобы восстановить нормальную высоту межпозвоночных промежутков.
Затем доктор разрабатывает индивидуальный курс восстановления фиброзного кольца межпозвоночного диска. Он может назначить курс лечебной гимнастики в сочетании с физиотерапией, иглоукалыванием, массажем и остеопатией.
Если вам необходимо провести лечение нарушения целостности фиброзного кольца межпозвоночного диска, то вы можете обратиться на бесплатный прием к вертебрологу в нашу клинику в Москве.