Главная / Флебология / Врожденные дисплазии или аплазии
Врожденный венозный порок виден у ребенка сразу после рождения. Однако в некоторых случаях патология проявляется спустя годы. Врожденные дисплазии или аплазии могут иметь смешанную форму. Для заболевания капилляров характерно снижение кровотока. Артериальные патологии характеризуются увеличением кровотока.
Причины появления
Обычно патология начинает развиваться у эмбриона в период 4-8 недель внутриутробного развития. Именно в этот период формируется кровеносная система человека.
Причины развития дисплазии сосудов до конца не выявлены. На развитие патологии оказывают влияние многие генетические аномалии. Прием вредных лекарств, большой возраст матери, хромосомная аномалия, инфекция могут оказать прямое влияние на развитие сосудов плода.
К числу провоцирующих факторов также относятся:
- сахарный диабет;
- гипоксия плода;
- туберкулез;
- воздействие угарного газа.
Как заподозрить порок вен?
Сама по себе венозная болезнь предполагает недостаток кровотока. В зависимости от зоны поражения (мозг и ноги) дисплазия может сопровождаться:
- дискомфортом/болями/распиранием в зоне развития (это может быть связано с утолщением стенок сосудов или венозным удвоением);
- часто при венозной дисплазии наблюдается пигментация кожи;
- из-за сдавливания венозной системы тяжами фиброзных тканей возможно вытягивание одной ноги относительно второй;
- нередко дисплазию сопровождает варикоз.
Встречается венозная дисплазия примерно у 2–3 младенцев из 100. Доподлинно причины ее зарождения остаются неизвестными. Болезнь может протекать без признаков (примерно 30% случаев). Наиболее сложные случаи венозной болезни связаны со средоточием пораженных сосудов глубоко в мышцах.
Основную угрозу несет не, собственно, дисплазия, которая де-факто является пороком венозной системы (локализованным или генерализованным), а возможные осложнения, на лечение которых и должны быть направлены усилия. К таким последствиям венозной недостаточной активности относятся:
- разные формы сосудистых мальформаций (патология связей вен с артериями, которая может привести к недостаточному кровоснабжению частей тела);
- кавернозные гемангиомы (сосудистые образования, заметные на коже);
- тромбоз;
- тромбофлебия;
- тромботические язвы;
- аневризмы.
Лечение венозной дисплазии
Методы лечения венозной дисплазии напоминают комплексную терапию варикозной болезни на глубоких стадиях. — Лекарственная терапия улучшает текучесть крови и предотвращает появление сгустков крови (тромбов). — Хирургическое лечение восстанавливает проходимость глубоких вен и устраняет поверхностные вены, на месте которых формируются здоровые вены. — Компрессионная терапия улучшает работу венозной системы, предотвращает появление отеков и трофических язв.
Российская выпускает компрессионное белье (колготки и чулки) 2 класса компрессии, которые подойдут молодым людям с венозной дисплазией поверхностных вен (до появления трофических язв).
Распознавание дисплазии вен
Нередки случаи перерастания венозной во флебоангиозную дисплазию. В этом случае инвалидности не избежать. В случае сепсиса или разрыва аневризмы при венозной болезни возможен и летальный исход.
По этой причине диагностика дисплазии должна проводиться как можно раньше – при первых подозрениях на венозную недостаточность. В современной практике флебологии применяются различные тактики распознавания дисплазии глубоких вен. Поскольку наружные признаки болезни позволяют достаточно точно определить ее локализацию, в проблемной зоне проводится:
- КТ/МРТ/УЗИ;
- ангиография и другие флебологические манипуляции.
Часто для подтверждения проводят исследование мозга (МРТ).
Литература
- Mulliken J. B. Hemangioma sandvascular malformations in infants and children: A classification based on endothelial characteristics / J. B. Mulliken, J. Glowacki // Plast Reconst Surg. – 1982 Mar. – Vol. 69, N 3. – P. 412–420.
- Венозные мальформации (ангиодисплазии) – возможности современных методов диагностики и лечения / В. Н. Дан [и др.] // Флебология. – 2010. – Т. 4, № 2. – С. 42–48.
- Ethanol Sclerotherapy for the Management of Craniofacial Venous Malformations: the Interim Results / Ho Lee // Korean J Radiol. – 2009 May-Jun. – Vol. 10, N 3. – P. 269–76.
- Venous malformations of skeletal muscle / K. D. Hein // Plast Reconstr Surg. – 2002 Dec. – Vol. 110, N 7. – P. 1625–35.
- Ethanol sclerotherapy of venous malformations: evaluation of systemic ethanol contamination / F. D. Hammer // J Vase Interv Radiol. – 2001 May. – Vol. 12, N 5. – P. 595–600.
- Advanced management of venous malformation with ethanol sclerotherapy: mid-term results / B. B. Lee // J Vasc Surg. – 2003 Mar. – Vol. 37, N 3. – P. 533–38.
- Diagnosis and treatment of venous malformations. Consensus Document of the International Union of Phlebology / B. B. Lee [et al.] // Int Ang. – 2009 Dec. – Vol. 28, N 6. – P. 434–51.
- Sonographically guided percutaneous sclerosis using 1% polidocanol in the treatment of vascular malformations / R. Jain // J Clin Ultrasound. – 2002 Sep. – Vol. 30, N 7. – P. 416–23.
- Treatment of venous malformations with sclerosant in microfoam form / J Cabrera // Arch Dermatol. – 2003 Nov. – Vol. 139, N 11. – P. 1409–16.
- Percutaneous sclerotherapy of peripheral venous malformations in pediatric patients / F. Gulsen // Pediatr Surg Int. – 2011 Dec. – Vol. 27, N 12. – P. 1283–37.
Что можно сделать?
При дисплазии важно направить максимум усилий на ликвидацию осложнений и профилактику смежных сосудистых патологий. Только такой подход позволит полностью избавиться от дисплазии (возможно более чем в 40% случаев).
В комплекс мероприятий могут входить:
- лазеротерапия (коагуляция) – один из современных методов активации кровоснабжающих каналов, который дает положительный эффект даже в сложных случаях, связанных с мозговым или внутримышечным поражением;
- обязательна физиотерапия (в том числе, контрастные души, электростимуляция, вихревые ванны);
- рекомендована при венозной дисплазии и постоянная компрессия, но подбирать ее может только врач-флеболог.
В зависимости от времени обнаружения эффективным может оказаться и медикаментозный курс, и срочное оперативное вмешательство. Для самостоятельных действий при венозной дисплазии места мало. Лечебная физкультура, постоянный массаж (разминание), контроль регулярной нагрузки на ноги, если вены поражены в них, – вот, что может сделать родитель для ребенка сам. Без профессионального вмешательства этих мер будет категорически недостаточно.
Клинический случай
Клинический случай демонстрируется с информированного согласия пациентки и письменное согласие представлено в редакцию.
Пациентка, 1987 г.р., обратилась в отделение сосудистой хирургии Дорожной клинической больницы, г. Санкт-Петербург, 17.05.2010 г. с жалобами на наличие двух образований правой половины лица, деформирующих его форму.
Страдает с рождения, отмечает медленный рост образований последние 4 года (рис. 1).
Рис. 1. Фотография пациентки до лечения
Одном из медицинских учреждений Санкт-Петербурга произведена КТ головы, по результатам которого подтверждено наличие участка ангиоматоза в области скуловой дуги и солидной гиперваскулярной структуры в проекции жирового тела правой щеки.
В медицинской помощи отказано с рекомендацией динамического врачебного наблюдения. Через два года, в связи с дальнейшим ростом образований пациентка обратилась на кафедру челюстно-лицевой хирургии Северо-Западного государственного университета имени И.И Мечникова г. Санкт-Петербурга. Учитывая прогрессирующий рост образования, значительное ухудшение качества жизни пациентки рекомендовано стационарное обследование с этапным хирургическим лечением на базе ангиохирургического отделения Дорожной клинической больницы.
При поступлении состояние удовлетворительное. Комплексное обследование не выявило каких-либо отклонений со стороны внутренних органов и систем.
Местный статус. В проекции правой скуловой дуги в толще подкожной клетчатки – образование 4×4 см, округлой формы, мягко-эластической консистенции, с ровными контурами, безболезненное, кожа над ним обычной структуры и окраски; в глубине подкожной клетчатки правой щеки имеется аналогичное образование 5×5 см, кожа щеки обычной структуры и окраски.
При ультразвуковом исследовании (аппарат Logiq Book XP, режим цветного доплеровского картирования, датчик с рабочей частотой 6,8 МГц) тканей скуловой дуги выявлены участки ангиоматоза с разнокалиберны- ми сосудистыми полостями с низко- и среднескоростным кровотоком в последних (рис. 2).
Рис. 2. Ультразвуковая сканограмма ангиоматозных тканей
По результатам пункционной биопсии об- разования щеки данных за наличие злокачественного процесса не выявлено.
В июне 2010 года выполнены: 1 сеанс foam-form склерозирования 2% и 1 сеанс 3% раствором фибро-вейна с интервалом в 10 дней. Оба сеанса без какого-либо клинического эффекта. С июля 2010 по сентябрь 2010 г. выполнены четыре сеанса пункционной эндовазальной лазерной коагуляции (ЭВЛК) ангиоматоза скуловой области и два сеанса ЭВЛК гиперваскулярной ткани щеки справа с временным интервалом 10-14 дней. В сентябре 2010 г. лазерная аблация сосудистого новообразования скуловой области дополнена двумя процедурами foam-form склерозирования 3% раствором фибро-вейна. Все процедуры с хорошим непосредственным клиническим и ультразвуковым эффектом (рис. 3).
Рис. 3. Фотография пациентки после склерозирования и ЭВЛК ангиоматозных тканей
Данное образование значительно уменьшилось в размерах, по данным дуплексного ангиосканирования кровоток в нем не регистрировался.
Однако в области телец Биша образование сохраняло свой объем. С целью коррекции формы лица с радикальным удалением солидной структуры щеки совместно с пластическими хирургами кафедры челюстно-лицевой хирургии Северо-Западного государственного университета имени И.И Мечникова принято решение выполнить открытое комбинированное вмешательство.
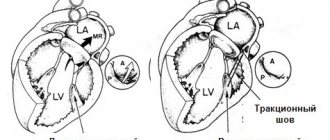
9.03.11 года в отделении ангиохирургии Дорожной клинической больницы проведена операция: односторонний face-lifting со SMAS-пликацией средней и нижней зоны лица; удаление жирового тела щеки; ЭВЛК резидуального участка гиперваскулярной ткани (рис. 4).
Рис. 4. Этапы операции. Стрелками показаны участки гиперваскулярной ткани
Склерозированные и коагулированные лазером на первых этапах основные участки гиперваскуляризации значительно упростили технику вмешательства и позволили выполнить ее почти бескровно.
Послеоперационный период протекал без особенностей. Пациентка выписана 23.03.11 с хорошим клиническим результатом и косметическим эффектом (рис. 5).
Рис. 5. Фотография пациентки после операции
Гистологическое заключение: в первом фрагменте ткани – фрагменты жировой клетчатки с включениями фиброзной и костной ткани. Во втором фрагменте ткани – множество расширенных капилляров и сосудистых полостей различной формы и величины. Стенки полостей выстланы эндотелием и разделены соединительнотканными перегородками.
На примере этого клинического наблюдения мы хотели показать возможности и эффективность различных методов сосудистой облитерации – лазерного, химического и хирургического – в этапном лечении ангиодисплазий. Наличие в арсенале хирурга несколь- ких взаимодополняющих методов лечения позволяет добиться достаточного радикализма и хорошего косметического эффекта.
Причины
Конкретные причины, механизм возникновения и течение болезни окончательно не изучены. Большинство исследователей полагают, что эта системная патология сосудов является следствием врожденных изменений в структуре эластической ткани. Дефицит эластических волокон ведет к компенсаторному увеличению и разрастанию мышечной и фиброзной ткани.
Некоторые врачи акцентируют внимание на определенной роли механического стресса. Примером может служить развитие характерного перерождения почечной артерии вследствие натяжения сосудистой ножки почки при ее чрезмерной патологической подвижности – птозе. Но этот вывод остается достаточно спорным.
Введение
Дисплазии митрального клапана (употребляемые синонимы: пролапс, миксоматозная трансформация, дегенеративная митральная недостаточность) относятся к группе наследственных дисплазий соединительной ткани, гетерогенных по своим фенотипическим проявлениям. Эти системные заболевания соединительной ткани имеют чаще всего аутосомно-доминантный тип наследования мутаций, нарушающих синтез и структурирование волокнистых белков коллагена и эластина и их обозначают как синдром Элерса-Данло. В кардиохирургии это прежде всего больные аневризмами крупных сосудов, неревматической митральной и аортальной недостаточностью, некоронарогенными кардиомиопатиями.
Дисплазии, в основе которых лежит генетически обусловленная дезорганизация волокнистой основы створок митрального клапана, между тем неминуемо прогрессируют с возрастом. Чаще всего клинические проявления такой митральной недостаточности с признаками нарушения центральной гемодинамики развиваются после третьей и четвертой декады жизни [1].
Современный подход к лечению наследственных дисплазий митрального клапана ориентирует на выполнение ранней хирургической коррекции порока, до дилатационного ремоделирования левых камер сердца и развития вторичной кардиомиопатии [2]. При этом стремление сохранить собственный клапан больного и избежать протезирования естественно. Спектр реконструктивных хирургических методик с периода первых разработок в 70-80 годах, сделанных А. Carpentier, а в нашей стране Б.А. Константиновым, ежегодно расширяется [1, 3, 4].
Надежность и долговечность реконструкции должны быть основными критериями при выборе хирургической методики: ненадежная пластика хуже современной, ремоделирующей подклапанные структуры техники протезирования [7]. Цель настоящего ретроспективного анализа заключается в разработке алгоритма выбора хирургической методики при операциях у взрослых больных с дисплазиями митрального клапана.
Материал и методы
В группу больных, отобранных для анализа хирургической тактики при лечении дисплазий митрального клапана, осложненных гемодинамически значимой митральной недостаточностью, вошли 203 человека, оперированных в период с июля 1998 г. по июль 2012 г. 92 операции выполнены в отделе сердечно-сосудистой хирургии Российского кардиологического научно-производственного комплекса (РКНПК) МЗ РФ и 111 операций — в отделении хирургии дисфункции миокарда и сердечной недостаточности РНЦХ. Принципы лечения, тактика и техника хирургических вмешательств были идентичными благодаря работе одной команды специалистов.
Среди оперированных были 139 мужчин и 64 женщины с преобладанием больных молодого и среднего возраста (от 20 до 75 лет; в среднем 52,4 года). По клинической симптоматике все больные были отнесены к III-IV функциональному классу по NYHA.
Пациенты разделены на 2 группы. Основной критерий для разделения — характер хирургического вмешательства на митральном клапане: клапаносохраняющая пластика (73 больных, или 36%) или универсальное хордосохраняющее протезирование.
Принципиально важными во время операции были точный анализ и описание анатомии митрального клапанного аппарата, а также выявление основных причин митральной регургитации (табл. 1 и 2).
Уже только по сравнению причин митральной недостаточности в приведенных таблицах видна существенная разница, определившая выбор хирургической тактики оперирующим хирургом, стремящимся к надежному конечному результату. Вид и объем сопутствующих операций представлены по группам в
табл. 3 и 4.
В группе пластических реконструкций всегда использовали опорное полужесткое кольцо AnnuloFlow (73 операции). Оригинальная техника его имплантации, используемая авторами, заключается в наложении узловых швов без сборивания в области передней створки и непрерывного шва, редуцирующего размер фиброзного кольца в области задней створки. Универсальное хордосохраняющее протезирование также является оригинальной методикой, предполагающей сохранение четырех опорных хорд по передней и задней полуокружности фиброзного кольца митрального клапана. Техника этих операций подробно описана в наших ранних публикациях [1, 6].
При митральном протезировании были использованы только механические протезы, что обусловлено прежде всего относительно молодым возрастом больных (табл. 5).
Все операции выполнены в условиях искусственного кровообращения (28 °С) и холодовой кардиоплегии внеклеточным коллоидным раствором «Консол».
Результаты и обсуждение
Общая госпитальная летальность составила 2,46% (из 203 больных умерли 5). Соответственно в 1-й и 2-й анализируемых группах неудачи распределились следующим образом: в группе пластических реконструкций на митральном клапане — 2,74% (из 73 больных умерли 2), в группе протезирования — 2,3% (из 130 больных умерли 3). Причины госпитальной летальности в обеих группах были различными. В 1-й группе у больной 59 лет, которой в связи с отрывом хорд задней створки была выполнена резекция последней в зоне Р2, пластика и имплантация опорного кольца AnnuloFlow-32, на 5-е сутки после операции на фоне стабильной гемодинамики развилась клиническая картина тяжелого псевдомембранозного колита. В последующем присоединились выраженный гемолиз и острая почечная недостаточность. Несмотря на интенсивную плазмозамещающую и волемическую терапию, сеансы гемодиализа, больная умерла на 9-й день после операции. Другому больному этой группы 71 года также была произведена резекция и пластика задней створки в связи с отрывом хорд и имплантация опорного кольца AnnuloFlow-34. При линейной пластике створки были использованы тефлоновые прокладки. В связи с прогрессирующим послеоперационным гемолизом на 5-е сутки была выполнена операция универсального хордосохраняющего протезирования (дисковый протез МИКС-29). Больной умер на 12-е сутки при явлениях сердечно-легочной и почечной недостаточности.
Во 2-й группе больному 54 лет с отчетливыми симптомами Элерса-Данло произведено митрально-аортальное протезирование (МИКС-31 и МИКС-25). В постперфузионном периоде развилось неконтролируемое кровотечение из корня аорты по линии швов, фиксирующих аортальный протез. У больного 70 лет, у которого изначально имелась дисплазия митрального клапана с отрывом хорд и ишемической болезнью сердца, после операции универсального хордосохраняющего протезирования протезом АТS-28 и 2АКШ развилась тяжелая дыхательная недостаточность. Больной 55 лет с диагнозом вторичной дилатационной кардиомиопатии (ДКМП) и отрыва хорд передней створки умер на 7-е сутки после операции обратного ремоделирования сердца на фоне медикаментозно неконтролируемой аритмии и сердечно-сосудистой недостаточности.
В течение первого года после операции в 1-й группе умерла одна больная 64 лет, которая 2,5 мес ранее перенесла пластическую операцию в связи с отрывом хорд задней створки на фоне инфекционного эндокардита. Она умерла при явлениях остро развившейся митральной недостаточности, на аутопсии выявлен множественный отрыв хорд передней створки. При 14-летнем наблюдении за больными этой группы не было повторных операций, связанных с рецидивом митральной регургитации. Одной больной через 2 года после пластической операции на митральном клапане произведена пластика трикуспидального клапана, обусловленная прогрессированием изолированной (без легочной гипертензии) трикуспидальной недостаточности. Во 2-й группе через 3 года умерла больная в результате остро развившегося (при синусовом ритме и адекватной антикоагулянтной терапии) тромбоза протеза «Роскардикс».
Функциональные результаты прослежены в сроки до 10 лет после операции у 89 больных, оперированных в отделе сердечно-сосудистой хирургии РКНПК МЗ РФ (полнота обследования 94,4%). Большинство пациентов (83,3%) соответствовали I-II функциональному классу по NYHA при среднем сроке наблюдения 6,9±2,4 года.
Таким образом, приведенные результаты позволяют говорить о высокой эффективности хирургического лечения генетически обусловленных дисплазий митрального клапана. Обязательным условием такой эффективности, на наш взгляд, является комплексный хирургический подход с коррекцией всех сопутствующих изменений и осложнений митрального порока.
Выбор хирургической тактики в значительной степени определяется точностью не только анатомической, но и этиологической диагностики порока. Основными критериями диагностики митральной соединительнотканной дисплазии в наших наблюдениях являлись клинические
(рано диагностированный или внезапно появившийся систолический шум, наджелудочковая тахиаритмия, одышка при нагрузке),
эхокардиографические
(пролапс створок, умеренный фиброз, неправильно сформированные створки и подклапанный аппарат, отрыв хорд, увеличение левого желудочка и предсердия, струя регургитации),
медико-генетические
(стигматы системной соединительнотканной дисплазии: сколиоз позвоночника, избыточная подвижность суставов, паховые и пупочные грыжи, нарушение зрения, нарушения сердечного ритма, вегетативные расстройства, синкопе и пресинкопе в анамнезе) и
гистологические
(фрагментация и дезинтеграция коллагеновых и эластических волокон и их частичный лизис, миксоматозная трансформация и уменьшение плотности волокнистых структур, фрагментация субэндотелиальной эластической мембраны, при длительном существовании порока — появление обширных участков краевого фиброза)
критерии.
В настоящее время в лаборатории медицинской генетики РНЦХ им. акад. Б.В. Петровского создан Банк данных биологических образцов больных с синдромом дисплазий соединительной ткани и идет поиск ДНК-мутаций в генах, наиболее часто вовлеченных в патогенез заболевания (д.м.н. Е.В. Заклязьминская, В.А. Румянцева).
Оценивая клиническое состояние наблюдавшихся нами больных, имеющих, как правило, признаки системной декомпенсации кровообращения, следует отметить, что российские кардиологи опаздывают направлять больных с дисплазиями митрального клапана на хирургическое лечение. По сравнению с аналогичными статистиками зарубежных клиник, в которых операции в случае дисплазии митрального клапана считают показанными уже при II функциональном классе по NYHA, в наших наблюдениях доминируют больные с III-IV функциональным классом. У 26 из оперированных степень декомпенсации и нарушения внутрисердечной гемодинамики соответствовали синдрому вторичной дилатационной кардиомиопатии со снижением фракции выброса левого желудочка до 20-25%, что заставило нас решать сложную задачу: предлагать больным реконструктивное органосохраняющее вмешательство или ортотопическую трансплантацию сердца. Соответственно исходной тяжести состояния больных объем хирургического вмешательства существенно превышал только операцию на митральном клапане.
Наш опыт позволяет говорить о том, что все поражения трикуспидального клапана при диагнозе дисплазии соединительной ткани имеют самостоятельный органический характер, а не являются следствием дисфункции митрального клапана: степень трикуспидальной недостаточности, как правило, прямо не зависит от величины давления в легочной артерии и от дилатации и недостаточности насосной функции правого желудочка. Поэтому у всех этих больных, перенесших митрально-трикуспидальное вмешательство, имеются реальные двухклапанные пороки сердца. Больным этой группы шовную аннулопластику по De Vega следует выполнять жесткой нитью «Этибонд-2,0».
При имплантации искусственных хорд в позицию передней створки мы получили хорошие функциональные результаты в 6 наблюдениях. Однако пока относимся осторожно к мысли о расширении показаний к этому виду хордального протезирования у больных с признаками выраженной декомпенсации кровообращения и сочетанными сердечными заболеваниями [5].
Таким образом, оценивая результаты хирургического лечения дисплазий митрального клапана у взрослых в российской популяции, следует отметить тот отличительный факт, что хирургическое лечение приходится выполнять, как правило, больным с гемодинамически запущенными пороками и клиническими симптомами левожелудочковой недостаточности. В такой ситуации выбор хирургической методики и техники оперативного вмешательства играет решающую роль в достижении эффективного и надежного результата. В каждом наблюдении мы стремились к проведению реконструктивного клапаносохраняющего вмешательства, при этом оставляя главным приоритетом надежность операции [7].
Ретроспективно анализируя характер и объем поражения митрального клапанного аппарата и вид выполненной операции (пластика или протезирование), мы определяли те факторы, которые ограничивают возможности надежной реконструкции. При таких структурных и клинических особенностях, как отрыв хорд передней створки митрального клапана, множественный отрыв хорд, чрезмерный избыток створок клапана Бэрлоу, двухклапанный митрально-аортальный порок, прогрессирующая кардиомиопатия и дилатация полостей сердца, вторичный инфекционный эндокардит, часто более надежной, гемодинамически обоснованной и эффективной является операция универсального хордосохраняющего протезирования. Как и клапаносохраняющая коррекция, за счет полноценной работы сохраненных нативных хорд эта операция обеспечивает близкую к естественной механику сокращений левого желудочка.
Абсолютно надежна и долговечна в отдаленном периоде пластическая реконструкция митрального клапана при дилатациии фиброзного кольца, умеренном пролапсе створок, частичном отрыве хорд задней створки. Для выполнения пластической операции в рискованных ситуациях должны быть веские, прежде всего медицинские основания.
Сведения об авторах
Сонькин И.Н., к.м.н., заведующий отделением сосудистой хирургии НУЗ «Дорожная клиническая больница» ОАО «Российские железные дороги», г. Санкт-Петербург. Шайдаков Е.В., д.м.н., профессор, заместитель директора по научной и клинической работе ФГБУ «НИИ Экспериментальной Медицины» Северо-Западного отделения Российской академии медицинских наук, г. Санкт-Петербург. Михайлов В.В., к.м.н., доцент кафедры челюстнолицевой хирургии ГБОУ ВПО «Северо-Западный государственный университет имени И.И Мечникова». Ремизов А.С., к.м.н., заместитель главного врача по хирургии НУЗ «Дорожная клиническая больница» ОАО «Российские железные дороги», г. Санкт-Петербург. Крылов Д.В., хирург отделения сосудистой хирургии НУЗ «Дорожная клиническая больница» ОАО «Российские железные дороги», г. Санкт-Петербург. Черных К.П., хирург отделения сосудистой хирургии НУЗ «Дорожная клиническая больница» ОАО «Российские железные дороги», г. Санкт-Петербург.
Статья поступила 24.05.2013 г.
Диагностика заболевания
Дисплазия слизистой не болит, не мешает жить – у неё нет симптомов.
Самый простой способ выявления патологии слизистой шейки матки был придуман Папаниколау в 1940-х годах и состоял он из взятия соскоба поверхностных клеток. Сегодня применяется модифицированный инструментарий, позволяющий собрать больше материала. Исследование клеток под микроскопом – цитология позволяет определиться во следующим диагностическим этапом – кольпоскопией.
Расширенная кольпоскопия – осмотр тканей под большим увеличением от пятикратного до 30-кратного, с дополнительным усилением «картинки» специальными обработками растворами, что помогает выбору оптимального места для взятия кусочка ткани – биопсии участка дисплазии. Кусочки слизистой размером не менее 3 миллиметров отправляются на микроскопию – гистологию. Биопсия исключается при воспалении и инфекциях, но только на время.
Дальше при морфологическом подтверждении дисплазии проводится выскабливание слизистой оболочки цервикального канала для выявления его изменений, у женщины дисплазия может локализоваться в железистых криптах – ямках слизистой и зона эпителиального перехода способна смещаться выше. Выскабливание визуализирует скрытый от глаза патологический субстрат.