Зачем делать стентирование чревного ствола и брыжеечной артерии
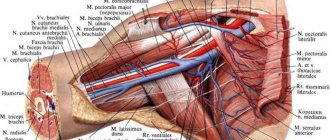
Внутри брюшной полости располагаются органы, которые отвечают за пищеварительные процессы. Они обильно снабжаются кровью крупными сосудами – чревным стволом, верхней и нижней брыжеечной и почечными артериями. Нарушение кровотока в этих артериях затрудняет работу внутренних органов и ухудшает их функциональность. Это нарушение может возникнуть резко, например при закупорке тромбом сосуда, или развиться в хронической форме, когда поступление крови к органу сохраняется, но заметно снижается.
Острое нарушение кровообращения требует немедленного оперативного вмешательства, так как чревато летальным исходом. Хронические формы ухудшают качество жизни человека, вызывают другие заболевания внутренних органов, и также требуют проведения операции.
Стеноз чревного ствола (синдром Данбара) — симптомы и лечение
Лечение стеноза бывает консервативным и оперативным. Первый вариант возможен в стадии компенсации и субкомпенсации. Он направлен на купирование симптомов. Если консервативная терапия оказалась неэффективной, пациенту назначают оперативное лечение.
Консервативная терапия
Консервативное лечение не влияет на основную причину болезни. Оно сугубо симптоматическое или направлено на сопутствующие заболевания: ГПОД или желчнокаменную болезнь.
В качестве симптоматического лечения используют различные лекарства:
- гастропротекторы — защищают и восстанавливают слизистую оболочку желудка;
- обволакивающие препараты — используют с той же целью непосредственно перед приёмом пищи;
- прокинетики — положительно влияют на моторику желудка, назначают при тошноте во время еды или гастроэзофагеальном рефлюксе (ГЭРБ);
- спазмолитики — воздействуют на гладкую мускулатуру, снижая болевой синдром;
- нестероидные противовоспалительные препараты (НПВП) — используются для обезболивания.
Следующий важный момент консервативного лечения — щадящая диета. Важно исключить из рациона острую, жирную и жареную пищу. Чтобы снизить нагрузку на желудок, рекомендуется питаться дробно, небольшими порциями. Также важно избегать стрессов и чрезмерной физической нагрузки. Всё это помогает снизить интенсивность боли после еды.
Некоторые клиники в комплексное лечение включают психотерапию и иглорефлексотерапию [16]. У последнего метода лечения нет безоговорочно доказательной базы, но многие практикующие врачи отмечают его эффективность в комплексной терапии.
Если консервативное лечение не помогает, встаёт вопрос о проведении операции.
Оперативное лечение
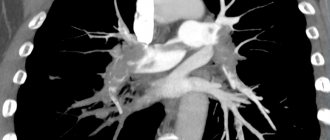
Чтобы выяснить, нужна ли пациенту операция, врач должен определить клиническую стадию болезни, выраженность симптомов, частоту их появления и оценить результаты обследования: УЗДС или КТ-ангиографии.
Затем нужно выбрать метод оперативного лечения:
- отрытая или лапароскопическая декомпрессия чревного ствола [7];
- реконструктивная операция;
- эндоваскулярная хирургия;
- гибридное оперативное лечение.
Отрытая операция — самый частый способ хирургического лечения. Чтобы добраться до чревного ствола, доктор рассекает брюшную стенку, а затем — давящие на него структуры: срединную дугообразную связку диафрагмы и ткани чревного сплетения.
Эта операция эффективна, но довольно травматична. После вмешательства организм восстанавливается примерно три месяца. Могут образоваться вентральные грыжи, при которых внутренние органы смещаются кнаружи. Иногда стеноз развивался повторно [17].
Лапароскопическая декомпрессия чревного ствола по технике выполнения принципиально не отличается от открытой операции. Разница — в менее травматичном (малоинвазивном) доступе и удобном отображении зоны вмешательства, которая видна всей операционной бригаде.
Боль в ране после такой операции менее выражена, пациент быстрее восстанавливается: в среднем 4–5 дней он находится в стационаре под наблюдением врача, а через 3–4 недели возвращается к обычной жизни и привычным нагрузкам.
Об успешной лапаросокпической декомпрессии чревного ствола первым сообщил американский хирург S. Roayaie в 2000 году [19]. С тех пор эту методику осваивают многие хирурги, но пока она не смогла «вытеснить» открытую декомпрессию. Это связано с техническими трудностями во время операции и приверженности пожилых хирургов к традиционной, более привычной методике.
Реконструктивные операции рекомендуются при выраженных изменениях, которые не позволяют освободить чревный ствол от сдавливающих тканей. Они выполняются сосудистыми хирургами в специализированных центрах. Врачи делают пластику чревного ствола или заменяют его трансплантатом — искусственным или естественным, т. е. другим сосудом. Эти операции выполняются открытым способом и переносятся пациентом так же, как и открытая декомпрессия чревного ствола.
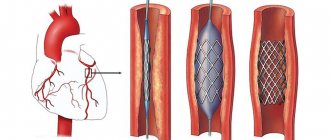
Эндоваскулярная операция рекомендуется пациентам старше 60 лет, артерии которых сужены атеросклеротическими бляшками. Чревный ствол расширяют с помощью баллонного дилататора или стента [18]. Оба варианта можно выполнить только после предварительной хирургической декомпрессии [12].
Хотя эндоваскулярные операции являются самым малоинвазивным способом лечения, они сопровождаются определёнными рисками: деформацией, переломом, миграцией стентов или тромбозом стентированной артерии.
Гибридное (комбинированное) лечение проводится, если чревный ствол сужен как изнутри, так и снаружи. Оно заключается в одномоментном или поэтапном выполнении двух методов лечения: декомпрессии чревного ствола и установки стента [18].
После эндоваскулярных и реконструктивных операций нужно наблюдаться у сосудистого хирурга и постоянно принимать препараты, разжижающие кровь. Схемы приёма зависят от проведённой операции. Эти обязательные меры помогут избежать повторного стеноза.
Подготовка к стентированию чревного ствола и брыжеечной артерии
Врач может назначить пациенту комплекс исследований, в том числе:
- общий анализ и биохимические показатели мочи и крови, оценку показателей свертываемости;
- видеогастроскопию;
- рентген легких;
- электрокардиограмму;
- УЗИ сердца;
- УЗИ брюшной полости;
- мультиспиральную КТ аорты.
Непосредственно перед операцией нужно воздержаться от приема пищи (за 8 часов до вмешательства). За два часа до операции нельзя принимать даже жидкость.
Как проводится стентирование чревного ствола и брыжеечной артерии
Перед операцией внутривенно или внутримышечно может быть введен успокоительный препарат, после чего пациент сопровождается в операционную, где готовят к хирургическому доступу его бедро или локтевой сгиб: обрабатывают кожу септиком, закрывают стерильными простынями операционное поле.
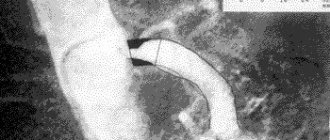
Хирург обезболивает место прокола, пунктирует артерию и устанавливает специальную трубку. Через трубку (интродюссер) врач вводит в аорту проводник, а по нему – катетер для контрастного исследования артерий. Заполняя кровеносное русло, рентгеноконтрастное вещество обозначает места сужения. Прямо во время исследования врач может завести проводник ниже места сужения, доставить туда баллон со стентом и раскрыть его, чтобы увеличить просвет сосуда. Стент поддерживает сосудистую стенку, а артерия начинает пропускать кровоток в нужной мере.
После вмешательства обязательно проведение контрольной ангиографии для исключения осложнений. Из сосуда извлекают катетер, интродюссер, место доступа подвергается компрессии для остановки кровотечения. Для ликвидации разреза используют также специальные сшивающие устройства.
Причины сужения чревного ствола и диагностика методом ультразвукового дуплексного сканирования
Научный интерес к определению информативности неинвазивных методов исследования обусловлен поиском доступных недорогих способов диагностики и прогнозирования органических и функциональных заболеваний внутренних органов. При поражении висцеральных ветвей брюшного отдела аорты появляются клинические признаки, свойственные заболеваниям гастродуоденальной области, желчного пузыря, поджелудочной железы и кишечника. У пациентов с заболеваниями этой области диагностируют органические и функциональные изменения органов, проводят лечение, несмотря на которое рецидивируют симптомы обострения болезни. Изучение кровотока в непарных висцеральных ветвях брюшного отдела аорты
(НВВА) — чревном стволе, верхней и нижней брыжеечной артерии — нередко позволяет установить причину нарушений деятельности органов и подобрать адекватные эффективные методы лечения. Ультразвуковые исследования, выполненные на современной аппаратуре с использованием доплеровских методик, — новая методология визуализации сосудов брюшной полости, позволяющая изучать анатомические особенности и кровоток на всем протяжении артериовенозного русла и расширить возможности диагностики заболеваний гастродуоденальной области.
При ультразвуковом дуплексном сканировании
визуализируют брюшную аорту, начальные отделы чревного ствола и его ветвей (общую печеночную и селезеночную артерии), а также верхнюю и нижнюю брыжеечные артерии. Исследование позволяет оценить размеры сосудов, расширение или сужение их просвета, изменение толщины стенок и соотношение интимы и медии, аневризматические выпячивания, наличие атеросклеротических бляшек, а также изучить скорость и характер кровотока.
К основным признакам, обусловленным нарушениями кровообращения
в непарных висцеральных ветвях брюшного отдела аорты, относят следующие:
- полное отсутствие кровотока в случае окклюзии сосуда,
- снижение скорости кровотока дистальнее места стеноза,
- усиление скорости кровотока непосредственно в месте стеноза и турбулентность в устье сосуда,
- выявление коллатерального кровотока с противоположным током крови при окклюзии магистрального сосуда,
- уменьшение диаметра пораженного сосуда,
- постстенотическое расширение.
Используя различные позиции датчика, из переднебрюшного доступа визуализируют брюшной отдел аорты и ее непарные висцеральные ветви в продольной и поперечной плоскости. Для получения продольного изображения брюшного отдела аорты датчик располагают левее средней линии тела вдоль вертикальной оси туловища, ориентируя плоскость сканирования перпендикулярно передней брюшной стенке c направлением на позвоночный столб при положении пациента на спине. Сканирование проводят ниже мечевидного отростка на 1-2 см, смещая датчик в каудальном направлении. Для получения поперечного среза брюшного отдела аорты датчик должен быть ориентирован перпендикулярно парамедиальной линии слева.
Брюшной отдел аорты
при ультразвуковом исследовании выглядит как трубчатая пульсирующая структура с ровными, гладкими стенками, однородным анэхогенным просветом. Диаметр аорты ниже диафрагмы составляет 25-28 мм, на уровне висцеральных артерий — 20-24 мм. При доплеровском исследовании кровоток в аорте соответствует магистральному типу с наличием острого систолического антеградного пика с высокой максимальной систолической скоростью и обратным кровотоком в период ранней диастолы.
Визуализация чревного ствола
осуществляется при получении поперечных срезов из эпигастральной области. Датчик перемещается от мечевидного отростка каудально (на 2-3 см) до появления характерного признака «крыльев чайки», который обусловлен делением чревного ствола на общую печеночную и селезеночную артерии. Чревный ствол лоцируется в виде сосуда длиной 2-4 см, отходящего под углом от передней поверхности аорты. При поперечном сканировании визуализируют чревный ствол на всем протяжении, а общую печеночную и селезеночную артерии — в области устьев и в проксимальном отделе. Чревный ствол и его висцеральные ветви относятся к артериям с высоким периферическим сопротивлением.
Для получения изображения верхней брыжеечной артерии
в продольном сечении датчик разворачивают на 90°. На 1-2 см ниже чревного ствола определяют отходящую от передней поверхности аорты верхнюю брыжеечную артерию. На поперечных срезах она лоцируется между селезеночной веной и аортой. Верхняя брыжеечная артерия визуализируется над аортой на протяжении 7 см от места своего отхождения. Для получения спектра кровотока контрольный объем располагают в просвете сосуда в 1-1,5 см от места отхождения от аорты. Регистрацию спектра кровотока в верхней брыжеечной артерии выполняют в устье. Верхняя брыжеечная артерия относится к артериям с высоким периферическим сопротивлением.
Нижняя брыжеечная артерия
берет свое начало непосредственно ниже почечных артерии от левой переднебоковой поверхности брюшной аорты. Визуализация нижней брыжеечной артерии затруднена из-за малого диаметра (3 мм и менее). В ряде случаев ее изображение может быть получено при сканировании брюшного отдела аорты в поперечной либо продольной плоскости, ниже устья левой почечной артерии. Спектр кровотока нижней брыжеечной артерии характеризуется высоким периферическим сопротивлением.
К критериям сужения или окклюзии артериальных сосудов
относятся качественные и количественные показатели спектральных характеристик доплеровского сигнала. Рассчитывают количественные показатели, отражающие гемодинамику артериального русла:
- максимальную, среднюю и минимальную скорости кровотока,
- индекс пульсативности (PI),
- индекс резистентности (RI),
- систолодиастолическое соотношение (S/D).
Оценивают качественные характеристики спектра частот доплеровских кривых. Важным признаком сужения артерии является регистрация турбулентного потока с расширением спектра в систолу и диастолу. В случае отсутствия заметного увеличения максимальной амплитуды скорости кровотока при турбулентности потока крови регистрируют широкое распределение частот и уменьшение площади лоцируемого «окна», характерного для нормального ламинарного движения крови в артериальном сосуде.
Наиболее достоверным и информативным признаком сужения магистральной артерии является увеличение максимальной систолической амплитуды доплерограммы (рис. 1).
Максимальную скорость потока крови или пиковую систолическую скорость кровотока
(ПСС) измеряют в висцеральных артериях на уровне устьев и визуализируемых сегментов чревного ствола и верхней брыжеечной артерии. Помимо пиковой систолической скорости кровотока оценивают низкоскоростные показатели кровотока, отражающие изменения (снижение) сердечного выброса либо указывающие на значительное сужение сосуда.
Непременным условием точного измерения
пиковой систолической скорости кровотока в чревном стволе является коррекция угла доплеровского сканирования кровотока, составляющего 60°.
Измерение параметров кровотока проводится в фазу глубокого вдоха и выдоха
. В норме на высоте выдоха отмечается увеличение пиковой систолической скорости кровотока в чревном стволе в среднем на 35,6 ± 5,9% по сравнению с фазой глубокого вдоха. Среднее значение пиковой систолической скорости кровотока кровотока в чревном стволе составляет 98-115 м/с, в верхней брыжеечной артерии — 98-142 м/с, в нижней брыжеечной артерии — 93-189 см/с. По данным Г. И. Кунцевич и соавт., максимальные значения скорости кровотока в чревном стволе соответствуют 128 ± 12 см/с, в верхней брыжеечной артерии — 136 ± 16 см/с. Вариабельность скоростных показателей кровотока является одной из причин расхождения результатов.
В диагностике стенозов
непарных висцеральных ветвей брюшного отдела аорты к наиболее распространенным относят критерии, предложенные G. L. Moneta и соавт. Авторы показали, что максимальная скорость кровотока в чревном стволе 200 см/с и более, в верхней брыжеечной артерии — 245 см/с и более, что свидетельствует о гемодинамически значимых стенозах (> 70%). Чувствительность, специфичность и предсказующая ценность теста для чревного ствола составили 75%, 89% и 85% соответственно.
Помимо изменений пиковой систолической скорости кровотока установлено значение конечной диастолической скорости кровотока
при гемодинамически значимом стенозе верхней брыжеечной артерии. Поскольку увеличивается диастолическая составляющая, приобретающая характер магистрально-измененного типа, при стенозе более 75% изменяется вид доплерограммы верхней брыжеечной артерии. Сравнительный анализ результатов доплерографии и артериографии показал информативность конечной диастолической скорости кровотока в диагностике стенозов чревного ствола и верхней брыжеечной артерии. В результате исследований установили, что для непарных висцеральных ветвей брюшного отдела аорты стеноз артерий более 50% является гемодинамически значимым.
Существуют различные этиологические факторы
, вызывающие анатомические изменения и нарушения гемодинамики в непарных висцеральных ветвях брюшного отдела аорты. Часто называют две основные группы причин, приводящих к изменению просвета сосуда: интравазальные и экстравазальные.
Интравазальные изменения
обусловлены врожденными или приобретенными заболеваниями артерий. К
врожденным
относят аномалии развития сосудов — гипо-, аплазия, фибромускулярная дисплазия, артериовенозные мальформации; к
приобретенным
— атеросклероз, неспецифический аортоартериит, облитерирующий тромбоангиит, постэмболическая окклюзия. Выделяют следующие формы поражения артерий: окклюзия, патологическая извитость, аневризма, также существуют комбинированные и сочетанные формы. Степень сужения сосуда рассматривают как стеноз до 50%, гемодинамически значимый стеноз — > 50%, 75-90%, > 90%.
Экстравазальную компрессию
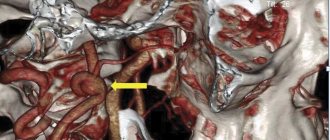
непарных висцеральных ветвей брюшного отдела аорты в первую очередь связывают с особенностями строения и развития аортального отверстия диафрагмы, образуемого спереди и с боков сухожильными краями правой и левой ножек диафрагмы, соединенных срединной дугообразной связкой диафрагмы, а сзади — телами позвонков. Происходит сдавление сосудов срединной дугообразной связкой диафрагмы, ее внутренними ножками, при этом воздействие на чревный ствол отмечают чаще, чем на верхнюю и нижнюю брыжеечные артерии. Причинами частого сдавления чревного ствола являются топографические особенности артерии. Поскольку срединная дугообразная связка диафрагмы располагается на уровне устья чревного ствола или ниже на 2/3 позвонка, во время дыхательных движений она смещается и соприкасается с чревным стволом. В результате взаимодействия чревного ствола и дугообразной связки на выдохе происходит сдавление устья и самого ствола (рис. 2).
Иногда компрессия чревного ствола возникает при высоком отхождении сосуда от аорты либо низком прикреплении диафрагмы с нормальным уровнем отхождения артерии. К тому же нарушения кровотока возникают при перегибе чревной артерии, который может произойти в результате ее низкого отхождения от аорты.
Другой частой причиной компрессии непарных висцеральных ветвей брюшного отдела аорты является внесосудистое сдавление
нервными ганглиями солнечного сплетения, нейрофиброзной тканью чревного сплетения, опухолями.
По данным патологоанатомических исследований, изменения непарных висцеральных ветвей брюшного отдела аорты наблюдают в 19,2-70% случаев, по результатам ангиографии — 4,4-53,5%. В неоднородных по возрастному и половому составу контингентах исследуемых пациентов частота встречаемости компрессии непарных висцеральных ветвей брюшного отдела аорты и причин ее развития значительно варьируются.
И. А. Комиссаров и соавт. наблюдали 538 детей в возрасте 5-18 лет с болями в животе. По результатам комплексного исследования, включающего ультразвуковое дуплексное сканирование, компрессию чревного ствола выявили у 109 детей (20,2%), в том числе у 65 (59,7%) девочек и 44 (40,3%) мальчиков. Среди причин компрессии чревного ствола
у детей выявили экстравазальное воздействие дугообразной связки диафрагмы, внутренних ее ножек, а также сдавление нейрофиброзной тканью чревного сплетения.
Л. А. Звенигородская и соавт. по результатам исследования 236 пациентов (средний возраст 53,5 ± 2,7 лет) с хронической ишемической болезнью органов кровообращения показали, что в большинстве случаев (76,8%) встречается внутрисосудистое поражение непарных висцеральных ветвей брюшного отдела аорты, обусловленное атеросклеротическим процессом в артериях. В остальных случаях экстравазальную компрессию чревного ствола связали с воздействием серповидной связки диафрагмы.
А. В. Покровский указывал, что по результатам ультразвукового доплерографического, рентгенографического и патологоанатомического исследований у пациентов с атеросклерозом коронарных артерий в 73,5% случаев выявляют атеросклеротическое поражение непарных висцеральных ветвей брюшного отдела аорты.
По мнению А. И. Канаева и соавт., исследовавших 325 пациентов в возрасте 17-72 лет (средний возраст 35,5 ± 0,8 лет) с компрессией чревного ствола, нарушения кровотока в чревном стволе обусловлены гемодинамическими факторами, возникающими в результате изолированного стеноза чревного ствола либо в сочетании с нарушением кровотока в верхней брыжеечной артерии. Другие патогенетические факторы гемодинамических нарушений в непарных висцеральных ветвях брюшного отдела аорты включали механическое раздражение срединной дугообразной связкой диафрагмы и пульсовой волной чревного сплетения. У большинства пациентов с гемодинамическими нарушениями в чревном стволе выявлены заболевания желудка, двенадцатиперстной кишки, поджелудочной железы.
По мнению многих исследователей, помимо сдавления непарных висцеральных ветвей брюшного отдела аорты в развитии гемодинамических нарушений значительную роль отводят состоянию коллатерального кровотока
. Коллатеральный кровоток между чревным стволом и верхней брыжеечной артерией обеспечивает панкреатодуоденальная аркада. В случае стеноза чревного ствола, являющегося основным артериальным сосудом, кровоснабжающим регион, недостаточность кровообращения компенсируется посредством перераспределения крови в зонах: из зоны верхнебрыжеечной артерии в зону чревного ствола. Несостоятельность коллатерального кровотока при перераспределении крови приводит к ишемии в обеих зонах (steal syndrome).
В одном исследовании высказывается предположение об общности причинной связи гемодинамических нарушений в чревном стволе с избыточным развитием створок митрального клапана и клиническими признаками пролапса митрального клапана. L. Arcari, исследовав ультразвуковым методом 1560 пациентов, выявил в 3,7% случаев (57 человек — 23 мужчины и 34 женщины) нарушения кровотока в чревном стволе. Пролапс митрального клапана диагностирован у 47 (82,4%) пациентов с нарушениями кровотока в чревном стволе и 118 (7,9%; р < 0,001) без таковых признаков. У большинства пациентов с компрессией чревного ствола (средний возраст 35 ± 12 лет) не было выявлено явных причин для экстра- либо интравазального сдавления артерии. Автор многомерным статистическим анализом показал, что гемодинамические нарушения в чревном стволе являются независимым от пола и возраста фактором, связанным с пролапсом митрального клапана.
Пролапс митрального клапана
и другие варианты малых аномалий сердца нередко определяют у лиц с признаками наследственной дисплазии соединительной ткани, характеризующейся системными изменениями. Среди системных нарушений отмечают особенности развития, функциональные и органические заболевания желудка, двенадцатиперстной кишки, кишечника. Поскольку при наследственной дисплазии соединительной ткани помимо сердечной архитектоники изменяются строение и функциональное состояние сосудистого русла, нарушения кровотока в чревном стволе, возможно, обусловлены особенностями строения и метаболизма соединительной ткани.
T. Scholbach исследовал чревный ствол ультразвуковым методом у 3449 пациентов от 0 до 18 лет с жалобами на абдоминалгию. В 1,7% (59 пациентов в возрасте 22 месяцев — 19 лет, в том числе 81% женского пола) выявлены признаки синдрома компрессии чревного ствола. Результаты сонографии подтвердили у 21 пациента методом магнитно-резонансной томографии. Помимо боли в животе компрессия чревного ствола сопровождалась симптомами боли в грудной клетке (22%), тошнотой (29%), изжогой (17%), рвотой (15%), потерей массы тела (15%), постпрандиальным усилением признаков (15%), диареей (14%), дыхательным дискомфортом (14%), синкопе (12%), систолическим шумом над артерией (15%).
Таким образом, истинная распространенность нарушений кровотока
в непарных висцеральных ветвях брюшного отдела аорты не определена, литературные данные свидетельствуют о вариабельности результатов, обусловленных неоднородностью по возрасту, полу, клиническим проявлениям исследованных пациентов. Ультразвуковая диагностика, включающая режим дуплексного цветового картирования, является доступным методом, сопоставимым с ангиографическими исследованиями, рекомендуемым для скрининга пациентов с нарушениями кровообращения в висцеральных сосудах. При комплексном исследовании пациентов с нарушениями кровообращения в непарных висцеральных ветвях брюшного отдела аорты возникают трудности в выявлении единственной причины экстравазальной компрессии чревного ствола, преобладающей нередко при нарушениях кровообращения в непарных висцеральных ветвях брюшного отдела аорты, поскольку гемодинамические нарушения возникают под влиянием многих факторов.
Трисветова Е. Л., Вараницкая Н. М.
Белорусский государственный медицинский университет, 432-й Главный военный клинический медицинский центр Вооруженных Сил Республики Беларусь. Журнал «Медицинская панорама» № 9, октябрь 2009.