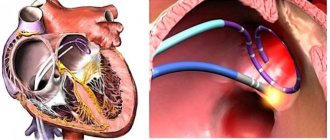
Представляем очередную статью нашего цикла публикаций, посвященного различным формам ИБС (ишемическая болезнь сердца). Сегодня мы поговорим об аритмиях.
Нарушения сердечного ритма и проводимости – это многочисленная группа преходящих или постоянных расстройств, в основном возникающих при органических поражениях сердечно-сосудистой системы. Они обусловлены нарушениями важнейших функций миокарда: автоматизма, возбудимости и проводимости.
Аритмии сердца – это собирательное понятие целого ряда различных нарушений частоты, ритмичности и последовательности сокращений сердца. Диагностика ишемической болезни сердца проводится с помощью ЭКГ..
Частота сердечного ритма у большинства здоровых людей в покое составляет 60–75 ударов в минуту.
Что такое фибрилляция предсердий?
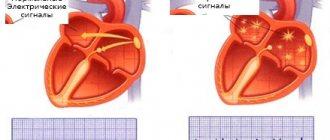
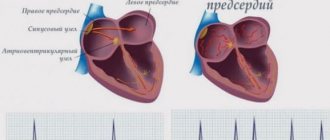
Фибрилляция предсердий — самый распространенный вид аритмии, при котором предсердия сокращаются хаотично и нерегулярно.
Синусовый узел, располагающийся в правом предсердии, продуцирует импульс частотой 60-80 в минуту, который передается по всей проводящей системе сердца. Орган сокращается, образуя синусовый ритм. При фибрилляции предсердий в них возникает много очагов электровозбуждения, в результате чего предсердие очень быстро сокращается, и в этот момент синусовый узел не работает. Пароксизмы (эпизоды) ФП могут быть короткими и бессимптомными, а могут продолжаться несколько дней или месяцев. ФП сама по себе не опасна, но в трети всех случаев приводит к развитию ишемического инсульта.
Чем опасна фибрилляция предсердий?
Среднестатистический российский пациент с фибрилляцией предсердий — это человек 72 лет с ишемической болезнью сердца. Сама по себе ФП не является угрожающим жизни состоянием, но может привести к развитию тяжелой клинической ситуации.
Ишемический инсульт 75% всех инсультов — это ишемические инсульты. Каждый третий ишемический инсульт случается в результате ФП. Как это происходит? При фибрилляции предсердий кровь в сердце имеет турбулентный ход, в левом предсердии возникает тромбоз. Этот тромб забивает сосуды и вызывает инфаркт головного мозга.
Инфаркт миокарда 6 из 10 пациентов с ФП имеют в анамнезе ишемическую болезнь сердца. Если есть ФП и ИБС, то риск развития инфаркта миокарда увеличивается в 5 раз.
Инвалидность и смерть Европейские исследования, основанные на данных 4000 пациентов, показали, что каждый третий человек, перенесший ишемический инсульт на фоне ФП и не принимавший антикоагулянты, умирал в течение трех месяцев. Исследование показало повышение риска инвалидизации на 43%, это происходит из-за длительной реабилитации.
| В 2020-м году Европейское общество кардиологов выработало ABC- алгоритм действий при фибрилляции предсердий: А — антикоагулянты В — контроль частоты сердечных сокращений С — контроль образа жизни человека |
Механизм развития патологии
В стенках желудочков располагаются группы клеток, способные самостоятельно генерировать биоэлектрические импульсы. При полной блокаде атриовентрикулярного узла эта способность приводит к появлению множества изолированных, циркулирующих по кардиомиоцитам желудочков импульсов.
Атриовентрикулярная блокада – причина фибрилляции желудочков
Их силы достаточно для того, чтобы вызывать слабые, разрозненные сокращения отдельных групп клеток, но недостаточно для сокращения желудочков в целом и для полноценного сердечного выброса крови.
Частота неэффективных фибрилляций желудочков варьируется от 300 до 500 в минуту, при этом импульс не ослабевает и не прерывается, поэтому аритмия не может прекратиться самостоятельно (только после остановки сердца или искусственной дефибрилляции).
В результате сила сердечных сокращений, объем выброса, артериальное давление стремительно падают, результатом становится полная остановка сердца.
Как узнать, что у меня фибрилляция предсердий?
Самые частые симптомы ФП — чувство сердцебиения, одышка и общая слабость. Не стоит доверять субъективным ощущениям — необходимо сделать кардиограмму или провести суточный мониторинг ЭКГ по Холтеру.
Холтер поможет более точно определить наличие пароксизмов. Если пароксизм длится от 30 секунд — можно обращаться к врачу за антикоагулянтами. В сутки проходит 40 тысяч сердечных сокращений, из них может быть 400 экстрасистол (сердцебиений вне ритма) — это норма.
Бывает что человек не ощущает пароксизмы — к примеру, когда они случаются ночью. Это плохо, потому что могут образовываться небольшие тромбы, которые будут закупоривать мелкие сосуды головного мозга. Нарушение кровоснабжения некоторых участков приведет к их отмиранию, что значительно повышает риск развития деменции.
У молодых людей экстрасистолы могут иметь внесердечные причины — необходимо проверить показатели ферритина, гемоглобина, гормонов щитовидной железы, исследовать желудочно-кишечный тракт с целью исключения рефлюкса-эзофагита, который также вызывает срывы ритма, в том числе и фибрилляцию предсердий. Людям с ФП раз необходимо в 6 месяцев сдавать анализы показателей печени, почек, общий анализ крови.
| Существует три формы фибрилляции предсердий: — Постоянная форма — Персистирующая форма (ФП проходит с медицинской помощью) — Пароксизмальная форма (ФП появляется и проходит самостоятельно) |
Характерные симптомы
Фибрилляция желудочков – жизнеугрожающее состояние с выраженными симптомами, эквивалент клинической смерти.
Во время аритмии функция желудочков нарушена, кровь в сосудистую систему не поступает, ее движение останавливается, стремительно нарастает острая ишемия (кислородное голодание) головного мозга и других органов. Больной не способен двигаться, быстро теряет сознание.
Летальный исход в 98% наступает в течение часа от появления первых признаков фибрилляции желудочков (промежуток времени может быть значительно короче).
Все симптомы фибрилляции проявляются почти одновременно:
- нарушение ритма сердца;
- резкая головная боль;
- головокружение;
- остановка сердца;
- внезапная потеря сознания;
- прерывающееся дыхание или полное его отсутствие;
- резкая бледность кожи;
- неравномерный цианоз (синюшность носогубного треугольника, кончиков ушей, носа);
- отсутствие пульса на крупных артериях (сонных и бедренных);
- расширенные зрачки глаз, не реагирующие на яркий свет;
- судороги или полная расслабленность;
- непроизвольное мочеиспускание, дефекация (не обязательно).
Период клинической смерти (пока изменения в организме не стали необратимыми) продолжается в течение 4–7 минут от момента полной остановки сердца, дальше наступает биологическая смерть (когда начинается процесс клеточного распада).
Главные препараты для профилактики инсульта при ФП — это антикоагулянты
Главные препараты для пациентов с ФП, профилактирующие инсульт, — антикоагулянты, воздействие которых снижает свертываемость крови. Они предотвращают образование тромбов и следовательно, снижают риск развития инсульта. Свертываемость является нормальной защитной реакцией организма на повреждение сосудистой стенки. При фибрилляции предсердий антикоагулянты принимать абсолютно необходимо практически всем.
Самые известные в России антикоагулянты — «Эликвис», «Ксарелто» и «Прадакса».
Также некоторым пациентам можно принимать «Варфарин» (с контролем МНО). Его назначают при низкой скорости клубочковой фильтрации (или клиренса креатинина — показателя работы почек) или при протезированных клапанах.
Принимая «Варфарин», необходимо контролировать МНО в крови (Международное Нормализованное Отношение) — показатель должен быть от 2.0 до 3.0.
| Главные препараты для пациентов с ФП, профилактирующие инсульт — антикоагулянты, воздействие которых снижает свертываемость крови. При фибрилляции предсердий антикоагулянты принимать абсолютно необходимо практически всем. |
Диагностика
Диагностируют фибрилляцию желудочков, ориентируясь по внешним симптомам (отсутствие пульса, дыхания, реакции зрачков на свет). На электрокардиограмме последовательно фиксируется несколько стадий развития аритмии:
- Короткая тахисистолия или трепетание желудочков (15–20 секунд).
- Судорожная стадия (частота сокращений стремительно нарастает, нарушается ритм, сердечный выброс ослабевает, занимает промежуток времени до 1 минуты).
- Собственно фибрилляция желудочков сердца (регистрируются достаточно крупные, но хаотичные и частые (300–400) волны мерцания без выраженных интервалов и зубцов, меняющие высоту, форму, протяженность, стадия длится от 2 до 5 минут).
- Атония (появляются мелкие, небольшой длины и высоты низкоамплитудные волны, продолжается до 10 минут).
- Полное отсутствие сердечных сокращений.
Поскольку любое состояние с подобными симптомами – прямая угроза жизни, реанимационные мероприятия начинают немедленно, не дожидаясь данных ЭКГ.
Проявление патологии на ЭКГ
Принимать антикоагулянты можно только по назначению врача
Стандартная дозировка: «Ксарелто» 20 мг / 1 раз в день «Эликвис» 5 мг / 2 раза в день «Прадакса» 150 мг / 2 раза в день
Исследования показывают, что пациентам удобнее принимать «Ксарелто» — прием 1 раз в день легче запомнить, особенно пожилым людям.
«Вафарин»: пить по одной таблетке вечером, через 3–4 дня сдать МНО. Если МНО не достигло 2.0, то доктор должен увеличить дозировку. МНО следует сдавать раз в 3–4 дня, пока нужный уровень не будет достигнут. Затем нужно сдавать МНО раз в 3 недели.
Важно: все препараты и их дозировка назначаются строго на очном приеме у врача! Данная информация носит ознакомительный характер и не может быть руководством к действию. Самолечение при аритмии недопустимо и может иметь серьезные последствия для здоровья.
| Снижение дозировки антикоагулянтов в основном зависит только от трех параметров: — Показатель клиренс-креатинина меньше 50. — Вес пациента меньше 65 кг. — Возраст пациента больше 85 лет. В остальных случаях снижение дозировки грозит риском инсульта. |
Антикоагулянты разжижают кровь — это опасно?
Как и любые кроворазжижающие препараты, антикоагулянты могут вызвать кровотечение. Однако, риск кровотечения в 10 раз ниже риска инсульта. Если у человека спонтанные синяки, кровь из носа, обильные менструации, кровь в моче — это не показатель того, что нужно снижать дозировку. От мелких кровотечений не умирают, в отличие от инсульта. При вышеуказанных симптомах кровотечений нужно прийти на осмотр к лечащему врачу — гинекологу, урологу и, обязательно, к кардиологу.
| Если человек принимает антикоагулянты, он должен раз в 6 месяцев сдавать общий анализ крови, креатинин, скорость клубочковой фильтрации (клиренс–креатинин), калий, натрий, АЛТ, АСТ. |
Фибрилляция желудочков и внезапная сердечная смерть
Предыдущая | Содержание | Фибрилляция, или мерцание, желудочков — это аритмичные, некоординированные и неэффективные сокращения отдельных групп мышечных волокон желудочков с частотой более 300 в 1 мин. При этом желудочки не развивают давления, и насосная функция сердца прекращается. Близким к фибрилляции желудочков является их трепетание, которое представляет собой желудочковую тахиаритмию с частотой 220— 300 в 1 мин. Как и при фибрилляции, сокращения желудочков при этом неэффективны и сердечный выброс практически отсутствует. Трепетание желудочков — неустойчивый ритм, который в большинстве случаев довольно быстро переходит в их фибрилляцию, изредка — в синусовый ритм. Клинически эквивалентна фибрилляции желудочков также частая желудочковая тахикардия с потерей сознания (так называемая желудочковая тахикардия без пульса).
Фибрилляция желудочков является основной причиной внезапной сердечной смерти, возникающей на фоне стабильной гемодинамики в течение 1—б ч от появления симп томов нарушения состояния. В последнее время большинство специалистов ограничивает это временное окно 1 ч. Удельный вес фибрилляции желудочков среди непосредственных причин внезапной сердечной смерти составляет 75 —80 %.
Этиология и частота. Этиологическими факторами фибрилляции желудочков и связанной с ней внезапной сердечной смерти в порядке убывающей частоты являются:
1) ИБС, прежде всего острое нарушение коронарного крово обращения, острый и перенесенный инфаркт миокарда (см. также в разделе Внезапная коронарная смерть, т. I ). По данным фремингемского исследования, при ИБС на долю внезапной сердечной смерти приходится 46 % летальных исходов среди мужчин и 34 % — среди женщин. Близкие данные получены и в других исследованиях. Наибольшая частота фибрилляции желудочков и внезапной сердечной смерти отмечается на высоте ишемии миокарда в первые 12 ч острого инфаркта. Тромбы в венечных артериях сердца обнаруживают ся примерно в 50 % случаев внезапной внебольничной смерти, а новый инфаркт миокарда с зубцом О диагностируют приблизительно у 25 % успешно реанимированных. Постановка этого диагноза сопряжена с определенными трудностями, так как отмечающиеся у части больных после реанимации изменения реполяризации и повышение активности кардиоспеци-фических ферментов могут быть вызваны длительной артериальной гипотензией во время нарушения ритма. Повышенный риск фибрилляции желудочков и внезапной сердечной смерти отмечается также у больных, перенесших инфаркт миокарда с зубцом О,
в связи с наличием морфологического субстрата для возникновения потенциально фатальных желудочковых аритмий;
2) гипертрофическая кардиомиопатия. При гипертрофической кардиомиопатии внезапная сердечная смерть чаще всего наступает у лиц молодого возраста во время интенсивной физической нагрузки. С возрастом ее риск снижается. В последние годы обнаружена ее связь с определенными вариантами генных мутаций из числа ответственных за возникновение этого заболевания. Во время остановки кровообращения у таких больных обычно регистрируется полиморфная желудочковая тахикардия или фибрилляция желудочков. Необходимо помнить, что потеря сознания и выраженные нарушения гемодинамики у них могут вызываться также любой супра-вентрикулярной тахикардией с частым ритмом желудочков;
3) идиопатическая дилатационная кардиомиопатия. На долю таких больных приходится около 10 % успешно реанимирован ных после внезапной остановки сердца. Внезапная смерть наступает обычно на фоне выраженных расстройств гемоди-
намики примерно у половины больных дилатационной кар-диомиопатией. Необходимо помнить, что у таких больных, как и у больных гипертрофической кардиомиопатией, внезапная смерть одинаково часто обусловлена фибрилляцией желудочков и брадиаритмиями;
4) аритмогенная кардиомиопатия правого желудочка. Хотя такие больные весьма подвержены мономорфной желудочковой тахикардии с частой трансформацией в фибрилляцию желудочков, вследствие редкой встречаемости этого заболевания его удельный вес среди причин внезапной смерти от аритмии очень мал;
5) клапанные пороки сердца. Среди них к возникновению фибрилляции желудочков и внезапной сердечной смерти чаще всего приводит стеноз устья аорты (врожденный и приобретенный), что, как и в случае гипертрофической кардиомиопа-тии, обусловлено гипертрофией миокарда левого желудочка и возможностью резкого ухудшения его наполнения и изгнания. У больных с пролапсом митрального клапана, несмотря на зна чительную частоту желудочковых аритмий, фибрилляция желудочков возникает крайне редко и обычно связана с нарушениями электрофизиологических свойств миокарда (см. ниже);
6) специфические кардиомиопатии, прежде всего воспалительного характера, особенно кардиомиопатия при саркои-дозе;
7) первичные нарушения электрофизиологических свойств миокарда при отсутствии видимых структурных заболеваний сердца. К этой категории относятся синдром удлинения интервала О—Т
(врожденный и приобретенный, ятрогенного происхождения) и суправентрикулярная тахикардия при синдроме преждевременного возбуждения желудочков, ЭКС или электрическая кардиоверсия с нанесением импульсов тока на зубец
Т.
Встречаются также случаи идиопатической фибрилляции желудочков, которые предположительно связывают с дисфунк цией вегетативной нервной системы.
Риск возникновения внезапной смерти наибольший у перенесших внезапную остановку кровообращения, у которых он составляет 10—30 % в год. У больных идиопатической дилата ционной кардиомиопатией он примерно равен 10 % в год, в
течение первого года после инфаркта миокарда — 5 %,
при гипертрофической кардиомиопатии и синдроме удлиненного интервала
Q
—Г— 1—3 %. Для сравнения можно привести такие данные: у взрослого населения США частота внезапной смерти составляет 0,22 % в год и у больных с пролапсом митрального клапана без регургитации — 0,019 % ( G . Nacca — relli , 1966).
Кроме перечисленных случаев развития фибрилляции желудочков как причины внезапной сердечной смерти в результате первичных нарушений электрофизиологических свойств миокарда, связанных или не связанных с органическими заболеваниями сердца, она может быть терминальной аритмией, возникающей на фоне прогрессирующих расстройств центральной и периферической гемодинамики.
Патофизиологические механизмы. В основе возникновения фибрилляции желудочков лежат множественные очаги ри-эн-три в миокарде с постоянно меняющимися путями. Это обусловлено неоднородностью электрофизиологического состояния миокарда, когда его отдельные участки одновременно находятся в разных временных периодах де- и реполяризации.
Фибрилляция желудочков более чем у 90 % больных вызывается желудочковой тахикардией, мономорфной или полиморфной, значительно реже она может индуцироваться 1—2 ранними, типа Дна Г, желудочковыми экстрасистолами, вызывающими возникновение неодинаковой степени деполяризации в различных мышечных волокнах. Фибрилляция желудочков у человека не может прекратиться спонтанно. Восстановить синусовый ритм способна лишь электрическая дефибрилляция, эффективность которой зависит от характера основного заболевания, выраженности связанной с ним сердечной недостаточности, а также от своевременности применения. Описанные в литературе случаи купирования фибрилляции желудочков с помощью одних медикаментозных препаратов единичны и вызывают сомнение.
Клиника. Поскольку при возникновении фибрилляции желудочков насосная функция сердца прекращается, отмечается картина внезапной остановки кровообращения и клинической смерти. Больные теряют сознание, что часто сопровождается судорогами, непроизвольными мочеиспускани-
ем и дефекацией. Зрачки расширены и не реагируют на свет.
Развивается диффузный цианоз, отсутствуют пульсация на крупных артериях — сонных и бедренных — и дыхание. Если в течение 4 мин не удается восстановить эффективный сердечный ритм, наступают необратимые изменения в центральной нервной системе и других органах.
При трепетании желудочков МОС, сознание и АД, обычно низкое, на короткое время могут сохраняться. В большинстве случаев, однако, этот неустойчивый ритм довольно быстро переходит в фибрилляцию желудочков.
На ЭКГ
фибрилляция желудочков проявляется различными по амплитуде и продолжительности хаотическими волнами мерцания с недифференцирующимися зубцами и частотой более 300 в 1 мин. В зависимости от их амплитуды можно выделить крупноволновую (см. рис. 35, е) и мелковолновую (см. рис. 35,
д)
фибрилляцию желудочков. При последней амплитуда волн мерцания составляет менее 0,2 мВ и вероятность успешной дефибрилляции значительно ниже.
Дифференциальная диагностика. Возможность внезапной остановки кровообращения следует иметь в виду во всех случаях потери сознания. Этому вопросу посвящена специальная глава. Хотя при внезапном прекращении сердечной деятельности в течение первых 1—2 мин может сохраняться агональ-ное дыхание, ранним признаком этого состояния является отсутствие пульсации на крупных артериях и, что менее надежно, тонов сердца. Быстро развивается цианоз и расширяются зрачки. Подтвердить диагноз и установить непосредственную причину внезапной остановки сердца (фибрилляция, асистолия желудочков, электромеханическая диссоциация) позволяет регистрация ЭКГ. Необходимо подчеркнуть, что сердечно-легочную реанимацию следует начинать, не дожидаясь данных ЭКГ, сразу после постановки клинического диагноза внезапной остановки сердца.
Крупноволновую фибрилляцию желудочков на ЭКГ иногда бывает трудно отличить от трепетания желудочков и полиморфной желудочковой тахикардии. Для обеих этих форм аритмий характерна меньшая частота желудочковых комплексов, а для трепетания — также большее постоянство их амплитуды.
Осложнения и исходы фибрилляции желудочков зависят от своевременности оказания медицинской помощи — сердечно-легочной реанимации (см. ниже). Эффективность последней, в свою очередь, определяется характером органического заболевания сердца, прежде всего выраженностью его дисфункции, и своевременностью начала реанимационных мероприятий. За исключением относительно редких случаев ранней электрической дефибрилляции, после восстановления эффективного сердечного ритма отмечаются более или менее выраженные осложнения, связанные как с остановкой кровообращения, так и с самими реанимационными мероприятиями. К возможным осложнениям со стороны легких относятся аспирационная пневмония и повреждение легких при переломе ребер. Во время остановки сердца развивается тотальная ишемия миокарда, а после восстановления коронарного кровообращения — его более или менее выраженная преходящая дисфункция вследствие реперфузионного синдрома и так называемого оглушения ( Stunning ). В постреанимационный период очень часто возникают также самые разнообразные аритмии, обусловленные либо той же причиной, что и предшествовавшая фибрилляция желудочков, либо нарушениями биоэлектрической и механической функций миокарда, связанными с перенесенной остановкой кровообращения. Неврологические осложнения (аноксическая энцефалопатия) проявляются судорожным синдромом и комой, вплоть до декортикации. Даже после сравнительно длительного, до. 72 чг периода бессознательного состояния, сознание может вос становиться без остаточных неврологических нарушений. Если продолжительность комы превышает 3 сут, прогноз в отношении выживания и восстановления функции головного мозга плохой.
Лечение включает неотложную помощь — сердечно-легочную реанимацию и, в случае успеха, мероприятия по преду-1 преждению повторного возникновения фибрилляции желудочков и внезапной смерти.
Сердечно-легочная реанимация.
Сердечно-легочная реанимация состоит в обеспечении адекватной вентиляции легких и циркуляции крови до устранения причины прекращения дыхания и кровообращения.
Современная концепция комплексной сердечно-легочной реанимации была разработана в I960 г. P . Safar , W . Kouven — hoven и G . Knickerbocker . В конце 20-х годов W . Kouvenhoven с сотрудниками, изучавшие действие электрического тока на сердце в эксперименте по заказу Электрической компании США, впервые обнаружили, что ток низкой мощности способен вызывать фибрилляцию желудочков, а высокой — ее устранять, причем электрическую дефибрилляцию можно производить даже без вскрытия грудной клетки. Первая успешная электрическая дефибрилляция в клинике была выполнена, однако, лишь 20 лет спустя С. Beck на открытом сердце во время кардиохирургической операции током переменной частоты. Современный дефибриллятор с использованием импульсного тока был создан В. Lown в 1960 г.
Эффективность искусственного дыхания изо рта в рот была доказана P . Safar в 1957 г. В конце 60-х годов W . Kouvenhoven и G . Knickerbocker , проводя экспериментальные исследования, обнаружили возможность увеличения продолжительности временного окна для успешной электрической дефибрилляции с помощью закрытого массажа сердца и вскоре с успехом использовали этот прием в клинике.
Раньше считали, что при проведении наружного массажа сердца искусственное кровообращение обеспечивается механическим сдавлением сердца между грудиной и позвоночником. В 70-е годы теория сердечного насоса подверглась критике. Основанием для этого послужили данные эхо-кардиографии о несостоятельности сердечных клапанов во время реанимации и наблюдения о способности одного только повышения внутригрудного давления при кашле, без наружного сдавления сердца, вызывать искусственное кровообращение, достаточное для минимального жизнеобеспечения. Согласно этой теории грудного насоса, в основе эффективности наружного массажа сердца лежит создаваемое им повышение внутригрудного давления, в результате чего происходит спадение вен верхней грудной апертуры, в то время как просвет артерий остается свободным. Следует отметить, однако, что даже при оптимальном выполнении наружное сдавление сердца обеспечивает не более чем 30 % величины МОС в норме.
В соответствии с рекомендациями по основам поддержания жизнеобеспечения у взрослых Европейского совета по реанимации (1998), базирующимися на соответствующих рекомендациях Международного согласительного комитета ( ILCOR ), последовательность действий при проведении сердечно-легочной реанимации на неспециализированном этапе включает:
1) проверку реакции на вопрос: с Вами все в порядке? и мягкое потряхивание за плечи;
2) при отсутствии ответа словом или движениями — обеспечение проходимости дыхательных путей. Для этого голову больного, который должен лежать горизонтально на спине без подушки на твердой поверхности (полу, земле или щите), осторожно запрокидывают назад, положив руку ему на лоб. Одновременно другой рукой выводят кпереди и кверху нижнюю челюсть. В результате язык смещается в ротовой полости кпереди, что предупреждает закрытие его корнем воздухоносных путей;
3) определение наличия или отсутствия дыхания путем оценки дыхательных движений грудной клетки, дыхательных звуков изо рта больного и ощущения его дыхания щекой спасателя;
4) при отсутствии дыхания — проведение двух искусственных вдохов после предварительной ревизии полости рта и (при необходимости) удаления из нее инородных тел, зубных протезов и рвотных масс. Искусственное дыхание проводят путем.. вдувания воздуха изо рта спасателя в рот больного, зажав его-нос большим и указательным пальцами руки, которая находит- ; ся на лбу, и поддерживая приподнятое положение подбородка. Вдувание проводят относительно медленно — на протяжении 1,5—2 с, так как податливость легких в этой ситуации зна-чительно снижается. При медленном вдувании также уменьшается риск открытия нижнего сфинктера пищевода, наполнения воздухом желудка и регургитации и аспирации его содержимого. Количество вдуваний составляет 10—12 в 1 мин. Рекомен дуемый объем вдуваемого воздуха — 400—500 мл (в предыдущих рекомендациях — 800—1200 мл). Установлено, что, в связи>, со значительным снижением образования углекислоты во вре-;, мя остановки сердца, этого достаточно для адекватной вентиля-
ции. При проведении дыхания изо рта в рот необходимо контролировать его эффективность, наблюдая за движениями грудной клетки;
5) оценку состояния кровообращения путем наблюдения за видимыми движениями, включая глотательные и дыхательные (кроме редких атональных вдохов), и проверки пульса на сонных артериях. На это следует потратить не более чем 10 с. Поскольку определить наличие или отсутствие пульса обывателю с достаточной точностью за 10 с практически невозможно, для перехода к следующему этапу данного алгоритма, ориентированного на население, в отличие от предыдущих рекомендаций, достаточно отсутствия каких бы то ни было видимых признаков жизни;
6) при отсутствии признаков жизни и кровообращения — непрямой массаж сердца. Его выполняют путем надавливания ладонями двух сцепленных кистей на нижнюю половину грудины на 4—5 см вглубь. Для обеспечения оптимальной в этой ситуации перфузии внутренних органов частота сдавле-ний должна составлять 100 в 1 мин. Однако при проведении реанимации одним спасателем каждые 15 сдавлений чередуют с 2 вдуваниями, поэтому за 1 мин можно произвести лишь 60 компрессий и 8 вдохов.
Первичную реанимацию продолжают до прибытия квалифицированного медицинского персонала и (или) появления признаков жизни больного.
В последние годы растет обеспокоенность относительно риска передачи инфекции от потерпевшего к реаниматору при искусственном дыхании изо рта в рот. Имеются сведения о возможности заражения при этом кожным туберкулезом, шигеллиозом, менингококковым менингитом, простым герпесом и сальмонеллезом. Этот риск, однако, ничтожно мал. При этом сообщения о случаях передачи таких получающих все большее распространение инфекционных заболеваний, как СПИД и гепатит, полностью отсутствуют. В то же время установлено, что при проходимости дыхательных путей один только правильно выполняемый наружный массаж сердца обеспечивает адекватный газообмен с поддержанием насыщения артериальной крови кислородом более чем на 90 % в течение не менее чем 4 мин, что позволяет на протяжении
этого времени обойтись без дыхания изо рта в рот. Избежать контакта с ртом больного и несколько повысить эффективт ность искусственного дыхания при проведении мероприятий по поддержанию жизнеобеспечения можно при использовании пластмассовых трубок — воздухопроводов, удерживающих язык кпереди, и маски с мешком типа Амбу.
Сердечно-легочную реанимацию на специализированном этапе начинают с электрической дефибрилляции, которую проводят вслепую, без предварительной оценки сердечного ритма по данным ЭКГ. Концепция о важности возможно более ранней электроимпульсной терапии основывается на следующих фактах:
а) на долю фибрилляции желудочков и желудочковой та хикардии, сопровождающейся исчезновением пульса, прихо дится подавляющее большинство — не менее 80 % — случаев внезапной остановки кровообращения у взрослых;
б) фибрилляция желудочков у человека не может прекра титься спонтанно, а купируется лишь с помощью электричес кой дефибрилляции. Последняя является также наиболее действенным методом восстановления синусового или другого гемодинамически эффективного суправентрикуляриого ритма при желудочковой тахикардии;
в) эффективность дефибрилляции с течением времени быстро снижается. По имеющимся данным, вероятность ус пеха реанимации с каждой минутой, прошедшей от момента наступления клинической смерти, уменьшается на 7—10 % ( R . Cummins и соавт., 1991). Это обусловлено переходом круп новолновой фибрилляции желудочков в мелковолновую и асистолию, которые сопряжены со значительно худшим про гнозом.
В связи с этим дефибриллятором дожны быть оснащены каждая бригада скорой помощи и все подразделения медицинских учреждений, а владеть этим методом реанимации должны все медработники. Поднимается вопрос о целесообразности использования дефибрилляции также всеми пара-медицинскими бригадами, оказывающими неотложную медицинскую помощь.
Электрическую дефибрилляцию производят трансторакальным путем током синусоидальной формы разрядом с на-
чальной мощностью 200 Дж. Важное значение имеют хороший контакт электродов с кожей и их правильное расположение. Один из них обычно помещают книзу от правой ключицы по среднеключичной линии, а второй — над нижними ребрами по левой передней подмышечной линии, т. е. кнаружи от верхушки сердца, за пределами молочной железы. При безуспешности дефибрилляции можно попробовать изменить положение электродов на переднезаднее.
До подключения дефибриллятора можно использовать прием толчка в прекардиальную область, эффективность которого, однако, убедительно не доказана. Он не позволяет купировать фибрилляцию желудочков, а при желудочковой тахикардии иногда вызывает ее трансформацию в фибрилляцию желудочков или асистолию.
Алгоритм сердечно-легочной реанимации на специализированном этапе зависит от характера сердечного ритма по данным ЭКГ. При этом в зависимости от наличия или отсутствия фибрилляции желудочков или желудочковой тахикардии используют один из двух вариантов.
В случаях обнаружения фибрилляции желудочков или желудочковой тахикардии проводят дефибрилляцию тремя разрядами мощностью 200, 200 и 360 Дж. Если после этого на ЭКГ регистрируется изолиния продолжительностью более 1 стандартного интервала, что может быть обусловлено электрическим или механическим оглушением, необходимо продолжить сердечно-легочную реанимацию в течение 1 мин, после чего вновь оценить ритм. В случаях сохранения фибрилляции желудочков или желудочковой тахикардии для обеспечения оптимальной вентиляции легких производят интубацию трахеи и налаживают доступ к центральной — яремной либо подключичной — или периферической вене, через которую вводят в виде болюса 1 мг адреналина гидрохлорида. Установлено, что этот препарат способствует улучшению коронарного и мозгового кровотока и показателя выживаемости при остановке кровообращения у животных. Эффективность адреналина гидрохлорида при сердечно-легочной реанимации обусловлена его способностью предупреждать коллабирование сонных артерий и повышать АД в целом как во время надавливания на грудину, так и в период диастолы, а также вызывать централиза-
цию кровотока путем спазма артерий органов брюшной полости и почек. Возможность дальнейшего улучшения результатов реанимации у людей при использовании более высоких, чем 1 мг, доз адреналина гидрохлорида в плацебо-контролиро-ванных исследованиях пока не подтвердилась.
Если фибрилляция желудочков сохраняется, дефибрилляцию повторяют 1—3 разрядами мощностью 360 Дж. В случаях неэффективности или быстрого возобновления фибрилляции введение адреналина гидрохлорида повторяют каждые 3—5 мин в соответствии с алгоритмом фибрилляция — дефибрилляция — сердечно-легочная реанимация — адреналина гидрохлорид — оценка ритма по данным ЭКГ.
При сохранении фибрилляции желудочков после двух серий разрядов и первого введения адреналина гидрохлорида в программу реанимации включают антиаритмическую терапию. Однако ее эффективность пока не доказана в контролированных исследованиях. Лечение обычно начинают с внутривенного введения лидокаина в виде болюса в дозе 1— 1г5мг/кг, которое можно повторять каждые 3—5 мин до получения суммарной дозы 3 мг/кг. Установлено, что у человека, в отличие от животных, введение этого препарата перед электрической дефибрилляцией не оказывает отрицательного влияния на ее порог.
Альтернативой лидокаину может служить антиаритмический препарат III класса бретилий, способный повышать порог фибрилляции желудочков и уменьшать гетерогенность продолжительности рефрактерного периода в ишемизированном и неишемизированном миокарде. Имеются данные о его более выраженном по сравнению с плацебо положительном влиянии на выживаемость и частоту стойкого восстановления синусового ритма при проведении реанимационных мероприятий во внебольничных условиях ( D . Olson и соавт., 1984, и др.). В про спективных рандомизированных исследованиях ( R . Haynes и соавт., 1981) существенные преимущества бретилия перед лидо- каином не были обнаружены. Бретилий вводят внутривенно в виде болюса в дозе 5 мг/кг, после чего через 1—2 мин повторяют трансторакальную деполяризацию. При отсутствии эффекта дозу повышают до 10 мг/кг, которую можно вводить каждые 15—30 мин, но всего — не более 30—35 мг/кг.
Препаратом III ряда при рецидивирующей фибрилляции
желудочков или желудочковой тахикардии без пульса является новокаинамид, который вводят в начальной дозе 1 г при скорости инфузии 20—30 мг в 1 мин. При неэффективности перечисленных препаратов можно попытаться ввести внутривенно (3-адреноблокаторы — пропранолол по 1 мг каждые 5 мин до общей дозы 0,1 мг/кг или эсмолол. Эти препараты особенно показаны больным с острым инфарктом миокарда. Имеются единичные сообщения об эффективности высоких доз (1000—1500 мг в сутки) амиодарона, при использовании которого отмечается менее выраженная артериальная гипо-тензия по сравнению с бретилием и новокаинамидом.
В последнее время подверглись пересмотру показания к назначению буферных оснований в сторону их ограничения. Установлено, что при адекватных непрямом массаже сердца и искусственной вентиляции легких в случае отсутствия значительного расстройства гемодинамики до остановки сердца выраженный ацидоз в большинстве случаев не развивается. Кроме того, введенный натрия гидрокарбонат вызывает образование в плазме крови большого количества углекислоты, которая диффундирует внутрь клеток быстрее, чем НС03, приводя к резкому повышению РС02 и снижению внутриклеточного рН. Следствием внутриклеточного ацидоза могут быть снижение сократимости миокарда и усугубление мозговой комы. Отрицательный эффект дают также гипернатрие-мия и гиперосмолярность. Исходя из этих предпосылок, а также отсутствия доказательств положительного влияния на выживаемость в эксперименте, введение натрия гидрокарбоната показано только в отдельных случаях. К ним относятся предшествующие тяжелый метаболический ацидоз { BE меньше —10) и гиперкалиемия, а также отравление трицикличес-кими антидепрессантами и барбитуратами. Начальная доза составляет 50 ммоль, или 50 мл 8,4 % раствора, а повторные — не более 25 ммоль (вводить не чаще чем через каждые 15 мин). При внебольничной внезапной остановке сердца к применению натрия гидрокарбоната прибегают лишь при длительной сердечно-легочной реанимации, при безуспешности дефибрилляции, адекватной искусственной вентиляции легких, введения адреналина гидрохлорида и антиаритмических препаратов.
На том или ином этапе реанимации фибрилляция желудочков может перейти в идиовентрикулярный ритм и (или) аси*: столию. Алгоритм тактики в этом случае описан в главе 4, .
После успешной реанимации у больных обычно более или: менее длительное время сохраняются нестабильность гемодинамики, неадекватный газообмен и явления аноксической энцефалопатии, поэтому их надо госпитализировать в блок или отделение интенсивного наблюдения и лечения.
Наиболее чувствительна к развивающимся во время остановки кровообращения ишемии и гипоксии центральная нервная система. От неврологических осложнений погибает примерно 1/3 успешно реанимированных больных, а у 1/3 выживших остаются стойкие моторные или сенсорные нарушения. Специфических методов лечения энцефалопатии не существует. Проводимая в таких случаях симптоматическая терапия направлена на коррекцию и предупреждение артериальной гипотензии, гипоксии, гипо- или гиперкапнии, нарушений электролитного и углеводного обмена, Эффективность глю-кокортикостероидов, часто применяемых эмпирически для лечения отека мозга, не доказана. Оценить неврологический прогноз в первые часы после восстановления кровообращения и дыхания не представляется возможным.
В случаях непродолжительной реанимации после короткого периода фибрилляции желудочков для коррекции гипоксемии обычно достаточно самостоятельного дыхания кислородом в высоких концентрациях под контролем данных пульсоксимет-рии. При этом насыщение гемоглобина кислородом должно быть не менее 95 %. Неадекватная самостоятельная вентиляция и ацидоз повышают риск возникновения повторной остановки сердца и способствуют вторичному повреждению головного мозга. Поэтому таким больным показаны интубация трахеи и ИВЛ.
У ряда больных после успешной реанимации отмечается артериальная гипотензия, которая может быть связана с развитием острого инфаркта миокарда или оглушением миокарда как проявлением реперфузии. Такие больные нуждаются в инотропной терапии.
Распространенными постреанимационными осложнениями являются разнообразные нарушения сердечного ритма. К
числу факторов, способствующих их возникновению в этот период, относится гипокалиемия. Она возникает в результате транспорта К+ в клетку под влиянием действия катехолами-нов на р2-адренорецепторы. В связи с этим важное значение имеет контроль уровня К+ в плазме крови, который следует поддерживать в пределах 4—4,5 ммоль/л.
Мнения относительно целесообразности введения магния сульфата противоречивы. Его назначение в средней дозе 2 г безусловно показано в случаях длительной реанимации и при упорных постреанимационных аритмиях.
Коррекцию ацидоза начинают с обеспечения адекватной вентиляции легких и гемодинамики, прибегая к введению натрия гидрокарбоната только при недостаточной эффективности этих мероприятий.
С учетом отрицательного влияния постреанимационной гипергликемии на неврологический статус по показаниям проводят ее коррекцию простым инсулином.
Учитывая высокую вероятность возникновения рецидива фибрилляции желудочков и желудочковой тахикардии без пульса, лечение всех успешно реанимированных больных должно включать мероприятия по их вторичной профилактике.
Они базируются на тщательной оценке других возможных факторов риска, в том числе данных инвазивного обследования — коронарографии (при ИБС) и программируемой ЭКС (см. т. I , Внезапная коронарная смерть). Вторичная про филактика включает активное лечение ишемии и сердечной недостаточности, назначение антиаритмических препаратов, желательно под контролем данных ЭФИ, и имплантацию кар-диовертера-дефибриллятора, Последнему методу, который получает все большее распространение, отдают предпочтение при неэффективности контроля факторов риска с помощью других подходов и прежде всего в случаях невозможности индуцировать желудочковую тахикардию у больных с низкой ФВ левого желудочка (подробнее см. т. I , Внезапная коронарная смерть и выше в разделе Желудочковая тахикардия).
Ближайший прогноз, как уже было
сказано, зависит от своевременности начала реанимационных мероприятий. Остановка кровообращения продолжительностью
более
чем 4 мин, как правило, приводит к необратимым изменениям в цент-
ральной нервной системе. Если сердечно-легочную реанимацию удается начать в первые 3 мин и провести электрическую дефибрилляцию в первые 6 мин, вероятность выживания достигает 70 %. При запоздалом, спустя более 12 мин, применении дефибрилляции живыми остаются менее 20 % больных. Основной причиной смерти в ближайший постреанимационный период является гипоксическая энцефалопатия.
Отдаленный прогноз определяется состоянием функции левого желудочка, и при тяжелом заболевании сердца эффективное предупреждение фатальной аритмии, в том числе с помощью имплантации кардиовертера-дефибриллятора, часто не оказывает существенного влияния на исход. У больных с острым инфарктом миокарда при возникновении фибрилляции желудочков, как и желудочковой тахикардии, в ранние сроки — в первые 24—48 ч — она существенно не отягощает прогноз, тогда как прогностическое значение более поздней фибрилляции желудочков весьма неблагоприятно.
Первичную профилактику в основном проводят так же, как при внезапной коронарной смерти (см. т. I ).
Опасные или бесполезные препараты
● 50% инсультов при ФП связано с тем, что человек принимает аспирин. Ни аспирин, ни «Клопидогрел», ни их комбинация, не защищают человека от развития ишемического инсульта. ● Многие пьют кровь-разжижающие препараты, когда к этому нет причин, другие готовы заменять антикоагулянты «Кардиомагнилом», «Милдронатом», «Рибоксином» — так делать нельзя. ● «Предуктал» может вызвать экстрасистолию и усилить аритмию, его применяют только при ишемической болезни сердца. ● Сердце ничем нельзя «попитать», не существует «витаминов для сердца». Сердце это отражение вашего образа жизни — питание, движение, сон.
Почему нужно контролировать образ жизни?
Потому что он отражается на размере левого предсердия. Чем выраженнее ожирение, тем размер левого предсердия выше. Если у человека есть лишний вес, давление в сердце увеличивается, увеличивается объем циркулирующей крови, растягивается левое предсердие. Чем больше левое предсердие от нормы (400 мм), тем выше риск развития фибрилляции предсердий.
Ситуации
При нормальном размере левого предсердия эффективность радиочастотной абляции может достигать 70%. Чем больше размер левого предсердия, тем эффективность РЧА ниже.
● Если пациент проходит радиочастотную абляцию, важно помнить: чем больше отклонений от нормы в работе предсердия, тем выше риск рецедива мерцательной аритмии. ● Когда у человека сбивается сердечный ритм, во время проведения УЗИ обращают внимание на размер левого предсердия: если оно незначительно расширено, имеет смысл попытаться восстановить этот ритм с помощью медикаментозных методов или электроимпульсной терапии. Но если левое предсердие значительно расширено, особого толка восстанавливать ритм нет — рано или поздно он опять сорвется.
Что делать?
● Контролировать вес. ● Отказаться от алкоголя — алкоголь увеличивает риск кровотечения и утяжеляет течение аритмии либо увеличивает частоту срывов этой аритмии. ● Отказаться от курения. ● Отказаться от приема БАДов — большинство из них может усилить действие антикоагулянтов. ● Увеличить физические нагрузки. ● Контролировать состояние щитовидной железы у эндокринолога.
Лечение
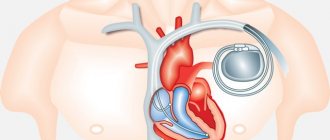
Вылечить фибрилляцию невозможно, подобная форма аритмии – смертельно опасное осложнение, которое обычно возникает неожиданно. При некоторых сердечно-сосудистых заболеваниях его удается прогнозировать и предотвратить, установив кардиостимулятор или кардиовертер-дефибриллятор.
Лечение фибрилляции заключается в оказании первой помощи и кардиореанимационных мероприятиях, в 20% жизнь пострадавшему удается спасти.
Оказание первой помощи
Если остановка сердца в результате фибрилляции желудочков произошла не в больнице, до приезда профессиональной бригады медиков нужно оказать первую помощь. Времени на нее отпущено совсем немного – сердце необходимо запустить в течение 7 минут, затем шансы пострадавшего стремительно падают.
Первый этап неотложной помощи
Окликните человека, потормошите, ощутимо ударьте по щеке, возможно, человек придет в себя.
Подложите руку на грудную клетку, ее движение свидетельствует о наличии дыхания.
Приложите ухо к грудной клетке в области грудины (на ладонь ниже подключичной ямки), так можно уловить звук сердцебиения или ощутить, как поднимается грудная клетка в такт дыханию.
Сложенными вместе пальцами (средним и указательным) постарайтесь прощупать пульс на любом доступном крупном кровеносном сосуде (сонной, бедренной артерии).
Отсутствие пульса, дыхания, движений грудной клетки – сигнал к оказанию первой помощи.
Второй этап неотложной помощи
Уложите пострадавшего на ровную поверхность лицом вверх.
Запрокиньте его голову назад, пальцами попробуйте определить, что мешает дыханию, очистите дыхательные пути от посторонних предметов, рвотных масс, отведите в сторону западающий язык.
Производите вентиляцию легких: зажмите одной рукой нос пострадавшего, с силой вдувайте воздух «рот в рот». Одновременно оценивайте, насколько поднимается грудная клетка (искусственное дыхание не дает легким спадаться, стимулирует движение грудной клетки).
Встаньте сбоку от пострадавшего на колени, сложите кисти рук друг на друга (крест-накрест), начните ритмично надавливать на нижнюю треть грудины скрещенными ладонями на вытянутых руках.
На каждые 30 ритмичных надавливаний на грудную клетку делайте 2 глубоких вдоха «рот в рот».
Через несколько циклов прямого массажа и вентиляции легких оценивайте состояние пострадавшего (возможно, у него появилась реакция, пульс, дыхание).
Прямой массаж сердца делают интенсивно, но без резких движений, чтобы не сломать пострадавшему ребра. Не пытайтесь запустить сердце ударом локтя в грудину – это под силу только очень квалифицированным специалистам.
Оказание первой помощи производят до приезда бригады медиков, которых необходимо вызвать до начала реанимации. Время, в течение которого имеет смысл оказывать первую помощь, – 30 минут, дальше наступает биологическая смерть.
Профессиональные кардиореанимационные методы
После приезда медиков мероприятия по восстановлению работы сердца и гемодинамики продолжают в машине «Скорой помощи» и в реанимационном отделении больницы.
Применяют:
- Электрическую дефибрилляцию сердца (с помощью электрических импульсов разной частоты и силы устраняют нарушения проводимости и возбудимости миокарда желудочков, восстанавливают ритм). Если отсутствуют серьезные органические изменения миокарда, на первых минутах дефибриллятором восстанавливают работу сердца в 95%, на фоне серьезных патологий (кардиосклероза, аневризмы) стимуляция эффективна только в 30%.
- Аппарат искусственной вентиляции легких (вентилируют легкие вручную, с помощью мешка Амбу или подключают к автоматическому аппарату, осуществляя подачу дыхательной смеси через трубку или маску).
Введением лекарственных средств корректируют нарушения обмена электролитов, устраняют последствия накопления продуктов метаболизма (ацидоз), поддерживают ритм сердца, положительно влияют на проводимость и возбудимость миокарда.
| Группы и лекарственные средства | Для чего предназначены |
| Адреномиметики (адреналин) | Повышают тонус и сопротивляемость клеток миокарда, стимулируют их синхронное сокращение, улучшают показатели гемодинамики (коронарный и мозговой кровоток) |
| Антиаритмики (лидокаин, орнид, новокаинамид) | Улучшают проводимость и снижают возбудимость кардиомиоцитов, подавляют циркулирующие импульсы возбуждения в миокарде |
| Регуляторы кислотно-щелочного и электролитного баланса (гидрокарбонат натрия, лактат натрия) | Используют для нейтрализации продуктов метаболизма и восстановления кислотно-щелочного баланса при ацидозе |
После приступа фибрилляции желудочков больные некоторое время находятся в отделениях интенсивной терапии, в этот период лечащий врач-кардиолог принимает решение, каким способом улучшить прогноз (рассматриваемые варианты – имплантация кардиовертера-дефибриллятора или кардиостимулятора).
Осложнения постреанимационного периода
Реанимационными мероприятиями (прямой массаж, дефибрилляция) удается сохранить жизнь 20% больных.
Характерные осложнения постреанимационного периода:
- повреждения грудной клетки и переломы ребер (из-за интенсивного прямого массажа);
- гемоторакс и пневмоторакс (скопление крови или воздуха в плевральной полости легких);
- аспирационная пневмония (из-за попадания в дыхательные пути и легкие содержимого желудка, носоглотки и ротовой полости);
- нарушения в работе сердца (дисфункция миокарда);
- аритмия;
- тромбоэмболия (закупорка легочной артерии сгустком крови);
- нарушения в работе головного мозга (на фоне нарушений гемодинамики и кислородного голодания).
Результатом восстановления работы сердца и гемодинамики спустя длительное время (через 10–12 минут после наступления клинической смерти) могут стать необратимые изменения тканей головного мозга, вызванные кислородной недостаточностью, кома, полная потеря умственной и физической трудоспособности. Только 5% выживших после остановки сердца не имеют выраженных нарушений мозговой деятельности.