Узнайте, какую роль они играют в организме, а также как определить их уровень.
Лимфоциты являются иммунными клетками
– уже одно это в какой-то мере определяет их роль в организме. Если их уровень недостаточен или превышает норму, это может свидетельствовать о неправильном функционировании организма. Вот почему так важно проводить профилактический анализ крови, чтобы
в случае каких-либо отклонений
можно было провести дальнейшую диагностику и начать целенаправленное лечение.
«Боевая» и «самоконтролирующая» функции иммунной системы
Дополнительно см.:
Примечание. На данной странице кратко рассмотрены функции и характеристики основных иммунокомпетентных клеток: Т- и В-лимфоцитов и дендритных клеток (DCs). Но в начале дана характеристика особому двойному функционалу иммунной системы, в которой основную роль играют лимфоциты. Поэтому стоит напомнить, что же из себя предсталяют эти клетки.
Лимфоциты — это клетки иммунной системы, представляющие собой разновидность лейкоцитов, которые обеспечивают гуморальный иммунитет (выработка антител), клеточный иммунитет (контактное взаимодействие с клетками-мишенями), а также регулируют деятельность клеток других типов. По морфологическим признакам выделяют два типа лимфоцитов: большие гранулярные лимфоциты (чаще всего ими являются NK-клетки и малые лимфоциты (T-клетки и B-клетки).
Типы лимфоцитов
Те или иные механизмы иммунной защиты есть практически у всех животных. Эти механизмы сильно различаются по своей структуре, сложности, эффективности и, главное, по соотношению врожденных и приобретенных компонентов. У беспозвоночных преобладает врожденный иммунитет, хотя это далеко не абсолютное правило. У позвоночных вдобавок к врожденным защитным механизмам развилась необычайно сложная адаптивная иммунная система, способная приспосабливаться (адаптироваться) к всевозможным новым инфекциям, вырабатывать новые средства борьбы с ними и обладающая к тому же хорошей памятью (именно благодаря иммунной памяти мы получаем стойкий иммунитет ко многим болезням, однажды переболев ими).
У всех «высших» позвоночных основными компонентами адаптивной иммунной системы являются лимфоциты двух типов: B и T (см.: B cell, T cell). Каждый зрелый лимфоцит производит один (и только один) тип рецепторов, причем каждый рецептор способен распознавать чужеродные молекулы (антигены) строго определенного типа. Рецепторы B-лимфоцитов называются антителами, они могут отделяться от поверхности лимфоцита и самостоятельно атаковать «врагов» (например, бактерий). Рецепторы Т-лимфоцитов (Т-клеточные рецепторы) по своей структуре похожи на антитела, но они прочно приделаны к поверхности Т-лимфоцита и не расплываются свободно в окружающей среде, подобно антителам.
В ходе развития (созревания) лимфоцитов происходит сложная перестройка их генома. Суть ее состоит в том, что из имеющегося в геноме набора «заготовок» комбинаторным путем формируются зрелые, готовые к использованию гены антител или Т-клеточных рецепторов. Возникает огромное разнообразие лимфоцитов, производящих сотни тысяч и миллионы разных иммунных рецепторов. Среди этих рецепторов неизбежно появляются и опасные для организма, готовые наброситься на свои собственные антигены. Лимфоциты, производящие такие рецепторы, отбраковываются; остальные сохраняются. В результате организм получает огромный набор лимфоцитов, способных распознавать чуть ли не любые чужеродные белки и углеводы. Когда в организм проникает инфекция (например, бактерии), те B-лимфоциты, чьи антитела проявляют наибольшее сродство к поверхностным веществам (антигенам) данной бактерии, дополнительно «подгоняют» гены своих антител к этим антигенам путем соматического гипермутирования.
T- и B-лимфоциты высших позвоночных обмениваются между собой разнообразными химическими сигналами (см. ниже интерлейкины). В соответствии с этим у разных типов лимфоцитов активны строго определенные гены, ответственные за прием и передачу этих сигналов.
Интерлейкины — группа цитокинов (белков), синтезируемая и секретируемая Т-лимфоцитами, В-лимфоцитами и NK-клетками, а также взаимодействующими с ними клетками. Цитокины — это небольшие пептидные информационные молекулы. Цитокины имеют молекулярную массу, не превышающую 30 кD. Цитокин выделяется на поверхность клетки А и взаимодействует с рецептором находящейся рядом клетки В. Таким образом, от клетки А к клетке В передается сигнал, который запускает в клетке В дальнейшие реакции. Их основными продуцентами являются лимфоциты (дополнительно о цитокинах см. здесь →).
Более подробно о цитокинах см. в отдельном разделе:
Одно из главных функциональных различий В- и Т-лимфоцитов состоит в том, что первые специализируются в первую очередь на борьбе с инфекциями путем массового производства антител, а вторые — в большей степени «разведчики» и специалисты по тонкому различению «своих» и «чужих» антигенов; в частности, они внимательно следят за тем, чтобы B-лимфоциты по ошибке не начали производить аутоиммунные антитела, атакующие собственные клетки организма.
Т-клеточные рецепторы идентифицируют присутствие чужеродной белковой молекулы только в том случае, если эта молекула уже попала внутрь какой-нибудь другой клетки организма (например, B-лимфоцита) и была там расщеплена на короткие кусочки. Эти кусочки затем соединяются со специальными белками (их называют белками Главного Комплекса Гистосовместимости (ГКГС, англ. MHC, major histocompatibility complex). Комплексы из белков ГКГ и коротких обрывков других белков — своих и чужих — клетки выставляют на своей поверхности специально для того, чтобы Т-лимфоциты могли их «ощупать» своими рецепторами. Т-клеточные рецепторы безошибочно отличают «свое» от «чужого», но только в том случае, если исследуемый образец аккуратно порезан на кусочки нужной длины и присоединен к белку ГКГ.
Разделение труда между лимфоцитами неизбежно вытекает из самой «идеи» производства огромного количества разнообразных иммунных рецепторов комбинаторным путем. С одной стороны, благодаря этой технологии позвоночные успешнее, чем любые другие животные, противостоят разнообразным инфекциям. Вряд ли без этого наши предки смогли бы стать теплокровными, то есть превратиться в ходячий термостат с питательной средой для микробов. С другой, такая иммунная система должна находиться под строжайшим контролем, иначе она мгновенно убьет свой собственный организм. Кто же может проконтролировать, какой антиген распознал тот или иной лимфоцит, точно ли этот антиген чужой и не будет ли для организма вреда, если данный лимфоцит начнет размножаться? Кроме другого лимфоцита, никто в этом не разберется. Иммунная система должна контролировать себя сама.
Совместить в одной и той же клетке обе функции — «боевую» и «самоконтролирующую» — очень трудно, особенно если эти функции должны выполняться с очень высокой эффективностью. Тем самым создаются предпосылки для разделения труда между лимфоцитами: одни из них специализируются на борьбе с инфекцией, а другие внимательно следят за первыми, чтобы те не начали по ошибке производить опасные для организма антитела.
Что ещё назначают с этим исследованием?
Биохимия 8 показателей
27.113. Вен. кровь 1 день
990 ₽ Добавить В корзину
ГЕМОСТАЗИОГРАММА (Коагулограмма)
27.4. Вен. кровь 1 день
2 020 ₽ Добавить В корзину
Иммунный статус (скрининг) (Фагоцитарная активность лейкоцитов, клеточный иммунитет, иммуноглобулин IgE общий, иммуноглобулины IgA, IgM, IgG)
27.960. Вен. кровь 3 дня
7 640 ₽ Добавить В корзину
Клинический анализ крови с лейкоцитарной формулой и СОЭ (с микроскопией мазка крови при выявлении патологических изменений) (венозная кровь)
3.9.1. Вен. кровь 1 день
720 ₽ Добавить В корзину
Общий анализ мочи
9.1. Моча 1 день
380 ₽ Добавить В корзину
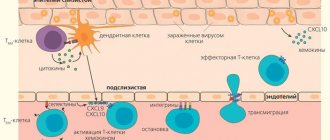
Активация иммунитета и Дендритные клетки
Источник: «Наука и жизнь» №11, 2011 Автор: Ольга Белоконева, кандидат химических наук
В 2011 году Нобелевская премия по физиологии и медицине присуждена Брюсу Бойтлеру и Жюлю Хоффманну за открытие механизмов активации врождённого иммунитета, и Ральфу Штайнману за открытие дендритных клеток и их роли в активации адаптивного иммунитета. Эти исследования называют революционными, поскольку открытие врождённого иммунитета в корне изменило представление о функционировании иммунной системы.
Иммунитет. Это слово давно и прочно заняло своё место в лексиконе современного человека. Чаще всего под иммунитетом понимают способность организма защищаться от опасных вирусов, бактерий, грибков или других паразитов. Но что это за механизм и как, собственно, осуществляется эта защита, понимают лишь немногие специалисты. Механизм и вправду очень сложный. Нобелевские лауреаты этого года вскрыли лишь некоторые ключевые моменты «первой линии обороны» — системы врождённого иммунитета.
В природе существуют две линии защиты, два вида иммунитета.
Первая и самая древняя — система врождённого иммунитета, которая нацелена на разрушение клеточной мембраны чужеродной клетки. Она присуща всем живым существам — от дрозофилы до человека. Если всё же какой-либо белковой молекуле-чужаку удалось прорваться сквозь «первую линию обороны», с ней расправляется «вторая линия» — адаптивный, или приобретённый, иммунитет.
Адаптивный иммунитет — это высшая форма защиты, которая присуща только позвоночным. Механизм приобретённого иммунитета очень тонко настроен и специфичен. Вкратце: при попадании в организм чужеродной белковой молекулы белые кровяные клетки (лейкоциты) начинают производить антитела — на каждый белок (антиген) вырабатывается своё определённое антитело. Сначала активируются так называемые T-клетки (T-лимфоциты), которые начинают производить активные вещества цитокины, запускающие синтез антител B-клетками (B-лимфоциты). Сила или слабость иммунной системы обычно оценивается по количеству именно B- и T-клеток, настолько они важны для защиты организма. Взаимодействие антиген-антитело очень сильное и очень специфическое. Когда антитела «садятся» на белки-антигены, находящиеся на поверхности вируса или бактерии, развитие инфекции в организме блокируется (дополнительно об адаптивном имунитете см. здесь →).
Процесс выработки антител запускается не сразу, у него есть определённый инкубационный период, зависящий от типа патогена. Зато, если уж процесс активации пошёл, как только та же самая инфекция попытается проникнуть в организм ещё раз, B-клетки моментально отреагируют выработкой антител, и инфекция будет уничтожена немедленно, не причинив никакого вреда. Именно поэтому на некоторые виды инфекций у человека вырабатывается иммунитет на всю оставшуюся жизнь.
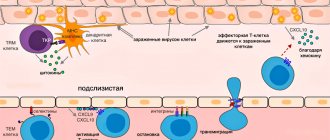
Рисунок 1. Дендритные клетки как бы показывают T-клеткам их «врагов». Toll
-подобные рецепторы на поверхности взаимодействуют с характерными молекулярными структурами на поверхности клеточной мембраны бактерии (PAMP), внутрь клетки идёт биохимический сигнал, и на поверхность дендритной клетки выносятся антигены, которые T-клетки могут легко «пощупать» с помощью специальных антиген-распознающих белков. «Узнавание» антигена сопровождается активацией T-клеток с последующим превращением их в Т-хелперы и запуском каскада биохимических реакций, конечный результат которых — выработка специфических антител В-клетками. Кроме того, под действием PAMP дендритные клетки и макрофаги вырабатывают специальные молекулы — цитокины, также способствующие активации T-клеток. Адаптированный рисунок из статьи Medzhitov R. Toll-like receptоrs and innate immunity.
Nat. Rev. Immunol
. 2001, 1, 135–142.
А вот система врождённого иммунитета неспецифична и не обладает «долгосрочной памятью», поскольку реагирует на некие молекулярные структуры, присущие всем патогенным микроорганизмам. Эти структуры получили название «патоген-ассоциированные молекулярные образы» (pathogen-associated molecular patterns
— PAMP). Такими PAMP служат молекулы, входящие в состав клеточной мембраны бактерий. Несмотря на химические различия, все эти структуры обладают следующими свойствами: они синтезируются только микроорганизмами (в клетках животных их нет, поэтому распознавание PAMP расценивается иммунной системой как сигнал к началу борьбы с чужаком); они характерны для целого ряда патогенов, а не только для одного; эти структуры являются важными для жизнедеятельности бактерии, поэтому в процессе эволюции они меняются очень медленно (иначе иммунная система просто не успевала бы настраивать распознавание). Если бактерии удаётся прорвать «первую линию обороны» и избежать уничтожения макрофагами или гранулоцитами, то в борьбу должна включиться система приобретённого иммунитета.
Каким образом система врождённого иммунитета подаёт знак системе приобретённого иммунитета на выработку специфических антител? Вот за решение этого ключевого вопроса иммунологии и присуждена Нобелевская премия 2011 года.
В 1973 году Ральф Штайнман открыл новый вид клеток, которые назвал дендритными, поскольку внешне они напоминали дендриты нейронов. Клетки обнаружились во всех тканях организма, которые соприкасались с внешней средой: в коже, лёгких, слизистой оболочке желудочно-кишечного тракта. Сначала исследователь предположил (в ту пору это вызвало скептицизм многих учёных), а затем и доказал, что дендритные клетки служат посредниками между врождённым и приобретённым иммунитетом. То есть «первая линия обороны» подаёт через них сигнал, который активирует T-клетки и запускает каскад выработки антител B-клетками (дополнительно о врожденном иммунитет см. здесь →).
Дендритные клетки (англ. Dendritic cells
, DC) – это популяция особых клеток иммунной системы костно-мозгового происхождения, функция которых заключается в презентации «вражеских» антигенов другим клеткам иммунной системы. Таким способом они активируют адаптивный иммунитет. По научному, такие клетки-посредники называются
антигенпрезентирующими (АПК). См. механизм действия на рис. 1 и рис. 2).
Как оказалось позже, дендритные клетки (так же как и макрофаги и эпителиальные клетки) имеют на клеточной поверхности специальные белковые комплексы — рецепторы. Гены, кодирующие эти рецепторы, аналогичны Toll
-генам плодовой мушки дрозофилы (от нем.
toll
— сногсшибательный, безумный), играющим ключевую роль в эмбриогенезе. В 1996 году Жюль Хоффманн обнаружил, что у мушек с «выключенным»
Toll
-геном полностью отсутствовал иммунитет и они погибали от любой грибковой инфекции. Хоффманн предположил, что ген
Toll
важен не только для развития эмбриона, он ещё играет ключевую роль в иммунной системе. Как оказалось, этот ген кодирует специальные рецепторы, распознающие молекулы в структуре мембран бактериальных патогенов (PAMP), посылая биохимический сигнал на устранение «чужака». Их назвали «
Toll
-подобные рецепторы» (англ.
Toll-like
).
При взаимодействии РАМР с Toll
-подобным рецептором на поверхности дендритной клетки появляются белки-антигены, которые и запускают адаптивный иммунный ответ T-клеток. У человека обнаружен десяток таких
Toll
-подобных рецепторов. Некоторые из них находятся на поверхности клеток, другие «плавают» в клеточной цитоплазме. Конечным результатом взаимодействия PAMP с этими рецепторами является активация T-клеток. На клеточном уровне происходит активация фагоцитов: они начинают продуцировать активные формы кислорода, а следовательно, более интенсивно переваривать «обрывки» клеточных стенок чужеродных бактерий.
В 1998 году Брюс Бойтлер изучал рецепторы бактериальных липополисахаридов (LPS) — молекул, в которых липид и сахар «сшиты» между собой. LPS — очень активные в иммунологическом отношении молекулы, они не просто стимулируют, а «суперстимулируют» иммунитет, в определённых условиях вызывая септический шок. Бойтлер пытался найти ген, отвечающий за эффекты LPS, и обнаружил, что мыши, нечувствительные к LPS, имеют мутацию в гене, очень похожем на Toll
-ген мушки-дрозофилы.
Toll
-подобный рецептор случайно оказался тем самым неуловимым LPS-рецептором, то есть LPS взаимодействует с
Toll
-подобным рецептором, приводя к активации воспалительных процессов, вплоть до септического шока. Так выяснилось, что у мушек и мышей есть один и тот же механизм защиты от инфекции. «Зловредными» компонентами мембраны клеточных бактерий, которые и вызывали реакцию врождённого иммунитета, оказались липополисахариды — компоненты клеточной стенки грамотрицательных бактерий.
Таким образом, открытие врождённого иммунитета привело к появлению новых подходов в профилактике и лечении заболеваний, в разработке новых вакцин и противоопухолевых препаратов.
Активация адаптивной иммунной системы
Адаптивный иммунитет может дифференцировать между конкретными патогенами и нацелить ответ, который является специфическим для данного патогена. Он может быстро реагировать при повторном воздействии конкретного патогена, предотвращая развитие симптомов (иммунологическая память). Адаптивная иммунная система координируется лимфоцитами (класс лейкоцитов) и приводит к выработке антител. В-лимфоциты (В-клетки) являются антитело-продуцирующими клетками, которые распознают и нацеливают определенный фрагмент патогена (антиген). Хелперные Т-лимфоциты (Т-клетки) являются регуляторными клетками, которые высвобождают химические вещества (цитокины) для активации специфических В-лимфоцитов
- Когда фагоцитарные лейкоциты поглощают патоген, некоторые из них представляют переваренные фрагменты (антигены) на их поверхности
- Эти антигенпрезентирующие клетки (дендритные клетки) мигрируют в лимфатические узлы и активируют специфические хелперные Т-лимфоциты
- Затем хелперные Т-клетки высвобождают цитокины для активации конкретной В-клетки, способной продуцировать антитела, специфичные к антигену
- Активированная В-клетка будет делиться и дифференцироваться с образованием короткоживущих плазматических клеток, которые производят большое количество специфических антител
- Антитела будут нацелены на их специфический антиген, повышая способность иммунной системы распознавать и уничтожать патоген.
Небольшая доля активированной B-клетки (и активированной TH-клетки) будет развиваться в клетки памяти, чтобы обеспечить длительный иммунитет.
См. дополнительно:
Лимфоциты ответственны за приобретенный иммунитет
Использованная литература
- В. Л. Быков. Цитология и общая гистология. 2002.
- Хаитов, Р.М. Аллергология и иммунология: национальное руководство / под ред. Р.М. Хаитова, Н.И. Ильиной. 2009.
- Афанасьев Ю.И Гистология, эмбриология, цитология. Учебник. Переработанное и дополненное 6-е издание. 2021.
- Иммунология: структура и функции иммунной системы: учебное пособие / Р. М. Хаитов. 2013.
- Иммунология и аллергология: учебное пособие для студентов медицинских вузов / под ред. А А. Воробьева, А.С. Быкова, А.В. Караулова. 2006
1. Общая характеристика B-лимфоцитов
B-лимфоциты (B-клетки) — функциональный тип лимфоцитов, играющих важную роль в обеспечении гуморального иммунитета. При контакте с антигеном или стимуляции со стороны T-клеток некоторые B-лимфоциты трансформируются в плазматические клетки, способные к продукции антител. Другие активированные B-лимфоциты превращаются в B-клетки памяти. Помимо продукции антител, В-клетки выполняют множество других функций: выступают в качестве антигенпрезентирующих клеток, продуцируют цитокины и экзосомы.
B-лимфоциты продуцируют и секретируют в кровоток молекулы антител, являющиеся измененными формами антигенраспознающих рецепторов этих лимфоцитов. Возникновение антител в крови после появления любого чужеродного белка- антигена — независимо от того, вреден он или безвреден для организма, и представляет собой иммунный ответ. Появление антител не просто защитная реакция организма против инфекционных заболеваний, но явление, имеющее широкое биологическое значение: это общий механизм распознавания «чужого». Например, иммунная реакция распознает как чужой и постарается удалить из организма любой аномальный и, следовательно, потенциально опасный вариант клетки, в которой в результате мутации в хромосомной ДНК образуется мутантная белковая молекула.
B-лимфоциты млекопитающих дифференцируются сначала в печени плода, а после рождения — красном костном мозге. В цитоплазме покоящихся B-клеток отсутствуют гранулы, но имеются рассеянные рибосомы и канальцы шероховатого эндоплазматического ретикулума. Каждая B-клетка генетически запрограммирована на синтез молекул иммуноглобулина, встроенных в цитоплазматическую мембрану. Иммуноглобулины функционируют как антигенраспознающие рецепторы, специфичные к определенному антигену. На поверхности каждого лимфоцита экспрессируется около ста тысяч молекул рецепторов. Встретив и распознав антиген, соответствующий структуре антигенраспознающего рецептора B-клетки размножаются и дифференцируются в плазматические клетки, которые образуют и выделяют в растворимой форме большие количества таких рецепторных молекул — антител. Антитела представляют собой крупные гликопротеины и содержатся в крови и тканевой жидкости. Благодаря своей идентичности исходным рецепторным молекулам они взаимодействуют с тем антигеном, который первоначально активировал B-клетки, проявляя таким образом строгую специфичность.
После связывания антигена с рецепторами B-клетки клетка активируется. Активация B-клеток состоит из двух фаз: пролиферации и дифференцировки; все процессы индуцируются контактом с антигеном и T- хелперами.
В результате пролиферации увеличивается число клеток, способных реагировать с введенным в организм антигеном. Значение пролиферации велико, поскольку в неиммунизированном организме очень мало B-клеток, специфичных для определенных антигенов.
Часть клеток, пролиферирующих под действием антигена, созревает и дифференцируется последовательно в антителообразующие клетки нескольких морфологических типов, в том числе и плазматические клетки . Промежуточные стадии дифференцировки B-клеток отмечены меняющейся экспрессией разнообразных белков клеточной поверхности, необходимых для взаимодействия B-клеток с другими клетками.
Каждый лимфоцит, относящийся к B-лимфоцитам и дифференцирующийся в костном мозге, запрограмирован на образование антител только одной специфичности.
Молекулы антител не синтезируются никакими другими клетками организма, и все их многообразие обусловлено образованием нескольких миллионов клонов B-клеток. Они (молекулы антител) экспрессируются на поверхностной мембране лимфоцита и функционируют как рецепторы. При этом на поверхности каждого лимфоцита экспрессируется около ста тысяч молекул антител. Кроме того, B-лимфоциты секретируют в кровоток продуцированные ими молекулы антител, являющиеся измененными формами поверхностных рецепторов этих лимфоцитов.
Антитела формируются до появления антигена, и антиген сам отбирает для себя антитела. Как только антиген проникает в организм человека, он встречается буквально с войском лимфоцитов, несущих различные антитела, причем у каждого есть свой индивидуальный распознающий участок. Антиген соединяется только с теми рецепторами, которые в точности ему соответствуют. Лимфоциты, связавшие антиген, получают пусковой сигнал и дифференцируются в плазматические клетки, продуцирующие антитела. Поскольку лимфоцит запрограммирован на синтез антител только одной специфичности, антитела, секретируемые плазматической клеткой, будут идентичны своему оригиналу, т.е. поверхностному рецептору лимфоцита и, следовательно, будут хорошо связываться с антигеном. Так антиген сам отбирает антитела, распознающие его с высокой эффективностью.
Интерпретация:
- Повышение уровня B-1-клеток, B-2-клеток и В-клеток памяти характерно при: • Аутоиммунной патологии (системная красная волчанка, ревматоидный артрит, аутоиммунный тиреоидит, неспецифический язвенный колит, миастения.• Аутоиммунные поражения при инфекционных заболеваниях (хламидиоз, синдром Рейтера, бруцеллёз).• Лимфопролиферативные процессы.• Острых и хронических бактериальных, грибковых и паразитарных инфекциях.• Хронических заболеваниях печени, циррозе.• Хроническом лимфолейкозе.• Эндотелиоме, остеосаркоме.• Миеломной болезни.• Макроглобулинемии Вальденстрема.• Кандидозе, муковисцидозе.• Астме, туберкулезе.• Моноклональной гаммапатии.
- Снижение уровня наблюдается при первичных иммунодефицитах (тяжелые комбинированные иммунодефициты, наследственная гипогаммаглобулинемия, общий вариабельный иммунодефицит, часто — при хронической гранулематозной болезни, комбинированных иммунодефицитах — синдроме Ниймеген, синдроме Вискотта-Олдрича и других) и при лечении препаратами, направленными против В-лимфоцитов.
Образец результата (PDF)
Влияние возраста человека на качественный состав лимфоцитов
После достижения человеком возраста 35-40 лет вилочковая железа самоуничтожается. Ее ткань заменяется на жировую. Прекращается выработка Т-лимфоцитов. Поэтому создается очень опасная и неуправляемая реакция иммунной системы. Возможна любая ненормальная реакция на инфекционные возбудители, прекращается обезвреживание атипичных клеток. Уровень лимфоцитов в крови указывает на защитные силы организма.
Ведущая теория старения (иммунная) связывает процессы старения с резким снижением клеток-киллеров и этим объясняет, почему происходит накопление различных шлаков.