Симптоматика
Средний объем тромбоцитов, а точнее, отклонение от нормальных параметров, обладает собственными клиническими проявлениями. Однако проблема заключается в том, что какое-либо нарушение может протекать совершенно бессимптомно или же клинические проявления настолько слабо выражены, что остаются незамеченными.
Если повышен средний объем тромбоцитов, то могут проявляться следующие симптомы:
- кровоточивость десен;
- легкое образование синяков, которые долго не проходят;
- носовые кровоизлияния;
- чрезмерно обильные месячные у представительниц женского пола;
- кожный зуд;
- слабость и быстрая утомляемость;
- постоянная сонливость;
- проблемы со зрением.
Когда объемы тромбоцитов ниже нормы, симптоматика будет включать в себя:
- кровоизлияния в сетчатку глаза;
- образование гематом;
- частые носовые кровотечения;
- появление подкожных кровоизлияний.
Кровоизлияние в сетчатку глаза
Помимо вышеуказанных признаков, необходимо как можно быстрее обратиться за врачебной помощью в следующих ситуациях:
- резкое снижение массы тела;
- сильнейшая усталость (до такой степени, что человек не может встать с постели);
- постоянные кровотечения из носа;
- гипертензия;
- учащение сердечного ритма;
- синюшность кожи и чрезмерная бледность слизистых.
Такие симптомы являются общими для взрослого и ребенка.
Расшифровка анализа на агрегацию тромбоцитов
В анализе на агрегацию тромбоцитов о хорошем кроветворении говорят показатели 25 – 75%. Это значит, что ткани и органы нормально снабжаются кислородом, и тромбы отсутствуют.
Норма тромбоцитов
| Возраст | Показатель, х 10^9/л |
| Новорождённый | 100–420 |
| Ребёнок до года | 160–320 |
| 1–4 года | 150–300 |
| 15–18 лет | 180–340 |
| Мужчины старше 18 лет | 180–400 |
| Женщины старше 18 лет | 150–380 |
О чем говорит низкий уровень тромботических клеток у взрослого?
В отличие от эритроцитов, жизненный цикл которых составляет примерно 120 дней, тромботические пластины на 9-12 день своего существования разрушаются. Их количество непрерывно возобновляется костным мозгом для поддержания в крови физиологически необходимого количества.
Как и для остальных форменных элементов крови, для тромбоцитов установлены значения, называемые нормой, они определены диапазоном 180-320*109 единиц на литр, или 180-320 тысяч единиц на микролитр. Если по результатам анализа окажется, что количество тромботических клеток не дотягивает до уровня нормы, это говорит о развитии тромбоцитопении у взрослого или ребенка.
Тромбоцитопения (тромбоциты значительно ниже нормы) возникает из-за ускоренного разрушения тромботических клеток или нарушения их продуцирования, что происходит при целом ряде заболеваний.
Активация
Для выполнения своей основной функции — заделывания повреждения в стенке сосуда — тромбоциты должны перейти в активное состояние. Как и у большинства клеток нашего организма, этот процесс протекает по следующей схеме: сигнал — рецептор — внутриклеточный сигнал — усилитель — регулятор — ответ (рис. 3). Сигналом к активации служит появление в кровотоке агониста — специальной сигнальной молекулы, которая должна появляться только при необходимости и связываться со специфической молекулой, пронизывающей мембрану тромбоцита (рецептором). Агонист взаимодействует с одним «хвостом» рецептора, выступающим снаружи, и это приводит к изменению другого, со стороны цитозоля, где появляется следующая сигнальная молекула — вторичный мессенджер. Он запускает синтез еще нескольких мессенджеров, те, в свою очередь, — еще нескольких, и так сигнал распространяется в цитозоле и усиливается с помощью каскада внутриклеточных реакций, что в конечном итоге приводит к комплексному ответу тромбоцита. Важно, что в тромбоците существуют специальные регуляторные системы, модулирующие концентрации внутриклеточных мессенджеров на разных этапах активации, чтобы, например, не было реакции на следовые количества агониста.
Рис. 3.
Схема активации тромбоцита
Как же эта схема реализуется в нашем организме? В сосудах тромбоциты выталкиваются эритроцитами из основного потока и движутся вдоль стенок, проводя своего рода мониторинг их состояния. Одним из первых сигналов к активации тромбоцитов становится коллаген — основной белок соединительной ткани, обнажающийся при повреждении сосуда. Обнаружив коллаген, они связываются с ним через специальные рецепторы, одновременно активируясь и прочно прикрепляясь к месту повреждения. Взаимодействие тромбоцита с коллагеном и ведет к запуску упомянутого внутриклеточного сигнального каскада и появлению в цитозоле вторичного мессенджера — инозитолтрифосфата (ИФ3). Эта маленькая водорастворимая молекула способна быстро передвигаться в цитозоле и служит сигналом к выходу ионов кальция из внутриклеточных хранилищ. А повышение его внутриклеточной концентрации может приводить к разнообразным ответам тромбоцита: выплескиванию содержимого гранул (секреции), изменению формы, прикреплению к стенке сосуда (адгезии), скреплению с другими тромбоцитами (агрегации), появлению прокоагулянтной активности (рис. 4). После того, как кровеносная система уже распознала повреждение сосуда, в крови появляются еще три природных активатора тромбоцита — тромбин, АДФ и тромбоксан A2. Белок тромбин образуется из предшественника, протромбина, в плазме крови, но массово — уже на мембранах активированных тромбоцитов. При секреции их плотных гранул выбрасывается большое количество АДФ (маленькая молекула, выполняющая в клетках в основном энергетические функции), и гораздо меньше АДФ высвобождается из поврежденных клеток эндотелия, выстилающего внутреннюю поверхность сосудов. Из арахидоновой кислоты, находящейся в мембранах активированных тромбоцитов, синтезируется тромбоксан А2. Связывание этих трех активаторов со своими рецепторами на мембране тромбоцита приводит, как и в случае с коллагеном, к появлению ИФ3 в цитозоле и повышению в нем концентрации кальция (рис. 4). Таким образом, все три растворимых активатора и коллаген действуют по одному пути, однако вызывают разные тромбоцитарные ответы. Например, тромбоксан А2 провоцирует выброс плотных гранул, а АДФ — нет. Активация отдельно коллагеном или тромбином вызывает все перечисленные ответы одновременно, а совместно — приводит к появлению группы прокоагулянтных тромбоцитов и синтезу тромбина на их мембранах. Видимо, существуют еще недостаточно изученные различия в сигнализации, запускаемой разными агонистами. Чтобы случайная активация не превращала тромбоцит в настоящую «бомбу», несущуюся в кровотоке и запускающую всю систему свертывания, в организме неповрежденные клетки эндотелия постоянно выделяют простациклин и оксид азота, которые блокируют активацию клеток, препятствуя повышению в них концентрации кальция.
Рис. 4.
Схема основных путей активации тромбоцита и его ответных реакций:
АДФ
— аденозиндифосфат,
ИФ3
— инозитолтрифосфат,
ЭПР
— эндоплазматический ретикулум
Сигнализация — один из самых сложных и плохо изученных разделов в исследовании тромбоцитов. По устройству каждого рецептора и сигнального пути существует множество вопросов, и самый простой из них: зачем вообще столько активаторов?
Как повысить?
В поисках средств, как повысить тромбоциты в крови, не следует забывать главного – самолечение может быть опасным для жизни. Лекарственные препараты, применяемые для экстренного повышения тромботической массы, имеют массу побочных действий и не должны использоваться без назначения врача.
- Тромбоциты повышены у взрослого — о чем это говорит, и как их снизить?
Если тромбоциты понижены из-за приема лекарств (аспирина и т.п.), следует отказаться от их употребления.
Продуктов, способных эффективно воздействовать на тромбоциты, если они понижены, не существует, народных средств – также. Указанные средства могут использоваться только в качестве вспомогательных, но не основных методов повышения тромбоцитов.
Главный способ устранения патологической тромбоцитопении – лечение приведшего к ней заболевания.
Последствия пониженного количества тромбоцитов
Главным и самым страшным нарушением подобного состояния является возможность развития массивного кровотечения даже из-за маленькой травмы, которое сложно поддается купированию. Особенно опасны подобные проблемы в период беременности, родов и менструаций. Маточные кровотечения очень сложно поддаются лечению даже при нормальном уровне тромбоцитов, а при сниженном во многих случаях могут привести к летальному исходу.
Норма и изменение уровня тромбоцитов в крови
Помимо этого, такое состояние может стать причиной кровоизлияния в мозг и в глазное яблоко с сетчаткой. Подобные нарушения могут быть спровоцированы даже незначительным ростом артериального и глазного давления.
Внимание! Снизить вероятность подобных состояний позволит правильный образ жизни и соблюдение рекомендаций по предотвращению кровотечения из-за малого количества тромбоцитов.
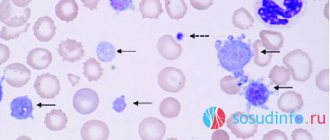
Строение
Рис. 1.
Микрофотография неактивированных тромбоцитов []
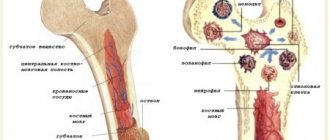
Тромбоциты (от греч. θρομβοζ — ‘сгусток’ и κυτοζ — ‘клетка’) — специализированные безъядерные клетки крови, имеющие форму диска диаметром около 3 мкм и толщиной около 0,5 мкм (рис. 1). Образуются они при фрагментации больших клеток костного мозга — мегакариоцитов и циркулируют в кровотоке в концентрации 200–400 тыс. клеток в 1 мкл крови. Живут тромбоциты в кровотоке в среднем 5–9 дней, а затем разрушаются в селезенке и печени.
Устроен тромбоцит довольно сложно. Снаружи он ограничен билипидным слоем мембраны, многочисленные впячивания которой (открытая канальцевая система) дают запас поверхности для изменения формы (рис. 2). Поддерживает ее и одновременно позволяет сильно менять цитоскелет (каркас) клетки. Внутри находятся эндоплазматический ретикулум (хранилище ионов кальция, необходимых для сигнализации и выполнения тромбоцитом своих функций) и митохондрии (органеллы, обеспечивающие дыхание). В цитозоле присутствуют гранулы, содержащие вещества, выплескивающиеся при активации клетки (переходе в новое состояние) во внеклеточное пространство. В плотных гранулах содержатся нуклеотиды (АТФ, АДФ, ГТФ, ГДФ), серотонин, ионы кальция в высокой концентрации, в α-гранулах — различные белки (в том числе факторы свертывания крови), а в лизосомах — некоторые ферменты (коллагеназа, эластаза и др.).
Рис. 2.
Схема строения тромбоцита []
После активации тромбоцита на внешней поверхности его мембраны появляется отрицательно заряженный липид — фосфатидилсерин. С ним с помощью ионов кальция связываются некоторые факторы свертывания, формируя специальные комплексы. Они во много раз ускоряют реакции, приводящие к желированию плазмы крови у места повреждения (этот процесс называется плазменным гемостазом). Иными словами, фосфатидилсерин обеспечивает прокоагулянтную, способствующую плазменному гемостазу, функцию тромбоцитов.
Почему же век этих клеток крови столь недолог (эритроциты, например, живут три-четыре месяца), ведь в норме, в отсутствие серьезных повреждений сосудов, они практически не работают? Почему они имеют вид дисков? Зачем тромбоциту митохондрии, если его энергетические расходы крайне скромны? Зачем природе понадобилось ускорять реакции плазменного свертывания на клеточных мембранах? Для чего α-гранулы содержат белки свертывания, которые есть и в плазме крови? Это только некоторые из вопросов, не имеющих пока четких ответов.
Что это значит при беременности?
Среди физиологических причин пониженных тромбоцитов у женщин названа беременность, и для ранних сроков это действительно нормальная ситуация, если речь идет о допустимых пониженных значениях. На ранних сроках у беременных отмечается увеличение объема циркулирующей крови за счет плазмы, в то время как масса эритроцитов и тромбоцитов вырабатывается менее быстрыми темпами. В результате наблюдается эффект гемодилюции – разжижения крови, сопровождаемого пониженным содержанием эритроцитов и тромбоцитов.
Обычно это проходящее явление не оказывает особого воздействия на гемостаз. Если же тромбоциты снижены до уровня 50 единиц на микролитр и ниже, могут потребоваться экстренные меры по стабилизации показателей. Особенно, если мало тромбоцитов за пару недель до родов – это значит, что организм не готовится к предстоящей кровопотере и может сильно пострадать в процессе родов.
- Тромбоцитопения – симптомы и лечение
Вот когда ценность общего исследования крови становится очевидной – благодаря ему удается своевременно обнаружить низкое количество тромбоцитов, предположить причины отклонения и принять меры.
Диапазон консервативных методов повышения низких тромбоцитов при беременности ограничен, однако без помощи будущая мама не останется, так как в арсенале медицины имеются препараты с минимальным воздействием на плод.
Что мы обнаружили и как нам это удалось
Биофизический подход
Как и любая сложная система, формирование тромба в артерии нуждается в управлении. Выявление механизмов, регулирующих биологические процессы, является одной из традиционных задач биофизики, поэтому проблема регуляции артериального тромбообразования уже давно привлекает внимание не только врачей и физиологов, но и биофизиков. На кафедре биофизики физического факультета МГУ на протяжении более двух десятилетий развивается направление, связанное с анализом принципов устройства и регуляции системы гемостаза: например, в ставших классическими работах профессора Ф.И. Атауллаханова и его учеников была продемонстрирована автоволновая природа распространения процесса свертывания плазмы крови в отсутствии потока [5], [6].
Установление механизмов, регулирующих тромбообразование в условиях артериального кровотока, — одна из главных задач нашего научного коллектива, участниками которого являются профессор кафедры медицинской физики М.А. Пантелеев, профессор кафедры биофизики Ф.И. Атауллаханов, с.н.с. кафедры биофизики Д.Ю. Нечипуренко, а также студенты и аспиранты физического факультета.
Исследование in vitro и in silico
Связать поверхностное распределение умирающих тромбоцитов с процессом сжатия тромба позволили недавние исследования, выполненные нами в сотрудничестве с коллегами из Франции и США [7]. При помощи конфокальной микроскопии в экспериментах по тромбообразованию in vitro мы показали, что прокоагулянтные тромбоциты формируются в различных частях растущего тромба, после чего перемещаются на его поверхность (рис. 1).
Рисунок 1. Динамика перемещения прокоагулянтных тромбоцитов в тромбе. а — Конфокальные микрофотографии тромбов в различные моменты времени. Зеленый цвет соответствует флуоресценции умирающих клеток (используется флуоресцентный маркер клеточной смерти). б — Тромбы в различные моменты времени. Зеленый цвет соответствует флуоресценции умирающих клеток, фиолетовый цвет — флуоресценции прикрепившихся к тромбу тромбоцитов (используется флуоресцентно-меченное антитело к поверхностным белкам тромбоцита). в — Основные величины, используемые для анализа перемещения тромбоцитов — вектор перемещения d, угол транслокации α между направлением перемещения и начальным радиус-вектором центра умирающей клетки, проведенным из центра тромба. г — Результаты анализа модулей средних скоростей перемещения и углов транслокации умирающих клеток (зеленый цвет) и «свежих» тромбоцитов, прикрепившихся к поверхности тромба (фиолетовый цвет). Масштаб — 10 микрометров.
[7]
Такое перераспределение сопровождается формированием фибрина на поверхности тромба. Так как умирающие (прокоагулянтные) тромбоциты достаточно слабо взаимодействуют с другими клетками и не участвуют в процессе контракции, было высказано предположение, что их перераспределение является результатом механического вытеснения в процессе активного сжатия тромба. Для проверки этой гипотезы была создана компьютерная модель сжатия тромбоцитарного агрегата, которая продемонстрировала работоспособность сформулированной гипотезы (рис. 2).
Рисунок 2. Моделирование контракции клеточного агрегата. а — Тромбоцитарный агрегат до и после сжатия. Зеленым цветом отмечены сферы, имитирующие прокоагулянтные клетки, которые не участвуют в процессе контракции и относительно слабо взаимодействуют с другими сферами. Контракция описывается как уменьшение равновесной длины парного потенциала (Морзе) взаимодействия между центрами сфер. б — Агрегат до и после контракции, в котором «прокоагулянтные» сферы, изначально расположенные внутри агрегата, имели различные радиусы. Фиолетовым цветом отмечены сферы, которые после контракции остались внутри агрегата, а зеленым — вне агрегата. в — Значение абсолютных величин перемещений прокоагулянтных тромбоцитов в экспериментах (ex vivo) и «прокоагулянтных» сфер в модели (in silico). г — Доля сфер, вытесненных в результате сжатия агрегата на его поверхность. Показаны результаты расчета для сфер различного радиуса.
[7]
Важной доказательной базой работы стали эксперименты с кровью уникальных генетически модифицированных мышей, тромбоциты которых лишены возможности проявлять механическую активность и, следовательно, обеспечивать контракцию тромба. В соответствии с предсказаниями модели и сформулированной гипотезы, умирающие клетки не перемещались к поверхности тромба в случае отсутствия контракции (рис. 3). Отсутствие поверхностного распределения умирающих тромбоцитов также сопровождалось отсутствием поверхностной локализации фибрина.
Рисунок 3. Сравнение распределения прокоагулянтных клеток и фибрина для нормальных и генетически модифицированных мышей. а — Распределение прокоагулянтных тромбоцитов (зеленый цвет) в нормальных мышах (верхняя панель) и модифицированных мышах (нижняя панель). Желтым цветом отмечен контур тромба, построенный по изображению в режиме дифференциально-интерференционного контраста. б — Анализ величин отношения суммарной флуоресценции поверхности умирающих клеток, находящихся вне плотной части тромба к флуоресценции таких же поверхностей внутри тромба для нормальных (WT) и генетических модифицированных мышей (MYH9). в — Распределение прокоагулянтных поверхностей (зеленый цвет) и фибрина (фиолетовый цвет) в тромбах мышей дикого типа (верхняя панель) и тромбах генетически модифицированных мышей (нижняя панель). Масштаб — 10 микрометров.
[7]