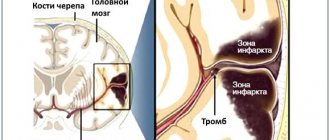
Инсульт, прежде носивший имя апоплексического или мозгового удара, – это острое нарушение мозгового кровообращения. Кровь не поступает в клетки мозгового вещества, они перестают получать кислород и начинают умирать.
Во время инсульта утрачиваются способности человека, которые контролируются пострадавшей областью мозга, в том числе, например, память и мышечный контроль.
Инсульт может случиться с кем угодно, где угодно и когда угодно, поэтому так важно обладать достаточной информацией о признаках инсульта и знать, что требуется делать.
Причины инсульта
Инсульт может быть вызван несколькими причинами. Важнейшими факторами риска этого состояния являются курение, малоподвижный образ жизни, злоупотребление алкоголем, ожирение, генетическая предрасположенность (её косвенным признаком можно считать случаи инсультов у близких родственников). В зависимости от вида инсульта причина может варьироваться. Два наиболее распространенных вида описаны ниже:
Геморрагический инсульт происходит из-за внутреннего кровотечения, когда разрывается сосуд внутри мозга. Другие названия геморрагического инсульта – кровоизлияние в мозг или внутричерепное кровоизлияние. В числе причин геморрагического инсульта выделяют:
- неактивный образ жизни;
- повышенный уровень стресса;
- злоупотребление алкоголем;
- ожирение;
- курение.
Геморрагический инсульт также может быть вызван аномальным образованием кровеносных сосудов или разрывом расширенных сосудов (осложнением венозной недостаточности сосудов головного мозга).
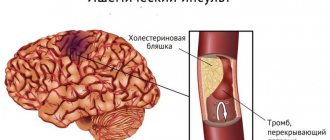
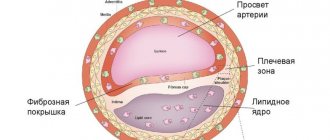
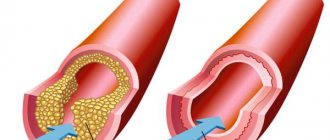
Ишемический инсульт происходит вследствие нарушения кровообращения. Типичный случай – перекрытие просвета сосуда кровяным сгустком. Причиной ишемического инсульта может быть:
- сахарный диабет;
- чрезмерное употребление алкоголя;
- ожирение;
- повышенное содержание холестерина (вызвавшее атеросклероз сосудов головного мозга);
- курение;
- артериальная гипертензия.
Мерцательная аритмия, вид нерегулярного сердцебиения, является еще одной причиной ишемического инсульта.
Профилактика
Независимо от возраста важно следить за уровнем артериального давления. Если имеются отклонения от нормы, то следует обратиться к специалисту. Врач назначит необходимое лечение и даст рекомендации относительно физических нагрузок, питания и режима отдыха. Иногда во время обследования молодому человеку могут диагностировать мерцание предсердий или нерегулярные сердечные сокращения. Это заболевание ведет в застою крови, что в свою очередь может завершиться инсультом. Любые проблемы с кровообращением требуют обращения к врачу. Только вовремя оказанная помощь избавит от гораздо более серьезных проблем в будущем.
Отказ от курение, контроль за выпитым спиртным, решение заниматься спортом, правильно подобранный рацион питания, аутогенные тренировки – это лучшая профилактика ишемического инсульта, которую молодой человек может осуществить самостоятельно.
Инсульт представляет собой реальную и серьезную угрозу для жизни. Поэтому уже с молодости необходимо уделять внимание профилактике, а также обращаться к врачу при появлении тревожных сигналов.
Симптомы инсульта
Первыми признаками инсульта являются:
- нарушение связности речи. Трудно разобрать, что говорит человек;
- появление асимметрии лица. Нарушается мимика, как правило, страдает одна сторона. Если попросить человека в таком состоянии улыбнуться, улыбка выйдет кривой;
- выраженная слабость конечностей. Как правило, страдают конечности с одной стороны (правая рука и правая нога или левая рука и левая нога). Если человека попросить поднять одновременно обе руки, одна из них будет заметно отставать или вообще не сможет пошевелиться;
- ухудшение зрения. Один зрачок при этом будет расширен больше второго, возможно хаотичное движение глазных яблок. Больной может ощущать сдавленность глаз и жаловаться на двоение зрения.
Как определить, когда у кого-то случается инсульт?
В качестве мнемонического правила можно привязать признаки инсульта к слову УДАР:
«У» – улыбка
«Д» – движение рук
«А» – артикуляция
«Р» – «решение»: если указанные признаки несомненны, надо вызывать скорую помощь.
Другими проявлениями инсульта могут быть:
- путаница сознания. Пострадавший от инсульта человек плохо понимает, что ему говорят;
- головокружение;
- сильная головная боль
Актуальность проблемы ишемического инсульта (ИИ) у лиц молодого возраста (18—45 лет) в первую очередь определяется отличием его причин от таковых в старших возрастных группах, распознание которых требует проведения специальных лабораторно-инструментальных исследований и часто сопряжено с немалыми трудностями. На актуальность проблемы указывает и высокая частота криптогенного инсульта (15—40%), т. е. инсульта неустановленной этиологии [1—5]. Кроме того, за последние годы изменились причины И.И. Так, успехи в лечении ревматизма, достигнутые в прошлом столетии, привели к тому, что кардиогенные эмболии церебральных артерий, обусловленные ревматическим поражением клапанов сердца, ранее бывшие основной причиной ИИ в молодом возрасте, в настоящее время встречаются нечасто. А заболевания, прежде считавшиеся раритетными или неизвестными (диссекция, антифосфолипидный синдром — АФС) диагностируются все чаще. Наконец, немаловажное значение имеют социально-экономические факторы, сопряженные с молодым возрастом больных, а также тенденция к росту ИИ в молодом возрасте [6].
Изучение причин ИИ у молодых пациентов в Научном центре неврологии (далее — Центр) проводится на протяжении последних 30 лет. В настоящем обзоре представлен анализ причин ИИ более чем у 600 больных, обследованных в течение последних 13 лет.
Самой частой причиной ИИ, по данным настоящего исследования, является диссекция артерий, кровоснабжающих головной мозг (28%). Реже, почти с одинаковой частотой встречаются кардиогенные эмболии (12%), АФС (11%), коагулопатии не-уточненного генеза, включая серонегативный (отрицательные антитела к фосфолипидам — аФЛ) синдром Снеддона (6%), изолированный церебральный артериит (5%). На долю прочих причин, включающих болезнь/синдром моя-моя, полицитемию, генетически детерминированные артериопатии, митохондриальные заболевания, приходится 3%. Частота артериальной гипертонии и атеросклероза, основных причин ИИ в старших возрастных категориях, невелика и составляет 7 и 3% соответственно. Криптогенный инсульт был диагностирован у 25% больных. Почти у половины из них клинические проявления были типичны для диссекции, однако отсутствие инструментального подтверждения последней в остром периоде инсульта не позволило отнести их в разряд инсультов с установленной этиологией [1].
Диссекция (расслоение) стенки артерий, кровоснабжающих головной мозг, является самой частой причиной ИИ в молодом возрасте. Клиническая диагностика данной патологии и ее активное изучение стали возможными только во второй половине 90-х годов ХХ века после внедрения в клинику магнитно-резонансной томографии (МРТ), позволившей широко проводить неинвазивную ангиографию, выявляя характерные для диссекции признаки. Диссекция представляет собой проникновение крови из просвета в стенку артерии через разрыв интимы с ее последующим распространением между слоями стенки и пролабированием в сторону интимы, что ведет к сужению или даже окклюзии просвета артерии [7]. Последнее служит одной из причин ИИ по механизму сосудисто-мозговой недостаточности, наиболее характерному для диссекции внутренней сонной артерии (ВСА) [8]. Другим механизмом развития инсульта при диссекции служит артерио-артериальная эмболия пристеночными тромбами, сформировавшимися в месте разрыва интимы, или тромбированными элементами интрамуральной гематомы (ИМГ), проникающими в кровоток при вторичном прорыве интимы. Этот механизм чаще встречается при диссекции позвоночной артерии (ПА) [9]. Преимущественное распространение ИМГ в сторону наружной оболочки артерии (адентиции) может приводить к формированию расслаивающей аневризмы, которая также может стать источником артерио-артериальной эмболии.
Причиной разрыва интимы, согласно исследованиям, проведенным в лаборатории патологической анатомии Центра, являются ее диспластические изменения (фибромышечная дисплазия), представленные разволокнением, истончением, а местами — отсутствием внутренней эластической мембраны, субинтимальным фиброзом, неправильной ориентировкой миоцитов среднего слоя, участками кальцификации интимы. В этих условиях присоединение различных провоцирующих факторов, вызывающих натяжение артерии или ее дополнительное «расслабление», приводит к надрыву интимы и развитию диссекции [10, 11]. Причина диспластических изменений артериальной стенки остается до конца не ясной. Генетические исследования по поиску мутаций в гене коллагена и эластина дали негативный результат [12, 13]. Полногеномное исследование (GWAS) показало, что аллельный вариант G олигонуклеотидной замены rs9349379 в интронной части гена PHACTR1
(ген фосфатазы и регулятора актина 1) ассоциируется с более низким риском развития диссекции, тогда как аллельный вариант, А этого же гена ассоциируется с фибромышечной дисплазией [14]. Это согласуется с морфологическими данными настоящего исследования, показавшими, что основной причиной диссекции служит именно фибромышечная дисплазия. Было сделано предположение, что в ее развитии играет роль митохондриальная патология, и это подтвердили гистологические и гистохимические исследования мышечных биоптатов, полученных от больных с диссекцией, а также электронно-микроскопические исследования артерий в биоптатах кожи [15, 16].
Диссекции развивается как в системе сонных, так и П.А. Чаще поражается экстракраниальный, чем интракраниальный отдел, включая его крупные ветви (средняя, передняя, задняя мозговые артерии, основная артерия) [7]. Диссекция ВСА происходит чаще, чем ПА, причем в первом случае чаще страдают мужчины, во втором — женщины [17—20]. Средний возраст больных российской популяции при развитии инсульта составляет 37 лет. Инсульт, обусловленный диссекцией, как правило, развивается у молодых людей, считавших себя до этого практически здоровыми, у которых нет атеросклероза, сахарного диабета, клинических признаков тромбофилии. Примерно ½ больных до развития диссекции страдали головными болями, почти у 1/3 имелась артериальная гипотония, а у ¼ — повышение артериального давления, как правило, умеренное [7, 17].
Характерным признаком инсульта вследствие диссекции ВСА/ПА является предшествование ему таких провоцирующих факторов, как ушибы головы (обычно легкие, без признаков сотрясения головного мозга), физическая нагрузка и напряжение, наклоны, повороты, запрокидывание головы, в том числе при занятиях фитнесом, вынужденное, не-удобное положение головы, мануальная терапия, прием алкоголя, контрацептивов, банальные инфекции, перенесенные в предшествующие 3 нед [7, 17]. Еще одной характерной и диагностически важной клинической чертой инсульта, обусловленного диссекцией, является наличие предшествующей ему шейной и головной боли в проекции расслоенной артерии. Ее патофизиологической основой служит раздражение чувствительных рецепторов артериальной стенки развивающейся в ней гематомой. Функциональное восстановление после перенесенного инсульта определяется локализацией и размером инфаркта головного мозга. В целом при экстракраниальной диссекции наблюдается хорошее восстановление нарушенных функций, причем это более характерно для диссекции ПА, чем ВСА [17]. Рецидивы диссекции происходят менее чем в 10% случаев [7, 21]. Летальность при инсульте, обусловленном диссекцией, составляет 1—3% и наблюдается, как правило, при интракраниальной диссекции с развитием обширных инфарктов головного мозга [7, 10, 11, 22].
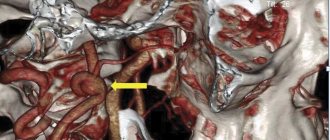
На протяжении многих лет «золотым» стандартом в диагностике диссекции считалась дигитальная субтракционная ангиография (инвазивная методика), тогда как в последние десятилетия приоритет отдается нейровизуализационному исследованию, в первую очередь магнитно-резонансной ангиографии (МРА) и МРТ артерий шеи [23]. МРА позволяет выявить типичные для диссекции изменения просвета артерий. К ним относятся пролонгированный равномерный стеноз (симптом «струны») или неравномерный пролонгированный стеноз (симптом «четок или нитки бус»). В случае окклюзии ВСА, обусловленной ИМГ, выявляется характерное для диссекции предокклюзионное конусовидное сужение артерии — симптомы «пламени свечи». Другие патогномоничные для диссекции ангиографические признаки включают расслаивающую аневризму и двойной просвет артерии (истинный и ложный) (рис. 1).
Рис. 1. Ангиографические признаки диссекции экстракраниальных отделов внутренней сонной и позвоночной артерий. а) 3DTOF МРА. Пролонгированный равномерный стеноз (стрелки) шейной части левой ВСА; б) 3DTOF МРА. Пролонгированное неравномерное сужение просвета правой ПА (длинные стрелки). Гематомы в стенки ПА, распространяющиеся в сторону адвентиции (короткие тонкие стрелки); в) КТ-ангиография. Диссекция левой ВСА. Конусообразное предокклюзионное сужение артерии — симптом «пламени свечи» (длинная стрелка), общая сонная артерия (короткие стрелки) проходимы; г) расслаивающая аневризма левой ВСА (стрелка), связанная с основным кровотоком. Просвет артерии до и после аневризмы сужен вследствие наличия в ее стенке крови; д) двойной просвет (истинный и ложный) левой ПА (стрелка).
МРТ артерий шеи, в отличие от МРА, позволяет обнаружить ИМГ. Наиболее информативным режимом является Т1_f/s ВИ (f/s — «fat suppression», подавление сигнала от жировой ткани). С конца 1-й недели и на протяжении следующих примерно 2,5 мес ИМГ в режиме T1_f/s в аксиальной проекции выглядит как гиперинтенсивное образование полулунной формы, сужающее просвет артерии, а в случае окклюзии — полностью выполняющего его. В коронарной проекции ИМГ выглядит как образование, повторяющее контуры сосуда и муфтообразно охватывающего суженный просвет, а при окклюзии — полностью занимающего его. Наружный диаметр артерии увеличен за счет наличия в ее стенке ИМГ (рис. 2). Через 2,5—3 мес от развития диссекции ИМГ также не визуализируется в связи с ее «рассасыванием», сопровождающимся восстановлением проходимости по артерии, либо, если сохраняется окклюзия, сигнал от организовавшейся ИМГ становится изоинтенсивным, в связи с чем она не дифференцируется от окружающих тканей.
Рис. 2. МРТ артерий шеи, режим T1 f-. а) аксиальная проекция. Гематома в стенке экстракраниального отдела левой ВСА (толстая стрелка), наружный диаметр артерии увеличен. Просвет артерии сужен, эксцентрично расположен (тонкая стрелка); б) коронарная проекция. Гематома в стенке левой ВСА, муфтообразно охватывающая суженный просвет артерии (стрелки).
Повторное нейровизуализационное исследование при диссекции показало, что все стенозы ВСА и ПА, обусловленные ИМГ, полностью или частично регрессируют через 3 мес. При исходной окклюзии полная или частичная реканализация наблюдается только в половине случаев [7, 9, 17, 24, 25]. В связи с этим однократное исследование в остром периоде ИИ может привести к ошибочному диагнозу тромбоза или атеросклеротического стеноза неясного генеза, следствием чего служит неадекватное лечение. Однократное исследование в поздние сроки инсульта, когда проходимость по артерии восстановилась, приводит к ошибочной диагностике инсульта неясного генеза.
Лечение ИИ, обусловленного диссекцией, окончательно не определено, так как отсутствуют рандомизированные плацебо-контролируемые исследования, выполненные на большом количестве больных [26—29]. В остром периоде обычно применяются антикоагулянты или антиагреганты с целью предотвращения артерио-артериальной эмболии и поддержания ИМГ в разжиженном состоянии, способствующем ее разрешению. Следует иметь в виду, что назначение больших доз антикоагулянтов небезопасно, так как может привести к увеличению ИМГ и обусловленного ей стеноза/окклюзии просвета артерии, и как следствие — увеличению зоны ишемии. Исходы инсульта при лечении антикоагулянтами и антиагрегантами не отличаются [7, 27, 29, 30]. Следует подчеркнуть, что применение антикоагулянтов и антиагрегантов показано в течение примерно 3 мес, на протяжении которых происходит организация ИМГ. Их дальнейший прием с целью вторичной профилактики инсульта нецелесообразен, так как его причиной при диссекции служит не гиперкоагуляция, а слабость артериальной стенки.
Тромболитическая терапия
. Показания к проведению тромболизиса, а также рандомизированные контролируемые исследования по оценке его эффективности отсутствуют [30]. Описано успешное проведение как внутривенного, так и внутриартериального тромболизиса [31—33]. Внутриартериальный тромболизис может комбинироваться со стентированием [33]. Частота осложнений тромболизиса у больных с диссекцией, по-видимому, такая же, как при тромболизисе у больных с ИИ иного генеза [29, 30]. Смертность при тромболизисе у больных с диссекцией составляет 8,1% [34]. Частота благоприятных исходов инсульта при диссекции не отличалась у больных с тромболизисом и без него, а частота внутримозговых кровоизлияний (во всех случаях асимптомных) при тромболизисе выше (5,9% против 0,6%) [35].
Наряду с медикаментозным лечением в остром периоде диссекции, особенно в течение 1-го месяца, когда риск рецидива диссекции повышен, необходимо ограничение движений в шейном отделе позвоночника, для чего рекомендуется ношение шейного ортеза. Кроме того, необходимо избегать физического напряжения, натуживания, которые могут привести к нарастанию диссекции. Диета должна быть богата белком и витаминами. Женщинам противопоказаны эстрогенсодержащие контрацептивы.
Хирургическое и эндоваскулярное лечение
. Показания к ним, основанные на рандомизированных контролируемых исследования, не разработаны, хотя в литературе имеются указания на такой подход к лечению [36]. J. Robertson и A. Koyfman [30] в обзоре, посвященном диссекции цервикальных артерий, отмечают, что такой вид лечения может обсуждаться при неэффективности консервативного лечения. Наш опыт свидетельствует о нецелесообразности стентирования в остром периоде диссекции, приводящего к стенозу просвета артерии, так как по мере организации ИМГ все стенозы полностью или в значительной степени регрессируют. Попытки удаления ИМГ, которая при ангиографии обычно ошибочно трактуется как тромб, приводят к реокклюзии и нарастанию очаговой неврологической симптоматики. Вопрос хирургического и эндоваскулярного лечения должен обсуждаться в случаях выраженного остаточного стеноза артерии, особенно если в ее бассейне развиваются повторные нарушения мозгового кровообращения (НМК), а также при формировании расслаивающей аневризмы, представляющей опасность как источник артерио-артериальной эмболии и развития повторного инсульта [37].
Антифосфолипидный синдром
Доля АФС среди прочих причин ИИ в молодом возрасте составляет 11% [1]. АФС — аутоиммунное состояние, характеризующееся развитием артериальных и/или венозных тромбозов, акушерской патологии (повторные спонтанные аборты, внутриутробная гибель плода, поздние осложнения беременности: преэклампсия, замедление роста плода) в присутствии аФЛ (волчаночный антикоагулянт, антитела к кардиолипину, антитела к β-2-гликопротеину 1) [38].
Механизмы действия аФЛ многообразны и включают активацию эндотелия, моноцитов, тромбоцитов, что ведет к выделению тканевого фактора, активирующего внешний путь свертывания крови; ингибирование фибринолитической системы и системы естественного антикоагулянта протеина С; повышение агрегации тромбоцитов; активацию системы комплемента; выделение провоспалительных цитокинов; развитие гиперплазии интимы, ведущей к стенозу/окклюзии просвета артерии [39—42]. Артериальные тромбозы при АФС чаще всего развиваются в артериях головного мозга, приводя к ишемическим НМК. Средний возраст больных при первом ИИ составил 33 года [43—46]. Чаще заболевают женщины (до 80%), у которых инсульты могут развиваться во время беременности, послеродовом периоде или при приеме контрацептивов. Инсульты при АФС обусловлены тромбозом интрацеребральных, а не экстракраниальных артерий. Они развиваются в разных сосудистых бассейнах, так как связаны с гиперкоагуляцией, а не локальным изменением какого-либо одного сосуда, и имеют наклонность к рецидивам при отсутствии вторичной профилактики антикоагулянтами. Важное диагностическое значение на клиническом этапе имеет то, что примерно у ¾ больных развитию инсульта предшествуют системные проявления АФС (невынашивание беременности женщинами, периферические венозные тромбозы) [43].
В рамках АФС отдельно выделяется синдром Снеддона,
характеризующийся сочетанием двух основных признаков — цереброваскулярных нарушений и распространенного ливедо [43, 47, 48]. Синдром носит имя впервые описавшего его в 1965 г. английского дерматолога, который подчеркнул нозологическую самостоятельность заболевания и его отличие от диффузных болезней соединительной ткани (системная красная волчанка, узелковый периартериит и др.) [49]. Ливедо представляет собой достаточно стойкие, синеватые, ветвящейся формы пятна на коже, обусловленные нарушением в ней кровообращения, в том числе вследствие расстройства иннервации артерий дермы [50]. В конце 80-х годов ХХ века впервые в мире было показано, что, наряду с цереброваскулярными нарушениями и ливедо, у части больных имеются и другие системные и неврологические проявления. К ним относятся: кардиальная патология (поражение клапанов сердца, ишемическая болезнь сердца), периферические венозные тромбозы, тромбоцитопения, изменения почек (легкая протеинурия, изменение мочевого осадка), внутриутробная гибель плода или спонтанные аборты, головные боли, эпилептические припадки и др. В целом спектр клинических проявлений синдрома Снеддона оказался аналогичным таковому при АФС, что и инициировало исследование антител к кардиолипину у наших больных. Последние были найдены у 6 из 17 обследованных больных [48, 51]. В этом же году (1988) вопрос идентичности синдрома Снеддона и АФС был поставлен американскими исследователями S. Levine и соавт. [52] на основе наблюдения за 1 больной. Несмотря на клиническое сходство синдрома Снеддона и АФС, аФЛ определяются не у всех больных, а примерно в половине случаев, при этом больные без аФЛ рассматриваются как больные с серонегативным АФС [43]. Клинические проявления синдрома Снеддона у больных с аФЛ или без аФЛ сходны, а подход к лечению и профилактике повторных инсультов одинаков [53]. Цереброваскулярные нарушения при синдроме Снеддона по сравнению с таковыми при АФС без ливедо отличаются большей тяжестью: чаще происходят НМК, постепенно развивается сосудистая энцефалопатия с когнитивными нарушениями коркового типа вплоть до тяжелой деменции, а также псевдобульбарный и подкорковый синдромы [43, 54]. Лечение и вторичная профилактика инсультов состоят в постоянном приеме непрямых антикоагулянтов — ингибиторов витамина К (варфарин), часто в сочетании антиагрегантами (небольшие дозы аспирина) [41, 43]. Достаточные данные по эффективности нового поколения антикоагулянтов — прямых ингибиторов тромбина (дабигитран) и Xa-фактора свертывания крови (ривороксабан, апиксабан, эндоксабан) при АФС, протекающем с артериальными тромбозами, отсутствуют [41, 42]. Небольшой опыт применения этих препаратов при АФС свидетельствует об их меньшей эффективности по сравнению с варфарином по предотвращению повторных НМК. Для коррекции иммунопатологического процесса используется плаквенил [41—43].
Кардиогенная эмболия
Доля кардиогенной эмболии среди других причин ИИ у молодых составляет, по нашим данным, 12% [1]. Основной причиной кардиогенной эмболии у молодых является поражение клапанов сердца (врожденные, приобретенные, искусственные клапаны), реже — кардиомиопатии, аневризмы межпредсердной перегородки, инфаркт миокарда, опухоли сердца. Основная причина кардиоэмболии в старших возрастных группах — мерцательная аритмия — у молодых пациентов встречается редко. Инсульт обычно развивается остро во время активного бодрствования больного. Почти в ¼ случаев отмечается утрата сознания различной степени выраженности. В связи со спонтанным лизисом тромба окклюзия интракраниальных артерий выявляется не всегда и частота ее обнаружениях зависит от сроков исследования артерий. Выявление кардиогенной причины инсульта напрямую связано с проведением ЭхоКГ.
Васкулиты
Частота васкулитов как причины ИИ в молодом возрасте с точностью не известна, так как часто они не диагностируются. Васкулиты чрезвычайно гетерогенны по своим клиническим проявлениям, калибру и типу пораженных сосудов, а также их морфологическим изменениям. Согласно международной унифицированной номенклатуре васкулитов, различают васкулиты, поражающие сосуды крупного, среднего, небольшого размеров, а также васкулиты при системных заболеваниях и васкулиты, этиология которых не уточнена, но предполагается их ассоциация с гепатитами, раком, приемом лекарств [55]. Практически все из перечисленных васкулитов могут быть причиной И.И. Это относится к болезни Такаясу и гигантоклеточному артерииту; эозинофильному гранулематозу с полиангиитом; болезни Бехчета, для которой характерно поражение венозной системы головного мозга; системной красной волчанке; склеродермии и др. Отдельную рубрику классификации составляют васкулиты одного органа, в рамках которой выделяют первичный васкулит ЦНС. Его критерии, разработанные в 1988 г. американскими ревматологами L. Calabrese и J. Mallek [56], включают: 1) неврологический или психический дефект, не объяснимый другими причинами; 2) классические ангиографические признаки васкулита (чередующиеся участки расширения и сужения артерий) или гистологически доказанный васкулит ЦНС; 3) отсутствие признаков системного васкулита или любых других заболеваний, которые могли бы вызвать или имитировать ангиографическую картину васкулита (обратимый вазоконстрикторный церебральный синдром) или его морфологические проявления.
Первичный церебральный васкулит является малоизвестной и малоизученной причиной ИИ в молодом возрасте, ему посвящены лишь немногочисленные публикации. Наибольшее число наблюдений (163), опубликованных в 2015 г., принадлежит клинике Mayo (США) [57]. Первоначально считалось, что для первичного церебрального васкулита характерно поражение сосудов мелкого и среднего калибров. Однако в начале 2000-х годов было предложено выделение 2 подвидов церебрального васкулита: васкулит с поражением крупных/средних артерий (интракраниальный отдел ВСА, проксимальные отделы средней мозговой, передней мозговой и задней мозговой артерии) и мелких артерий (
интрацеребральные артерии) [58—60]. Целесооб-разность выделения определяется отличием их клинических проявлений, течения, диагностических и лечебных подходов. Решающее значение в изучении васкулита крупных церебральных артерий сыграла разработка нейровизуализационных методов верификации воспалительных изменений в стенке артерии, а именно, проведение высокоразрешающей МРТ с толщиной срезов 3 мм и менее в режиме T1_db_fs (подавление сигнала от жировой ткани) до и после введения контрастного вещества. Накопление последнего в артериальной стенке рассматривается как признак васкулита [61—63].
Согласно нашим исследованиям, первичный васкулит, поражающий крупные интракраниальные артерии, чаще встречался у мужчин (76%), средний возраст больных составил 33,7±11,0 года (19—50 лет). Характерными чертами васкулита являются: наиболее частое поражение ВСА, изолированно (86%) или в сочетании с поражением ПА (9%); односторонность поражения (91%); а также однофазное непрогрессирующее в большинстве случаев течение. Как правило, НМК развивались у лиц, считавших себя практически здоровыми, не имеющих клинических признаков тромбофилии. Почти в 1/3 случаев инсульту предшествовали преходящие НМК. Очаговая неврологическая симптоматика могла развиться как в период активного бодрствования больного, так и во время сна. Головная боль в остром периоде наблюдалась менее чем у половины больных. При МРА или ультразвуковом исследовании выявлялось окклюзирующе-стенозирующее поражение интракраниальных артерий, которое ошибочно расценивается как тромбоз или атеросклеротический стеноз. Истоком ошибочной трактовки является отождествление тромбоза и окклюзии просвета артерии, хотя последняя включает более широкую патологию и может быть связана не только с тромбозом, но и с ИМГ или воспалительными изменениями стенки артерии. Кроме того, недоучитывается молодой возраст пациентов, отсутствие у них признаков атеросклероза и тромбофилии.
Верификация васкулита интракраниального отдела ВСА, ПА и их крупных ветвей состоит в проведении МРТ в режиме T1_db_fs до и после введения контрастного вещества. Нейровизуализациоными маркерами воспаления являются утолщение артериальной стенки и накопление в ней контрастного вещества (рис. 3). Инсульт при васкулите крупных артерий развивается по механизму сосудисто-мозговой недостаточности (при наличии окклюзии или выраженного стеноза) или по механизму артерио-артериальной эмболии, источником которой служат пристеночные тромбы, сформировавшиеся на «воспаленной стенке».
Рис. 3. МРТ, режим T1_db_fs. Артериит правой ВСА. a) стенка каменистой части правой ВСА утолщена (стрелка); б) накопление контрастного вещества в стенке каменистой части правой ВСА — признак васкулита (стрелка).
Причина церебрального васкулита с поражением крупных артерий остается нераскрытой. Преимущественное поражение интракраниального отдела ВСА и проксимального отдела средней и передней мозговой артерии, которые имеют богатую тригеминальную иннервацию, односторонность поражения, а также сходство с непрогрессирущим (монофазным) васкулитом ЦНС у детей, в генезе которого в части случаев играет роль вирус Varicella
zoster
, персистирующий в тригеминальном ганглии после перенесенной ветрянки [64, 65], позволяют рассматривать тригерную роль этого вируса в развитии васкулита крупных интракраниальных артерий у взрослых.
Лечение окончательно не определено. В остром периоде инсульта применяются антикоагулянты, короткие курсы кортикостероидов, при наличии показаний — ацикловир. При прогрессировании васкулита показаны иммуносупрессоры [64—66].
Наследственные тромбофилии и гипергомоцистеинемия
Большое значение в отечественной литературе придается наследственно обусловленным тромбофилиям как причине И.И. По данным зарубежных исследователей, наследственные тромбофилии, в первую очередь обусловленные мутацией 1691G→A в гене V-фактора свертывания крови (мутация Лейдена), мутацией 20210G→A в гене протромбина и полиморфизм 677 С→Т в гене 5,10-метилентетрагидрофолатредуктазы (МТГФР), ассоциируются с венозными тромбозами. Они могут возникать в венах и синусах головного мозга, приводя к развитию венозного инфаркта. В отличие от этого их роль в генезе артериальных тромбозов, в том числе и церебральных, противоречива. Эти мутации чаще встречаются при ИИ, чем в популяции, и обычно рассматриваются как дополнительный фактор риска инсульта, а не его единственная самостоятельная причина [67—70]. С этим согласуются результаты наших исследований мутаций в гене протромбина, V-фактора свертывания крови (мутация Лейдена) и МТГФР при артериальном ИИ в молодом возрасте. С одной стороны, они показали отсутствие ассоциации указанных мутаций с инсультом неясного генеза (криптогенного), с другой — наличие ассоциации между мутациями в гене протромбина и гене V-фактора свертывания крови с инсультами, об-условленными АФС и кардиогенной эмболией. Последнее позволило предполагать, что данные мутации усиливали тромбогенный потенциал при АФС и кардиогенной эмболии [71]. Исследование мутаций, ассоциирующихся с тромбофилиями у молодых больных с ИИ, показано проводить при наличии у них в анамнезе тромбозов и наследственной отягощенности. Отечественные неврологи и гематологи нередко придают тромбофилическим мутациям каузальное значение при ИИ, обусловленном окклюзией экстра- и крупных интракраниальных артерий. Это необоснованно с патофизиологической точки зрения, так как тромбозы при гиперкоагуляции всегда развиваются на уровне микроциркуляторного русла. Предположить, что тромбофилия может привести к тромбозу крупной артерии в условиях интактности ее стенки и имеющейся в ней высокой скорости кровотока, невозможно, так как в первую очередь тромбоз развивается в сосудах небольшого калибра, скорость кровотока в которых низкая. Кроме того, окклюзия экстракраниальных и крупных интракраниальных артерий у молодых пациентов обычно обусловлена не тромбозами, а диссекцией или васкулитом, развитие которых не связано с наследственными тромбофилиями. Таким образом, мутации в указанных генах тромбофилий встречаются при артериальных инсультах разного генеза и являются дополнительным фактором риска его развития, а не причиной.
Умеренная гипергомоцистеинемия достаточно широко распространена в популяции и является фактором риска ИИ различного генеза вследствие повреждения эндотелия и усиления протромботической тенденции [72—74]. В отличие от этого выраженная гипергомоцистеинемия (более 80—100 мкг/мл), ассоциирующаяся с гомоцистинурией, встречается очень редко и может приводить к раннему развитию атеросклероза и тромбозов, выступая в этих случаях в качестве ведущей причины ИИ [75, 76].
Иные, реже встречающиеся причины ИИ в молодом возрасте включают болезнь/синдром моя-моя, наследственные микроангиопатии (церебральная аутосомно-доминантная или рецессивная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией, наследственная эндотелиопатия с ретинопатией, нефропатией и инсультом, болезнь Фабри), пострадиационные артериопатии, митохондриальные заболевания, спазм артерий головного мозга, употребление наркотических веществ и другие. Их диагностика требует проведения интракраниальной ангиографии, генетических и специальных биохимических исследований.
В заключение еще раз следует подчеркнуть, что причины ИИ в молодом возрасте значительно отличаются от таковых в старших возрастных группах. Их выявление напрямую зависит от появления в клинике новых лабораторно-инструментальных методов диагностики и опыта/квалификации врачей, определяющих программу исследования. Несмотря на большие успехи, достигнутые в раскрытии причин ИИ у молодых, процент криптогенного инсульта остается высоким и обосновывает проведение дальнейших исследований, направленных на раскрытие неизвестных причин ИИ у молодых пациентов.
Авторы заявляют об отсутствии конфликта интересов.
Анализ крови
Ситуация прояснилась после того, как у пациентки взяли кровь. В общем анализе крови врачи обнаружили:
- тяжелую анемию — гемоглобин 58 г/л (норма более 115 г/л);
- увеличение количества тромбоцитов до 564 × 109/л (норма до 380 × 109/л), расцененное как компенсаторный тромбоцитоз;
- увеличение среднего объема эритроцитов: MCV (mean cell volume) — 64 фл (норма 81–100 фл);
- повышенное распределение эритроцитов по величине: RDW (red cell distribution width) — 18,2 % (норма 11,6–14,8 %).
Также анализ показал изменения в биохимическом анализе крови:
- железо сыворотки — 3,58 мкмоль/л (норма 9,0–30,4 мкмоль/л);
- общая железосвязывающая способность сыворотки — 85,6 мкмоль/л (норма 45–76 мкмоль/л);
- насыщение трансферрина железом — 6 % (норма 15–50 %).
Другие биохимические показатели, включая липидный профиль, креатинин, мочевину и ферритин — оставались в пределах нормы.