Артериовенозная мальформация – церебральная сосудистая аномалия развития. Для нее характерно образование в некоторых участках головного или спинного мозга сосудистого клубка, состоящего из артерий и вен, соединяющихся друг с другом непосредственно, то есть без участия капиллярной сети.
Заболевание встречается с частотой 2 случаев на 100 000 населения, ему больше подвержены мужчины. Чаще оно клинически проявляется в возрасте от 20 до 40 лет, но иногда дебютирует и после 50 лет.
Главная опасность артериовенозной мальформации заключается в риске возникновения внутричерепных кровоизлияний, способных привести к гибели или повлечь стойкую инвалидность.
Сосудистый клубок в головном мозге при артериовенозной мальформации
Причины и факторы риска
Артериовенозная мальформация – врожденная патология, не являющаяся наследственной. Основная ее причина – негативные факторы, влияющие на процесс закладки и развития сосудистой сети (в I триместре беременности):
- внутриутробные инфекции;
- некоторые общие заболевания (бронхиальная астма, хронический гломерулонефрит, сахарный диабет);
- применение лекарственных препаратов, обладающих тератогенным эффектом;
- курение, алкоголизм, наркомания;
- воздействие ионизирующей радиации;
- интоксикация солями тяжелых металлов.
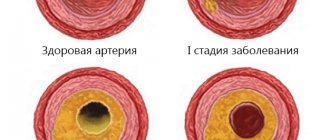
Артериовенозные мальформации могут находиться в любом участке головного или спинного мозга. Так как в подобных сосудистых образованиях отсутствует капиллярная сеть, сброс крови происходит непосредственно из артерий в вены. Это приводит к тому, что в венах повышается давление и их просвет расширяется. Артерии при данной патологии имеют недоразвитый мышечный слой и истонченные стенки. Все в совокупности повышает риск развития разрыва артериовенозной мальформации с возникновением угрожающего жизни кровотечения.
При внутричерепном кровоизлиянии, связанном с разрывом артериовенозной мальформации, погибает каждый десятый пациент.
Прямой сброс крови из артерий в вены в обход капилляров влечет за собой нарушения дыхания и обменных процессов в мозговой ткани в области локализации патологического сосудистого образования, что становится причиной хронической локальной гипоксии.
Артериовенозная мальформация: причины, симптомы, диагностика
Артериовенозная мальформация (АВМ) – врожденное состояние, возникающие из-за появления аномального сброса крови через артериовенозные шунты. Патология локализуется преимущественно в затылочной области, Анатомическая структура типична – несколько артерий, клубковое сплетение, вена. Отсутствие аномального капиллярного русла между сосудистым блоком сопровождается расширением артерий, что обуславливает особенности клинических симптомов. Диспластическая ткань повышает вероятность внутримозговых кровоизлияний по торпидному или геморрагическому типу.
Формы заболевания
Артериовенозные мальформации классифицируются по размеру, локализации, гемодинамической активности.
По локализации:
- Поверхностные. Патологический процесс протекает в коре головного мозга или в расположенном непосредственно под ней слое белого вещества.
- Глубокие. Сосудистый конгломерат находится в подкорковых ганглиях, в районе извилин, в стволе и (или) желудочках головного мозга.
По диаметру клубка:
- мизерные (менее 1 см);
- маленькие (от 1 до 2 см);
- средние (от 2 до 4 см);
- большие (от 4 до 6 см);
- гигантские (свыше 6 см).
В зависимости от особенностей гемодинамики артериовенозные мальформации бывают активными и неактивными.
Артериовенозная мальформация способна локализоваться в любой части тела, но чаще всего – в сосудах шеи и головы
Активные сосудистые образования легко обнаруживаются при ангиографии. В свою очередь, они делятся на фистульные и смешанные.
К неактивным мальформациям относятся:
- некоторые виды каверном;
- капиллярные мальформации;
- венозные мальформации.
В какой части головы локализируются АВМ головного мозга?
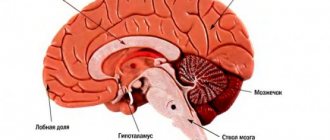
Распространенная локализация артериовенозной аномалии – это супратенториальное пространство (верхние отделы мозга), проходящее над палаткой мозжечка. Чтобы было понятнее, изъяснимся проще: сосудистый дефект примерно в 85% случаев обнаруживается в больших полушариях. Преобладают поражения сосудистых звеньев теменной, лобной, затылочной, височной долей больших полушарий.
В целом, АВМ могут располагаться в любом полюсе головного мозга, причем как в поверхностных частях, так и глубинных слоях (таламусе и др.). Достоверно определить точную локализацию очага возможно только после прохождения аппаратного исследования с возможностями визуализации мягких тканей. К базовым принципам диагностики относят МРТ и метод ангиографии. Эти методы позволяют качественно оценить порядок ветвления артерий и построение вен, их соединение между собой, калибр ядра АВМ, афференты артерий, дренирующие вены.
Симптомы
Артериовенозная мальформация нередко протекает бессимптомно и обнаруживается случайно, во время обследования по другому поводу.
При значительном размере патологического сосудистого образования оно оказывает давление на ткани головного мозга, что приводит к развитию общемозговых симптомов:
- распирающей головной боли;
- тошноты, рвоты;
- общей слабости, снижения трудоспособности.
В ряде случаев в клинической картине артериовенозной мальформации могут появляться и очаговые симптомы, связанные с нарушением кровоснабжения определенного участка головного мозга.
При расположении мальформации в лобной доле для пациента характерны:
- моторная афазия;
- снижение интеллекта;
- хоботковый рефлекс;
- неуверенная походка;
- судорожные припадки.
При мозжечковой локализации:
- мышечная гипотония;
- горизонтальный крупноразмашистый нистагм;
- шаткость походки;
- нарушение координации движений.
При височной локализации:
- судорожные приступы;
- сужение полей зрения, вплоть до полного выпадения;
- сенсорная афазия.
При локализации в области основания мозга:
- параличи;
- нарушения зрения вплоть до полной слепоты на один или оба глаза;
- косоглазие;
- затруднения при движении глазных яблок.
Артериовенозная мальформация в спинном мозге проявляется парезами или параличами конечностей, нарушением всех видов чувствительности в конечностях.
При разрыве мальформации возникает кровоизлияние в ткани спинного или головного мозга, что приводит к их гибели.
Риск разрыва артериовенозной мальформации составляет 2–5%. Если однажды кровоизлияние уже имело место, риск рецидива увеличивается в 3-4 раза.
Признаки разрыва мальформации и кровоизлияния в головной мозг:
- внезапная резкая головная боль высокой интенсивности;
- светобоязнь, нарушения зрения;
- нарушения речевой функции;
- тошнота, многократная, не приносящая облегчения рвота;
- параличи;
- потеря сознания;
- судорожные припадки.
Разрыв артериовенозной мальформации в спинном мозге приводит к внезапному параличу конечностей.
Понятие артериовенозной мальформации – что это такое
Самое опасное проявление нозологии – разрыв стенки. Любое повышение внутричерепного давления (черепно-мозговая травма, гипертоническая болезнь) способствует повышению проницаемости артериальной стенки, деформации эндометрия.
Периодичность кровотечения у пациентов с эссенциальной гипертензией сочетается с повышением артериального давления, кризами. Недостаток поступления кислорода к головному мозгу во время кровоизлияний объясняется венозным составом.
Вероятность разрыва АВМ составляет 15%.
В отличие от аневризмы при артериовенозной мальформации возникает преимущественно ангиоспазм с субарахноидальным кровоизлиянием. Первоначальное сужение артерий является компенсаторной реакцией, направленной на предотвращение массивного кровоизлияния.
Первые признаки разрыва артериальной мальформации:
- Неврологические расстройства;
- Головная боль, головокружения;
- Эпилептические судороги.
Вначале развивается внутриклеточный отек, набухание тканей способствует гипоксии. Компрессия тканей гематомой, избыточным скоплением спинномозговой жидкости – провоцирующие факторы.
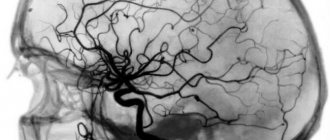
Диагностика
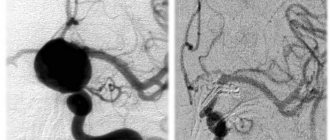
Неврологический осмотр позволяет выявить симптомы, характерные для поражения спинного или головного мозга, после чего пациенты направляются на ангиографию и компьютерную или магнитно-резонансную томографию.
Артериовенозная мальформация, выявленная при КТ-ангиографии
Заболевание встречается с частотой 2 случаев на 100 000 населения, ему больше подвержены мужчины. Чаще оно клинически проявляется в возрасте от 20 до 40 лет, но иногда дебютирует и после 50 лет.
Заболеваемость (на 100 000 человек)
| Мужчины | Женщины | |||||||||||||
| Возраст, лет | 0-1 | 1-3 | 3-14 | 14-25 | 25-40 | 40-60 | 60 + | 0-1 | 1-3 | 3-14 | 14-25 | 25-40 | 40-60 | 60 + |
| Кол-во заболевших | 0.01 | 0.1 | 0.5 | 15 | 15 | 19 | 7 | 0.01 | 0.1 | 0.5 | 12 | 12 | 16 | 5 |
Лечение
Единственный метод, позволяющий устранить артериовенозную мальформацию и тем самым предотвратить развитие осложнений – хирургическое вмешательство.
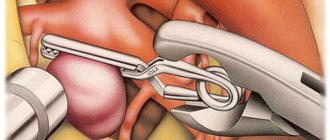
Если мальформация расположена вне функционально значимой зоны и ее объем не превышает 100 мл, ее удаляют классическим открытым методом. После трепанации черепа хирург перевязывает приводящие и отводящие сосуды сосудистого клубка, затем выделяет его и удаляет.
Классический способ удаления артериовенозной мальформации
При расположении артериовенозной мальформации в глубинных структурах мозга или функционально значимых областях провести ее транскраниальное удаление бывает сложно. В этих случаях предпочтение отдается радиохирургическому методу. Его основные недостатки:
- длительный период времени, требующийся для облитерации сосудов мальформации;
- низкая эффективность при удалении сосудистых сплетений, диаметр которых превышает 3 см;
- необходимость выполнения повторных сеансов облучения.
Еще один способ удаления артериовенозной мальформации – рентгенэндоваскулярная эмболизация питающей артерии. Данный метод может быть применен только в случае наличия доступного для катетеризации кровеносного сосуда. Его недостатками являются необходимость поэтапного лечения и низкая эффективность. Как показывает статистика, рентгенэндоваскулярная эмболизация позволяет добиться полной эмболизации сосудов мальформации только в 30–50% случаев.
В настоящее время большинство нейрохирургов отдают предпочтение комбинированному удалению артериовенозных мальформаций. Например, при значительном их размере сначала применяют рентгенэндоваскулярную эмболизацию, а после уменьшения сосудистого конгломерата в размере осуществляют его транскраниальное удаление.
Методы лечения мальформаций сосудов головного мозга
Терапия заключается в полной резекции или полноценной облитерации сосудистого дефекта хирургическим путем. Существует 3 вида высокотехнологичных операций, которые применяются в этих целях: эндоваскулярное лечение, стереотаксическая радиохирургия, микрохирургическое вмешательство.
- Эндоваскулярная операция
. Метод подходит для лечения глубоко расположенных и крупных образований. Вмешательство выполняется под рентгенологическим контролем, анестезиологическое обеспечение – наркоз общего типа. Эта малоинвазивная тактика нередко является начальным этапом лечения перед предстоящей открытой операцией.
- К патологической части головного мозга через бедренную артерию по сосудам подводят тонкую трубочку катетера.
- Через установленный проводник в область мальформации подается специальный клеевый биоматериал, похожий на монтажную пену.
- Нейрохирург пенным составом перекрывает участки поражения, то есть тромбирует аномально развитые сосуды при сохранении здоровых.
- Эмболизация позволяет «выключить» патологическое сплетение из общей системы мозгового кровообращения.
- После выполненной операции под стационарным наблюдением пациент обычно находится 1-5 суток.
- Стереотаксическая радиохирургия.
Лечебная тактика хоть и относится к ангионейрохирургии, но не является травматичной. Это означает, что никаких разрезов, введения внутрисосудистых зондов вообще не будет. Подходит для лечения сосудистого порока небольших размеров (до 3,5 см) или в том случае, когда очаг расположен в неоперабельной секции мозга.
- Радиохирургия предполагает разрушение ангиом системами вида Кибер-нож или Гамма-нож.
- Аппараты работают по принципу прицеленного воздействия на аномалию радиоактивным облучением.
- Лучи испускаются с разных сторон и сходятся в одной точке только дефектной зоны, здоровые структуры не затрагиваются. В результате сосуды АВМ срастаются, очаг подавляется.
- На Кибер- или Гамма-ноже процедуры абсолютно безболезненные, во время лечения пациент находится в сознании. Аппараты, на кушетке которых нужно будет просто неподвижно лежать (от 30 минут до 1,5 часов), напоминают традиционные томографы.
- При лечении Гамма-ножом на голову надевается специальный шлем и жестко фиксируется. Чтобы пациент, которому ставят шлем, не испытывал чувства дискомфорта, делают поверхностное местное обезболивание отдельных участков головы. Операция на Кибер-ноже не требует анестезии и помещения головы в жесткую конструкцию.
- В госпитализации нет необходимости. Но возможно понадобится пройти не один сеанс радиохирургии, чтобы окончательно ликвидировать остаточные явления АВМ ГМ. Иногда процесс облитерации длится 2-4 года.
- Прямое микрохирургическое удаление.
Микрохирургия при данном диагнозе – единственный метод, который дает максимально высокие шансы на радикальное излечение патологии, сведение до минимума рисков рецидива. Является «золотым стандартом» в лечении данного заболевания с поверхностной локализацией и компактными формами узла.
- Микрохирургическая операция не обходится без типичной краниотомии, обязательно выполняется экономное вскрытие черепа для проведения основных хирургических манипуляций на мозге.
- Вмешательство проходит под общей эндотрахеальной анестезией, под контролем сверхмощного интраоперационного микроскопа и ультразвукового оборудования.
- Для предотвращения кровяного сброса по питающему артериальному сосуду и вене применяется метод биполярной коагуляции, то есть осуществляется прижигание.
- Далее единым блоком через трепанационное окно производится одномоментное иссечение всего тела мальформации с минимальными кровопотерями.
- В конце операционного сеанса отверстие в черепе закрывается костным лоскутом, на кожные покровы накладывается шов.
- Выписка возможна ориентировочно через 14 суток после операции. Далее нужно продолжить послеоперационное восстановление в специализированном центре реабилитации. Продолжительность реабилитации устанавливается индивидуально.
Видео открытой операции можно посмотреть по ссылке: https://www.youtube.com/watch?v=WA2FTX1NK1Y
В определенных ситуациях невозможно сразу приступить к прямой микрохирургии ввиду высоких интраоперационных рисков, особенно при АВМ больших размеров. Или же другой вариант: ангиома после стереотаксии или катетерной эмболизации лишь частично компенсирована, что крайне плохо. Поэтому иногда целесообразно обращаться к поэтапному лечению, используя последовательную комбинацию нескольких ангионейрохирургических методов.
Анатомия и виды патологии большой вены мозга
Вену Галена называют большой веной мозга, поскольку это один из наиболее крупных венозных стволов, несущих кровь, насыщенную углекислотой и продуктами обмена, от внутренних отделов головного мозга — подкорковые ядра, зрительные бугры, прозрачная перегородка, сплетения боковых желудочков.
Большая вена мозга относится к глубокой венозной системе и проходит в подпаутинном пространстве (его еще называют цистерной одноименной вены в этой области), соединяющемся с нижним саггитальным венозным синусом с образованием прямого синуса. В прямой синус и впадает крупная вена Галена.
Анатомия вены Галена зависит от формы головы. Длина ее составляет около 12-14 мм, при этом у людей с долихоцефалическим типом черепа (с длинной и узкой головой) она может достигать 2 сантиметров, а у брахицефалов при короткой и широкой голове — чуть более сантиметра.
Диаметр сосуда не связан с формой черепа и составляет в среднем 5-7 мм, однако замечено, что брахицефалы имеют относительно короткий, но более широкий ствол, чем долихоцефалы с длинной и более узкой веной.
Норма скорости кровотока в вене Галена у детей до года — 4-18 см/сек.
Среди изменений, которые наиболее часто выявляются в рассматриваемом сосуде, выделены:
- Аневризма вены Галена;
- Артериовенозная мальформация большой вены мозга.
Почему она возникает?
Долгое время обсуждался вопрос о генетической предрасположенности к данной патологии, но достоверных доказательств найдено не было. Является врождённой болезнью. Процессы нарушения сосудов, которые приводят к данной патологии, происходят на первом-втором месяце внутриутробного формирования плода. В настоящее время предрасполагающими факторами считают:
- бесконтрольное употребление лекарственных препаратов, особенно влияющих на плод (с тератогенным эффектом);
- перенесённые болезни, возникающие в первом триместре беременности, вирусной или бактериальной природы;
- заболевание краснухой при вынашивании плода;
- курение и приём алкоголя при беременности. Далеко не все девушки, даже будучи «в положении» бросают эти привычки;
- ионизирующее излучение;
- патологию матки;
- выраженное отравление химическими или другими ядовитыми средствами;
- внутриутробные травмы плода;
- обострение у беременной женщины хронической патологии (сахарный диабет, гломерулонефрит, бронхиальная астма и др.)
В результате сосудистые пучки соединяются неправильно, переплетаются и возникает артериовенозная мальформация. При формировании её до значительных размеров увеличивается сердечный выброс, стенки вен гипертрофируются (компенсаторно увеличиваются), и образование принимает образ большой пульсирующей «опухоли».
Артериовенозные мальформации вены Галена (АВМвГ) — особый вид артериовенозных мальформаций (АВМ), характерный в основном для педиатрической группы пациентов. АВМвГ составляют примерно 30% среди АВМ, выявляемых в детском возрасте. Патология является врожденной и характеризуется формированием артериовенозного шунта в области одного из главных венозных коллекторов — большой вены мозга (вены Галена) [3—5, 7, 9, 11].
Основными клиническими проявлениями АВМвГ служат: 1) гипертензионно-гидроцефальный синдром, развивающийся в результате окклюзии водопровода мозга, нарушения резорбции ликвора; 2) очаговая неврологическая симптоматика, обусловленная вторичными нарушениями церебрального кровообращения по ишемическому типу; 3) задержка психомоторного развития ребенка младшей возрастной группы [5—7, 10, 12].
На первых этапах развития сосудистой нейрохирургии лечение АВМвГ было паллиативным и ограничивалось проведением шунтирующих операций по поводу окклюзионной гидроцефалии, что не решало проблему основного заболевания. В случаях естественного течения болезни, т.е. без медицинской поддержки, в течение 1-го года жизни погибали до 90—96% детей [14].
В связи с модернизацией и принципиальными изменениями подходов к лечению АВМвГ особую актуальность приобретает вопрос ранней диагностики данной патологии. В настоящее время стандартом диагностики АВМвГ является ультразвуковое обследование, позволяющее установить точный диагноз уже в III триместре беременности [1, 2, 15].
Попытки открытых вмешательств по поводу АВМвГ, проводившиеся до эпохи эндоваскулярной хирургии, были сопряжены с высокой послеоперационной летальностью, достигавшей 60%. В настоящее время этот вариант открытых вмешательств проводится только при тромбированной вене Галена, оказывающей объемное воздействие на средний мозг [8].
Дискутабельным остается вопрос о необходимости, сроках, четких показаниях к проведению ликворошунтирующих операций в рамках комплексного лечения этой патологии; имеется в виду сочетание и последовательность эндоваскулярных и ликворошунтирующих операций [16].
Малое количество данных в мировой и отечественной литературе, противоречивость в подходах к комплексному лечению стали поводом для проведения настоящего исследования, цель которого — разработка оптимального алгоритма диагностики и лечения пациентов с АВМвГ.
Материал и методы
Работа основана на анализе результатов обследования и лечения 90 пациентов с АВМвГ в НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН за период с 1987 по 2009 г. За весь анализируемый период отмечалось постепенное ежегодное увеличение количества больных с АВМвГ, в основном детей младшей возрастной группы, что связано с улучшением ранней диагностики и расширением возможностей эффективного лечения этой патологии. Наибольшее количество наблюдений (38) приходится на период с 2006 по 2009 г. Пациенты, обследованные и оперированные в этот период, составили проспективную группу.
Возраст пациентов варьировал от 3 нед до 38 лет. Все пациенты (27 (30%) — женского пола и 63 (70%) — мужского) были разделены на четыре возрастные группы: 1-я группа (≤1 год) — 35 (39%), 2-я группа (1—3 года) — 15 (17%), 3-я группа (3—10 лет) — 19 (21%), 4-я группа (старше 10 лет) — 21 (23%), в том числе 11 — в возрасте до 16 лет, 10 — взрослых. Средний возраст пациентов до 16 лет составил 3,5 года, взрослых — 22,9 года.
Обследование больных включало сбор анамнеза и общих клинических данных (срок и метод диагностики, наличие гидроцефалии, задержки психомоторного и речевого развития, эпилептических приступов, кровоизлияний в анамнезе, общемозговых симптомов), показателей физического развития (масса, рост, окружность головы), офтальмологическое, отоневрологическое, кардиологическое обследование (эхокардиография), КТ и МРТ головного мозга на до- и послеоперационном этапах. Ангиографическое исследование (АГ) выполнено всем 90 пациентам, в большинстве наблюдений — 75 (83,3%) проводилось непосредственно во время эндоваскулярной операции. Разделение АВМвГ на ангиоархитектонические типы — муральный и хориоидальный — проводилось по данным тотальной селективной церебральной ангиографии в соответствии с классификацией P. Lasjaunias и соавт. [10].
Анестезиологическое обеспечение всех операций у пациентов младших возрастных групп (моложе 10 лет) проводилось под эндотрахеальным наркозом и постоянным мониторингом ЭКГ, артериального давления, парциального давления СО2 и частоты дыхания. У пациентов старше 10 лет чаще всего применялась внутривенная седация или нейролептаналгезия.
Из 90 пациентов у 78 (86,7%) использовались различные варианты лечения АВМвГ. У 12 (13,3%) больных была выбрана тактика динамического наблюдения. В этой группе 3 пациентам была выполнена только ликворошунтирующая операция.
Эндоваскулярное лечение проведено у 75 (94,9%) пациентов из 78 оперированных. Им в общей сложности выполнена 131 эндоваскулярная операция. В подавляющем большинстве случаев — 129 (98,5%) — операции выполнялись трансартериальным доступом, в единичных наблюдениях — 3 (2,3%) использовался трансвенозный доступ. Тактика эндоваскулярного лечения зависела от типа АВМ, калибра афферентов и возраста пациента.
Микрохирургическое лечение АВМвГ проведено у 4 (5%) пациентов. Целью прямых хирургических вмешательств было иссечение тромбированной ампулы вены Галена после эндоваскулярной окклюзии либо после спонтанного тромбирования расширенной вены Галена, которая оказывала локальное объемное воздействие на прилежащие структуры мозга, в сочетании с окклюзионной гидроцефалией.
Радиохирургическое лечение проведено 8 (10,1%) больным.
Ликворошунтирующие операции выполнены 24 (26,7%) пациентам. У 20 проведена вентрикулоперитонеостомия, в 4 наблюдениях выполнялась эндоскопическая перфорация дна III желудочка. В 3 наблюдениях последовательно были выполнены эндоскопическая вентрикулостомия III желудочка и вентрикулоперитонеостомия.
В группу естественного течения вошли 12 (13,3%) пациентов. В 9 наблюдениях имелась функционирующая АВМвГ, у 3 (3,3%) пациентов, по данным АГ, выявлено спонтанное тромбирование АВМвГ.
Оценка динамики картины заболевания проводилась на основании клинико-рентгенологического обследования пациентов в ближайшем послеоперационном периоде, а также через 3 и 6 мес после эндоваскулярной операции в зависимости от возраста, динамики психоречевого и моторного развития ребенка в проспективной группе больных. В ретроспективной группе анализ проводился по записям контрольных обследований пациентов в поликлинике института нейрохирургии.
Клиническая картина и ангиоархитектоника
Первичный диагноз АВМвГ был установлен на основании УЗИ плода внутриутробно у 22 (22,2%) пациентов, у новорожденных — по данным нейросонографии — у 16 (17,8%), КТ — у 23 (25,5%), МРТ — у 30 (33,3%), АГ — у 1 (1,1%).
Ведущим в клинической картине у детей всех возрастных групп с АВМвГ являлся гидроцефальный синдром, в группе детей от 1 года до 3 лет он выявлялся в 80% наблюдений. Гидроцефалия являлась результатом гипорезорбции спинномозговой жидкости, обусловленной нарушением венозного кровообращения, или носила окклюзионный характер за счет компрессии водопровода мозга расширенной ампулой вены Галена. Увеличение окружности головы встречалось в основном у пациентов младшей возрастной группы — до 3 лет (60%). Среди пациентов старше 10 лет (47%), у которых была выявлена гидроцефалия, по данным КТ, краниомегалия обнаружена у 4% больных. В 1-й группе у детей в возрасте до 6 мес гидроцефалия была выявлена у 59%, а в возрасте от 6 мес до 1 года — у 75% (табл. 1).
Реже встречались другие симптомы: симптоматическая эпилепсия — у 19 (21,1%), нарушение функции черепно-мозговых нервов (II, III, VI, VII) — у 19 (21,1%) и внутримозговые кровоизлияния — у 8,9%. Врожденные пороки сердца наблюдались у 34,4% пациентов, из них у 3 проводилось хирургическое лечение по поводу данной патологии.
По данным ангиографии, АВМвГ хориоидального типа выявлена у 67 (74,4%) пациентов, муральный тип АВМ верифицирован у 20 (22,2%) больных (рис. 1, а, б).
Рисунок 1. Ангиограмма больных с АВМвГ. а — хориоидальный тип; б — муральный тип.
У 3 (3,3%) пациентов к моменту проведения АГ наступило спонтанное тромбирование.
Афферентами АВМвГ чаще всего являлись артерии вертебробазилярного бассейна, реже — артерии каротидного бассейна. В большинстве случаев выявлялось смежное кровоснабжение (табл. 2).
Результаты и их обсуждение
Результаты эндоваскулярного лечения
Основной задачей эндоваскулярного вмешательства было прекращение или уменьшение сброса артериальной крови в венозную систему мозга, что достигалось в основном за счет окклюзии афферентных сосудов трансартериальным доступом. Лишь у 3 больных была произведена окклюзия большой вены мозга ввиду полной неперспективности трансартериальной эмболизации при хориоидальном типе АВМ. Для окклюзии афферентов АВМ мурального типа применялись микроспирали и баллон-катетеры, при хориоидальном типе — микроспирали, клеевые композиции или их сочетание.
В качестве окклюзирующих материалов были использованы микроспирали в 45 (60%) наблюдениях, отделяемые баллон-катетеры — у 21 (28%) пациента, в 19 (24,9%) наблюдениях использовались клеевые композиции, в том числе у 2 — композиция ONYX (MTI, EV3, USA). В некоторых наблюдениях —10 (13,3%) применялась комбинация разных окклюзирующих материалов.
По данным контрольной церебральной АГ, полное прекращение артериального притока удалось достичь при муральном типе АВМвГ в 61% случаев, в то время как при мальформациях хориоидального типа этот показатель не превысил 7%.
Осложнения после эндоваскулярных операций отмечены в 10 (16%) наблюдениях. Из них клинически значимые осложнения — стойкий неврологический дефицит, обусловленный ишемическими расстройствами кровообращения мозга в бассейне хориоидальных артерий, — у 6 (10,7%). У 3 пациентов развилось внутрижелудочковое кровоизлияние, у 1 — после эндоваскулярной операции была выявлена забрюшинная гематома.
Летальный исход в раннем периоде после эндоваскулярной операции произошел в 2 (2,7%) случаях. В одном случае причиной смерти послужило массивное внутрижелудочковое кровоизлияние, во втором — остро развившаяся окклюзия на уровне сильвиева водопровода. Несмотря на экстренно проведенное наружное дренирование боковых желудочков, ребенок скончался от аксиального вклинения ствола мозга.
При оценке динамики клинических симптомов через 3 и 6 мес после эндоваскулярного лечения получены примерно одинаковые результаты во всех возрастных группах, в подавляющем большинстве наблюдений отмечен положительный результат (рис. 2).
Рисунок 2. Динамика клинической картины в разных возрастных группах через 1 год после эндоваскулярного лечения.
В отдаленном периоде (катамнез от 1 года до 15 лет) после эндоваскулярного лечения улучшение наступило во всех возрастных группах, наиболее хороший результат (82,8%) отмечен в группе пациентов до 1 года (рис. 3).
Рисунок 3. Исход заболевания в разных возрастных группах после эндоваскулярного лечения.
В группу «выздоровление» включены пациенты, у которых не было клинических симптомов заболевания, и по данным нейровизуализации не выявлялись признаки функционирования АВМвГ и гидроцефалии (рис. 4).
Рисунок 4. АВМвГ мурального типа. Эндоваскулярная окклюзия афферентов микроспиралями. Пациент М. 4 мес жизни. а — МРТ до операции; б — исходная АГ позвоночной артерии; в — МРТ через 1 год после операции; г — контрольная АГ позвоночной артерии. При сравнительном анализе исхода заболевания в разных возрастных группах установлено, что улучшение наступало во всех возрастных группах. Показатель выздоровевших больных значительно выше в 1—2-й группе по сравнению со 2—3-й группой. Эти тенденции отражают степень влияния эндоваскулярных операций на клиническое течение заболевания. Так, даже частичное уменьшение степени артериовенозного сброса создает условия для улучшения церебральной гемодинамики, вследствие чего улучшается и клинический статус больных (рис. 5).
Рисунок 5. АВМвГ хориоидального типа. Окклюзия афферентов АВМвГ микроспиралями (2 этапа). Пациент Г. 3 мес жизни. а — МРТ до операции; б — исходная АГ позвоночной артерии; в — МРТ через 2 года после 2-го этапа операции; г — контрольная АГ позвоночной артерии. Тотальное выключение патологического артериовенозного шунта (чаще при АВМвГ мурального типа или при продолженном тромбировании после эмболизации мальформаций хориоидального типа) создает условия для полной нормализации мозгового кровотока и приводит к выздоровлению пациентов. При этом чем в более ранние сроки произведена эндоваскулярная операция, тем более очевиден общий положительный эффект. Кроме этого, технически выполнить эндоваскулярные вмешательства проще в более раннем возрасте, когда еще отсутствует выраженная гипертрофия афферентных сосудов и объем артериовенозного шунтирования относительно невысок.
Вероятность нарастания неврологической симптоматики наибольшая во 2-й группе — 23,1%, а в группе пациентов до 1 года отрицательный результат был минимальным — 3,2%.
Общая летальность среди всех 90 пациентов с АВМвГ составила 6,7%. В раннем периоде после эндоваскулярной операции скончались 2 (2,7%) пациента. В отдаленном периоде после частичной окклюзии афферентов мальформации скончались 2 (2,7%) пациента. Среди пациентов, которым никакого лечения по поводу АВМвГ не проводилось, от внутрижелудочкового кровоизлияния скончались 2 (16,7%) пациента.
Результаты микрохирургического и радиохирургического лечения
Микрохирургическое тотальное иссечение тромбированной вены Галена проведено 4 больным. У 3 из них произошла инвалидизация с развитием грубой пирамидной симптоматики.
Радиохирургическое лечение проведено 8 пациентам в возрасте старше 5 лет с АВМвГ хориоидального типа. В 7 (87,5%) наблюдениях лучевой терапии предшествовала эндоваскулярная частичная окклюзия доступных афферентов АВМ. При анализе отдаленных результатов радиохирургического лечения у большинства пациентов выявлена стабилизация в клинической и рентгенологической картине заболевания. У 2 пациентов отмечено нарастание симптоматики в неврологическом статусе. В 7 наблюдениях, по данным контрольных КТ и МРТ, выполненных в разные сроки после облучения, рентгенологическая картина оставалась без изменений. Лишь в 1 наблюдении при контрольной АГ выявлено полное тромбирование АВМ. Однако у этого пациента через год после протонного облучения развилась симптоматика поражения подкорковых структур, гемипарез, парез III нерва слева, эмоционально-личностные нарушения, обусловленные развитием лучевого некроза.
Результаты в группе естественного течения
В группу естественного течения болезни вошли пациенты со спонтанным тромбированием АВМвГ, пациенты, на момент обращения у которых отсутствовали технические возможности проведения эндоваскулярной операции, а также пациенты, отказавшиеся от хирургического вмешательства, всего 12 (13,3%) наблюдений. При оценке неврологического статуса через 1 год наблюдения в 8 (66,7%) случаях отмечена стабилизация клинических симптомов заболевания. У 4 (33,3%) произошло улучшение в неврологическом статусе. Следует указать, что у 3 из этих 4 пациентов выявлено спонтанное тромбирование АВМвГ по данным АГ.
При анализе частоты случаев стабилизации и улучшения состояния в группах эндоваскулярного лечения и естественного течения через 1 год показано статистически значимое (р<0,05) увеличение положительного результата в группе пациентов, которым проводилось эндоваскулярное лечение.
Оценка отдаленных результатов в группе с естественным течением заболевания выявила высокую смертность — 16,7% (2 наблюдения) — в сравнении с группой эндоваскулярного лечения (5,3%). Выздоровление наступило только у 3 пациентов со спонтанно тромбированной мальформацией, в остальных 5 (41,7%) случаях клинический статус оставался относительно стабильным.
Результаты лечения АВМвГ на фоне ликворошунтирующих операций
Ликворошунтирующие операции проведены 24 больным. В 9 наблюдениях шунтирующая операция была выполнена до эндоваскулярного лечения, 13 пациентам — после частичной окклюзии АВМвГ, в 2 наблюдениях — при спонтанно тромбированной мальформации. Ни в одном случае на фоне ликворошунтирующей операции не было внутричерепных кровоизлияний.
Осложнения после шунтирующих операций развились у 9 (37,5%) пациентов. Они не носили специфический характер и были связаны с воспалительными изменениями, а также с синдромом гипердренирования и развитием субдуральных скоплений ликвора.
Таким образом, АВМвГ имеет сложную ангиоархитектонику, которая в значительной степени индивидуальна для каждого пациента. Несомненно, что именно на основе тщательного изучения ангиоархитектоники возможно адекватное планирование всех этапов хирургического лечения больных с АВМвГ.
Подводя итоги нашей работы, следует отметить, что наиболее эффективным методом лечения АВМвГ является эндоваскулярный метод. Высокий процент полученных удовлетворительных результатов свидетельствует о правильном подборе оптимальных видов лечения в зависимости от анатомического типа АВМвГ и возраста больного.
Выжидательная тактика при бессимптомных АВМвГ является необоснованной, поскольку успешное эндоваскулярное лечение в первый год жизни, до появления необратимых неврологических нарушений, позволяет достигнуть хороших клинических результатов. Естественное течение болезни при АВМвГ сопряжено с более высоким риском внутричерепных кровоизлияний.
При АВМвГ мурального типа с помощью эндоваскулярного лечения можно достичь полного выздоровления пациента, тогда как при АВМвГ хориоидального типа путем окклюзии наиболее крупных афферентов может быть достигнута стабилизация клинических проявлений заболевания за счет улучшения мозгового кровообращения.
Лучевая терапия при АВМвГ с крупными афферентами и высокой скоростью шунтирования неэффективна. Показания к радиохирургическому лечению могут быть определены у пациентов с АВМвГ хориоидального типа с многочисленными афферентами малого калибра и относительно невысоким объемом артериовенозного сброса, а также после частичной эмболизации по достижении максимальной редукции кровотока.
Существующее в некоторых источниках литературы [1, 13] предположение, что ликворошунтирующие операции на фоне функционирующей АВМвГ сопряжены с высоким риском геморрагических осложнений, в наших наблюдениях не нашло подтверждения. При прогрессирующей окклюзионной гидроцефалии методом выбора является эндоскопическая вентрикулостомия, при арезорбтивной гидроцефалии — вентрикулоперитонеальное шунтирование.
Выводы
1. Пренатальная диагностика АВМвГ методами ультрасонографии и МРТ плода делает возможным установить диагноз уже в III триместре беременности, что позволяет адекватно планировать родоразрешение и дальнейшее лечение ребенка.
2. Эндоваскулярный метод является высокоэффективным и малотравматичным методом лечения АВМвГ с низким уровнем инвалидизации и смертности. Микрохирургическое иссечение АВМвГ сопряжено с высоким риском осложнений и инвалидизации пациента.
3. Оптимальным для лечения является возраст пациентов 4—5 мес. Сердечная недостаточность не является абсолютным противопоказанием для эндоваскулярной операции, кроме декомпенсированной сердечной недостаточности, требующей хирургического лечения.
4. Наличие прогрессирующей гидроцефалии с соответствующей симптоматикой является показанием для проведения ликворошунтирующей операции до эндоваскулярного лечения.
Рецензия
Лечение больных с артериовенозными мальформациями вены Галена (АВМвГ) продолжает оставаться одной из важных проблем современной нейрохирургии. Из-за относительно редкой встречаемости нет единого стандарта в лечении данной патологии.
В статье приведены убедительные данные в пользу эндоваскулярного метода лечения данной патологии, основанные на ретроспективном и проспективном анализе большого, даже по мировым данным, количества пациентов. В то же время авторы доказывают малую эффективность лучевой терапии и обосновывают проведение ликворошунтирующих операций при прогрессирующей окклюзионной и арезорбтивной гидроцефалии.
Работа показывает, что эндоваскулярное лечение АВМвГ в первый год жизни позволяет достичь полного выздоровления большого количества больных, поэтому выжидательная тактика при данной патологии является необоснованной.
Несомненно, представленная статья содержит новизну и определенную ценность в решении проблемы лечения АВМвГ и будет полезна как для научных, так и для практических нейрохирургов.
В.Е. Рябухин
(Москва)
Принципы микрохирургического удаления АВМ
| АВМ. Вид на операции |
Прямые хирургические вмешательства предпочтительно проводить в холодном периоде после кровоизлияния, так как сопутствующие изменения мозга затрудняют выделение АВМ, что приводит к усугублению травмы мозга и тяжелее переносятся больным. В остром периоде паренхиматозного кровоизлияния оправдана тактика удаления больших гематом без попыток иссечения АВМ. Операция по одномоментному удалению гематомы и мальформации может быть выполнена при небольших лобарных АВМ. Следует помнить, что в условиях наличия гематомы и отека мозга, контрастирование АВМ может существенно отличаться от истинного вследствие компрессии сосудов мальформации. При глубинных АВМ, а также при АВМ больших размеров, целесообразно дождаться рассасывания гематомы. В случае вентрикулярного кровоизлияния показана установка наружного вентрикулярного дренажа. Трепанация должна быть выполнена таким образом, чтобы, помимо узла АВМ, обеспечить визуализацию афферентных артерий и основных дренажных вен мальформации на протяжении. При выделении питающих сосудов АВМ, для меньшей травматизации мозгового вещества важно использовать естественные борозды и пространства (например: широкая препаровка латеральной щели при выделении афферентов, идущих от средней мозговой артерии; межполушарные доступы для контроля афферентов, идущих от перикаллезной или задней мозговой артерий и т. п.). Выключение афферентных артерий необходимо производить на минимальном отдалении от клубка АВМ. Это связано с тем, что от питающих АВМ артерий, могут отходить ветви к мозговой паренхиме. Данное положение особенно актуально при иссечении АВМ глубинной и парастволовой локализации, когда могут пострадать ветви, кровоснабжающие функционально важные структуры. Во избежание травмы сосудов АВМ ее выделение должно осуществляться единым блоком по перифокальной зоне. У больных после кровоизлияния один из полюсов клубка АВМ может быть четко отграничен от мозга внутримозговой гематомой или постгеморрагической кистой, что упрощает хирургические манипуляции. Следует помнить, что в ряде случаев гематома может фрагментировать АВМ, в связи с чем ревизия стенок полости удаленной АВМ обязательна. Пересечение основных дренажных вен должно проводиться после полного выделения АВМ. Принцип поэтапного выключения артериального притока по мере выделения клубка, а венозного — по завершении диссекции АВМ, хорошо известен. При сокращении венозного дренирования в условиях сохраняющегося артериального притока узел АВМ становиться напряженным и кровоточивым. В определенных случаях при дисбалансе кровотока происходят самопроизвольные разрывы тонких сосудов мальформации, ведущие к интенсивному кровотечению, которое крайне сложно остановить. Единственным выходом в такой ситуации является быстрое выделение АВМ с выключением афферентов. Поскольку стенки артерий мальформации в отличие от нормальных сосудов имеют истонченный мышечный слой, коагулировать сосуды необходимо тщательно и на протяжении. К значимым интраоперационным осложнениям следует отнести воздушную эмболию. В послеоперационном периоде ухудшение в неврологическом статусе отмечено у 30% больных при значительном регрессе выраженности симптоматики в большинстве случаев. Послеоперационная летальность составила 1,3%. Послеоперационные зрительные расстройства являются достаточно стойкими и практически не регрессируют. При речевых послеоперационных нарушениях в подавляющем большинстве случаев удается добиться значительного регресса симптоматики, а у многих больных полностью избавится от дефекта речи.