А. Финкельштейн (Andrey Finkelshteyn) врач-стоматолог, специалист (Израиль)
Врачи-стоматологи все чаще сталкиваются с пациентами пожилого возраста, которые принимают антикоагулянты или антиагреганты. Применение препаратов «разжижающих» кровь является важным звеном первичной и вторичной профилактики таких сердечно-сосудистых осложнений как инфаркт миокарда, ишемический инсульт и острый коронарный синдром. Большинство исследований и мета-анализов подтверждают повышение риска кровотечений во время хирургических вмешательств на фоне приема антикоагулянтов/антиагрегантов.
При планировании хирургических манипуляций, оперирующим врачам приходится соизмерять индивидуальный риск периоперационных кровотечений и тромботических осложнений у таких пациентов. С одной стороны, прекращение антикоагулянтной и антиагрегантной терапии приводит к увеличению риска тромбоэмболических осложнений, с другой стороны, на фоне приема антикоагулянтов и антиагрегантов высока вероятность периоперационных геморрагических осложнений.
Полезно будет вспомнить физиологические механизмы гемостаза для того, чтобы понять механизм действия назначаемой таким больным антиагрегантной или антикоагулянтной терапии.
Физиология гемостаза
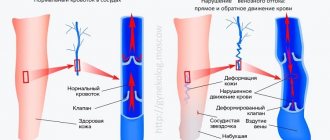
Различают клеточные и плазменные факторы свертывания крови. К клеточным факторам относятся тромбоциты, a к плазменным — белки и ферменты, участвующие в процессе коагуляции крови. Плазменные факторы свертывания синтезируются в печени и циркулируют в крови в неактивной форме.
Остановка кровотечения происходит в 3 этапа и участвуют в нем как сосуды и тромбоциты, так и плазменные факторы свертывания:
- Временный (первичный) спазм сосудов (VascularPhase).
- Образование нестабильной, рыхлой тромбоцитарной пробки за счёт адгезии и агрегации тромбоцитов (PlateletPhase).
- Ретракция (сокращение и уплотнение) тромбоцитарной пробки за счет нитей фибрина (CoagulationPhase).
Вторичный гемостаз (коагуляционный)
Сформировавшаяся тромбоцитарная пробка (без последующего образования фибрина) способна лишь временно остановить кровотечение, и если не произойдет уплотнение тромбоцитарного тромба с помощью нерастворимого фибрина, то такой тромб через несколько часов распадетс. Одновременно с активацией тромбоцитов происходит активация плазменных факторов свертывания (вторичный гемостаз). Цель: стабилизация первичной тромбоцитарной пробки за счёт образования сетей фибрина и образование плотного и стабильного фибринового сгустка.
Клиническое значение:
- если нарушения присутствуют на этапах первичного гемостаза (сосудисто-тромбоцитарного) например, тромбоцитопения (< 50,000 клеток/мм3) или прием антиагрегантных препаратов (Аспирин, Плавикс), то следует ожидать длительное и непрерывное кровотечение во время и сразу после хирургического вмешательства (из-за нарушения образования первичной тромбоцитарной пробки);
- если же нарушения присутствуют на этапах вторичного гемостаза (коагуляционного), а первичный гемостаз не нарушен (например, приём антикоагулянтов) проблемы с кровотечением будут обнаружены только через несколько часов, или даже на следующий день, после хирургического вмешательства (когда пациент уже не в клинике).
Антиагрегантные препараты (препараты нарушающие первичный гемостаз)
Ацетилсалициловая кислота (АСК)
Египетские папирусы, которые датируются приблизительно 1550 годами до н. э., упоминают использование отвара из листьев ивы белой при многих заболеваниях. Гиппократ назначал экстракт коры ивы при головной боли и лихорадке. Ива — первый источник аспирина. Ацетилсалициловая кислота, активный ингредиент Аспирина, была синтезирована из коры ивы Эдвардом Стоуном в 1897 году. Век лекарства короче, чем век человека и многие из них быстро устаревают. Но Аспирин не только не устарел за последнюю сотню лет, он еще и продемонстрировал новые качества. Кажется, он лечит все болезни — от простуды до инсульта.
Ацетилсалициловая кислота (АСК) в течение многих лет является золотым стандартом антиагрегантной терапии. Аспирин в низких дозах (40-100 мг) необратимо блокирует действие фермента циклооксигеназы-1 в тромбоцитах с последующим уменьшением образования тромбоксана А2, являющегося мощным вазоконстриктором и проагрегантом. Поскольку АСК блокирует ЦОГ-1 необратимо, антиагрегантный эффект сохраняется на протяжении жизненного цикла тромбоцита (7–10 дней). Способность необратимо блокировать ЦОГ-1 тромбоцитов выгодно отличает АСК от других нестероидных противовоспалительных препаратов, антиагрегантное действие которых является кратковременным [1]. Учитывая вышесказанное, хотел бы обратить внимание на следующий клинический момент.
Что происходит, когда стоматолог назначает НПВП пациенту принимающему Аспирин? Данные эпидемиологических исследований свидетельствуют о том, что приём препаратов из группы НПВС может отменить или существенно уменьшить кардиопротективный эффект аспирина.
Почему? Аспирин и НПВП конкурируют за один и тот же субстрат – ЦОГ 1. Следовательно, при параллельном назначении часть тромбоцитов будет обратимо связана с НПВП, а другая часть — необратимо с ацетилсалициловой кислотой. Через несколько часов тромбоциты, которые были временно инактивированы препаратами НПВП, восстановят свою функцию и пациент останется без кардиопротективного действия.
Какие анальгетики противопоказаны, а какие являются препаратом выбора у таких пациентов можно подробно узнать из моих лекций.
В исследовании RISK(ResearchonInstabilityinCoronaryarterydisease) при назначении АСК в дозе 75 мг/сут больным нестабильной стенокардией, риск развития инфаркта миокарда уменьшился на 50% [2]. В другом исследовании у больных острым ИМ эффективность АСК (160 мг/сут) оказалась сопоставимой с эффективностью тромболитической терапии [3].
Многие пациенты получают двойную антитромбоцитарную терапию (Аспирин + Клопидогрел). При остром коронарном синдроме, а также после чрескожного коронарного вмешательства (ЧКВ) или установки стента, АСК, как правило, назначается в комбинации с Клопидогрелом. Согласно многочисленным исследованиям, прекращение антитромбоцитарной терапии у пациентов с активным стентом коррелирует с 90-кратным увеличением риска тромбоза стента [4]. В литературе также задокументированы тромбоэмболические осложнения со смертельным исходом на фоне самовольной отмены стоматологом приема антикоагулянтных/антитромбоцитарных препаратов перед хирургической манипуляцией. Риск кровотечений на фоне двойной антитромбоцитарной терапии во время хирургических вмешательств резко возрастает.
Современная антиагрегантная терапия: место тикагрелора в клинических рекомендациях
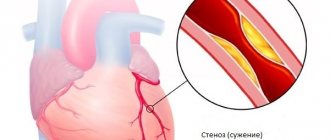
Лидирующей причиной смертности населения во всем мире по-прежнему является сердечно-сосудистая патология, несмотря на высокий уровень развития кардиологии за последние десятилетия [1, 2]. В основе различных клинических проявлений сосудистой патологии лежит общий анатомический субстрат в виде дисфункции эндотелия артерий, хронического воспаления и повреждения покрышки атеросклеротической бляшки, замедления кровотока, формирования внутрисосудистого тромба [3]. В этой связи снижение риска развития тромботических осложнений является главной задачей, которую должен ставить перед собой врач, желающий увеличить продолжительность и улучшить качество жизни пациентов с сердечно-сосудистыми заболеваниями.
Патогенез тромбообразования включает три основные точки для лекарственного воздействия: тромбоцитарное звено — действие антиагрегантов, свертывающая система — зона действия антикоагулянтов, фибрин — действие фибринолитиков. Тромбоциты первыми реагируют на разрыв атеросклеротической бляшки, запуская коагуляционный каскад, являются источником активного синтеза гуморальных факторов, стимулирующих одновременно процессы образования тромба и воспаления. По данным метаанализа 287 рандомизированных исследований по вторичной профилактике и 6 исследований по первичной профилактике назначение антиагрегантной терапии позволяет снизить риск развития нефатального инфаркта миокарда и нефатального инфаркта мозга на 23% [4]. Данный метаанализ подтверждает, что ведущая роль в профилактике осложнений атеросклероза должна отводиться антиагрегантам.
Антиагреганты — лекарственные препараты, препятствующие тромбообразованию за счет уменьшения функциональной активности тромбоцитов. На сегодняшний день известно более 20 различных лекарственных препаратов, которые способны угнетать функции тромбоцитов путем различных механизмов действия. Однако в ходе многолетней практики и клинических исследований эффективность была подтверждена только для ингибиторов циклооксигеназы (ацетилсалициловая кислота), блокаторов рецепторов аденозиндифосфата (АДФ) — Р2Y12 (клопидогрел, прасугрел, тикагрелор), ингибиторов фосфодиэстеразы (дипиридамола) и антагонистов гликопротеинов IIb–IIIa для внутривенного применения (абциксимаб, тирофибан, эптифибатид). Активация тромбоцитов и их последующая агрегация происходят под действием различных медиаторов, наиболее важными из которых являются тромбоксан А2 и АДФ, поэтому наиболее широкое применение получили ацетилсалициловая кислота (АСК) и ингибиторы АДФ (клопидогрел, прасугрел, тикагрелор).
История создания класса началась с обнаружения антитромбоцитарных свойств АСК. В 1987 г. было опубликовано первое рандомизированное Канадское исследование с участием 585 больных с инсультом, получавших АСК в течение 26 месяцев. В исследовании была доказана эффективность АСК в отношении повторного инсульта [5]. Это послужило поводом к тому, что в 1980 г. Управление по надзору за качеством пищевых продуктов и лекарственных средств США (Food and Drug Administration, FDA) одобрили АСК для лечения больных после инсульта. В последующем была доказана эффективность АСК в снижении риска смерти и повторного инфаркта миокарда у больных с нестабильной стенокардией и инфаркта миокарда без подъема сегмента ST [4]. Так началась эпоха антиагрегантной терапии и первого ее достойного представителя — ацетилсалициловой кислоты.
Ацетилсалициловая кислота блокирует активацию тромбоцитов за счет ингибирования циклооксигеназы (ЦОГ), предотвращая образование тромбоксана А2. Тромбоциты — безъядерные клетки, поэтому они лишены способности синтезировать белки. Необратимое ингибирование ЦОГ-1, невозможность ее ресинтеза из-за отсутствия ядра, а также ежедневное обновление пула тромбоцитов лишь на 10% приводят к тому, что блокада синтеза тромбоксана во время терапии АСК сохраняется на протяжении периода жизни тромбоцитов, до 10 дней. Полное подавление продукции тромбоксана достигается при постоянном длительном приеме АСК в дозах ≥ 75 мг/сут. У большинства больных со стабильной ишемической болезнью сердца (ИБС) предпочтительнее назначение АСК в низких дозах за счет благоприятного соотношения пользы и риска. АСК для данной категории пациентов остается основой медикаментозной профилактики артериального тромбоза [6]. Повреждающее действие АСК на желудочно-кишечный тракт (ЖКТ) возрастает по мере увеличения дозы. Препарат рекомендуется всем больным с установленным диагнозом ИБС без каких-либо ограничений длительности применения. Оптимальное соотношение пользы и риска достигается при применении АСК в диапазоне доз от 75 до 150 мг/сут, при использовании в составе двойной антитромбоцитарной терапии доза составляет 75–100 мг.
Однако в последние годы активно обсуждается проблема резистентности к терапии АСК, под которой понимают неспособность препарата у некоторых больных в должной мере подавлять функцию тромбоцитов, снижать синтез тромбоксана А2 и/или удлинять время кровотечения. Распространенность резистентности к терапии АСК, по данным различных исследований, составляет от 10% до 45% [7]. Среди возможных причин этого феномена выделяют следующие:
- фармакодинамические взаимодействия АСК с нестероидными противовоспалительными препаратами (НПВП);
- наличие нетромбоцитарных источников синтеза тромбоксанов А2;
- экспрессию ЦОГ-2 во вновь образующихся тромбоцитах;
- гидролиз АСК эстеразами слизистой оболочки ЖКТ;
- повышенный синтез тромбоксана А2;
- гиперлипидемию;
- генетические особенности.
В ряде независимых исследований было установлено, что у больных с острым коронарным синдромом (ОКС) без подъема сегмента ST (ESSENCE, PRISM PLUS) ближайший прогноз зависит от предшествующего приема АСК до развития обострения ИБС. Так, в исследовании PRISM PLUS при применении АСК при ОКС частота развития инфаркта миокарда, рефрактерной стенокардии и внезапной смерти к 7-му дню наблюдения составила 12,1% среди больных, не принимавших ранее АСК, и 23,5% — среди лиц, принимавших АСК до развития обострения. Этот факт получил название «аспириновый парадокс», что послужило поводом D. L. Bhatt и E. J. Topol (2004 г.) отнести АСК к «субоптимальным антитромбоцитарным средствам» [8, 9]. Все это способствовало разработке и изучению новых антитромбоцитарных препаратов-ингибиторов АДФ P2Y12-рецепторов и определению подходов к двойной антитромбоцитарной терапии.
Группу блокаторов рецепторов АДФ — Р2Y12 представляют препараты тиклопидин, клопидогрел, прасугрел, тикаглерол. Данные препараты ингибируют агрегацию тромбоцитов, индуцированную аденозиндифосфатом, вызывая изменения в рецепторе АДФ тромбоцитов, который получил название Р2Y12 [9]. Существуют значительные отличия между перечисленными выше препаратами, так, к необратимым ингибиторам P2Y12-рецепторов относятся тиенопиридины (тиклопидин, клопидогрел и прасугрел), а к обратимым — триазолопиридины (тикагрелор). Сравнительная характеристика препаратов представлена в табл. 1.
Клопидогрел — наиболее известный и активно применяемый в отечественной медицине на сегодняшний день антиагрегант после АСК [10]. Результаты крупных клинических исследований доказали эффективность по снижению частоты осложнений у широкого круга пациентов с ИБС при добавлении клопидогрела к АСК [11, 12], что послужило основанием для разработки показаний к двойной антитромбоцитарной терапии у пациентов с ОКС без подъема ST, а также после аортокоронарного шунтирования (АКШ) и чрескожного коронарного вмешательства (ЧКВ) для профилактики тромбоза [13].
Клопидогрел, как видно из таблицы, относится к пролекарствам, препарат имеет сложный метаболизм. Абсорбция клопидогрела в кишечнике контролируется особым белком (Р-гликопротеином), кодируемым геном АВСВ1, в этой связи только около 15% из абсорбируемого клопидогрела в печени превращается в активный метаболит. Процесс является двухступенчатым (окисление и гидролиз), зависящим от нескольких изоферментов системы цитохрома P450, наиболее важными из которых являются СУР2С19 и СУР3А4 [14]. Несмотря на широкую доказательную базу эффективности данного препарата, клопидогрел обладает рядом недостатков, к которым можно отнести отсроченное антиагрегантное действие, так как это пролекарство и требуется время для активации, максимальное подавление рецепторов АДФ наступает только на 4–5 день регулярного приема. Кроме того, отмечается вариабельность антитромботического эффекта клопидогрела у различных пациентов, что может быть обусловлено рядом фармакокинетических факторов, в т. ч. недостаточной ударной и поддерживающей дозой препарата, нарушением его всасывания и образования активного метаболита, лекарственным взаимодействием, в частности с ингибиторами протоновой помпы, которые часто назначаются для профилактики кровотечений из верхних отделов ЖКТ [15, 16].
В связи с имеющимися недостатками клопидогрела и невозможностью решить данную проблему, мировому сообществу стала очевидной необходимость создания нового препарата группы блокаторов рецепторов АДФ — Р2Y12.
Новым антиагрегантным препаратам является тикагрелор — обратимый антагонист P2Y12-рецепторов прямого действия. Препарат представляет собой активное вещество, которое метаболизируется посредством изофермента СYР3А4 с образованием активного метаболита. Степень ингибирования P2Y12-рецепторов определяется, прежде всего, содержанием тикагрелора в плазме и, в меньшей степени, его активного метаболита. Период полувыведения составляет около 12 ч, в связи с чем препарат назначается дважды в сутки. Тикагрелор характеризуется более быстрым началом терапевтического действия и обеспечивает более выраженное и стойкое ингибирование активации тромбоцитов по сравнению с клопидогрелом. В то же время восстановление функции тромбоцитов после отмены тикагрелора происходит быстрее по сравнению с клопидогрелом. Наличие более привлекательных фармакологических свойств, а также существующие проблемы, связанные с приемом клопидогрела, послужили основными причинами организации крупномасштабного исследования PLATO (Platelet inhibition and patient outcomes), в котором сравнивались эффективность и безопасность применения тикагрелора по сравнению с клопидогрелом у больных с ОКС [17]. По данным исследования, обнародованного 30 августа 2009 на Конгрессе Европейского общества кардиологов (European Society of Cardiology, ESC), новый антитромботический препарат тикагрелор эффективнее клопидогрела при лечении пациентов с острым коронарным синдромом и при этом не повышает риск кровотечений.
Исследователи под руководством Lars Wallentin рандомизировали 18 624 пациента с ОКС, в период с 2006 по 2008 год госпитализированных в 862 лечебные учреждения, включенных в исследование PLATO. Больных разделили на 2 группы: в первой больные получали тикагрелор (180 мг нагрузочная доза и 90 мг дважды в день), в другой — клопидогрел (300 или 600 мг нагрузочная доза и 75 мг ежедневно). Все пациенты также принимали АСК в дозе 75–100 мг. Группы были тщательно сбалансированы с учетом исходных клинических показателей, сопутствующих заболеваний и тактики лечения. У 37,5% пациентов был острый инфаркт миокарда с подъемом сегмента ST, у 42,9% — острый инфаркт миокарда без подъема сегмента ST, у 16,6% — нестабильная стенокардия. Продолжительность приема лекарств составляла от 6 до 12 месяцев, в среднем — 277 дней. Результаты показали, что на фоне терапии тикагрелором по сравнению с клопидогрелом наблюдалось значительное уменьшение общего количества первичных конечных точек (сердечно-сосудистая смерть, инфаркт миокарда или инсульт): 9,8% против 11,7%, снижение риска составило 16%, р < 0,001. У получавших тикагрелор, по сравнению с лечившимися клопидогрелом, отмечалось достоверное снижение частоты развития инфаркта миокарда: с 6,9% до 5,8%, сердечно-сосудистой смерти — с 5,1% до 4%. В то же время общее число перенесенных инсультов было одинаковым в обеих подгруппах: 1,5% и 1,3%. Частота комбинированной вторичной конечной точки (смерть от сосудистых причин, инфаркт миокарда, инсульт, рецидивирующая ишемия миокарда, транзиторная ишемическая атака или другие варианты артериального тромбоза), а также смерти от всех причин были достоверно ниже в группе тикагрелора по сравнению с клопидогрелом: 14,6% против 16,7% и 4,5% против 5,9% соответственно. Не было выявлено значимых различий между группами в частоте больших, а также фатальных и угрожающих жизни кровотечений. Интересно отметить, что риск больших кровотечений, включая фатальные внутричерепные, не связанных с процедурой АКШ, был несколько выше в группе тикагрелора по сравнению с клопидогрелом (4,5% против 3,8%, p = 0,03). В то же время количество связанных с АКШ кровотечений было меньше среди лиц, получавших тикагрелор (7,4% против 7,9%) [18].
Отдельно были проанализированы результаты 13 408 (72%) больных с запланированной на этапе рандомизации инвазивной стратегией лечения [18]. У 49,1% пациентов был диагностирован острый коронарный синдром с подъемом сегмента ST на электрокардиографии (ЭКГ) и у 50,9% — острый коронарный синдром без подъема сегмента ST на ЭКГ. Во время первой госпитализации ЧКВ было проведено у 10 298 (72%) больных, а АКШ — у 782 (5,8%). Среднее время до проведения ЧКВ составило 2,4 (0,8–20,1) ч после рандомизации у больных ОКС без подъема сегмента ST на ЭКГ и 0,5 (0,2–1) ч при ОКС с подъемом сегмента ST на ЭКГ. Среднее время до проведения АКШ составило 6 (3–10) дней. Общее количество инфарктов миокарда, инсультов и случаев сердечно-сосудистой смерти на фоне терапии тикагрелором уменьшилось до 9% (клопидогрелом — на 10,7%), т. е. снижение риска составило 16%, р < 0,0025.
Важно подчеркнуть, что преимущества тикагрелора в отношении первичной конечной точки отмечались в различных подгруппах и не зависели от нагрузочной дозы клопидогрела. Большие кровотечения одинаково часто встречались как у принимавших тикагрелор, так и у лечившихся клопидогрелом (11,6% против 11,5%). Число случаев тромбоза стента было достоверно ниже в группе тикагрелора, причем как при использовании стентов с лекарственным покрытием, так и без него. Частота случаев определенных тромбозов стента у больных, получавших тикагрелор, была достоверно ниже как через 30 дней, так и через 360 дней наблюдения в сравнении с лечившимися клопидогрелом, включая и тех пациентов, кто принимал нагрузочную дозу препарата 600 мг и более.
При анализе фрагмента исследования, включившего 1261 пациента, подвергнутого процедуре АКШ, в течение 7 дней от последнего приема исследуемого препарата не было выявлено достоверной разницы в снижении количества первичных конечных точек (10,6% в группе тикагрелора и 13,1% — клопидогрела). При этом среди принимавших тикагрелор наблюдалось достоверное уменьшение общей смертности на 51%, а сердечно-сосудистой — на 48%, как в ранние, так и в поздние сроки после операции [19].
Таким образом, РLATO явилось первым крупномасштабным исследованием, в котором была продемонстрирована клиническая эффективность тикагрелора в отношении снижения частоты развития основных сосудистых событий у больных с ОКС, без существенного повышения риска кровотечений. Более значимое снижение риска развития тромботических эпизодов на фоне терапии тикагрелором, по всей видимости, обусловлено более быстрым и интенсивным ингибированием P2Y12-рецепторов тромбоцитов. При назначении нагрузочной дозы клопидогрела в 600 мг требуется 2–4 ч для достижения 50% ингибирования агрегации тромбоцитов, и тот же эффект достигается через 30 мин при приеме 180 мг тикагрелора. Кроме того, существует достаточно большая группа больных с наличием дефективных вариантов аллелей системы цитохрома P450, что ассоциируется с замедлением образования активного метаболита клопидогрела, недостаточным подавлением функции тромбоцитов при его приеме, а также с более высоким риском сердечно-сосудистых осложнений после острого коронарного синдрома и при ЧКВ. К преимуществам тикагрелора также относится обратимый характер ингибирования P2Y12-рецепторов тромбоцитов, что означает более быстрое прекращение антиагрегантного эффекта после отмены препарата. Это обстоятельство представляется важным при инвазивных вмешательствах, а также перед предстоящей процедурой АКШ. Хотя частота больших кровотечений на фоне приема тикагрелора была не ниже, чем при назначении клопидогрела, следует учесть, что более интенсивное ингибирование функции тромбоцитов не сопровождалось увеличением частоты больших кровотечений. Это выгодно отличает тикагрелор от прасугрела, чей более выраженный антиагрегантный эффект сопровождается увеличением риска больших кровотечений.
Европейское общество кардиологов рекомендовало прием тикагрелора (в нагрузочной дозе 180 мг и 90 мг 2 раза/сут — в поддерживающей) всем больным с ОКС, вне зависимости от планируемой стратегии лечения (инвазивной или консервативной) как терапию первого ряда. Если пациенты в самом начале заболевания получали клопидогрел, его следует заменить на тикагрелор. Прием клопидогрела у больных с ОКС с инвазивной или консервативной стратегиями возможен только в случаях отсутствия или непереносимости тикагрелора или прасугрела. Продолжительность терапии ингибиторами P2Y12-рецепторов у больных, перенесших острый коронарный синдром, составляет 12 мес. У пациентов, находящихся на терапии ингибиторами P2Y12-рецепторов, в случаях планового оперативного вмешательства (включая АКШ) тикагрелор и клопидогрел отменяются за 5 сут, а прасугрел — за 7 сут. Двойная антитромбоцитарная терапия проводится обязательно на фоне приема АСК в дозе 75–100 мг/сут [13]. Применение двойной антитромбоцитарной терапии при стабильной ИБС могло бы обеспечить более эффективное предупреждение коронарного тромбоза. Однако в исследовании CHARISMA, включавшем стабильных пациентов с атеросклеротическим поражением различных сосудистых бассейнов или множественными сердечно-сосудистыми факторами риска, добавление клопидогрела к АСК дополнительной пользы не принесло [20]. В рекомендациях Европейского общества кардиологов 2013 г. указывается, что двойная антитромбоцитарная терапия имеет преимущества лишь у отдельных категорий пациентов с высоким риском развития ишемических событий. Рутинное назначение этой терапии больным стабильной ИБС не рекомендовано [21].
Таким образом, именно атеротромбоз является причиной высокой смертности пациентов с сердечно-сосудистыми заболеваниями во всем мире. Одним из ключевых моментов терапии является грамотное назначение антиагрегантных препаратов. Основными эффективными пероральными препаратами для назначения в клинической практике являются АСК, клопидогрел, тикагрелор, прасугрел. В табл. 2 представлен алгоритм выбора антиагрегантов. Современная кардиология активно развивается, и можно надеяться, что новые грани известных препаратов и разработка новых помогут врачам в ежедневной борьбе с сердечно-сосудистыми заболеваниями.
Литература
- Singh, V. V., Toskes P. P. Small Bowel Bacterial Overgrowth: Presentation, Diagnosis, and Treatment // Curr Treat Options Gastroenterol. 2004. Vol. 7 (1). Р. 19–28.
- McMurray J. J., Adamopoulos S., Anker S. D. et al. Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology // Eur. Heart J. 2012. Vol. 33 (14). P. 1787–1847.
- Uster V., Fallon J. T., Badimon J. J. et al. The unstable atherosclerotic plaque: clinical significance and therapeutic intervention // Thrombosis and Hemostasis. 1997. Vol. 78 (1). P. 247–255.
- Antithrombotic Trialists’ Collaboration. Collaborative meta-analysis of randomized trials of antiplatelet therapy for prevention of death, myocardial infarction? And stroke in high-risk patients // BMJ. 2002. Vol. 324. P. 71–86.
- A randomized trial of aspirin and sulfinpyrazone in threatened stroke. The Canadian Cooperative Study Group // N. Engl. J. Med. 1978. Vol. 299 (2). P. 53–59.
- ACCF/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines // Circulation. 2012. Vol. 126. P. 354–471.
- Ушкалова Е. А. Аспиринорезистентность: механизмы развития, методы определения и клиническое значение // Фарматека. 2006. № 13 (128). С. 35–41.
- Айнетдинова Д. Х., Удовиченко А. Е., Сулимов В. А. Роль антитромбоцитарной терапии в первичной и вторичной профилактике сердечно-сосудистых заболеваний // Эффективная фармакотерапия в кардиологии и ангиологии. 2007. № 2. С. 36–41.
- Шалаев С. В. Антитромбоцитарные средства в лечение острых коронарных синдромов // Фарматека. 2003. № 312. С. 94–97.
- Kei A. A., Florentin M. et al. Antiplatelet Drugs: What comes next? // Clin. Applied Thrombosis // Hemostasis. 2011. Vol. 17 (1). P. 9–26.
- Patrono C., Baigent C., Hirsh J. On behalf of American College of Chest Physicians.Antiplatelet drugs: American College of Chest Physicians evidence-based clinical practice guidelines (8 th edition) // Chest 2008. Vol. 133 (6). P. 1995–2335.
- Steg G., James S. K., Atar D. et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation The Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC) // European Heart Journal. 2012. Vol. 33. Р. 2569–2619.
- ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST segment elevation. The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST segment elevation of the European Society of Cardiology // Eur. Heart J. 2011. Vol. 32. P. 2999–3054.
- Cattaneo M. ADP receptors antagonists. In Michelson AD, ed Platelets. San Diego, Calif: Akademic Press. 2006. P. 1127–1144.
- Snoep J. D., Hovens M. M. Clopidogrel nonresponsiveness in patients under-going percutaneous coronaryintervention with stenting: a systematic review and meta-analysis // Am. Heart J. 2007. Vol. 154. P. 221–231.
- Norgard N. B., Mathews K. D., Wall G. C. Drug-drug interaction between clopidogrel and the proton pump inhibitors // Ann. Pharmacother. 2009. Vol. 43. P. 1266–1274.
- Wallentin L., Becker R. C., Budaj A. et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes // N. Engl. J. Med. 2009. Vol. 361. P. 1045–1057.
- Cannon C. P., Harrington R. A., James S. et al. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLATO): a randomised double–blind study // Lancet. 2010. Vol. 375 (9711). P. 283–293.
- Held C., Asenblad N., Bassand J. P. et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes undergoing coronary artery bypass surgery, results from the PLATO // J. Amer. Coll. Cardiol. 2011. Vol 57. P. 672–684.
- Bhatt D. L., Flather M. D., Hacke W. et al. Patients with prior myocardial infarction, stroke, or symptomatic peripheral arterial disease in the CHARISMA trial // J. Am. Coll. Cardiol. 2007. Vol. 49. P. 1982–1988.
- ESC guidelines on the management of stable coronary artery disease. The Task Force on the management of stable coronary artery disease of the European Society of Cardiology // Eur. Heart J. 2013. Vol. 38. P. 2949–3003.
Г. И. Нечаева1, доктор медицинских наук, профессор О. В. Дрокина, кандидат медицинских наук Н. И. Фисун, кандидат медицинских наук
ГБОУ ВПО ОмГМА МЗ РФ, Омск
1 Контактная информация
* Препарат в РФ не зарегистрирован.
Клопидогрел (Плавикс)
Агрегация тромбоцитов — это процесс, который потребляет энергию. Эту энергию получают тромбоциты от специального энергоносителя клеток, аденозиндифасфата (АДФ). Для этого аденозиндифасфату необходимо прикрепиться к специальному месту связывания (рецептору).
Клопидогрел необратимо изменяет АДФ-рецепторы тромбоцита, в связи с чем, тромбоциты остаются нефункциональными на протяжении всей жизни, а восстановление нормальной функции происходит по мере обновления тромбоцитов (приблизительно через 7 дней).
Блокаторы АДФ-рецепторов используют, при непереносимости АСК или если Аспирин не действует в достаточной степени. По сравнению с АСК, пациенты, принимающие Клопидогрел, более склонны к кровотечениям и образованию гематом.
Результаты
Средний возраст пациентов составил 69 лет, 63% были мужчинами, у 11% имелось указание на предшествующий инсульт, 19% имели сахарный диабет. Из включенных в анализ индивидуумов, у 70% в настоящее время произошел инсульт, у 30% — ТИА.
- Отношение шансов достижения первичной точки для инсульта/ТИА составило 0.93 (95% CI, 0.70 — 1.23), р=0,61, для фатального инсульта 1.62 (95% CI, 0.67 — 3.93), р=0,29.
- Обращало на себя внимание достоверное повышение частоты кровотечений на фоне тройной терапии. Отношение шансов для обычных кровотечений составило 2.49 (95% CI, 2.00 — 3.10), р <0.001; для фатальных кровотечений 2.32 (95% CI, 0.64 — 8.36), р=0.2; для серьезных кровотечений 2.04 (95% CI, 1.16 — 3.60), р=0.013. При этом было диагностировано очень мало эпизодов фатальных кровотечений – 7 в группе интенсивной терапии и 4 в контрольной группе.
- Совместная оценка эффективности и безопасности показала, что общий эффект лечения носил нейтральный характер. На фоне тройной терапии частота инсульта/серьезных кровотечений составила 5,9%, в контрольной группе – 4,9% (отношение шансов, 1.21 (0.88 — 1.67); р=0.23). Частота смерти, инсульта, инфаркта миокарда, серьезных кровотечений составила 7,1% и 6,8%, соответственно (отношение шансов, 1.04 (0.79 — 1.38); р=0.77).
Интересно отметить, что в настоящее время в США проводится исследование POINT, в котором сравнивается эффективность и безопасность комбинации аспирина и клопидогрела vs. монотерапия аспирином, начатой в течение 12 часов после небольшого инсульта или ТИА.
Источник:
International Stroke Conference 2021. Abstract LB4.
Антикоагулянты (препараты нарушающие вторичный гемостаз)
Варфарин
Помимо антиагрегантов на процесс тромбообразования могут влиять антикоагулянты — препараты, препятствующие активации плазменных факторов свертывания. Исследования, выполненные до широкого внедрения антикоагулянтной терапии, продемонстрировали высокую частоту тромбообразования (до 50%) в полости левого желудочка в постинфарктном периоде [5]. Причиной возникновения тромбов является не активация тромбоцитов, а локальное нарушение сократимости миокарда (нарушение реологических свойств крови), что в свою очередь активирует плазменные факторы свертывания. Простыми словами, тромбоциты здесь ни при чем, и антиагреганты не помогут. Показания к антикоагулянтной терапии: профилактика артериальных и венозных эмболий кардиогенного происхождения у больных с мерцательной аритмией (atrialfibrillation), после протезирования клапанов сердца, после обширного трансмурального ИМ у больных с пристеночным тромбозом левого желудочка и т. д.
Витамин К играет важную роль в продукции многих плазменных факторов свертывания. Варфарин блокирует в печени синтез витамин К-зависимых факторов свёртывания крови, а именно, факторов II, VII, IX и X. Концентрация этих компонентов в крови снижается и процесс свёртываемости замедляется.
Варфарин имеет узкое терапевтическое окно и требует индивидуального подбора дозы. Довольно трудно поддерживать оптимальный уровень препарата в крови при длительном амбулаторном лечении. Он взаимодействует со многими лекарствами. Большая группа фармакологических препаратов может усиливать или ослаблять действие Варфарина. Взаимодействие Варфарина с овощами зеленого цвета, содержащими большое количество витамина К, снижает его эффективность. Все это диктует необходимость регулярного мониторинга антикоагулянтов, что крайне затрудняет их применение на территориях, где такой мониторинг не организован или некачествен.
Для контроля за действием непрямых антикоагулянтов обычно используют INR (International Normalized Ratio), или международное нормализованное отношение (MHO). Интервал рекомендуемого INR (МНО) у больных с ССЗ варьируется в зависимости от заболевания, но все сердечные заболевания находятся в пределах 2-3,5. INR(МНО), выходящее за пределы рекомендуемого уровня, резко увеличивает риск геморрагических осложнений.
Протокол назначения антитромботической терапии у пациентов с фибрилляцией и трепетанием предсердий
(предназначен для терапевтов, кардиологов, неврологов)
1. Фибрилляция (ФП) и трепетание (ТП) предсердий диагностируется по данным ЭКГ в 12 отведениях или по данным холтеровского мониторирования ЭКГ.
2. Электрокардиографические критерии ФП:
- абсолютно нерегулярные интервалы RR;
- отсутствие зубцов Р.
Электрокардиографические критерии ТП:
- отсутствие зубцов Р;
- волны трепетания F.
3. При выявлении данных нарушений ритма лечащий врач назначает консультацию врача-кардиолога для определения показаний к антитромботической терапии. Врач-консультант при обследовании пациентов с ФП/ТП должен оценить:
3.1. Риск развития системных тромбоэмболий по шкале CHA2DS2VASc
| Фактор риска | Баллы |
| Хроническая сердечная недостаточность или дисфункция левого желудочка | 1 |
| Артериальная гипертензия | 1 |
| Возраст ≥ 75 лет | 2 |
| Сахарный диабет | 1 |
| Инсульт, или транзиторная ишемическая атака, или тромбоэмболия в анамнезе | 2 |
| Сосудистые заболевания, то есть заболевания периферических артерий, инфаркт миокарда, атеросклероз аорты | 1 |
| Возраст 65—74 года | 1 |
| Женский пол | 1 |
Итого__________баллов;
3.2. Риск кровотечения по шкале HAS-BLED
| Клиническая характеристика | Баллы |
| Артериальная гипертензия | 1 |
| Нарушение функции печени или почек — по 1 баллу | 1 или 2 |
| Инсульт в анамнезе | 1 |
| Кровотечение в анамнезе или склонность к нему | 1 |
| Лабильное МНО | 1 |
| Возраст >65 лет | 1 |
| Прием некоторых лекарств/алкоголя — по 1 баллу) | 1 или 2 |
Итого _________ баллов:
3.3. Клиренс креатинина (КК)_______мл/мин (по формуле Cockcroft-Gault);
3.4. Заболевания желудочно-кишечного тракта в анамнезе.
4. При всех типах ФП (впервые выявленная, пароксизмальная, персистирующая, длительно персистирующая, постоянная) и ТП подходы к антитромботической терапии едины.
5. Выбор антитромботической терапии.
5.1 Больным младше 65 лет и изолированной ФП/ТП (включая женщин без других факторов риска) с 0 баллами по шкале CHA2DS2VASc – антитромботическую терапию не назначать.
5.2 Больным ФП/ТП с 1 и более баллов по шкале CHA2DS2VASc– показано назначение пероральных антикоагулянтов:
5.2. 1. Больным с низким риском кровотечения (по шкалеHAS-BLED ≤ 2); с отсутствием патологии со стороны желудочно-кишечного тракта в анамнезе; младше 75 лет — назначить Dabigatran(Pradaxa) в дозе 150 мг 2 раза в сутки.
5.2. 2. HAS — BLED ≥ 3); с патологией со стороны желудочно-кишечного тракта в анамнезе; старше 75 лет — назначить Apixaban (Eliquis) в дозе 5 мг 2 раза в день.
5.2. 3. Доза Apixaban (Eliquis) должна быть уменьшена до 2,5 мг 2 раза в сутки у пациентов, обладающих двумя или более из следующих характеристик:
— возраст старше 80 лет; — масса тела менее 60 кг; — концентрация креатинина в плазме крови ≥133 мкмоль/л.
5.2. 4. Пациенты, длительное время принимающие Варфарин и демонстрирующие стабильные показатели МНО (МНО в терапевтическом диапазоне не менее 70% времени), с низким риском внутричерепных кровоизлияний и те, которые не могут покупать пероральные антикоагулянты — продолжить прием Warfarin под контролем МНО (целевое значение от 2 до 3).
5.2. 5. Лекарственные взаимодействия независящих от витамина К оральных антикоагулянтов (НОАК) представлены в Приложении 1.
6. Особые клинические случаи:
6.1 Пациентам с клапанной ФП (т. е. имеющим митральный стеноз умеренной или тяжелой степени ревматической этиологии, механические протезы клапанов сердца или биологические протезы в первые 6 месяцев после установки) показан прием Warfarin (целевые значения МНО 2–3 для неоперированного клапанного порока и искусственного клапана в аортальной позиции; 2,5–3,5 – для искусственного клапана в митральной позиции). Назначение НОАК противопоказано.
6.2. Пациентам с системной эмболией вне центральной нервной системы в анамнезе рекомендован прием Rivaroxaban (Xarelto) в дозе 20 мг 1 раз в сутки.
Для пациентов с нарушением функции почек (КК 49–15 мл/мин) доза Ривароксабана должна быть снижена до 15 мг 1 раз в сутки.
6.3 Пациентам с сахарным диабетом может быть назначен любой пероральный антикоагулянт.
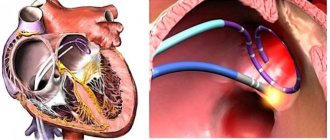
6.4. Пациентам, которым планируется выполнение катетерной аблации, с целью предоперационной подготовки следует назначить Warfarin и поддерживать МНО на целевых значениях 2–3 не менее 3 недель до операции и не менее 4 недель после нее. Следует предпочесть непрерывную терапию Warfarin во время процедуры, поддерживая МНО на уровне 2 и не прибегая к тактике «гепаринового моста». При высоком риске ишемического инсульта терапию пероральными антикоагулянтами после катетерной аблации следует продолжать пожизненно.
В качестве альтернативы Warfarin у пациентов с неклапанной ФП, которым планируется выполнение катетерной аблации, можно использовать Rivaroxaban (Xarelto) в дозе 20 мг 1 раз в сутки не менее 3 недель до операции и не менее 4 недель после нее. Следует предпочесть непрерывную терапию Rivaroxaban во время процедуры, не прибегая к тактике «гепаринового моста». При высоком риске ишемического инсульта терапию пероральными антикоагулянтами после катетерной аблации следует продолжать пожизненно.
6.5. Пациентам с ФП, которым планируется установка электрокардиостимулятора (ЭКС), с целью снижения риска развития тромбоэмболических осложнений рекомендован прием пероральных антикоагулянтов не менее 1 месяца до оперативного вмешательства.
6.5. 1. Warfarin
- При невысоком риске развития геморрагических осложнений (0–2 балла по шкале HAS-BLED) перед выполнением установки ЭКС не требуется отмена Warfarin. Вмешательство выполняется на терапевтическом уровне антикоагуляции (МНО 2–3)
- При высоком риске развития геморрагических осложнений (≥3 баллов по шкале HAS-BLЕD) перед выполнением установки ЭКС требуется отмена варфарина за 3 суток до операции.
6.5. 2. НОАК
Перед выполнением установки ЭКС требуется отмена НОАК за 24–48 часов до операции (сроки отмены варьируют в зависимости от препарата и функции почек – см. п. 7.2 «Вмешательства, ассоциирующиеся с умеренным риском кровотечения» для более подробной информации).
6.6. Пациентам с ФП, которым планируется выполнение электрической кардиоверсии, показаны следующие режимы антикоагуляции:
6.6. 1. Перед выполнением плановой кардиоверсии рекомендован прием Warfarin или НОАК не менее 3 недель до кардиоверсии и не менее 4 недель после проведения кардиоверсии. У пациентов с высоким риском развития ишемического инсульта рекомендован пожизненный прием варфарина или НОАК.
6.6. 2. Перед выполнением экстренной кардиоверсии при длительности пароксизма ФП менее 48 часов у пациентов, ранее не принимавших пероральных антикоагулянтов, рекомендована антикоагулянтная терапия парентеральными антикоагулянтами (низкомолекулярными или нефракционированным гепаринами).
6.6. 3. Перед выполнением экстренной кардиоверсии при длительности пароксизма ФП более 48 часов или неизвестной давности у пациентов, ранее не принимавших пероральных антикоагулянтов, рекомендована антикоагулянтная терапия парентеральными антикоагулянтами (низкомолекулярными или нефракционированным гепаринами) или Rivaroxaban (в дозе 20 мг не менее чем за 4 часа до кардиоверсии) под обязательным контролем чреспищеводной эхокардиографии (ЧП-ЭХО).
6.7. Пациентам с тяжелым нарушением функции почек (КК менее 30 мл/мин для Dabigatran, менее 15 мл/мин для Apixaban и Rivaroxaban) и/или находящимся на гемодиализе прием НОАК противопоказан. При наличии показаний к постоянной антикоагулянтной терапии у пациентов с тяжелой почечной дисфункцией следует рассмотреть возможность назначения Warfarin (целевые значения МНО 2–3).
7. Периоперационное ведение пациентов с фибрилляцией и трепетанием предсердий. Если пациенту планируется проведение хирургического вмешательства, сроки отмены антикоагулянтной терапии зависят от вида операции, принимаемого антикоагулянта и функции почек.
7.1 Вмешательства, ассоциирующиеся с низким риском кровотечения
7.2 Вмешательства, ассоциирующиеся с умеренным риском кровотечения:
7.3 Вмешательства, ассоциирующиеся с высоким риском кровотечения:
8. Возобновление антикоагулянтной терапии после хирургического вмешательства
- Назначение антикоагулянтов после хирургических вмешательств внесердечной локализации должно быть адаптировано к виду операции и осуществляться с учетом риска тромбоэмболических осложнений в соответствии со шкалой CHA2DS2VASc у конкретного пациента.
- При вмешательствах с низким риском кровотечения нет необходимости прерывать антикоагулянтную терапию, поскольку вмешательство выполняется на «излете» времени действия препарата.
- При вмешательствах с умеренным риском кровотечения антикоагулянтную терапию следует возобновить через 6–8 часов при достижении устойчивого гемостаза.
- При вмешательствах с высоким риском кровотечения антикоагулянтную терапию следует возобновить через 48–72 часа при достижении устойчивого гемостаза. Антикоагулянтную терапию для профилактики флеботромбоза у иммобилизированных пациентов можно начать спустя 6–8 часов после выполнения оперативного вмешательства.
- Выбор стратегии периоперационной антикоагулянтной терапии должен быть индивидуальным и всегда требует коллегиального обсуждения.
- Ранний послеоперационный период после радиочастотной катетерной абляцией левого предсердия — рекомендован прием варфарина или НОАК в течение трех месяцев после процедуры (не менее 8 недель). Дальнейшее решение вопроса об антикоагулянтной терапии должно осуществляться с учетом риска тромбоэмболических осложнений в соответствии со шкалой CHA2DS2VASc.
9. Сроки назначения антикоагулянтной терапии после транзиторно-ишемической атаки или ишемического инсульта:
Таблица 1. Сроки назначения антикоагулянтной терапии после транзиторно-ишемической атаки или ишемического инсульта
Факторы, способствующие раннему началу приема ОАК:
— низкая NIHSS (<8): — малые размеры /отсутствие изменений при нейровизуализации — высокий риск рецидива, например, тромб в полости сердца (по данным ЭХО-КГ) — нет необходимости в чрескожной эндоскопической гастростомии — нет необходимости в операции на сонных артериях — нет геморрагической трансформации — клинически стабильный пациент — молодой пациент — контролируемая артериальная гипертензия
Факторы, способствующие позднему началу приема ОАК:
— высокая NIHSS (≥8)
— большие/средние размеры инфаркт мозга при нейровизуализации — необходимость установки гастростомы или проведения «большого» хирургического вмешательства — необходимость в операции на сонных артериях — геморрагическая трансформация — нестабильный неврологический статус — пожилой пациент — неконтролируемая артериальная гипертензия
10. Сроки назначения антикоагулянтной терапии после внутричерепной гематомы:
Таблица 2. Сроки назначения антикоагулянтной терапии после внутричерепной гематомы
Назначение или возобновление НОАК рекомендовано пациентам с ФП через 4–8 недель после внутричерепной гематомы, с учетом выявления и лечения причины возникшего кровотечения, коррекции факторов риска геморрагических осложнений.
Факторы «против» старта ОАК: — Кровотечение происходило на адекватной дозе НОАК/ в отсутствие приема/на низкой дозе — Пожилой возраст — Неконтролируемая артериальная гипертензия — Латеральная гематома — Тяжелое внутричерепное кровотечение — Множественные микрокровоизлияния (например > 10 по данным МРТ в режиме T2*) — Причины кровотечения не могут быть устранены — Злоупотребление алкоголем
— Необходимость приема двойной антитромбоцитарной терапии после ЧКВ (чрезкожного коронарного вмешательства)
Факторы «за» старт ОАК: — Кровотечение происходило на фоне приема АВК или установлена передозировка НОАК — Травма или устранимая причина кровотечения — Молодой возраст — Хорошо контролируется гипертония
— Медиальная гематома — Нет признаков лейкоареоза в белом веществе больших полушарий — Хирургически удаленная субдуральная гематома — САК: клипированная или эмболизированная аневризма — Высокий риск ишемического инсульта
Изменение сывороточной концентрации НОАК, обусловленные фармакокинетическим взаимодействием:
* Дополнительные факторы риска геморрагических осложнений:
- Возраст ≥ 75 лет
- Вес ≤ 60 кг
- Нарушение функции почек (СКФ по Cockcroft-Gault 30–49 мл/мин/1,73 м2)
- Прием других лекарственных препаратов, увеличивающих риск кровотечения (препараты АСК, НПВС, глюкокортикоиды)
- Ранее перенесенное желудочно-кишечное кровотечение
- Недавно (до 4 недель) перенесенное хирургическое вмешательство
- Тромбоцитопения
- Количество баллов по шкале HAS-BLED ≥ 3
Препараты антикоагулянты нового поколения
Ривароксабан (Ксарелто), Апиксабан (Эликвис) и Дабигатран (Прадакса)
Несмотря на то, что Варфарин является популярным пероральным антикоагулянтом на протяжении более 50 лет, он имеет множество ограничений, таких как: высокая индивидуальная чувствительность и непредсказуемость антикоагулянтного эффекта, лекарственные взаимодействия, узкий терапевтический диапазон, необходимость подбора дозы и постоянного контроля МНО. Все это резко снижает приверженность к лечению и увеличивает риск тяжелых геморрагических осложнений.
Поэтому в последние годы FDAбыли одобрены новые антикоагулянты, которые более безопасны и имеют широкий терапевтический диапазон по сравнению с их предшественниками.
Уйти от проблемы контроля МНО сегодня позволяет новое поколение антикоагулянтов, которые успешно заменяют собой Варфарин во многих ситуациях (кардиологии, профилактике и лечении тромбозов глубоких вен конечностей, в терапии и профилактике инсультов). Речь идет о трех основных препаратах: Ривароксабан (Ксарелто), Апиксабан (Эликвис) и Дабигатран (Прадакса).
Ингибиторы фактора Xa (Эликвис и Ксарелто) связываются непосредственно с активным сайтом фактора Ха, что приводит к блокированию общего пути коагуляции. Это приводит к уменьшению образования тромбина, что, в свою очередь, ингибирует образование сгустка и активацию тромбоцитов.
Прямые ингибиторы тромбина (Прадакса) специфически и обратимо связываются с активным центром тромбина. За счет ингибирования тромбина происходит уменьшение образования фибринового сгустка и агрегации тромбоцитов.
Стандартным тестом для мониторинга пациентов «на Варфарине» является протромбиновое время или МНО, в то время как стандартным тестом мониторинга пациентов принимающих гепарин является активированное частичное тромбопластиновое время или АЧТВ. К сожалению, на сегодняшний день нет лабораторных тестов для мониторинга больных принимающих НОАК. В настоящее время рутинный лабораторный контроль у пациентов, принимающих новые оральные антикоагулянты (НОАК) не принят, вследствие доказанной эффективности фиксированных доз. Поэтому реальную степень гипокоагуляции у таких больных определить практически невозможно, что крайне усложняет тактику ведения при хирургических манипуляциях в полости рта. НОАК разрабатывались как удобная для врача и пациента альтернатива антагонистам витамина К (АВК), не требующая регулярного посещения лабораторий.
Количество пациентов с ишемической болезнью сердца (ИБС), получающих ацетилсалициловую кислоту (АСК) и/или тиенопиридины, с целью профилактики тромбоишемических осложнений или по поводу ранее имплантированных коронарных стентов, неуклонно возрастает. Это определяет значение дисбаланса периоперационного геморрагического риска и вероятности развития сосудистых тромбозов и тромбоэмболий при отмене базовой терапии перед предстоящим кардиохирургическим вмешательством [7, 15, 23, 25]. От 3,8 до 8,6% больных после экстренного или планового чрескожного коронарного вмешательства и более половины пациентов, ожидающих плановую операцию коронарного шунтирования (КШ), получают в периоперационном периоде двойную антитромбоцитарную терапию [12]. Прекращение подобной терапии ассоциировано с повышенным риском развития тромбоза стентов, острого инфаркта миокарда (ОИМ) и смерти [18, 20]. Отмена дезагрегантной терапии за неделю до операции является частой и серьезной проблемой для клиницистов. У 2-2,5% пациентов развиваются рецидивирующие сосудистые осложнения за время «периода ожидания» [10, 21], а использование схем периоперационной «переходной» терапии у этой категории пациентов остается темой для дискуссий [16, 26].
В этой связи обсуждаются три предоперационных стратегии отмены антиагрегантов: 1) применение гепаринов; 2) использование блокаторов IIb/IIIa-гликопротеиновых рецепторов тромбоцитов; 3) назначение кангрелора [6, 9]. В большинстве клиник Российской Федерации перед операцией КШ используется стратегия гепаринотерапии с одновременной отменой пероральных антиагрегантов. Следует отметить, что введение нефракционированного и низкомолекулярного гепаринов не продемонстрировало в этом случае свою эффективность [13], в том числе и за счет возможного развития «рикошетной» гиперкоагуляции после внезапной отмены, и за счет проагрегантного потенциала гепаринов. Гепаринорезистентность как к нефракционированному, так и к низкомолекулярному гепарину отмечена у 22% пациентов, оперированных с использованием искусственного кровообращения [1, 19, 22]. Остается проблемой и развитие гепарин-индуцированной тромбоцитопении [24]. При изучении потребности в гемотрансфузиях в четырех группах больных (получавших клопидогрел и аспирин, монотерапию этими препаратами и не получавших антиагреганты) вероятность проведения гемотрансфузий была наиболее высокой в группе клопидогрела и аспирина [8].
Цель исследования — анализ безопасности (с позиции послеоперационных геморрагических осложнений) и эффективности сохранения базовой антиагрегантной терапии перед КШ у пациентов из группы высокого риска развития острых коронарных осложнений.
Материал и методы
Исследование одобрено локальным этическим комитетом ФГБУ НИИ КПССЗ СО РАМН, все больные подписывали информированное согласие. Проведено проспективное исследование, в которое включен 321 пациент с ИБС, последовательно поступающий в клинику в течение 2013 г. для выполнения прямой реваскуляризации миокарда. Исходно все участники исследования до основной госпитализации в комплексе базовой терапии получали АСК.
В зависимости от тяжести поражения коронарного русла, функционального класса стенокардии и тактики предоперационной терапии, все пациенты были разделены на две группы:
— группа АСК (основная) — 103 больных с высоким риском (ИБС, стенокардия напряжения III-IV ФК; стеноз ствола левой коронарной артерии ≥50% в проксимальном/среднем сегментах или трехсосудистое поражение коронарных артерий со стенозами ≥70%; острый коронарный синдром/острое нарушение мозгового кровообращения по ишемическому типу; стентирование либо ангиопластика коронарных или некардиальных артерий в течение предыдущих 12 мес), которые перед операцией продолжали получать АСК в дозе 125 мг/сут;
— группа Гепарин (контрольная) — 218 пациентов, которым перед операцией отменялась АСК и назначался нефракционированный гепарин 20 000 ЕД/сут.
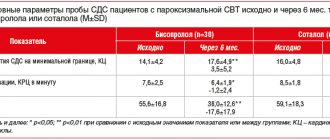
Клиническая характеристика групп представлена в табл. 1
.
Из исследования исключались больные, перенесшие экстренные вмешательства; симультанные вмешательства на других артериальных бассейнах или клапанном аппарате; повторные операции; пациенты с диагностированными коагулопатиями.
Во всех случаях КШ выполняли в условиях искусственного кровообращения при стандартизированном анестезиологическом и перфузионном обеспечении: холодовая кровяная кардиоплегия или раствор кустодиол; объем первичного заполнения 1200 мл (модифицированный желатин, маннитол, бикарбонат натрия, полиионный сбалансированный раствор) без использования свежезамороженной плазмы; индукция в анестезию пропофолом (2 мг/кг массы тела); поддержание анестезии — инфузия пропофола под контролем BIS-мониторинга + инфузия фентанила; начало искусственного кровообращения при уровне активированного времени свертывания крови >400 с; связывание гепарина протамин сульфатом (1 мг на 1 мг); целевой уровень гемоглобина 90 г/л с сатурацией венозной крови ≥65%; режим нормотермии в течение всей операции.
В периоперационном периоде (исходно, через 24 и 48 ч после операции) оценивали общеклинические лабораторные показатели, количество тромбоцитов, активированное частичное тромбопластиновое время (АЧТВ), концентрацию фибриногена, растворимых фибрин-мономерных комплексов (РФМК) с использованием стандартных лабораторных методик. Учитывались клинические показатели: темп дренажной послеоперационной кровопотери (6, 12 и 24 ч после операции), количественно-качественные характеристики трансфузионной терапии, потребность в повторных стернотомиях, связанных с кровотечением, частота периоперационного ОИМ, нарушений ритма, кровотечений из желудочно-кишечного тракта, потребность в заместительной почечной терапии, легочные осложнения, летальные исходы.
Статистическую обработку осуществляли с использованием программы Statistica 6.0, использовали непараметрические тесты (Манна-Уитни, Вилкоксона, поправка Бонферони). Различия считали статистически значимыми при p
<0,05.
Результаты и обсуждение
Риск тромбообразования повышается за счет стрессорного гормонального ответа и выброса цитокинов, развивающихся в ответ на проведение травматичных операций, которые усиливают напряжение сдвига атеросклеротических бляшек, увеличивают сосудистую реактивность, повышая склонность к вазоспазму, повышают активацию тромбоцитов и приводят к формированию гиперкоагуляционного протромботического и провоспалительного состояния, способствующего повышению риска развития артериальных тромбозов [8]. В предоперационном периоде в группе с сохраненной дезагрегантной терапией не зарегистрировано ни одного случая ОИМ, в то время как в группе с гепарином — 6 (2,8%) больных, что потребовало изменения тактики: проведения при ОКС чрескожного коронарного вмешательства со стентированием симптомзависимой артерии с последующей полной реваскуляризацией в отсроченном порядке — у 4 и экстренного КШ — у 2. Эти больные были исключены из исследования. Когда операция не может быть отложена по причине жизнеугрожающего состояния, требуется минимизация риска развития ишемических и геморрагических осложнений путем тщательного мониторирования состояния пациента, обеспечения доступности эндоваскулярного вмешательства и проведения фармакологической профилактики тромбообразования [5].
Обе исследуемые группы были сопоставимы по основным параметрам операционного периода (табл. 2)
.
Средний объем интраоперационной кровопотери был сопоставим. Уровень гемоглобина после операции также не отличался, хотя при этом в основной группе частота трансфузий эритроцитарной массы была статистически значимо больше. Последний факт был обусловлен более высоким темпом дренажных потерь в основной группе (табл. 3)
, но максимальное значение этих потерь все же не превышало допустимых пределов.
По данным других авторов [4], в связи с геморрагическими осложнениями около 50-60% кардиохирургических пациентов в периоперационном периоде получают аллогенные компоненты крови, и для лечения этих пациентов используется до 20% всех запасов консервированных продуктов крови.
Трансфузии компонентов крови являлись важным компонентом КШ с момента его появления, ранее почти все пациенты получали гемотрансфузии. В настоящее время потребность в трансфузионной терапии связывают с увеличением числа пациентов с неблагоприятным сочетанием факторов риска — тяжелой соматической патологией и, следовательно, с более высоким риском развития хирургических осложнений после вмешательств и применением антиагрегантной и антикоагулянтной терапии в дооперационном периоде [11]. Согласно принятому в клинике протоколу, в группе АСК в постперфузионном периоде 93 (90,3%) больным выполнили трансфузию тромбоцитарного концентрата, в группе Гепарин его использовали лишь в 2 (0,9%) случаях. Тем не менее следует отметить, что при сопоставимом количестве тромбоцитов в группах через 48 ч у пациентов, получавших антиагрегантную терапию, отмечена статистически значимая тромбоцитопения (медиана числа тромбоцитов 162·1012) в сравнении с группой Гепарин (медиана 252·1012). Существующий риск развития кровотечений, связанный с применением антиагрегантов, во многом зависит от степени ингибирования функции тромбоцитов и способности «новых» тромбоцитов восстановить агрегационную активность после отмены препарата, что приводит к индивидуальной вариабельности активности АДФ-рецепторов тромбоцитов [17].
При анализе базовых показателей гемостаза исходные значения АЧТВ и РФМК значимо не отличались (табл. 4)
, а уровень фибриногена оказался выше в группе Гепарин (
p
=0,029).
Через сутки после операции содержание фибриногена и АЧТВ в группах было сопоставимо, а уровень РФМК — статистически незначимо выше в группе Гепарин (p
=0,045), в целом в обеих группах оставаясь выше нормальных значений. При этом трансфузия свежезамороженной плазмы чаще использовалась в группе АСК, чем в группе Гепарин — в 21 (20,4%) и в 30 (13,8%) случаях соответственно.
У 2 (1,9%) больных группы АСК развился ОИМ, причины которого не имели отношения к состоянию гемостаза (при коронарошунтографии выявлены хирургические дефекты формирования анастомозов с коронарными артериями, что потребовало выполнения чрескожного коронарного вмешательства). При анализе других осложнений (табл. 5)
следует отметить, что некоторые из них (нарушения ритма, патология желудочно-кишечного тракта) в основной группе были связаны в первую очередь с более тяжелым исходным коморбидным фоном.
Более высокая частота острого повреждения легких в этой же группе объяснима более агрессивной трансфузионной тактикой, что согласуется с мнением некоторых авторов [14]. По данным литературы [3], повторные операции по поводу кровотечений требуются в 2-9% случаев после КШ. В настоящем исследовании потребность в повторных стернотомиях в связи с недостаточным хирургическим гемостазом, а также показатели летальности в группах оказались сопоставимыми между собой и с данными зарубежных авторов. Послеоперационные кровотечения и повторные операции с целью их остановки были ассоциированы прежде всего с удлинением времени пребывания в отделении интенсивной терапии, увеличением числа гемотрансфузий и развитием респираторных осложнений, что увеличивает стоимость лечения, повышает частоту развития послеоперационных осложнений (включая риск развития ОИМ, острой почечной недостаточности, инсульта, раневых инфекций, иммунодефицита) и смертность. [14]. Тем не менее в существующих рекомендациях по периоперационному применению АСК достигнуто относительное согласие: прием АСК должен быть пожизненным и не прерываться перед проведением хирургических вмешательств, если АСК принимается с целью вторичной профилактики после перенесенных острого нарушения мозгового кровообращения, острого коронарного синдрома, ОИМ или коронарной реваскуляризации, независимо от времени, прошедшего с момента назначения препарата, за исключением случаев, связанных с высоким риском геморрагических осложнений [2].
Таким образом, в нашем исследовании показано, что продолженный прием антиагрегантов перед операцией КШ у больных с высоким риском сердечно-сосудистых осложнений хотя и требовал изменений в трансфузионной терапии, однако не сопровождался увеличением объема кровопотери и частоты периоперационных осложнений, а также обеспечивал профилактику ОИМ в период «ожидания операции». Полученные результаты позволяют расширить показания для продолжения антиагрегантной терапии непосредственно до этапа выполнения коронарного шунтирования.
Стоматологический прием
Факторы, влияющие на принятие решений:
- масштаб запланированной операции;
- степень гипокоагуляции (монотерапия, двойная антитромбоцитарная терапия, Гепарин, Варфарин, НОАК, и т. д.);
- топографическая анатомия оперируемой области.
К оперативным вмешательствам в полости рта с наиболее высоким риском возможного кровотечения относятся:
- Синус-лифтинг.
- Инвазивные процедуры в области дна полости рта.
- Удаление ретинированных и дистопированных зубов мудрости.
Оценка риска тромбоэмболии (зависит от заболевания и требует консультации с лечащим врачом).
Медицинские интернет-конференции
В настоящее время актуальным в лечении больных инфарктом миокарда является использование двойной антитромбоцитарной терапии клопидогрелем и ацетилсалициловой кислотой (АСК), которые оказывают действие на различные механизмы агрегации тромбоцитов. Преимуществом такой терапии является снижение относительного риска сердечно-сосудистых осложнений и смертности.
В последнее время широко освещаются вопросы клинико-биохимической резистентности (устойчивости) к антитромбоцитарным препаратам. По литературным данным отсутствие антиагрегантного эффекта выявляется у 5-40% больных при длительном использование АСК и у 8-30% — при приеме клопидогрела (Пучиньян Н.Ф.,2010, Сулимов В.А, Мороз Е.В.,2012, Sibbing D., 2009 г.).
Одной из причин (далеко не единственной) такой резистентности видят в генетических особенностях организма, в так называемом полиморфизме гена, ответственного за синтез фермента, превращающего клопидогрель.
В таких случаях следует либо назначать клопидогрель в увеличенных дозах (как нагрузочных, так и разовых), либо назначать вместо клопидогреля другие антиагреганты (тикагрелор, прасугрел)
Одним из путей повышения эффективности антиагрегантной терапии является проведение генотипирования у всех больных, которым назначается клопидогрель, с целью выявления лиц с так называемым генетическим полиморфизмом.
Одним из последних достижений российской медицины в ведении больных ИБС является разработка инновационного метода тромбодинамики: высокочувствительного теста для диагностики гемостаза и оценки рисков тромбообразования и геморрагических осложнений, позволяющего выявить склонность к гиперкоагуляционным состояниям на ранней стадии, когда другие методы еще недостаточно чувствительны.
В качестве демонстрации тактики ведения больного инфарктом миокарда, получающего антиагрегантную и антикоагулянтную терапию, может служить клиническое наблюдение.
Больной З., 65 лет, в марте 2015 года перенес передний распространенный Q-инфаркт миокарда, осложненный сердечной недостаточностью. При исследовании крови: ОХС -3,62 ммоль/л, ХС ЛПВП-0,9 ммоль/л, ХС ЛПНП – 2,45 ммоль/л, ТГ – 0,6ммоль/л. КА – 3. Коагулограмма: фибриноген — 3,1г/л, АЧТВ — 23,1″, ТВ 17,8″, МНО — 1,6, ПТВ-15,7″.
УЗИ сердца. Локальная сократимость левого желудочка характеризуется: акинезией всех верхушечиых сегментов, гипокинезией средних — переднего, передне-перегородочного сегментов ЛЖ. Глобальная сократимость левого желудочка снижена – ФВ: 49%. Умеренные неспецифические дегенеративные изменения стенок аорты, аортального клапана и фиброзных структур сердца. Незначительное расширение ЛП (КСР — 41мм). Незначительная аортальная регургитация 1 ст. Незначительная митральная регургитация 1 ст.
В рамках стандартной медикаментозной терапии больному назначалась двойная антиагрегантная терапия кардиомагнилом и клопидогрелем (75мг/с). На фоне лечения проводилось исследование тромбодинамики. 16.04.2015г. Гиперкоагуляция. Регистрируются повышение скорости роста сгустка (31,1 мкм/мин), что также приводит к увеличению финального размера сгустка на 30 мин. (1223мкм). Регистрируется увеличение плотности фибринового сгустка (33,405 усл.ед.). Образование спонтанных сгустков не регистрируется.
В связи с этим было проведено исследование крови для определения генетических полиморфизмов (резистентность к клопидогрелю). Результат: выявлен генотип АА («медленный» CYP2C19-метаболизатор) Выбран другой режим дозирования клопидогреля (нагрузочная доза в день 600 мг/с, в последующие дни — поддерживающая доза 150 мг/с). Повторное исследование тромбодинамики не выявило положительных сдвигов, оставались признаки гиперкоагуляции.
Через 2 месяца после ИМ при УЗИ сердца сохранялись признаки дискинезии и снижения глобальной сократимости левого желудочка — ФВ 47%. Было обнаружено, что верхушку ЛЖ по периметру почти полностью выстилает пристеночный тромб, высотой до 27 мм.
Больному была проведена коронарография. Тип кровообращения правосторонний. Ствол ЛКА не изменен. ОВ — стеноз в среднем сегменте до 70%, стеноз в проксимальном сегменте ВТК1 до 80%. ПМЖВ – кальциноз, диффузный атероматоз, стеноз в среднем сегменте до 80%, в дистальном – до 70%. ПКА — кальциноз, диффузный атероматоз, стеноз в проксимальном сегменте 70%, серия стенозов на границе проксимального и среднего сегментов до 70 %.
Пациенту было рекомендовано оперативное лечение: аорто-коронарное шунтирование, от которого он отказался.
В последующем больному был назначен варфарин в дозе 7,5 мг/с с дальнейшей коррекцией дозы, продолжался прием кардиомагнила. Контроль МНО свидетельствовал о достижении целевого уровня (2,4 — 3,6 — 1,9 — 2,8 — 2,6).
При контрольном исследовании УЗИ сердца через 3 месяца лечения варфарином выявлялся плоский пристеночный тромб, выстилающий верхушечную область.
Лечение варфарином продолжалось. Повторное проведение УЗИ сердца еще через 3 месяца выявило плоскостную аневризму небольших размеров верхушечной локализации, повышенную трабекулярность верхушечной области. Глобальная сократимость ЛЖ оставалась сниженной – ФВ: 49%. Достоверных данных за наличие тромба не выявлено.
В настоящее время терапия варфарином продолжается, необходимо контролировать полость ЛЖ для подтверждения исчезновения тромба — факт, который непросто объяснить.
Данное наблюдение свидетельствует о том, что коррекция дозы клопидогреля не привела к улучшению тромбодинамики и, возможно, это способствовало тромбообразованию в полости левого желудочка, а наличие внутрисердечного тромба — прямое показание для проведения антикоагулянтной терапии.
Пациент, принимающий антиагреганты
Монотерапия
Последние исследования показали, что базовых хирургических навыков и локальных мер по остановке кровотечения достаточно, чтобы справится с кровотечением. Антиагрегантная монотерапия не представляет собой серьезного риска во время или после хирургических манипуляций.
Рекомендации [6]: категорически не рекомендуется прерывать приём пероральных антиагрегантов при амбулаторных стоматологических вмешательствах, включая хирургические манипуляции.
Двойная антитромбоцитарная терапия после имплантации стентов у пациентов со стабильной ИБС или при остром коронарном синдроме (ОКС)
Кардиологи рекомендуют прием двойной антитромбоцитарной терапии как минимум в течение шести недель после имплантации металлического (неактивного) стента, и в течение 12 месяцев после эпизода ОКС или имплантации стента с лекарственным прикрытием (активного стента).
Рекомендации [7]: дентоальвеолярные хирургические вмешательства с низким риском не требуют каких-либо изменений в плане лечения.
Дентоальвеолярные хирургические вмешательства со средним риском кровотечения требуют консультации кардиолога по поводу временной отмены одного из препаратов перед хирургической процедурой (монотерапия не представляет серьезного риска). Если нет возможности отменить один из препаратов, можно выполнить хирургическую манипуляцию поэтапно: разделить хирургическую манипуляцию со средним риском кровотечения на несколько меньших по объему вмешательств.
Дентоальвеолярные хирургические вмешательства с высоким риском кровотечения требуют консультации кардиолога по поводу временной отмены одного из препаратов перед хирургической процедурой. Если нет возможности отменить один из препаратов, следует отсрочить большие хирургические операции на 1 год.
Двойная антитромбоцитарная терапия: области клинического применения
Тромбоциты, атеротромбоз и антитромбоцитарные препараты Тромбоциты играют важную роль как в развитии и прогрессировании атеросклероза, так и в патогенезе ОКС. Коронарное вмешательство, особенно связанное с имплантацией стентов, также сопровождается значительными изменениями функционального состояния тромбоцитов. Активация тромбоцитов и их последующая агрегация происходят под действием различных медиаторов, наиболее важными из которых являются тромбоксан А2 и АДФ. Для подавления активации тромбоцитов и предупреждения агрегации применяются антитромбоцитарные или антиагрегантные препараты [5–9]. Ацетилсалициловая кислота (АСК) блокирует активацию тромбоцитов за счет ингибирования циклооксигеназы и образования тромбоксана А2. У большинства больных стабильной ИБС предпочтительнее назначение АСК в низких дозах за счет благоприятного соотношения пользы и риска, а также низкой стоимости лечения. АСК остается основой медикаментозной профилактики артериального тромбоза [8, 9]. Механизм действия АСК заключается в необратимом ингибировании циклооксигеназы-1 (ЦОГ-1) тромбоцитов и нарушении синтеза тромбоксана. Полное подавление продукции тромбоксана достигается при постоянном длительном приеме АСК в дозах ≥ 75 мг/сут. Повреждающее действие АСК на желудочно-кишечный тракт возрастает по мере увеличения дозы. Препарат рекомендуется всем больным с установленным диагнозом ИБС без каких-либо ограничений длительности применения. Оптимальное соотношение пользы и риска достигается при применении АСК в диапазоне доз от 75 до 150 мг/сут., причем при использовании в составе ДАТ обычно доза составляет 75–100 мг. Реализация эффектов АДФ происходит через P2Y12–рецепторы, антагонисты которых являются в настоящее время второй по частоте применения группой антиагрегантных препаратов. К необратимым ингибиторам P2Y12-рецепторов относятся тиенопиридины (тиклопидин, клопидогрел и прасугрел), а к обратимым – тикагрелор и кангрелор. Клопидогрел – наиболее известный на сегодняшний день представитель группы тиенопиридинов [5]. Доказательной базой для применения этого препарата у больных стабильной ИБС послужило исследование CAPRIE [10]. В этом исследовании, включившем больных высокого риска (недавно перенесших ИМ, инсульт и страдающих перемежающейся хромотой), клопидогрел 75 мг оказался эффективнее и имел лучший профиль безопасности, чем АСК в дозе 325 мг в отношении профилактики сосудистых осложнений [10]. Анализ подгрупп показал преимущества клопидогрела только у больных с атеросклеротическим поражением периферических артерий. Поэтому клопидогрел следует считать препаратом второй линии, назначаемым при непереносимости АСК [8, 9] или в качестве альтернативы АСК у больных с распространенным атеросклеротическим поражением. Клопидогрел, как тиклопидин и прасугрел, относится к пролекарствам. Препарат имеет сложный метаболизм. Абсорбция клопидогрела в кишечнике контролируется особым белком (Р-гликопротеином), кодируемым геном АВСВ1. Только около 15% из абсорбируемого клопидогрела в печени превращается в активный метаболит. Процесс является двухступенчатым (окисление и гидролиз), зависящим от нескольких изоферментов системы цитохрома 450, наиболее важными из которых являются СУР2С19 и СУР3А4. Предполагается, что вариабельность антитромботического эффекта клопидогрела у различных пациентов может быть обусловлена рядом фармакокинетических факторов, в т.ч. недостаточной ударной и поддерживающей дозой препарата, нарушением его всасывания, образования активного метаболита из пролекарства (вследствие полиморфизма генов, кодирующих изоферменты системы цитохрома 450), лекарственным взаимодействием. На фоне лечения антитромбоцитарными препаратами, в первую очередь клопидогрелом, наблюдается вариабельность показателей, характеризующих остаточную реактивность тромбоцитов. В связи с этим вызывает интерес возможность корректировки антитромбоцитарной терапии на основании результатов исследования функции тромбоцитов и фармакокинетики клопидогрела. Установлено, что сохранение реактивности тромбоцитов определяется такими факторами, как пол, возраст, наличие ОКС, сахарного диабета, а также повышенным потреблением тромбоцитов, сопутствующим приемом других лекарств и низкой приверженностью больных к лечению. Специфичным для клопидогрела является носительство однонуклеотидных полиморфизмов, ассоциирующихся со снижением всасывания препарата в кишечнике (ген АВСВ1 C3435T) либо его активацией в печени (ген CYP2C19*2). Влияние носительства указанных генетических вариантов на исходы лечения клопидогрелом доказано для больных ОКС, подвергаемых инвазивному лечению; подобных данных для больных стабильной ИБС нет. Поэтому рутинное исследование фармакокинетики клопидогрела и оценка ОРТ у больных стабильной ИБС, в т.ч. подвергаемых плановым ЧКВ, не рекомендованы [6–9]. Прасугрел характеризуется более быстрым в сравнении с клопидогрелом началом терапевтического действия [5]. Образование активного метаболита в печени также происходит под действием изоферментов системы цитохрома 450 в несколько этапов. Не исключена индивидуальная вариабельность эффекта препарата. В исследовании TRITON–TIMI 38 у больных ОКС с подъемом и без подъема сегмента ST на ЭКГ и с запланированным ЧКВ терапия прасугрелом в сравнении с клопидогрелом ассоциировалась с достоверно меньшим числом сердечно-сосудистых событий, но с большим риском возникновения больших кровотечений, включая фатальные [11]. В настоящее время назначение прасугрела при ОКС ограничено случаями запланированного ЧКВ у лиц, не имеющих высокого риска развития геморрагических осложнений. Назначение прасугрела противопоказано пациентам с инсультом/транзиторной ишемической атакой в анамнезе, не рекомендовано в возрастной группе старше 75 лет (за исключением лиц с сахарным диабетом и повторным ИМ), а также при весе менее 60 кг [6]. Не следует назначать прасугрел при предполагаемом экстренном аортокоронарном шунтировании (АКШ). Препарат не изучен у больных ОКС, получавших тромболитическую терапию. Нагрузочная доза прасугрела составляет 60 мг, поддерживающая – 10 мг, которая может быть назначена в комбинации с АСК на срок не менее 12 мес. у больных, перенесших ОКС [6, 7]. Тикагрелор – производное пиримидина (триазолпиримидин), прямой избирательный обратимый ингибитор рецептора Р2Y12-тромбоцитов, не нуждается в предварительном метаболизме и кофакторах [5]. Препарат представляет собой активное вещество, которое метаболизируется посредством изофермента СУР3А4 с образованием активного метаболита. Активный метаболит образуется в печени с участием цитохрома Р450 3A4. Степень ингибирования P2Y12-рецепторов определяется, прежде всего, содержанием тикагрелора в плазме и, в меньшей степени, его активного метаболита. Период полувыведения составляет около 12 ч, в связи с чем препарат назначается 2 раза/сут. Как и прасугрел, тикагрелор характеризуется более быстрым началом терапевтического действия и обеспечивает более выраженное и стойкое ингибирование активации тромбоцитов в сравнении с клопидогрелом. В то же время, восстановление функции тромбоцитов после отмены тикагрелора происходит быстрее по сравнению с клопидогрелом. Наряду с влиянием на функцию тромбоцитов тикагрелору свойственны и другие эффекты, которые связывают с его способностью стимулировать рецепторы к аденозину (одышка, паузы в сокращениях желудочков, повышение уровня креатинина и мочевой кислоты в крови и, возможно, другие). Наличие более привлекательных фармакологических свойств, а также проблемы, связанные с приемом клопидогрела, изучались в крупномасштабном исследования РLATO (Platelet inhibition and patient outcomes), в котором сравнивались эффективность и безопасность применения тикагрелора с таковыми у клопидогрела при приеме больными ОКС [12] (см. далее). ДАТ ЧКВ у больных стабильной стенокардией Оптимальная медикаментозная терапия стабильной ИБС, включающая АСК, статины, ингибиторы ангиотензинпревращающего фермента (АПФ), β-блокаторы и другие антиангинальные препараты, улучшает прогноз и позволяет длительное время эффективно контролировать приступы стенокардии [3, 8, 9]. Однако при сохранении приступов стенокардии или наличии эпизодов безболевой ишемии миокарда показано ангиографическое обследование и инвазивное лечение. Если проводится ЧКВ для восстановления коронарного кровотока, терапия антиагрегантами до и после вмешательства имеет ряд особенностей. Перед имплантацией коронарных стентов, особенно стентов с лекарственным покрытием (СЛП), пациентов следует проконсультировать на предмет необходимости применения длительное время ДАТ, связанных с ней рисков кровотечений, а также использовать альтернативные варианты терапии, если пациенты не желают или не могут соблюдать рекомендуемую продолжительность ДАТ [6]. Если у пациента было проведено ангиографическое исследование и решено выполнить плановое ЧКВ, то он продолжает получать АСК в дозе 75–150 мг/сут., а за 5–7 дней до вмешательства к лечению присоединяют клопидогрел 75 мг 1 раз/сут. Согласно обновленным рекомендациям Американской коллегии кардиологов/Американской ассоциации сердца/Специалистов интервенционной кардиологии (ACC/AHA/SCAI), доза и продолжительность приема АСК зависят как от типа стента, так и от риска кровотечения у данного больного [6]. В ранний срок после стентирования – после имплантации голометаллического стента (ГМС) – 1 мес., СЛП – 3–6 мес. (в зависимости от лекарства) пациенты должны принимать АСК в повышенной дозе 162–325 мг/сут. В последующем ее прием должен быть продолжен на постоянной основе в дозе 75–162 мг/сут. вне зависимости от типа стента. В случае повышенного риска кровотечений разрешается использовать АСК в дозе 75–162 мг/сут. и сразу после стентирования. Рекомендации Европейского кардиологического общества (ESC) по применению ДАТ у больных стабильной ИБС при проведении инвазивного лечения представлены в таблице 1. В том случае, если принимается решение о выполнении ЧКВ сразу после ангиографического лечения, а больной находился только на терапии АСК, непосредственно в рентгенооперационной дается нагрузочная доза клопидогрела 300 мг, после чего выполняется эндоваскулярное вмешательство. В обоих случаях после инвазивного лечения больной получает ДАТ АСК и клопидогрелом 75 мг/сут. Тиенопиридин третьего поколения – прасугрел, а также препарат с обратимым механизмом блокады Р2У12-рецептора – тикагрелор, как уже отмечалось ранее, вызывают более сильное ингибирование агрегации тромбоцитов по сравнению с клопидогрелом, однако клинических исследований, изучавших прасугрел и тикагрелор у больных стабильной ИБС, не проводилось. Следует отметить, что длительность приема тиенопиридинов является важнейшей профилактической мерой развития тромбоза стента, в т.ч. и позднего. Согласно современным рекомендациям, после имплантации СЛП в случае отсутствия высокого риска кровотечения пациенты должны принимать клопидогрел в дозе 75 мг/сут. в течение по крайней мере 12 мес. С учетом важности приема ДАТ в плане профилактики поздних тромбозов СЛП рекомендуется отложить элективные операции (например, плановую холецистэктомию) до окончания курса приема клопидогрела. После имплантации ГМС пациенты должны принимать клопидогрел в дозе 75 мг/сут. в течение по крайней мере 1 мес., в идеале – до 12 мес., а в случае высокого риска кровотечений срок приема клопидогрела должен составлять минимум 2 нед. ДАТ при стабильной ИБС без ЧКВ Применение ДАТ при стабильной ИБС могло бы обеспечить более эффективное предупреждение коронарного тромбоза. В исследовании CHARISMA, включавшем стабильных пациентов с атеросклеротическим поражением различных сосудистых бассейнов или множественными сердечно-сосудистыми факторами риска, добавление клопидогрела к АСК дополнительной пользы не принесло [13]. Анализ подгрупп этого исследования обнаружил положительный эффект комбинации АСК и клопидогрела лишь у больных ИБС, перенесших ИМ. В новых американских рекомендациях по лечению стабильной ИБС 2012 г. в разделе «Антитромбоцитарная терапия» отмечается, что АСК 75–162 мг и клопидогрел – 75 мг могут быть назначены у определенных больных с высоким риском осложнений – класс рекомендаций IIб, уровень доказательности Б [8]. В рекомендациях Европейского кардиологического общества 2013 г. указывается, что ДАТ имеет преимущества лишь у отдельных категорий пациентов с высоким риском развития ишемических событий. Рутинное назначение этой терапии больным стабильной ИБС не рекомендовано [9]. Тромбоциты и развитие острого коронарного тромбоза Как уже отмечалось, назначение ДАТ, включающей в себя АСК и ингибитор P2Y12 -рецепторов (клопидогрел), признано обязательным у больных ОКС, а также у лиц, перенесших ЧКВ. Вместе с тем у части больных, несмотря на регулярный прием комбинации этих антитромбоцитарных препаратов, отмечается отсутствие ожидаемого эффекта по предотвращению риска развития тромботических событий, с одной стороны, и наблюдаемых кровотечений, с другой. Наличие более привлекательных фармакологических свойств, а также существующие проблемы, связанные с приемом клопидогрела, послужили основными причинами организации крупномасштабного исследования РLATO (Platelet inhibition and patient outcomes), в котором сравнивались эффективность и безопасность применения тикагрелора с таковыми у клопидогрела среди больных ОКС [12]. В исследование были включены 18 624 больных ОКС с подъемом и без подъема сегмента ST на ЭКГ [12]. Исследование было двойным слепым рандомизированным проспективным, продолжительность наблюдения составила 6–12 мес. К основным критериям исключения относились: противопоказания к применению клопидогрела, тромболитическая терапия в течение 24 ч до момента рандомизации, необходимость приема непрямых антикоагулянтов, индексное событие (острое осложнение ЧКВ) или ЧКВ, выполненное до приема первой дозы исследуемого препарата, повышенный риск развития брадикардии, сопутствующее назначение сильных индукторов или ингибиторов изофермента СУР3А4. Пациенты были рандомизированы к приему тикагрелора в нагрузочной дозе 180 мг с последующим переходом на поддерживающую – по 90 мг 2 раза/сут. или клопидогрела 300–600 мг – нагрузочная доза и 75 мг/сут. – поддерживающая. Все больные получали АСК в дозе 75–100 мг, за исключением лиц с известной непереносимостью препарата. Пациентам, ранее не получавшим АСК, был рекомендован прием нагрузочной дозы 325 мг (допускался прием доз от 160 до 500 мг). Доза АСК в 325 мг также была разрешена для ежедневного приема в течение 6 мес. после имплантации стента. В случаях необходимости проведения АКШ исследуемый препарат отменялся: клопидогрел – за 5 дней, а тикагрелор – за 24–72 ч до операции. На фоне терапии тикагрелором, в сравнении с клопидогрелом, наблюдалось значительное уменьшение общего количества событий первичной конечной точки (сердечно-сосудистая смерть, ИМ или инсульт): 9,8 против 11,7%, снижение риска составило 16%, р<0,001 (рис. 1). У получавших тикагрелор, в сравнении с лечившимися клопидогрелом, отмечалось достоверное снижение частоты развития ИМ с 6,9 до 5,8%, сердечно-сосудистой смерти – с 5,1 до 4%. В то же время, общее число перенесенных инсультов было одинаковым в обеих подгруппах: 1,5 и 1,3%. Геморрагический инсульт встречался несколько чаще на фоне приема тикагрелора, чем клопидогрела – 23 (0,2%) и 13 (0,1%). Однако общее их количество было незначительным и разница недостоверной. Частота комбинированной вторичной конечной точки (смерть от сосудистых причин, ИМ, инсульт, рецидивирующая ишемия миокарда, транзиторная ишемическая атака или другие варианты артериального тромбоза), а также смерти от всех причин также была достоверно ниже в группе тикагрелора, в сравнении с клопидогрелом: 14,6 против 16,7% и 4,5 против 5,9% соответственно. Положительный эффект тикагрелора был более выраженным у больных с исходно положительным уровнем тропонина, в сравнении с тропонин-негативными пациентами, а также у лиц с окончательным диагнозом ИМ в сравнении с теми, у которых при выписке был диагноз нестабильной стенокардии. Большая эффективность тикагрелора, в сравнении с клопидогрелом, отмечалась в различных подгруппах больных, однако была ниже у пациентов с пониженной массой тела, у лиц, не принимавших гиполипидемическую терапию, а также у жителей Северной Америки. Не было выявлено значимых различий между группами в частоте больших, а также фатальных и угрожающих жизни кровотечений. Риск больших кровотечений, включая фатальные внутричерепные, не связанных с процедурой АКШ, был несколько выше в группе тикагрелора, в сравнении с клопидогрелом (4,5 против 3,8%, p=0,03). В то же время количество связанных с АКШ кровотечений было меньше среди лиц, получавших тикагрелор (7,4 против 7,9%, p-нд). Отдельно были проанализированы результаты 13 408 (72%) больных с запланированной на этапе рандомизации инвазивной стратегией лечения [14]. У 49,1% пациентов был диагностирован ОКС с подъемом сегмента ST на ЭКГ и у 50,9% – ОКС без подъема сегмента ST на ЭКГ. Во время первой госпитализации ЧКВ было проведено у 10 298 (72%) больных, а АКШ – у 782 (5,8%). Среднее время до проведения ЧКВ составило 2,4 ч (0,8–20,1) после рандомизации у больных ОКС без подъема сегмента ST на ЭКГ и 0,5 ч (0,2–1) – при ОКС с подъемом сегмента ST на ЭКГ. Среднее время до проведения АКШ составило 6 дней [3–10]. Общее количество ИМ, инсультов и случаев сердечно-сосудистой смерти на терапии тикагрелором уменьшилось до 9%, в сравнении с клопидогрелом – 10,7%, т.е. снижение риска составило 16% (р<0,0025). Важно подчеркнуть, что преимущества тикагрелора в отношении первичной конечной точки отмечались в различных подгруппах и не зависели от нагрузочной дозы клопидогрела. Большие кровотечения одинаково часто встречались как у принимавших тикагрелор, так и у лечившихся клопидогрелом (11,6 против 11,5%, р-нд). Число случаев тромбоза стента было достоверно ниже в группе тикагрелора, причем, как при использовании СЛП, так и без него. Частота случаев определенных тромбозов стента у больных, получавших тикагрелор, была достоверно ниже как через 30 дней, так и через 360 дней наблюдения в сравнении с лечившимися клопидогрелом, включая и тех пациентов, кто принимал нагрузочную дозу препарата 600 мг и более. При анализе фрагмента исследования, включившего 1261 пациента, подвергнутого процедуре АКШ, в течение 7 дней от последнего приема исследуемого препарата не было выявлено достоверной разницы в снижении количества первичных конечных точек (10,6% в группе тикагрелора и 13,1% – клопидогрела). При этом, среди принимавших тикагрелор наблюдалось достоверное уменьшение общей смертности на 51%, а сердечно-сосудистой – на 48%, как в ранние, так и в поздние сроки операции. У 5 216 (28%) из 18 624 пациентов, поступивших в больницу с ОКС, была выбрана неинвазивная тактика лечения. 2 183 (41,9%) пациентам проведена коронарная ангиография в период их госпитализации в клинику, 1065 (20,4%) – ЧКВ и 208 (4%) пациентам – АКШ. В конечном итоге 3 143 (60,3%) пациентам проводилась консервативная терапия до завершения исследования. Частота достижения первичной конечной точки на фоне приема тикагрелора была ниже по сравнению с клопидогрелом (12% (n=295) v 14,3% (346); относительный риск 0,85, 95% ДИ 0,73–1,00; p=0,04). Показатель общей смертности также был ниже (6,1% (147) по сравнению с 8,2% (195); 0,75, 0,61–0,93; p=0,01). Общая частота больших кровотечений (11,9% (272) по сравнению с 10,3% (238); 1,17, 0,98–1,39; p=0,08) и частота больших кровотечений, не связанных с АКШ (4% (90) по сравнению с 3,1% (71); 1,30, 0,95–1,77; p=0,10), была численно выше на фоне приема тикагрелора, по сравнению с клопидогрелом. Таким образом, у пациентов с ОКС с исходно запланированной неинвазивной стратегией преимущества терапии тикагрелором, по сравнению с клопидогрелом, согласуются с данными, полученными в исследовании PLATO в целом, что указывает на значительные преимущества ингибирования P2Y12- рецепторов тикагрелором независимо от запланированной стратегии лечения. РLATO явилось первым крупномасштабным исследованием, в котором была продемонстрирована клиническая эффективность тикагрелора в отношении снижения частоты развития основных сосудистых событий у больных ОКС, без существенного повышения риска кровотечений. Преимущества тикагрелора перед клопидогрелом наблюдались относительно снижения риска развития ИМ, общей и сердечно-сосудистой смертности, но не в отношении инсульта. Большая эффективность тикагрелора по сравнению с клопидогрелом отмечалась как в ранние (в первые 30 дней), так и в более поздние сроки (с 31 по 360-й день) лечения. Положительный эффект у больных ОКС был очевиден вне зависимости от планируемой стратегии лечения (инвазивной или консервативной), а также от приема более высоких нагрузочных доз клопидогрела. Более значимое снижение риска развития тромботических эпизодов на терапии тикагрелором, по всей видимости, обусловлено более быстрым и интенсивным ингибированием P2Y12-рецепторов тромбоцитов. При назначении нагрузочной дозы клопидогрела в 600 мг требуется 2–4 ч для достижения 50% ингибирования агрегации тромбоцитов, и тот же эффект достигается через 30 мин. при приеме 180 мг тикагрелора или 60 мг прасугрела. Кроме того, существует достаточно большая группа больных с наличием дефективных вариантов аллелей системы цитохрома 450, что ассоциируется с замедлением образования активного метаболита клопидогрела, недостаточным подавлением функции тромбоцитов при его приеме, а также с более высоким риском сердечно-сосудистых осложнений после ОКС и при ЧКВ. К преимуществам тикагрелора также относится обратимый характер ингибирования P2Y12-рецепторов тромбоцитов, что означает более быстрое прекращение антиагрегантного эффекта после отмены препарата. Это обстоятельство представляется важным при инвазивных вмешательствах, а также перед предстоящей процедурой АКШ. Хотя частота больших кровотечений на фоне приема тикагрелора была не ниже, чем при назначении клопидогрела, следует учесть, что более интенсивное ингибирование функции тромбоцитов не сопровождалось увеличением частоты больших кровотечений. Это выгодно отличает тикагрелор от прасугрела, чей более выраженный антиагрегантный эффект сопровождается увеличением риска больших кровотечений. Тикагрелор несколько чаще, чем клопидогрел, отменялся в связи с развитием нежелательных явлений: у 7,4 и 6% пациентов соответственно (р<0,001). Одышка чаще регистрировалась в группе тикагрелора, чем клопидогрела – 13,8 vs 7,8%, р<0,001. Появление одышки, как правило, носило преходящий характер, не было связано с ухудшением функции сердечно-сосудистой системы и легких. Одышка стала причиной отмены препарата лишь у 0,9% больных, принимавших тикагрелор. При мониторировании ЭКГ у принимавших тикагрелор в первую неделю достоверно чаще отмечались паузы, чем у лечившихся клопидогрелом. Паузы, как правило, наблюдались у лиц, уже имевших нарушения проводящей системы сердца. К 30-му дню лечения количество пауз значительно уменьшилось в обеих группах, и разница нивелировалась. С возможной причиной возникновения одышки и пауз связывают нарушение обратного захвата аденозина эритроцитами под действием тикагрелора. Как уже было отмечено, у 1814 пациентов из США и Канады положительный эффект тикагрелора не был подтвержден. Количество первичных конечных точек у принимавших тикагрелор в сравнении с клопидогрелом было 11,9% vs 9,6%, р-нд. Разница в результатах, полученных у пациентов Северной Америки и других регионов, возможно, объясняется особенностями популяции и неодинаковыми подходами в клинической практике, в частности приемом более высоких доз АСК. Эксперты Европейского кардиологического общества рекомендовали прием тикагрелора (в нагрузочной дозе – 180 мг и 90 мг 2 раза/сут. – в поддерживающей) всем больным с ОКС, вне зависимости от планируемой стратегии лечения (инвазивной или консервативной). Если пациенты в самом начале заболевания получали клопидогрел, его следует заменить на тикагрелор. Прием клопидогрела у больных с ОКС с инвазивной или консервативной стратегиями возможен в случаях отсутствия тикагрелора или прасугрела. Продолжительность терапии ингибиторами P2Y12-рецепторов у больных, перенесших ОКС, составляет 12 мес. У пациентов, находящихся на терапии ингибиторами P2Y12 -рецепторов, в случаях планового оперативного вмешательства (включая АКШ) тикагрелор и клопидогрел отменяются за 5 сут., а прасугрел – за 7 сут. Это не касается лиц с высоким риском ишемических сосудистых событий. В отдельных случаях у получающих терапию клопидогрелом возможно проведение генотипирования и изучения функции тромбоцитов [7]. В рекомендациях Американской коллегии кардиологов/Американской ассоциации сердца/Специалистов интервенционной кардиологии (ACC/AHA/SCAI) отмечается, что у больных с ОКС, подвергшихся ЧКВ, в равной степени допустимо применение тикагрелора, прасугрела и клопидогрела – вначале в нагрузочной, а затем в поддерживающей дозе. Применение тикагрелора не изучалось у лиц, получивших тромболитическую терапию. У больных без ОКС, подвергнутых процедуре ЧКВ, рекомендовано назначение клопидогрела. Не рекомендовано рутинное генотипирование и изучение функции тромбоцитов у всех больных, получающих клопидогрел, хотя в отдельных случаях у пациентов высокого риска и с предполагаемым неадекватным антиагрегантным эффектом клопидогрела такой поход возможен. В данной ситуации в качестве альтернативы клопидогрелу могут назначаться тикагрелор и прасугрел. Доза АСК при его комбинации с тикагрелором не должна превышать 75–100 мг/сут. Продолжительность терапии блокатором P2Y12 после имплантации стента должна быть следующей: у пациентов, которым был имплантирован стент (ГМС или СЛП) во время ЧКВ по поводу ОКС, терапия блокатором P2Y12 должна продолжаться не менее 12 мес.: варианты включают клопидогрел в дозировке 75 мг/сут. и тикагрелор в дозировке 90 мг 2 раза/сут. Особенности антитромбоцитарной терапии, согласно рекомендациям специалистов Европейского кардиологического общества по лечению больных с ОКС без подъема сегмента ST, представлены в таблице 2 [7]. Заключение ДАТ, включающая АСК в комбинации с тиенопиридиновыми прозводными (клопидогрел, прасугрел) или тикагрелором, является эффективным методом лечения больных как с ОКС, так и стабильной ИБС, подвергаемых плановым ЧКВ. Выбор второго антиагреганта определяется формой течения ИБС, методом лечения и степенью доказанности в конкретной клинической ситуации, что отражено в современных клинических рекомендациях.
Литература 1. Руководство по атеросклерозу и ишемической болезни сердца / Под ред. Е.И. Чазова, В.В. Кухарчука, С.А. Бойцова. М.: Медиа-Медика, 2007. 736 с. 2. Рациональная фармакотерапия сердечно-сосудистых заболеваний / Под ред. Е.И. Чазова, Ю.А. Карпова. М.: Литтерра, 2014. С. 28–36. 3. Карпов Ю.А., Сорокин Е.В. Стабильная ИБС: стратегия и тактика лечения. 3-е изд. М.: МИА, 2012. 270 с. 4. Карпов Ю.А., Самко А.Н., Буза В.В. Коронарная ангиопластика и стентирование. М.: МИА, 2010. 312 с. 5. Kei A.A., Florentin M. et. al. Antiplatelet Drugs: What comes next ? // Clin. Applied Thrombosis/Hemostasis. 2011. Vol. 17(1). P. 9–26. 6. Levine G.N. et al. 2011 ACCF/AHA/SCAI Guideline for percutaneous coronary intervention. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines and the Society for Cardiovascular Angiography and Interventions // J. Am. Coll. Cardiol. 2011. Vol. 58. P. e44–122. 7. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST segment elevation. The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST segment elevation of the European Society of Cardiology // Eur. Heart J. 2011. Vol. 32. P. 2999–3054. 8. 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS Guideline for the Diagnosis and Management of Patients With Stable Ischemic Heart Disease: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines // Circulation. 2012. Vol. 126. P. e354–e471. 9. 2013 ESC guidelines on the management of stable coronary artery disease. The Task Force on the management of stable coronary artery disease of the European SocietyofCardiology.https://eurheartj.oxfordjournals.org/content/early/2013/08/28/eurheartj.eht 10. A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). CAPRIE Steering Committee // Lancet. 1996. Vol. 348. P. 1329–1339. 11. Wiviotti S.D. Braunwald E. et al. for the TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes // N. Engl. J. Med. 2007. Vol. 357. P. 2001–2015. 12. Wallentin L., Becker RC, Budaj A et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes // N. Engl. J. Med. 2009. Vol. 361. P. 1045–1057. 13. Bhatt D.L., Flather M.D., Hacke W. et al. Patients with prior myocardial infarction, stroke, or symptomatic peripheral arterial disease in the CHARISMA trial // J. Am. Coll. Cardiol. 2007. Vol. 49. P. 1982–1988. 14. Cannon C.P., Harrington R.A., James S. et al. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLATO): a randomised double-blind study // Lancet. 2010. Vol. 375. P. 283–293. 15. James S.K., Roe M.T., Cannon C.P. at al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes intended for non-invasive management: substudy from prospective randomized PLATelet inhibition and patient Outcomes (PLATO)trial // BMJ. 2011. Vol. 342. P. d3527.