Стенотическое поражение сонной артерии – это состояние, при котором происходит сужение (стеноз) или полное закрытие (окклюзия) сонной артерии. У человека имеются две сонные артерии, располагающиеся на шее (справа и слева). Эти кровеносные сосуды приносят кровь к головному мозгу и лицу.
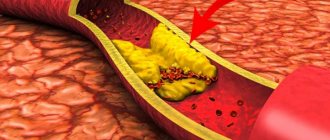
Наиболее частой причиной сужения или окклюзии сонной артерии является отложение на внутренних стенках сосуда атеросклеротических бляшек. Бляшка состоит из рубцовой ткани, клеток крови, холестерина и других жирных веществ. Увеличение бляшки сужает артерию и замедляет кровоток.
На бляшках могут образовываться сгустки крови (тромбы) еще больше препятствующие кровотоку. Части тромба или атеросклеротической бляшки могут отделяться и с током крови попадать в артерии головного мозга.
В результате чего, происходит, так называемая, эмболия сосудов головного мозга, приводящая к развитию ишемического инсульта.
Окклюзия сонной артерии может привести к развитию инсульта или внезапной быстрой смерти.
Риск для жизни возрастает при наличии поражения сонных артерий с обеих сторон. Наиболее частой причиной сужения или окклюзии сонной артерии является отложение на внутренних стенках сосуда атеросклеротических бляшек.
Бляшка состоит из рубцовой ткани, клеток крови, холестерина и других жирных веществ. Увеличение бляшки сужает артерию и замедляет кровоток. На бляшках могут образовываться сгустки крови (тромбы) еще больше препятствующие кровотоку.
Части тромба или атеросклеротической бляшки могут отделяться и с током крови попадать в артерии головного мозга. В результате чего, происходит, так называемая, эмболия сосудов головного мозга, приводящая к развитию ишемического инсульта.
Окклюзия сонной артерии может привести к развитию инсульта или внезапной быстрой смерти.
Риск для жизни возрастает при наличии поражения сонных артерий с обеих сторон.
Наиболее частой причиной сужения или окклюзии сонной артерии является отложение на внутренних стенках сосуда атеросклеротических бляшек.
Бляшка состоит из рубцовой ткани, клеток крови, холестерина и других жирных веществ. Увеличение бляшки сужает артерию и замедляет кровоток.
На бляшках могут образовываться сгустки крови (тромбы) еще больше препятствующие кровотоку.
Части тромба или атеросклеротической бляшки могут отделяться и с током крови попадать в артерии головного мозга. В результате чего, происходит, так называемая, эмболия сосудов головного мозга, приводящая к развитию ишемического инсульта.
Окклюзия сонной артерии может привести к развитию инсульта или внезапной быстрой смерти. Риск для жизни возрастает при наличии поражения сонных артерий с обеих сторон.
Симптомы стенозов сонных артерий
Большинство людей с поражениями сонных артерии не имеют никаких симптомов. При наличии симптомов риск возникновения ишемического инсульта повышается в несколько раз.
Наиболее частыми симптомами являются транзиторные (т.е. приходящие) ишемические атаки, которые иногда называются малым инсультом.
Во время ишемической атаки снижается кровоснабжение определенных участков головного мозга. Это может вызвать временные головокружения, нарушения зрения, онемение и покалывание кожи конечностей, слабость в руке или ноге, которые обычно длятся не более 30 минут.
Риск возникновения инсульта очень высок у людей, перенесших транзиторные ишемические атаки.
Инсульт возникает при резком снижении кровоснабжения по сосуду питающему головной мозг или при его окклюзии. В зависимости от страдающего участка мозга инсульт проявляется параличом руки и/или ноги, нарушениями зрения и речи, изменениями поведения.
Чем больше поражается участок мозга, тем больше риск для жизни.
Факторы риска возникновения инцульта:
- Атеросклероз
- Сахарный диабет
- Повышенное кровяное артериальное давление
- Курение
- Употребление жирной пищи
- Лишний вес
- Повышенное тромбообразование
У 15% больных симптомная церебральная ишемия обусловлена поражением подключичных артерий (ПКА) или брахиоцефального ствола (БЦС) с развитием синдрома позвоночно-подключичного обкрадывания (СППО) [1].
Феномен обкрадывания возникает при наличии двух сосудистых бассейнов с разным периферическим сопротивлением. К развитию позвоночно-подключичного steal-синдрома (англ.:
«steal» — красть, воровать, грабить) приводят окклюзионно-стенотические поражения I сегмента ПКА или БЦС, в результате чего кровь по ипсилатеральной позвоночной артерии ретроградно течет в руку, обкрадывая головной мозг — вертебрально-базилярную систему (ВБС). При этом головной мозг может терять до 20% необходимого кровотока [2].
Согласно определению группы экспертов ВОЗ (1970), вертебрально-базилярная недостаточность (ВБН) — это «обратимое нарушение функций мозга, вызванное уменьшением кровоснабжения области, питаемой позвоночными и основной артериями». В соответствии с МКБ-10 ВБН находится под рубрикой G45.0 — «синдром вертебрально-базилярной артериальной системы».
Ишемия в ВБС может проявляться не только в виде обратимых транзиторных ишемических атак или хронической сосудисто-мозговой недостаточности, но и развития инсультов. В течение 5 лет у 30% пациентов с симптомами ВБН возникает инсульт [3]. Инсульты в ВБС на фоне СППО носят гемодинамический характер.
Формирование СППО возможно также при поражении БЦС, одновременном поражении первого сегмента ПКА и аномальном отхождении позвоночной артерии от дуги аорты [4, 5], окклюзии проксимальной части позвоночной артерии и первого сегмента ПКА [6]. Обкрадывание в таких случаях развивается через подключично-позвоночную коллатеральную сеть (ветви щито-шейного и реберно-шейного стволов). Окклюзия БЦС несет дополнительную опасность обкрадывания правого каротидного бассейна с развитием синдрома позвоночно-подключично-сонного обкрадывания [7—9]. У пациентов, перенесших маммарно-коронарное шунтирование, при стенозе или окклюзии первого сегмента ПКА может развиваться синдром коронарно-подключичного обкрадывания через внутреннюю грудную артерию [2, 10, 11].
Впервые СППО описал L. Contorni в 1960 г. [12]. В 1961 г. C. Fisher [13] предложил устоявшийся термин СППО. В литературе СППО можно встретить также под названием «обратный синдром Робин Гуда». В 1965 г. J. Vollmar и соавт. [14] выделили четыре варианта обкрадывания при окклюзии первого сегмента ПКА: вертебрально-вертебральный, каротидно-базилярный, экстерно-вертебральный, сонно-подключичный. Наиболее частой причиной развития окклюзии или критического стеноза проксимального сегмента ПКА и других брахиоцефальных артерий являются атеросклероз, реже неспецифический аортоартериит [15—20], а также деформации проксимальных сегментов ПКА с формированием септального стеноза [21]. Атеросклеротические окклюзии и стенозы БЦС и ПКА возникают чаще в возрасте 50—60 лет. Левая ПКА страдает в 2—3 раза чаще, чем правая [22, 23].
В 70% случаев левая позвоночная артерия в 1,5—2 раза шире правой [24], являясь основным источником кровоснабжения задних отделов мозга, поэтому даже малейшее изменение кровотока по ней может приводить к расстройству во всей ВБС.
Сочетанное поражение позвоночной артерии и ПКА с развитием синдрома обкрадывания встречается в 6,1% случаев [25]. Поражение позвоночной артерии наиболее часто локализуется в начальном отделе V1 сегмента — в области устья [26]. Сопутствующий стеноз сонных артерий встречается у 82—84% пациентов с СППО [27]. Среди сочетанных гемодинамически значимых поражений каротидного бассейна наиболее часто встречается стеноз бифуркации общей сонной артерии [23, 28].
Разнообразие структур кровоснабжаемых ВББ и выполняемых ими функций обусловливает полиморфизм клинических проявлений ВБН. Хронические окклюзии артерий верхней конечности обычно бессимптомны из-за хорошего коллатерального кровотока на уровне плеча, а ВБН на начальных стадиях имеет множество клинических масок (шейный остеохондроз, заболевания внутреннего уха и др.) [18—20]. Симптомный стеноз первого сегмента ПКА встречается гораздо реже, чем при поражении сонной артерии. При этом симптомы со стороны верхней конечности возникают в 54% случаев, мозговая симптоматика — в 77% [29]. Асимптомное течение отмечается у 20% больных с изолированным поражением ПКА [30]. Стенозы ПКА могут осложняться дистальными атероэмболиями [31].
Клинически синдром обкрадывания проявляется симптомами ВБН. Клинические проявления ВБН могут включать признаки дисциркуляторной энцефалопатии, полушарную симптоматику в виде развития сенсорных и пирамидных нарушений (альтернирующий синдром), вестибулярных (атаксия, нистагм, интенционный тремор) и кохлеарных (одностороннее снижение слуха, шум в ухе), зрительных (выпадение полей зрения, фотопсии) симптомов, симптомов нарушения функции черепных нервов (стволовая симптоматика в виде глазодвигательных расстройств, периферический парез мимической мускулатуры, бульбарный и псевдобульбарный синдромы); характерны дроп-атаки (синдромы Унтернхарншейдта), синкопы, системное и несистемное головокружение. Возможны сопутствующие вегетативные проявления: тошнота, рвота, изменение артериального давления, частоты сердечных сокращений, гипергидроз [20]. Степень выраженности этих признаков зависит от локализации и размера очага ишемии, а также состояния коллатерального кровообращения [32]. Описан случай преходящей антеградной амнезии на фоне СППО [33].
СППО и симптомы ишемии головного мозга чаще выявляются у больных с сочетанным поражением ПКА и других брахиоцефальных артерий [30]. ВБН может протекать по тромбоэмболическому или гемодинамическому типу [34]. Выраженность клинических проявлений при тромбоэмболическом типе намного выше [35].
Изменение кровотока по позвоночной артерии не всегда ведет к ВБН за счет компенсированного кровотока по виллизиевому кругу замкнутого типа [36]. Функциональная неполноценность или разобщение виллизиева круга за счет отсутствия одной или двух передних или задних соединительных артерий может привести к развитию внутримозгового синдрома обкрадывания [37].
Субъективными признаками брахиальной ишемии являются зябкость, похолодание, онемение пальцев кисти, «перемежающаяся хромота» руки, на поздних стадиях развиваются боль в покое, трофические нарушения. Заподозрить наличие синдрома обкрадывания можно уже на этапе физикального обследования — различие артериального давления (АД) и пульса на обеих руках (вероятно полное их отсутствие), систолический шум над проекцией стенозированной ПКА [15, 38—40]. Градиент А.Д. на обеих руках более 20 мм рт.ст. говорит в пользу наличия СППО [41, 42].
Для диагностики ВБН могут использоваться функциональные пробы де Клейна, Хотана и др. Подтверждается СППО при ультразвуковом триплексном сканировании — коллатеральный тип кровотока дистальнее места поражения ПКА, а также постоянный или преходящий в фазу систолы ретроградный кровоток по позвоночной артерии на этой же стороне.
Тем не менее антеградный тип кровотока по позвоночной артерии при поражении первой порции ПКА не исключает наличие синдрома обкрадывания за счет хорошо развитой позвоночно-подключичной коллатеральной сети [43]. Чтобы выявить так называемый латентный синдром обкрадывания выполняют пробу с реактивной гиперемией — в момент декомпрессии плечевой артерии регистрируют ускорение кровотока в подключично-позвоночных ветвях и снижение в дистальных отделах (V4) позвоночной артерии.
В зависимости от результатов триплексного сканирования с тестом реактивной гиперемии различают три вида СППО [44]: 1) постоянный (при окклюзии или критическом стенозе устья ПКА или БЦС более 90%) — кровоток по позвоночной артерии имеет обратное направление, а тест реактивной гиперемии регистрирует стойкий усиленный ретроградный кровоток, сохраняющийся в течение нескольких секунд; 2) преходящий (при стенозе более 50%) — кровоток в позвоночной артерии имеет обратное направление только в фазу систолы, тест реактивной гиперемии показывает медленное восстановление исходной картины; 3) латентный (при стенозах менее 50%) — кровоток в позвоночной артерии антеградный, но изменен. Тест реактивной гиперемии в таких случаях показывает быстрое возвращение исходной допплерограммы.
Другим подтверждающим методом исследования является традиционная селективная рентгенконтрастная ангиография — заполнение пораженной ПКА через систему позвоночной артерии. Количество тяжелых осложнений при проведении этого исследования достигает 3,5%, летальность — 2,4% [45], а использование однопроекционной ангиографии в ряде случаев не позволяет достоверно определить степень стеноза. Для диагностики характера и детализации поражения, определения морфологии бляшки, состояния виллизиева круга в последнее время все чаще используют МСКТ-ангиографию, а применение ТКДГ помогает определить нарушение и резерв церебральной гемодинамики [46, 47].
Морфология атером играет значительную роль в развитии цереброваскулярных событий за счет микроэмболизации или острой окклюзии.
Комбинация МСКТ- и магнитно-резонансной ангиографии имеет большие возможности для определения морфологии атеросклеротических бляшек [1].
Для функциональной оценки мозгового кровообращения применяют динамическую ангиосцинтиграфию и допплерографию в сочетании с нагрузочной пробой, которая позволяет выявить функциональные нарушения церебрального кровообращения уже на ранних стадиях атеросклероза брахиоцефальных артерий и оценить эффективность хирургического лечения [48].
Описана [23] функциональная проба с дозированной физической нагрузкой, показывающая зависимость нарастания синдрома обкрадывания от объема физических нагрузок и доказывающая неуправляемость СППО.
Для оценки кислородного статуса головного мозга возможно применение церебральной оксиметрии с расчетом коэффициента экстракции кислорода и пробой с задержкой дыхания [49].
В случаях сочетанных поражений брахиоцефальных артерий определение наиболее гипоперфузируемой зоны головного мозга возможно благодаря МРТ- или КТ-перфузии [50]. Идеальным диагностическим методом выявления недостаточности мозгового кровотока признано исследование фракции экстракции кислорода с помощью позитронно-эмиссионной томографии. Использование МСКТ и МРТ является ведущим в диагностике острых нарушений мозгового кровообращения [50].
Наличие даже асимптомного СППО в силу непредсказуемого течения является абсолютным показанием к операции [23, 30, 51]. С 1980 г. в мире для лечения больных СППО применяют эндоваскулярные способы реканализации пораженного сегмента. Их неоспоримым преимуществом является малая инвазивность и травматичность [52—57]. Вероятность успешной эндоваскулярной реканализации снижается при наличии грубого атерокальциноза или окклюзии. Потенциал технического успеха реканализации окклюзий ПКА намного ниже, чем стенотических поражений [58]. Технический и ангиографический успех реканализации окклюзий БЦС и ПКА возможен в 57—96% случаев [54, 59—64]. Дополнительным негативным фактором является вариабельность анатомии позвоночно-подключичной артериальной зоны, сказываясь на результатах не только эндоваскулярных вмешательств, но и открытых реконструктивных операций. При наличии извитостей или вариантов отхождения ПКА и БЦС, не позволяющих подойти катетером к месту стеноза/окклюзии, в качестве операций выбора должны рассматриваться открытые вмешательства [59].
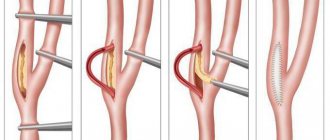
При патологии БЦС в качестве открытой операции обычно выполняют протезирование либо шунтирование БЦС непосредственно от дуги аорты. Доступ к стенозированному БЦС возможен из срединной стернотомии. Летальность при шунтировании БЦС находится в пределах 5,8—8% [65], а количество осложнений — 16,7% [56]. При этом 5-летняя проходимость шунтов составляет 94%.
Реконструкции ПКА могут выполняться как из грудного, так и шейного доступа. Более безопасным не только в плане летальности, но и ишемических осложнений считается шейный доступ [17, 59, 66, 67]. Летальность после операций на БЦС или ПКА, выполненных из грудного доступа, колеблется от 3 до 19% [59, 66, 68, 69].
При окклюзии ПКА предпочтение отдают реконструктивным операциям, при стенозах — эндоваскулярным [70, 71]. В случаях, когда при патологии ПКА выбирают открытую хирургическую тактику, методом выбора является сонно-подключичное шунтирование или сонно-подключичный анастомоз [23].
Сосудистые протезы, используемые для сонно-подключичного шунтирования, характеризуются отличной проходимостью [72]. Послеоперационная летальность составляет менее 1%, с 95% первичной 10-летней проходимостью шунтов [73]. В качестве пластического материала используют протезы из политетрафторэтилена, дакрона, реже аутовену. Во время пережатия сонной артерии рекомендуется прекращать обкрадывание ВБС путем пережатия позвоночной артерии или 2-го сегмента ПКА [74].
Подключично-сонный анастомоз, впервые выполненный в 1964 г. J. Parrot, является отличным методом лечения, но требует более широкого доступа в области шеи и невозможен без применения дополнительных эксплантов при пролонгированных поражениях с переходом на второй сегмент ПКА. Послеоперационная летальность при этом составляет менее 1%, а проходимость анастомоза в отдаленном периоде достигает 96—100% [75—77]. Некоторые авторы [30, 59, 78—80] считают, что транспозиция ПКА в общую сонную артерию имеет ряд преимуществ перед сонно-подключичным шунтированием.
Различные варианты экстраанатомического перекрестного шунтирования применяются редко ввиду большей длины шунта, противоположной направленности кровотока в донорской артерии, физического дискомфорта и возможно предстоящей в будущем операции аорто-коронарного шунтирования.
Некоторые сторонники шунтирующих операций наряду с сонно-подключичным шунтированием говорят о хорошем эффекте сонно-подмышечного [81].
Редким вариантом реконструктивной операции при патологии первого сегмента ПКА и достаточном диаметре вертебральной артерии является сонно-позвоночный анастомоз «бок в бок» [82].
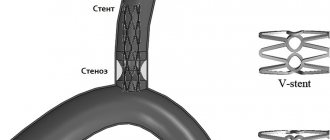
Частота развития рестенозов и реокклюзий ПКА и БЦС после эндоваскулярного вмешательства составляет от 7,3 до 29,8% [59, 60]. Непосредственные и отдаленные результаты открытых и эндоваскулярных вмешательств на БЦС статистически не различаются [83]. Первичная и 5-летняя проходимость ПКА после стентирования достигает 80—100%, а после баллонной ангиопластики — лишь 54%, причем при стенозах она выше [60, 84—87]. Для превертебрального сегмента ПКА лучше использовать баллонорасширяемые стенты, для поствертебрального — самораскрывающиеся [2, 54, 88, 89]. При стентировании устья ПКА стент должен выступать в просвет аорты на 2 мм и не перекрывать устья позвоночной и внутренней грудной артерии.
Интервенции являются операцией выбора при проксимальных поражениях ветвей дуги аорты [17, 84, 89, 90]. Некоторыми авторами отмечено [91—93], что результаты операции сонно-подключичного шунтирования в отдаленном периоде лучше, чем стентирования ПКА.
В настоящее время с целью уменьшения частоты реокклюзий и рестенозов после стентирования рекомендуется двухкомпонентная антиагрегантная терапия. При эндовмешательствах на БЦС необходимо использовать дистальные устройства для защиты головного мозга от микроэмболии. Вероятность церебральных эмболических осложнений при выполнении эндоваскулярных операций на левой ПКА при наличии реверсивного кровотока по позвоночной артерии минимальна [88].
В большинстве случаев для стентирования брахиоцефальных артерий используется трансфеморальный доступ. При выраженном поражении аорто-подзвдошно-бедренного сегментов, их деформации или извитости, а также окклюзии ПКА от устья используются ретроградные (лучевой, локтевой, плечевой, подмышечный) либо комбинированные доступы. Наиболее предпочтителен доступ через плечевую артерию. Подмышечную артерию труднее пунктировать и тяжелее достичь эффективной постпункционной компрессии. Вероятность ятрогенной окклюзии артерий предплечья выше, чем плечевой. Однако в случае окклюзии одной из артерий предплечья, при положительном тесте Аллена, вторая будет компенсировать кровообращение в кисти [88]. Для проведения пробы Аллена одномоментно пережимают лучевую и локтевую артерии, при этом больного просят сжать руку в кулак, затем отпускают одну из артерий. Если в течение 5—10 с появилась реактивная гиперемия, тест считается нормальным. Выполнение стентирования из радиального доступа является безопасной методикой [94].
Решение вопроса об объеме и первоочередности оперативного лечения при сочетанном лечении брахиоцефальных артерий является одной из важнейших задач в хирургии ишемической болезни головного мозга. При сочетанном поражении первого сегмента позвоночной артерии и ПКА одномоментное эндоваскулярное вмешательство приводит к лучшему клиническому результату [95]. При сочетанном поражении контралатеральной сонной артерии первым этапом реконструируют ее, при гомолатеральной локализации рекомендуется одномоментная коррекция кровотока, так как реваскуляризация только ВБС приводит к обкрадыванию каротидного бассейна [30, 51, 96, 97]. Одномоментную реконструкцию безопаснее выполнять в случае возможности одного хирургического доступа и наличия высокой толерантности головного мозга к пережатию сонной артерии [98].
Диагностика стенозов сонных артерий
Для того чтобы определить есть ли у Вас стенотические поражения сонных артерий или нет, Ваш врач осмотрит Вас.
Даже при отсутствии у Вас симптомов болезни, врач может выслушать шум над сонными артериями, вызванный током крови через стенозированный участок.
В случае необходимости Вам будет назначена ультразвуковая допплерография магистральных артерий головы (УЗДГ МАГ), электроэнцефалография головного мозга (ЭЭГ) или компьютерная томография (КТ).
Для более детальной оценки состояния сонных артерий врач может порекомендовать Вам сделать ангиографию (рентгенологическое исследование кровеносных сосудов).
Это исследование проводится путем катетеризации, как правило, бедренной артерии под местной анестезией в специальной операционной, оснащенной ангиографической установкой.
После исследования врач определит наличие поражения и выберет для Вас оптимальный способ лечения.
Диагностика
Для начала проводится физикальное обследование. Для этого нужно записаться на прием к кардиологу. При нарушениях со стороны зрения необходима консультация офтальмолога. Для подтверждения диагноза врач назначает следующие:
- ультразвуковую допплерографию;
- дуплексное сканирование всех сосудов верхней конечности;
- периферическую артериографию;
- рентгеноконтрастную ангиографию;
- реовазографию;
- термографию;
- сфигмографию;
- магнитно-резонансную ангиографию;
- периферическую КТ-артериографию;
- МСКТ-ангиографию.
Ангиография сонных артерий
Во время этого исследования очень тонкий катетер вводится в артерию на Вашей ноге и продвигается к шее. После этого через катетер вводится контрастное вещество, делающее видимыми сонные артерии и другие артерии шеи под рентгеновскими лучами.
Накануне исследования Вам следует побрить кожу в паховой области. Вам также следует с вечера воздержаться от приема пищи и жидкости (кроме лекарств). В операционной Вас укроют стерильными простынями, до которых нельзя дотрагиваться, чтобы не нарушить стерильность.
Во время исследования врач будет контролировать Вашу электрокардиограмму (ЭКГ) и кровяное давление (АД). Место введения катетера будет обработано антисептиком и обезболено.
После этого врач произведет пункцию Вашей артерии, через которую проведет катетер к Вашей шее. Вы не почувствуете этого, но сможете видеть катетер на мониторе.
Вы должны выполнять все указания врача. Иногда нужно будет задерживать дыхание и не шевелиться. Периодически, от введения контрастного вещества, Вы можете ощущать тепло или прилив жара в голове. Врач произведет съемку артерии. Если у Вас имеются стенозы или окклюзии сонных артерий – они будут обнаружены.
В зависимости от полученных результатов Вам может быть рекомендована лечебная процедура или назначено повторное обследование на более поздний срок.