Общие сведения
В норме уровень лактата низкий. Он повышается при нехватке кислорода и нарушении механизма выработки энергии. Основное количество энергии вырабатывает в митохондриях. Для этого процесса используется кислород и глюкоза. Такое образование энергии называют аэробным. Если этот процесс нарушен (например, недостаточно кислорода), образование энергии происходит анаэробно вследствие расщепления глюкозы. При этом образуется лактат. Если выработка молочной кислоты превышает возможности печени по ее утилизации, это вещество накапливается. При этом возможно развитие лактацидоза. Во многих случаях компенсаторных возможностей организма достаточно, чтобы избежать тяжелых последствий. Иногда лактацидоз не компенсируется. При этом нарушается кислотно-щелочной баланс, появляется тошнота, слабость, потливость, учащенное дыхание, возможна кома.
Причины переизбытка лактата подразделяют на две группы. Чаще всего встречается лактацидоз А. Он наблюдается при замедленном кровообращении или недостаточном захвате кислорода легкими. Такое состояние может развиваться при инфаркте, шоке от сильной кровопотери, сепсисе, отеке легких и в ряде других случаев. При лактацидозе типа Б нарушен обмен веществ и повышена потребность в кислороде. Его причиной может быть заболевание почек или печени, лейкемия и другие заболевания.
Клиническое значение уровня лактата крови в лабораторной экспресс-диагностике
Торшин В. А., к. м. н., доцент кафедры биохимии РМАПО, Москва
Метаболизм лактата
С момента описания в 1927 году J. Meakins и C. Long связи между повышением уровня лактата в крови и наличием признаков тканевой гипоксии у пациентов с циркуляторным шоком, уровень лактата оценивается как маркер тканевой гипоксии у этой группы больных. С другой стороны, лактат является нормальным конечным продуктом гликолиза в соответствии с реакцией:
LDH
Pyruvate + NADH + H+ <-> lactate + NAD (1)
В нормальных условиях формируется соотношение лактат: пируват = 10:1. Практически все клетки способны вырабатывать лактат. Ткани с высоким уровнем метаболизма (кишечник, мозг, скелетные мышцы и др.) привносят наибольший вклад в ежедневную продукцию лактата, формируя его нормальный уровень в крови около 1,3 ммоль/л. В норме суммарная продукция лактата составляет около 1,0 ммоль/кг/час, то есть суточная продукция в расчете на взрослого индивидуума колеблется от 1200 до 1500 ммоль. Базисная продукция лактата в энергично работающих скелетных мышцах может увеличиваться в десятикратном размере, что определяет интерес к уровню лактата крови в спортивной медицине. На фоне интенсивных физических упражнений уровень лактата крови повышается в 10—15 раз по сравнению с базовым, отражая напряженность метаболических процессов аэробного и анаэробного гликолиза. Динамика роста уровня лактата позволяет определять наиболее перспективных спортсменов в таких видах спорта как гребля, легкая атлетика, лыжные гонки и др. Это повышение абсолютно разнится от описанного J. Meakins и другими авторами повышения лактата у критических больных.
Метаболизация лактата осуществляется в основном в печени путем превращения в пируват. Следовательно, уровень лактата зависит от метаболизма пирувата. Для понимания роли пирувата важна реакция конверсии пирувата в ацетил-коэнзим-А под воздействием пируватдегидрогеназы, который затем, в свою очередь, метаболизируется в цикле Кребса (цикл трикарбоновых кислот) с последующим окислительным фосфорилированием с образованием основного универсального источника энергии — аденозинтрифосфата (АТФ). Пируват может быть использован также для регенерации глюкозы путем конверсии в оксалоацетат. Таким образом, лактат может быть превращен обратно в глюкозу, которая, соответственно, может быть метаболизирована в лактат (так называемый цикл Кори). Восстановление глюкозы из лактата является важным механизмом и удаления лактата из системного кровотока после длительной тканевой гипоксии (например, после остановки сердечной деятельности). И, наконец, пируват может быть преобразован в аланин и альфа-кетоглютамат. Обратимость этой реакции восстанавливает пируват, который может быть использован для окисления или глюконеогенеза. Из уравнения 1 мы можем сделать заключение, что даже в случае нормального соотношения NAD/NADH и рН клетки, уровень лактата будет расти при избыточном образовании пирувата, нарушении его утилизации или конверсии в ацетил-коэнзим-А. Утилизация пирувата нарушается при дефиците пируватдегидрогеназы (врожденные нарушения метаболизма). Дисфункция пируватдегидрогеназного комплекса может проявляться также при сепсисе, приводя к повышению уровня пирувата и лактата в крови. Клинически наиболее значимой причиной снижения утилизации пирувата является дефицит клетки по кислороду, так как оба процесса: и окисление пирувата, и глюконеогенез требуют наличия кислорода. Следовательно, при дефиците кислорода глюкоза в большей степени конвертируется в лактат с образованием только 2 молей АТФ вместо 34 молей при метаболизации в цикле Кребса.
Существует три механизма транспорта лактата через мембрану клетки:
- свободная диффузия молочной кислоты;
- обмен на другие анионы (например Cl- или HCO3-) облегчает транспорт лактата через клеточную мембрану;
- транспорт, связанный с переносом Н+ через мембрану; при наличии градиента рН на мембране клетки поток лактата увеличивается.
В соответствии с последним механизмом при ацидозе увеличивается захват лактата клетками (например, скелетной мускулатуры и кардиомиоцитами). В противоположность этому при алкалемии происходит выброс лактата из клетки, приводя к повышению уровня лактата в крови. Также при алкалемии играет определенную роль стимуляция фосфофруктозокиназы, приводящая к усилению гликолиза и, соответственно, к продукции лактата. Несмотря на то, что повышение уровня лактата в крови часто сопровождается развитием ацидоза (так называемый лактацидоз), продукция лактата не ведет напрямую к выбросу Н+ ионов, так как Н+ ионы утилизируются при продукции АТФ из АДФ или АМФ:
ATP -> ADP + Pi + H+ -> AMP + 2Pi + 2H+
Неспособность клеток утилизировать Н+ ионы, генерируемые при гидролизе АТФ, является основной причиной развития метаболического ацидоза при гипоксических состояниях.
Типы нарушений уровня лактата крови
Лактацидоз как клинический синдром был впервые описан Huckabee в 1961 году: это повышение уровня лактата крови вследствие его гиперпродукции или снижения элиминации, или сочетание этих факторов. Cohen и Woods в 1976 году выделили четыре типа лактацидоза: А, В1, В2, В3.
Тип А — наиболее часто встречающийся в клинической практике, является следствием снижения оксигенации тканей, то есть тканевой гипоксии (все виды шока, отравление моноксидом углерода, отек легких, острая асфиксия, застойная сердечная недостаточность и др.).
Расстройства, сгруппированные в тип B, не сопровождаются тканевой гипоксией вплоть до терминальных стадий заболеваний.
Тип В1 — пациенты с такими заболеваниями как диабет, болезни печени и почек, некоторые инфекции, неопластические процессы, судорожный синдром. Например, при большом судорожном синдроме уровень лактата повышается как вследствие ларингоспазма, так и вследствие гиперпродукции лактата в мышцах. При бактериемии одним из механизмов повышения лактата является повреждение пируватдегидрогеназного комплекса эндотоксином бактерий. При лейкемии и других неопластических процессах с хроническим повышением уровня лактата крови его снижение является признаком эффективности терапии цитолитиками.
Тип В2 — лактат-ацидоз, вызванный некоторыми препаратами или ядами. Терапия диабета бигуанидами сопровождается лактацидозом вследствие снижения активности пируваткарбоксилазы, приводящей к ингибиции глюконеогенеза. Механизм лактацидоза при отравлении этанолом не совсем понятен. Предполагается влияние судорожного синдрома, а также повышение соотношения NADH/NAD.
Тип В3 — включает достаточно редкие врожденные аномалии, связанные с нарушением митохондриального окисления пирувата.
Измерения лактата крайне важны в диагностике болезни McArdles (type 5 glycogen storage disease), встречающейся преимущественно у мужчин и проявляющейся мышечными болями и напряжением мышц после незначительных физических нагрузок. При увеличении нагрузок боль проходит, но развивается некроз мышц и миоглобинурия. Лабораторная диагностика основывается на отсутствии роста уровня лактата на фоне физических нагрузок.
Лактат и тканевая гипоксия (тип А лактацидоза)
В клинической практике уровень лактата в крови применяется для мониторирования уровня тканевой гипоксии: утилизация пирувата зависит от наличия кислорода и соответственно, снижение доставки кислорода к клеткам приводит к повышению продукции лактата и повышению его уровня в крови. Гипоксия тканей определяется как дисбаланс между потребностью в кислороде и его доставкой (DO2). При снижении доставки кислорода ткани обеспечивают потребность в нем, увеличивая экстракцию кислорода из артериальной крови. Это выражается в повышении индекса экстракции кислорода (O2ER) и снижении сатурации смешанной венозной крови (SvO2%). В норме в тканях экстрагируется около 25% кислорода, доставляемого артериальной кровью.
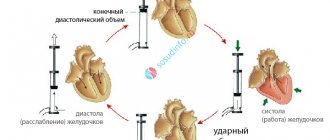
Доставка кислорода к тканям является производной содержания кислорода в артериальной крови (ctO2) и сердечного выброса (Qt).
DO2 = ctO2×Qt = (ctHb×SaO2 ×(1-FCOHb-FmetHb) + 0,003×pO2)×Qt (3)
ctHb — концентрация гемоглобина
SaO2% — сатурация артериальной крови
Снижение каждого компонента в уравнении может привести к снижению DO2. Обычно снижение концентрации гемоглобина или уровня сатурации компенсируется повышением сердечного выброса таким образом, что DO2 остается на уровне потребности и не наступает тканевой гипоксии. При срыве компенсаторных механизмов DO2 быстро снижается ниже критического уровня, снижается потребление кислорода тканями и повышается уровень лактата в крови. Этот феномен зависимости потребления от доставки был продемонстрирован в экспериментальных работах со снижением ctHb, SaO2% и Qt.
Shibutani, Komatsu et al. в работах 1983 и 1987 г. г. показали, что эффект зависимости потребления от доставки наступает при снижении DO2 ниже критического уровня в 300 мл/мин. Так как это была группа кардиохирургических больных со сниженными компенсаторными возможностями, снижение DO2 ниже критического уровня приводило к тканевой гипоксии и повышению уровня лактата. В 1990 году Vincent et al показали, что увеличение потребления кислорода у кардиохирургических больных с повышенным лактатом наступало только на фоне инфузии добутамина.
Интерпретация повышения уровня лактата у септических больных достаточно сложна. Тем не менее, в ранней фазе септического шока повышение уровня лактата в крови связано с наличием зависимости потребления от доставки и тканевой гипоксии.
В отсутствие тканевой гипоксии к повышению уровня пирувата приводит дисфункция пируватдегидрогеназного комплекса. Повышенный аэробный гликолиз увеличивает уровень внутриклеточного пирувата при отсутствии необходимости повышения продукции АТФ. Повышение активности Na+-K+-АТФ-азы в случае нормоксии клетки связано с этим механизмом аэробной продукции лактата (James JH, Fang CH et al, 1996). Описанный механизм важен для понимания повышения уровня лактата у септических больных, а также при врожденных метаболических аномалиях. Распад белков приводит к повышению выброса аминокислот, что может привести к повышению уровня пирувата в процессе глюконеогенеза. Третьим механизмом повышения лактата у септичеких больных в отсутствие тканевой гипоксии является снижение клиренса лактата (например, при снижении регионального кровотока и дисфункции печени).
Взаимоотношения уровня лактата и концентрации Н+ иона далеки от прямолинейных. Исследование, проведенное в 1996 году Gutierrez и Wulf, выявило отсутствие тесной связи между уровнем лактата и концентрацией Н+ ионов у септических больных. Авторы отметили влияние на эти отношения таких факторов, как наличие почечной дисфункции или уровня рСО2 вследствие манипуляций с аппаратом ИВЛ.
Суммируя вышесказанное, можно заключить, что повышение уровня лактата (сопровождаемое или нет системным ацидозом) отражает сложный комплекс метаболических нарушений, среди которых основными элементами являются увеличение аэробной или анаэробной продукции лактата и снижение его клиренса. Значимость этих элементов неоднозначна при различных патологических состояниях. Также нет прямой корреляции с другими клиническими и лабораторными признаками критического состояния. Все это создает необходимость измерения уровня лактата крови у критических больных, в противовес попыткам вывести лактат как расчетный показатель на основании других параметров.
Техника измерения и вид пробы
Впервые описанное Gaglio в 1886 году измерение уровня лактата требовало 100—200 мл крови и несколько дней для получения результата. Broder и Weil, впервые применив в 1964 году метод спектрофотометрии, существенно сократили время измерения, что позволило оценивать динамику уровня лактата у критических больных. Поистине революционным оказалось создание специфического лактат-электрода в составе анализатора газов крови и КОС, что позволило получать лактат за 1—2 минуты измерения из 100—150 мкл цельной крови наряду с другими параметрами ургентной диагностики критического больного. Важна возможность получения параметра из цельной крови, а не из плазмы или сыворотки, что требовало бы дополнительное время на сепарацию. Наиболее приемлема для оценки уровня лактата, также как и других параметров ургентной диагностики, артериальная кровь. Однако, допустимо также и взятие смешанной венозной крови. Капиллярная проба может быть альтернативой только в случае невозможности взятия артериальной пробы. При этом должны быть соблюдены правила забора пробы, препятствующие искажению результата. Проба крови по возможности должна быть немедленно исследована. В случае задержки она должна храниться в так называемой «ледяной бане», то есть охлажденной до 1—4 С°, что позволяет в несколько раз снизить уровень метаболизма в пробе цельной крови.
Клиническое значение измерения лактата крови
Измерение уровня лактата крови должно быть частью оценки любого больного в критическом состоянии. Уровень лактата крови в качестве маркера сложных метаболических нарушений, является хорошим предиктором в интенсивной практике.
По данным Roumen и Redl, опубликованным в 1993 году, лактат оказался лучшим предиктором развития респираторного дистресс-синдрома и полиорганной недостаточности у больных с политравмой, нежели такая известная многокомпонентная шкала оценки критического больного как APACHE. Снижение уровня лактата крови на фоне интенсивной терапии оказалось хорошим показателем ее адекватности.
Da Silva и Hemneber в публикации 2000 года показали значимость и сопряженность измеренных у новорожденного на 30 мин после родов таких параметров, как дефицит оснований и уровень лактата в крови в качестве прогностических признаков неврологических нарушений после перенесенной внутриродовой асфиксии. Лактемия меньше 5 ммоль/л и/или дефицит оснований менее 10 ммоль/л не приводили к неврологическим осложнениям. Концентрация лактата более 9 ммоль/л была связана с умеренной или тяжелой энцефалопатией с чувствительностью 84% и специфичностью 67%.
Тимербаев В. Х. с соавт. в публикации 2005 года продемонстрировали значимость интраоперационной динамики лактата крови, отражающего изменения тканевой перфузии и тканевого газообмена у больных с политравмой, осложнившейся геморрагическим шоком. Динамику лактата крови авторы использовали в качестве критерия эффективности проводимой терапии и предиктора летального исхода.
Лечение ВИЧ-инфекции аналогами нуклеозидов нередко сопровождается лактацидозом, то есть повышением уровня лактата более 5 ммоль/л с параллельным сниженим рН< 7,35 (O. Andersen et al, 2003), что, скорее всего, определяется митохондриальной токсичностью антиретровирусных препаратов.
Mullner et al в 1997 году показали прогностическую значимость лактата крови (100% специфичность при уровне лактата 16 ммоль/л) в развитии неврологических дефицитов после перенесенной фибрилляции желудочков.
Kellum в публикации 1998 года подчеркивает, что лактемия при септических состояниях связана не столько с кислородным дефицитом тканей, сколько с усилением аэробного и анаэробного гликолиза, параллельно с разобщенностью пируватдегидрогеназного комплекса. Также автор отмечает не диагностическую значимость уровня лактата per se, а его значимость в качестве маркера «неблагополучия».
В обзорной статье Hameed et al, опубликованной в 2003 году и посвященной проблемам доставки кислорода у критических больных, авторы подчеркивают неспецифичность таких традиционных признаков шока, как ЧСС, АД, температура кожи, диурез. Даже интерпретация таких параметров гемодинамики, как давление заклинивания в легочной артерии и сердечный выброс, может быть неоднозначной при прогрессировании шока. Нарушение доставки кислорода к тканям, приводящее к повреждению метаболизма пирувата, будет выражаться в накоплении лактата, увеличении дефицита оснований, увеличении анионного промежутка и снижении системного рН. Эти параметры играют также прогностическую роль в развитии такого осложнения, как полиорганная недостаточность, и, в конечном счете, в прогностике уровня смертности. Наиболее же информативны прямые измерения доставки кислорода к тканям (DO2) и потребления кислорода тканями (VO2), производимые с обязательным измерением Qt, SaO2%, SvO2%. Значимость региональной гипоперфузии в развитии шока выдвинула на одну из первых диагностических позиций такой параметр как рН при желудочной тонометрии (рНi). В заключение можно отметить, что далеко не исчерпаны как прогностические, так и диагностические возможности интерпретации уровня лактата крови в оценке эффективности транспорта кислорода при критических состояниях. Фактически еще не были проведены многоцентровые, международные исследования, способные решить спорные вопросы оценки тканевой гипоксии. Технически просматривается возможность в совершенствовании методики измерения, создании приборов для мониторирования уровня лактата в режиме реального времени.
Библиография
- Челноков С. Б., Пудина Н. А. Уровень лактата крови у новорожденных, рожденных в асфиксии. Материалы Российского конгресса по педиатрической анестезиологии, реанимации и интенсивной терапии. Москва, 2001, с. 233.
- Торшин В. А. Уровень лактата крови как показатель STAT-анализа. Лаборатория. № 4, 2001, с.17.
- Bakker J. Increased blood lactate levels: a marker of…? www.bloodgas.org. June, 2003
- Meakins J, Long CNH. Oxygen consumption, oxygen debt and lactic acid in circulatory failure. J Clin Invest, 1927; 4:273.
- Gutierrez G, Wulf ME. Lactic acidosis in sepsis: a commentary. Intensive Care Med 1996; 22, 1: 6—16.
- Shibutani K, Komatsu T, Kubal K et al. Critical level of oxygen delivery in anesthtized man. Crit Care Med 1983; 11, 8: 640—43.
- Vincent Jl, Roman A, De Backer D,Kahn RJ. Oxygen uptake/ supply dependency. Effects of short-term dobutamine infusion. Am Rev Respir Dis 1990; 142, 1: 2—7.
- Roumen RMH, Redl HR, Schlag G et al. Scoring systems and blood lactate concentration in relation to the development of adult respiratory distress syndrome and multiple organ failure in severely traumatized patients. J Trauma 1993; 35: 349—55.
- Andersen O, Haugaard SB, Jorgensen LT et al. Preanalytical handling of samples for measurement of plasma lactate in HIV patients. Scand J Clin Lab Invest 2003; 63: 449—454.
- Kost GJ, Nguyen TH, Tang Z. Whole-Blood Glucose and Lactate. Arch pathol lab Med 2000; 124: 1128—1134.
- Suen WW, Ridley B, Blakney G, Higgins TN. Comparison of lactate, bilirubin and hemoglobin F concentrations obtained by the ABL700 series blood gas analyzers with laboratory methods. Clinical Biochemistry 2003; 36: 103—107.
- Mullner M, Sterz F, Domanovits et al. The association between blood lactate concentration on admission, duration of cardiac arrest and functional neurological recovery in patients resuscitated from ventricular fibrillation. Intensive Care Med 1997; 23: 1138—1143.
- Kellum JA lactate and pHi: Our continued search for markers of tissue distress. Crit Care Med 1998; 26(11): 1783—1784.
- Hameed SM, Aird WC, Cohn SM Oxygen delivery. Crit Care Med 2003; 31 (12) : S658—S667.
- Toffaletti JG Blood Lactate: Biochemistry, Laboratory Methods and Clinical Interpretation. Critical Reviews in Clinical Laboratory Sciences 1991; 28 (4): 253—268.
Когда необходим тест на лактат
Результаты теста дают врачу возможность установить причины нарушения снабжения органов и систем организма кислородом. Анализ крови на лактат используют для выявления лактацидоза и гипоксии, оценки их тяжести. Уровень лактата дает возможность дифференцировать виды метаболического ацидоза. Новорожденным анализ назначается в случае асфиксии. В спортивной медицине исследование используется для контроля состояния спортсменов в период интенсивных тренировок.
Тест назначается в следующих случаях:
- подозрение на недостаток кислорода (наличие таких симптомов, как учащенное дыхание, потливость, бледность кожных покровов, одышка, внезапная слабость);
- нарушение ясности сознания, обморок, лихорадка, сильные головные боли, симптомы менингита;
- подозрение на диабет, сепсис, патологии сердца или почек, шок.
Общая характеристика
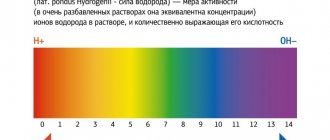
Молочная кислота является продуктом анаэробного метаболизма глюкозы (гликолиза) и образуется из пирувата под действием лактатдегидрогеназы при недостаточном поступлении кислорода. При достаточном поступлении кислорода пируват метаболизируется в митохондриях до воды и углекислоты. Основное количество молочной кислоты поступает в кровь из скелетных мышц, мозга и эритроцитов. Накопление лактата уменьшает рН крови, снижает концентрацию бикарбоната, приводя тем самым к метаболическому ацидозу.
Интерпретация результатов: норма, причины повышения показателей
Референсные значения: 0,5-2,2 ммоль/литр. Снижение показателей не имеет критического значения. Высокий уровень этого вещества может указывать на различные заболевания, в том числе, и на опасные для жизни состояния. Например, повышение показателей наблюдается при острой сердечной недостаточности, лейкозе, нарушении кровообращения, диабете. Поставить точный диагноз и назначить лечение может только врач. Также повышение показателей может быть вызвано эмоциональным или физическими перенапряжением, алкогольной интоксикацией. Даже при отсутствии симптомов в случае выявления нарушений состояние пациента должно контролироваться врачом.
Откуда берется боль
Тогда почему наутро после тренировки болят мышцы? Дело в том, что при интенсивных нагрузках разрушаются так называемые миофибриллы – тоненькие нити, идущие вдоль мышечных волокон. Так в мышцах образуются кусочки погибшей ткани. Иммунная система организма окончательно разрушает их и выводит из организма. Тем не менее, пока происходит процесс разрушения, в тканях выделяются свободные радикалы, а клетки начинают испытывать недостаток воды. В итоге возбуждаются болевые рецепторы, находящиеся на мембранах клеток, и человек ощущает боль в мышцах.
Пересчитываем протоны
Первым и основным источником протонов в активно работающей мышечной клетке считается не синтез, а распад АТФ, энергия которого используется для сокращений и расслаблений: АТФ + вода -> АДФ + фосфат + протон. Сам по себе фосфат способен служить буферной системой, которая смягчает колебания кислотности среды (так он и работает в организме), но он активно вовлекается в новые реакции в клетке, и не слишком эффективно решает эту проблему.
Другой источник протонов – упомянутый выше кофермент NAD+, который в ходе реакций гликолиза теряет протон, превращаясь в NADH. К слову, значительная часть протонов (а также фосфата и пирувата), оказавшихся во внутриклеточной среде, транспортируется в митохондрии и используется для проходящих в ней процессов окислительного фосфорилирования. Таким образом, митохондрии также можно назвать фактором снижения кислотности. Но когда мышцы с огромной интенсивностью поглощают энергию, перерабатывая АТФ в АДФ, эта реакция оказывается сильнее всех, действующих против нее.
Рис. 3.
Баланс между образованием и использованием протонов в работающей мышечной клетке. Появление протонов связано с гидролизом АТФ и реакциями гликолиза. Расходуются они в реакциях креатинфосфата и лактата. Кроме того, протоны связываются с неорганическим фосфатом и буферными соединениями цитоплазмы.
Как образуется молочная кислота в мышцах?
Молочная кислота образуется при распаде углеводов — гликолизе. Это сложный химический процесс из нескольких реакций, но мы опишем его более примитивно. Он бывает аэробным (с участием кислорода) и анаэробным (без участия кислорода).
Аэробный гликолиз происходит, когда энергия в организме вырабатывается кислородной энергосистемой. Это обычная жизнедеятельность или легкие физические нагрузки низкой и средней интенсивности. Такой гликолиз проходит в 2 этапа:
- Из глюкозы и молекул АДФ образуется молочная кислота и энергия
- Молочная кислота нейтрализуется при взаимодействии с кислородом и молекулами АДФ, в результате реакции выделяется энергия, образуются углекислый газ и вода
Пока работает кислородная система, молочная кислота не задерживается в мышцах.
Во время интенсивных нагрузок нужна быстрая энергия. Кислородная система медленная, поэтому на помощь приходит лактатная энергосистема — она работает без участия кислорода, не тратит время на его транспортировку, поэтому быстро производит энергию. Происходит анаэробный гликолиз: глюкоза расщепляется до молочной кислоты и энергии. Без участия кислорода молочная кислота не нейтрализуется, как при аэробном гликолизе, а накапливается в мышцах в виде лактата.
Показания
- Диагностика патологий кровообращения, в результате которых возникает тканевая гипоксия (недостаточное потребление тканями кислорода);
- Оценка степени ацидоза и назначение реанимационных мероприятий;
- Выявление заболеваний сердечно-сосудистой системы;
- Подозрение на инсулинонезависимый сахарный диабет;
- Определение причины лактацидоза;
- Оценка кислотно-щелочного статуса организма и рН крови;
- Диагностика асфиксии (резкое кислородное голодание) и энзимопатии (нарушение активности ферментов) у новорожденных;
- Патологические изменения в мышцах и тканях;
- Дифференциальная диагностика миопатий (наследственное заболевание мышц).
Расшифровку анализа проводят специалисты: эндокринолог, кардиолог, онколог, травматолог, хирург, терапевт, педиатр и т.д.
Как избежать боли
Определяем нагрузку
Городские жители двигаются намного меньше, чем им кажется. Подсчитайте, насколько вы активны, и узнайте, сколько нужно двигаться.
Во-первых
, дозируйте нагрузки, увеличивая их постепенно и систематически. Если нагрузка подобрана правильно, боли будет меньше, или их не будет совсем. Обязательно ознакомьтесь с базовыми принципами эффективных тренировок, чтобы избежать не только дискомфорта на следующий день после занятий, но и спортивных травм.
Во-вторых
, соблюдайте регулярность тренировок – это поможет мышцам привыкнуть к постоянным нагрузкам.
В-третьих
, если избежать перетренированности не удалось, уделите время полноценному восстановлению. Ускорить процесс разрушения веществ, вызывающих мышечную боль, помогает здоровый сон, а также продукты, содержащие антиоксиданты.
БИОЛОГИЧЕСКИЙ КОНТРОЛЬ (МОНИТОРИНГ) В СПОРТИВНОЙ ТРЕНИРОВКЕ[править | править код]
Источник:
Учебное пособие для ВУЗов «Спортивная физиология».Автор
: И.И. Земцова
Изд.
: Олимпийская лит-ра, 2010 год.
Общей целью биологического контроля в спорте является повышение эффективности спортивной тренировки за счет оптимизации физической нагрузки на основе объективной оценки функциональной подготовленности спортсмена.
На разных этапах подготовки спортсменов стоят разные задачи, в соответствии с которыми определяют цель и формы контроля. В теории и практике спорта различают четыре основных вида контроля: оперативный, текущий, этапный и углубленный (Волков, 1996; Биологический контроль…, 1996; Куроченко, 2005; Левушкин, 2001; Платонов, 1997; Clausen, 1997).
Оперативный контроль (срочный)
предполагает оценку оперативных состояний — срочных реакций организма спортсменов на нагрузку в ходе отдельных тренировочных занятий и соревнований.
Текущий контроль
направлен на оценку текущих состояний, являющихся следствием физических нагрузок серии занятий, тренировочных или соревновательных микроциклов.
Этапный контроль
позволяет оценить состояние спортсмена, являющееся следствием долговременного тренировочного эффекта на определенных этапах подготовки.
Углубленный контроль
проводят один раз в году для комплексной оценки подготовленности спортсмена и состояния его здоровья.
Показатели, используемые соответственно определенному виду контроля, должны быть информативными и надежными, соответствовать:
- специфике вида спорта;
- возрасту и квалификации испытуемых;
- направленности тренировочного процесса.
В видах спорта, связанных с проявлением выносливости (плавание, гребля, велосипедный спорт, лыжные гонки, бег на средние и длинные дистанции и др.), преимущественно исследуют показатели, характеризующие состояние сердечно-сосудистой и дыхательной систем, обменных процессов. Благодаря им можно наиболее достоверно оценить потенциальные возможности спортсменов в достижении высоких спортивных результатов.
В скоростно-силовых видах спорта, где главной задачей является умение проявлять кратковременные мышечные напряжения (спринтерский бег, легкоатлетические прыжки и метания, тяжелая атлетика, отдельные дисциплины велосипедного, конькобежного спорта, плавания и др.) как средства контроля используют показатели, характеризующие состояние нервно-мышечного аппарата, ЦНС, скоростно-силовых компонентов двигательной функции, которые проявляются в специфических тестовых упражнениях.
В видах спорта, где спортивные достижения преимущественно обусловлены деятельностью анализаторов, подвижностью нервных процессов, которые обеспечивают точность, размеренность движений во времени и пространстве (гимнастика, акробатика, фигурное катание, прыжки в воду, все виды спортивных игр, стрельба и др.), в процессе контроля используют широкий комплекс показателей. Они характеризуют точность воспроизведения временных, пространственных и силовых параметров специфических движений, способность к обработке информации и быстрому принятию решений, эластичность скелетных мышц, подвижность суставов, координационные возможности и др. (Белоцерковский, 2005; Биологический контроль…, 1996; Бргсюн, 2003; Платонов, 1997).
Повышение значений (лактацидоз)
- Патологии сердечно-сосудистой системы: сердечная недостаточность, кардиогенный шок (острая недостаточность левого желудочка), синдром Рейно (тяжелое сосудистое заболевание, спазм мелких кровеносных сосудов);
- Нарушения кровотока и заболевания кровеносной системы;
- Инсулинонезависимый сахарный диабет;
- Повышенная физическая нагрузка (как правило, у профессиональных спортсменов);
- Тетания (судороги на фоне нарушения кальциевого обмена);
- Столбняк (бактериальное заболевание с поражением нервной системы);
- Эпилепсия (патология нервной системы, проявляющаяся судорожными припадками с потерей сознания);
- Гепатит (вирусное воспаление печени) в острой форме;
- Цирроз печени (аномальное изменение структуры ткани органа);
- Онкологические процессы: лимфома (рак лимфатической системы), лейкемия (рак крови) и т.д.;
- Полиомиелит (высокозаразное заболевание нервной системы, спинномозговой паралич);
- Тканевая гипоксия (кислородное голодание);
- Гипотония (низкое артериальное давление);
- Тяжелые кровотечения;
- Легочная недостаточность, гипервентиляция (нарушение частоты или глубины дыхания).
Временное повышение концентрации молочной кислоты возможно в результате:
- дефицита в организме витамина В1;
- длительного регулярного употребления алкоголя;
- отравления химическими элементами: этанолом, салицилатами, токсинами, метанолом и т.д.;
- дегидратации (обезвоживание организма);
- беременности (на 3 триместре уровень молочной кислоты может немного повыситься);
- приема медикаментов: препарата натрия, нитропруссида, адреналина, метформина, фруктозы или глюкозы, пропиленгликоля, метилпреднизолона, фенформина и т.д.