Лечение нарушений сердечного ритма
ЛЕЧЕНИЕ МЕРЦАТЕЛЬНОЙ АРИТМИИ
Консервативная (медикаментозная) терапия. Высокотехнологичное кардиохирургическое лечение – радиочастотная аблация (РЧА), радикальное решающая проблему. Операция проводится малоинвазивным чрезсосудистым доступом, с применением современной системы нефлюороскопического картирования «СARTO», помогающей точно найти зону необходимого воздействия.
ЛЕЧЕНИЕ ПАРОКСИЗМАЛЬНОЙ ТАХИКАРДИИ
Обучение экстренной помощи при пароксизмальной тахикардии. Медикаментозное лечение. Кардиохирургия — в зависимости от клинической ситуации и характера приступов: радиочастотная абляция аритмогенных зон или имплантация кардиовертера-дефибриллятора при желудочковой тахикардии.
ЛЕЧЕНИЕ СИНДРОМА ВПВ
Лекарственная терапия. Малоинвазивная кардиохирургическая операция — катетерная РЧА с точным определением и коагуляцией патологического очага – почти в 100% случаев навсегда избавляет от синдрома ВПВ.
ЛЕЧЕНИЕ ЭКСТРАСИСТОЛИИ
Основное лечение экстрасистолии – фармакотерапия и лечение первичных заболеваний, провоцирующих экстрасистолию. При очень частой желудочковой экстрасистолии – радиочастотная абляции аритмогенных зон.
ЛЕЧЕНИЕ БЛОКАД СЕРДЦА
Фармакотерапия, лечение основного заболевания – причины нарушения проводимости. Хирургическое лечение — установка в сердце двухкамерных электрокардиостимуляторов (ЭКС) в нужный момент восстанавливающих сбившийся сердечный ритм.
ЛЕЧЕНИЕ СИНДРОМА СЛАБОСТИ СИНУСОВОГО УЗЛА, КАРДИОГЕННЫХ ОБМОРОКОВ
Консервативное лечение заболевания, вызвавшего нарушение ритма, медикаментозная терапия. Кардиохирургия – имплантация в сердце двухкамерных ЭКС, обеспечивающих стабильный ритм сердца.
ПРОФИЛАКТИКА ВНЕЗАПНОЙ СМЕРТИ ОТ ОСТАНОВКИ СЕРДЦА
Установка в сердце кардиовертеров-дефибрилляторов, поддерживающих правильный ритм и снижающих риск сердечных катастроф.
Мы делаем
Радиочастотная аблация аритмий сердца
Радиочастотная аблация (РЧА) – это малоинвазивное, высокоэффективное, хирургическое вмешательство в сердце, выполняемое под контролем рентгеновского оборудования. Процедура проводится с целью лечения экстрасистолии, наджелудочковых и желудочковых нарушений ритма сердца. Терапевтический эффект достигается за счет точечного воздействия на аритмогенные зоны сердца, током высокой частоты (радиочастотная энергия) с температурой 40-55 градусов или охлаждением (крио-процедура) до -80 градусов. Катетерная аблация – очень эффективный метод лечения тахиаритмий и, являясь достаточно безопасной процедурой, может навсегда устранить причину нарушения ритма сердца. В подавляющем большинстве случаев, это позволяет Вам избежать постоянного приема лекарств и вести при этом активный образ жизни.
Показания к проведению РЧА
Наджелудочковые нарушения ритма:
- атриовентрикулярная узловая реципрокная тахикардия (АВУРТ),
- атриовентрикулярная реципрокная тахикардия (АВРТ) связанная с функционированием дополнительного пути проведения (ДПП)
- предсердная тахикардия (ПТ)
- фибрилляция предсердий (ФП)
- трепетание предсердий (ТП)
- предсердная экстрасистолия
Желудочковые нарушения ритма:
- желудочковая экстрасистолия
- идиопатическая желудочковая тахикардия
- желудочковая тахикардия на фоне структурных заболеваний сердца.
Подготовка к операции: − необходимо воздержаться от приема пищи и воды в течение 6-8 часов до начала процедуры. При необходимости по согласованию с врачом Вы можете сделать несколько небольших глотков воды, если Вам надо запить лекарство (при артериальной гипертензии, сахарном диабете и др.); − за 2-3 дня до операции Вам необходимо будет прекратить прием антиаритмическихпрепаратов (по согласованию с доктором); − обязательно скажите доктору или медсестре, если у Вас есть аллергия на лекарства.
Введение катетеров осуществляется под местной и внутривенной анестезией, как правило, в паховой области (доступ через бедренные вены), шее (доступ через ярёмную вену) или через подключичную вену. В ходе процедуры используются специальные длинные гибкие электроды, которые могут как записывать электрическую активность сердца, так и стимулировать сердце при выполнении электрофизиологического исследования (ЭФИ). Они проводятся в сердце под рентгеноскопическим контролем.
ЭФИ – это часть процедуры, проводимая для точной диагностики нарушения ритма сердца.
Посредством стимуляции сердца доктор индуцирует аритмию и изучает её. ЭФИ помогает выявить локализацию патологических проводящих путей или эктопических очагов. Это называется «картированием». В ЭФ-лаборатории имеется все необходимое оборудование и медикаменты для изучения и купирования аритмий.
После проведения ЭФИ и идентификации очага аритмии выполняется точечная радиочастотная или крио аблация. Это приводит к формированию рубца (3-4 мм в диаметре), который не проводит электрический импульс и устраняет аритмию.
Для контроля эффективности процедуры проводится повторное ЭФИ. В случае успешного устранения аритмогенного очага — процедура завершается.
Лечение аритмии при помощи аблации является достаточно продолжительной процедурой, обычно требуется от 30 минут до несколько часов.
После окончания процедуры и извлечения электродов для предотвращения кровотечения в области пункций накладываются давящие повязки. В первые сутки, следует соблюдать постельный режим, что позволяет стабилизировать состояние пациента.
Атрио-вентрикулярная узловая реципрокная тахикардия (АВУРТ)
Нормальное распространение импульса от синусового узла на желудочки проходит через область атрио-вентрикулярного узла. Кольца клапанов сердца отделяют миокард предсердий от желудочков и предотвращают прямое прохождение импульса.
У пациентов с узловой тахикардией в атрио-вентрикулярном узле существуют два пути проведения — медленный и быстрый. И при определенных условиях может возникнуть ситуация, когда импульс начинает быстро крутиться внутри самого узла, а затем практически одновременно распространяться на предсердия и желудочки.
Суть операции состоит в устранении «медленного» пути проведения импульса в АВ-узле, для предовращения закручивания тахикардии. Эффективность операции 95-98%.
Синдром WPW (синдром Вольфа-Паркинсона-Уайта)
Синдром WPW — вторая по частоте встречаемости форма наджелудочковой тахикардии (после атрио-вентрикулярной узловой тахикардии). В 1930 году L.Wolff, J.Parkinson и P.White описали ЭКГ-синдром “функциональной блокады ножки пучка Гиса” и короткого интервала P-Q, который наблюдается у молодых, физически здоровых лиц, страдающих приступами тахикардий.
Анатомическим субстратом синдрома WPW являются дополнительные предсердно-желудочковые (атрио-вентрикулярные) соединения (ДПЖС), “пучки Кента” или, так называемые, “мышечные мостики”. Дополнительные предсердно-желудочковые соединения – это проводящие пути между миокардом предсердий и желудочков, существующие помимо структур атрио-вентрикулярного узла.
Суть операции состоит в устранении «дополнительного, аномального» пути проведения импульса в АВ-борозде. Эффективность операции более 98%.
Осложнения процедуры. Как и любое хирургическое вмешательство радиочастотная абляция сопряжена с определенным риском. Однако риск небольшой (менее 1%) и процедура считается относительно безопасной: у некоторых пациентов возникает кровотечение в месте введения электродов — это может стать причиной образования гематомы, в редких случаях процедура может привести к более серьезным осложнениям, связанным с повреждением стенки сердца и кровеносных сосудов. В зависимости от типа и места положения патологического проводящего пути имеется риск повреждения проводящей системы сердца. Поэтому в некоторых случаях может потребоваться имплантация кардиостимулятора. Эти осложнения являются довольно редкими и ожидаемая польза от проведения процедуры чаще всего над ними превалирует. Врачи нашего отделения делают все возможное для снижения риска осложнений. Катетерная аблация – очень эффективный метод лечения тахиаритмий и, являясь достаточно безопасной процедурой, может навсегда устранить причину нарушения ритма сердца. В большинстве случаев, это позволяет Вам избежать постоянного приема лекарств и вести при этом активный образ жизни.
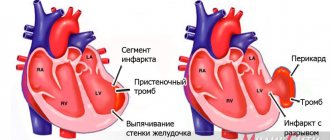
Желудочковые нарушения ритма сердца
Желудочковые нарушения ритма сердца могут быть в виде внеочередных желудочковых экстрасистол (ЖЭ) или в виде желудочковых тахикардий (ЖТ). РЧА выполняется у симптомных пациентов и, чаще всего, не зависит от количества ЖЭ и при гемодинамической стабильности пациента, имеющего ЖТ. Подготовка и операция проходит практически также, как и при наджелудочковых нарушениях ритма сердца.
Однако, эффективность процедуры РЧА напрямую зависит от локализации аритмогенного очага и от сопутствующих структурных заболеваний пациента (ишемическая болезнь сердца, клапанные пороки, кардиопатии и т.д.)
Фибрилляция предсердий
Более 3 млн. человек в России страдают самой распространенной формой тахиаритмии – мерцательной аритмией или фибрилляцией предсердий. Наряду с необходимостью частой госпитализации, вызовов бригад «скорой помощи», резкого снижения качества жизни и развития ишемических инсультов не менее чем у 40.000 пациентов в год, государство тратит огромные суммы денег, не возвращая этих больных к социально-активному образу жизни.
После 60 лет жизни до 6% населения страдает данным заболеванием и несмотря на постоянный прием антиаритмических препаратов и разжижающих кровь антикоагулянтов – 50-60% больных остаются симптомными и над ними висит «домоклов меч» – либо внезапной смерти, либо инвалидизации, прогрессивно увеличивающийся с момента начала заболевания.
Сегодня кардиологи и кардиохирурги, а точнее специалисты в области интервенционной аритмологии нашли новый подход к диагностике (его еще называют электрофизиологическим) и устранению так называемой пароксизмальной и ранней персистирующей формы мерцательной аритмии, когда аритмогенные очаги, запускающие аритмию, локализуются в сосудах, впадающих в левое предсердие. Используя различные системы электрофизиологической диагностики, с помощью катетерной технологии (без скальпеля) специалисты ГКБ им. И.В. Давыдовского проводят данные процедуры у ранее некурабельных больных, которые десятилетиями страдали от данной аритмии.
В настоящее время мы находимся только в начале пути использования современных технологий диагностики и лечения заболеваний сердца и аритмий с помощью так называемой «бескровной хирургии», которая не требует выполнения разрезов.
Подготовка к операции:
включает полноценное диагностическое исследование пациента – ЭКГ, ЭХОКГ, холтеровское мониторирование, анализы крови. Очень важно, чтобы пациент не менее чем за 3-4 недели до операции получал антикоагулянтную терапию (варфарин, эликвис, прадакса или ксарелто), так как операция будет выполняться в «артериальной камере» сердца. Все получаемые пациентом препараты отменяются уже в клинике, лечащим врачом. В клинике пациенту выполняется компьютерная томография и/или чреспищеводная ЭХОКГ для исключения «тромба в ушке левого предсердия. Наличие тромба является «абсолютным» противопоказанием к проведению оперативных вмешательств и требует смены антикоагулянтной терапии.
Процедура выполняется из венозного доступа (бедренные, подключичная, яремная вены). Диагностические электроды вводятся в область коронарного синуса и длинный интодюсер в полость правого предсердия. Под контролем рентгена, чреспищеводного или внутрисердечного ЭХОКГ производится пункция межпредсердной перегородки и инструменты проводятся в полость левого предсердия.
В зависимости от анатомии левого предсердия выполняется, либо Радиочастотная, либо Крио-изоляция легочных вен (ЛВ). На данный момент методики показывают равную эффективность. Выбор методики изоляции ЛВ происходит до или во время процедуры. Если пациенту до проведения операции выполнялась компьютерная томография – анатомия левого предсердия и легочных вен позволяет выбрать нужную методику (при проведении ЧПЭХОКГ до операции – во время операции выполняется ангиография левого предсердия).
— если левое предсердие не увеличено в размерах и легочные вены впадают в левое предсердие отдельными устьями – выбор падает на крио-изоляцию;
— если предсердие увеличено или ЛВ имеют «коллекторный» или «вестибюлярный» вход, либо размер легочных вен более 25 мм (размер криобаллона 28 мм) выбираем радиочастотную методику изоляции.
Операция выполняется под внутривенным наркозом (пропафол, фентанил), пациент полностью не спит, но болевых ощущений не испытывает. Последовательно изолируются все легочные вены (крио- или радиочастотная деструкция), проверяется эффективность электрической изоляции и производится повторное электрофизиологическое исследование.
После окончания процедуры введение анестезиологических препаратов заканчивается, и пациент переводится на 5-6 часов (иногда дольше) в реанимационное отделение, где за ним осуществляется мониторный контроль. Затем выполняется контрольная ЭХОКГ и пациент переводится в палату под наблюдение лечащего доктора. Еще один день производится наблюдение, подбор антиаритмической и антикоагулянтной терапии – затем пациент выписывается. Пациент находится в стационаре 3-4 дня от начала госпитализации. Изменение сроков госпитализации зависит от назначений лечащего кардиолога. В послеоперационном периоде могут возникать эпизоды болей в грудной клетке, головокружения, перебои в работе сердца и приступы аритмии, связанные с проведенной операцией (отёк), которые не являются признаками «рецидива» аритмии.
Далее следует 3 месячный «слепой период», когда происходит формирование и нормализация «изоляционной линии». Это период реабилитации и, в это время, дополнительные вмешательства в сердце не производятся. Эффективность оценивается по истечении этого срока и после отмены или снижения дозировок антиаритмических препаратов.
Общая эффективность первичных процедур по изоляции легочных вен при пароксизмальных формах мерцательной аритмии составляет 65-70%. Это связано с восстановлением проведения в изолированных структурах, другими аритмиями, прогрессированием заболевания и т.д. Поэтому части пациентов (до 50%), требуется проведение повторной процедуры для выявления и устранения прорывов проведения в легочных венах или сопутствующих «внелегочных» аритмий. Эффективность вторичной операции и улучшение качества жизни достигается у 90% пациентов. Желательно, осуществлять кардиологический контроль через 3, 6 мес и через 1 год после проведения последней операции. Отмена препаратов осуществляется только лишь с согласия лечащего доктора. Часто антикоагулянтная (разжижающая) терапия остается на длительный прием и не зависит от результатов операции (высчитывается по специфической шкале CHADS2-VASc).
Количество осложнений в ГКБ им. И.В. Давыдовского составляет менее 1% и включают гемоперикард (накопление жидкости в сердечной сумке), гематомы в области пункций, парез диафрагмального нерва (только при крио-процедурах). Все осложнения эффективно устраняются в госпитальный период и могут привести к отсрочке выписки. Смертельных исходов в нашей клинике не наблюдалось.
Трепетание предсердий
Цели ведения пациентов с трепетанием предсердий (ТП) схожи с лечением ФП. На основе имеющихся данных, риск инсульта у пациентов с трепетанием предсердий не сильно отличается от такового при ФП. Кроме того, многие пациенты с трепетанием предсердий имеют сопутствующую ФП (при такой комбинации – процедура проводится совместная). Таким образом, у пациентов с трепетанием предсердий антикоагулянтная терапия должна применяться также, как у пациентов с ФП. Контроль частоты при ТП достигается теми же лекарственными средствами, как и при ФП, но дозы препаратов как правило требуются более высокие. Типичные формы ТП имеют схожий механизм и «крутятся» вокруг трикуспидального клапана по часовой и против часовой стрелки.
Для того, чтобы эффективно устранить эту аритмию нужно провести «демаркационную» линию аблации в самом «узком» и «медленном» месте круга тахикардии – кава-трикуспидальном перешейке (от трикуспидального клапана до нижней полой вены).
Аблация кава-трикуспидального перешейка при истмус-зависимых ТП эффективно сохраняет синусовый ритм с эффективностью 90-95%. Процедура также, как и при ФП, производиться под внутривенным наркозом, трансвенозным доступом (бедренная, подключичная, яремная вены).
Эта процедура эффективно снижает рецидивы ФП у отдельных пациентов и поможет избежать ненужных госпитализаций. Аблация перешейка является относительно безопасным и более эффективным методом, чем антиаритмическая лекарственная терапия и рекомендуется при рецидивирующем течении трепетания предсердий. Катетерная аблация левопредсердной макро-реентри тахикардии является более сложной процедурой, с более низким уровнем эффективности и высоким уровнем послеоперационных рецидивов.
Особенности лечения аритмии в Клиническом госпитале на Яузе
Пациент может пройти полную диагностику, качественное лечение аритмии (в том числе и хирургическое), а также находиться под наблюдением специалистов (кардиологов, кардиохирургов) в течение года после операции.
В период амбулаторного наблюдения после хирургического лечения пациент может постоянно (при необходимости – практически круглосуточно) находиться на связи с врачом.
О кардиохирургическом лечении аритмии
Малоинвазивные операции с доступом через сосуд. Продолжительность — 2-3 часа.- Высокотехнологичное оборудование — нефлюороскопическая система картирования «СARTO» позволяет прямо во время операции провести внутрисердечное электрофизиологическое исследование для точного определения места проведения патологического импульса, вызывающего аритмию, коагулировать его, восстановив нормальный синусовый ритм.
- Пребывание в стационаре – 1-1,5 суток. Послеоперационная реабилитация – 2-7 дней.
- Операции можно проводить людям преклонного возраста (старше 65 лет).
- Малоинвазивное кардиохирургическое лечение возможно даже на фоне соматических заболеваний.
- Руководит отделением один из ведущих оперирующих аритмологов России доктор медицинских наук, профессор А.В.Ардашев.
Впервые в России выполнены
- лазерная ангиопластика при стенозирующих и окклюзирующих поражений венечных артерии сердца при ИБС – февраль 1989
- удаление инородного тела из просвета коронарной артерии при осложненной операции ангиопластики – апрель 1991
- стентирование венечной артерии при атеросклеротических поражениях коронарных артерии – январь 1992
- имплантация оригинального устройства для закрытия дефекта перегородки сердца – март 1995
- ретроградная реканализация через коллатеральный канал закупоренной венечной артерии – сентябрь 2006
- гидродинамическая реканализация при окклюзии коронарных артерии – март 2007
Опыт эндоваскулярных операции при ИБС и структурных патологиях сердца – более 6.000 успешных операции!
Как все начиналось . . .
1988 год. Свою первую операцию на венечных артериях сердца выполняет в качестве клинического ординатора Всесоюзного научного Центра хирургии АМН СССР, под руководством проф. Рабкина И.Х. После удачного старта далее интенсивное развитие новых малоинвазивных способов лечения ишемической болезни сердца и структурных патологии. Первая операция с помощью лазерного луча и тончайшего световода по устранению атеросклеротических поражений сначала во время операции коронарного шунтирования, затем и с помощью пункции (прокола) в бедренной артерии.
Затем был неожиданный поворот. Не зря же говорят, иногда случаи может решить всю дальнейшую жизнь. 1993 год. Во время операции молодого пациента присутствовал Бронштейн А.С. и после успешной операции и выписки пациента через неделю раздался телефонный звонок с приглашением наладить службу малоинвазивной кардиохирургии в Центре, возглавляемом Александром Семеновичем. Надо сказать, от неожиданности предложения наступил полный ступор, ведь хорошая перспектива имелась и на базе ВНЦ хирургии. Однако, предпочел большую «свободу творчества», хотелось бы проверить свои силы в налаживании полноценной службы малоинвазивной кардиологии. Далее события развивались довольно интенсивно, защита докторской, две монографии, организация и участие в 6 Российских симпозиумах, первые операции в «прямом эфире» с передачей в зал заседании, где находились коллеги, принимающие участие в научных конференциях. Первые операции, выполненные за рубежом (в частности, в госпитале onze lieve vrouwe Gathius в Амстердаме у проф. Kiemeneij F.), участие и представление докладов о наших достижениях в области малоинвазивной кардиологии на многочисленных международных престижных симпозиумах и конференциях (таких как, EUROpcr в Париже и Барселоне, TCT в США и Ю.Корее, CCT в Японии и др). Участие в более чем 10 международных клинических исследованиях.
Первый стент . . .
Это сейчас имплантации протезов (стентов) в венечные артерии сердца стало привычным делом, а в начале 90-х годов имплантация искусственного протеза в артерию сердца казалось такой же фантастикой, как полет на луну. . . Одни говорили, что это очень опасно, поскольку увеличивает риск возникновения тромба в артерии, понятно с какими результатами, другие сомневались в эффективности этих самих протезов. Но, тем не менее, прогресс не остановить.
Как-то в начале 1992 года, практически сразу после новогодних праздников ко мне подошел профессор Таричко Ю.В., тогда мы вместе работали в Российском Центре хирургии Академии медицинских наук, и сказал, что его хороший знакомый, научный работник одного из вузов Москвы страдает стенокардией и надо бы его обследовать. После выполнения диагностической коронарографии у него оказалось довольно опасное поражение – почти критическое сужение самой крупной артерии сердца, закрытие которого могла бы привести к катастрофическим последствиям. Мы обсудили ситуацию и лечебную тактику совместно с хирургами и кардиологами и решили выполнить баллонную ангиопластику (расширение и устранение сужения раздутым баллоном). Тогда у нас был самый большой опыт в России баллонной коронарной ангиопластики (более 700 операции). Так вот, 24 января мы его взяли на стол и . . . во время баллонной ангиопластики возникла отслойка внутренней поверхности сосуда (т.н. диссекция стенки сосуда) практически с полным перекрытием кровотока в артерии. Обстановку в операционной можете представить, паники не было, но ситуация казалось неразрешимой. До открытой операции шунтирования пациента не могли бы додержать, поскольку для подготовки операционной для открытой операции требовалось около 40-50мин и за это время сердце могло остановиться, других способов спасения ситуации с помощью хирургии в то время не было, оставалось лечить медикаментами неизвестным и абсолютно негарантированным исходом, и тем не менее, реанимационные мероприятии были начаты, в операционной царил стресс, уже начались опасные нарушения ритма, два раза дефибрилляция.
Реаниматологи готовились к интубации и наружному массажу сердца. Рядом со мной стоял проф. Таричко, наблюдая за этой картиной, и видимо в душе жалел, что приняли такое решение по поводу лечения друга. И вдруг тут осенило: у нас же лежит внутрисосудистый коронарный протез, тогда этот образец для апробации мне передали из фирмы Johnson&Johnson. Это был протез Palmaz-Shatz, которых к тому времени в мире было установлено только в 2-х или 3-х клиниках. А у нас в России стент еще никто не имплантировал! И мы рискнули, поскольку ситуация практически была критической . . подготовка к имплантации, как мне потом сказали, заняла всего 5мин . . я в стрессе просто потерял отчет времени. Но четко помню момент контрольной ангиографии после имплантации, кровоток восстановлен, артерия полностью заполняется кровью, сердце начало сокращаться в полную силу, ритм наладился. Первое ощущение было – человека спасли от неминуемого исхода. Таким счастливым оказался первый стент в России.
Кстати этот пациент до сих пор живет и здравствует, прошло уже 18 лет !!! и есть основание для гордости – пациента не только спасли, но и подарили 18 лет безбедной жизни. Что может быть еще лучше для хирурга.