Гипотензивный эффект – что это такое? Этим вопросом задаются женщины и мужчины, впервые столкнувшиеся с проблемой повышения артериального давления или гипертонической болезнью и не имеющие представления, что значит гипотензивное действие препаратов, назначаемых им лечащим врачом. Гипотензивное действие – это снижение артериального давления под влиянием определенного препарата.
Опытные профессиональные врачи-терапевты высшей категории клиники терапии Юсуповской больницы, владеющие передовыми методиками лечения и диагностики, окажут квалифицированную помощь больным артериальной гипертензией, подберут эффективную схему лечения, исключающую развитие негативных последствий.
Гипотензивный синдром
Гипотензивный синдром представляет собой целый симптомокомплекс, отображающий стойкое понижение внутричерепного давления у женщин. Возникает он только у беременных в возрасте от 25-ти до 29-ти лет. Данный синдром в значительной степени снижает качество жизни будущей мамочки и требует квалифицированной медицинской помощи.
Записаться на приём
Причины
Причинами данной патологии выступают следующие факторы:
- сильное обезвоживание организма после перенесенной медикаментозной терапии;
- травмы головы;
- истечение спинномозговой жидкости из-за нарушения целостности костей черепа или тканей головного мозга;
- снижение артериального давления, приводящее к понижению и внутричерепного давления.
Каждая беременная женщина должна быть вдвойне внимательней к своему здоровью, поскольку на ней лежит ответственность еще и за жизнь ребенка. Любые изменения самочувствия должны быть поводом для консультации с врачом. Доктора Юсуповской больницы в любое время готовы ответить на все вопросы своих пациентов на приеме лично либо по телефону.
Симптомами гипотензивного синдрома у беременных являются:
- сильные сжимающие внезапные головные боли;
- усиление головных болей при подъеме головы либо в сидячем положении;
- снижение интенсивности головной боли при опущении головы;
- упадок сил;
- чувство сонливости;
- раздражительность;
- приступы тошноты и рвоты.
Безусловно, многие из вышеперечисленных симптомов возникают у беременных и являются следствием изменения работы всех органов и систем в период вынашивания малыша. Никакого отношения к гипотензивному синдрому они могут и не иметь.
Но в любом случае, при ухудшении самочувствия будущей маме обязательно нужно сообщить об этом доктору. Осторожность и внимательность к своему здоровью позволят избежать развития осложнений, выявить гипотензивный синдром и пройти эффективный курс терапии.
Диагностика
Если при беременности появились симптомы недуга, необходимо пройти осмотры у гинеколога, невропатолога и нейрохирурга. Доктора проводят обследования, анализируют все жалобы пациентки и ставят предварительный диагноз. Чтобы его подтвердить или опровергнуть, беременной назначают ряд диагностических мероприятий, а именно:
- общий и биохимический анализ крови;
- общий анализ мочи;
- рентгенограмму черепа;
- спинномозговую пункцию;
- МРТ головного мозга.
В Юсуповской больнице все диагностические процедуры проводят на современной медицинской аппаратуре, позволяющей получить точные данные и оперативно приступить к лечению.
Гипотензивная терапия при сахарном диабете
Сахарный диабет является хроническим заболеванием, развитие которого связано с абсолютным либо относительным дефицитом гормона – инсулина. Недостаток инсулина либо отсутствие чувствительности к нему приводит к повышению в крови уровня глюкозы. Данное состояние оказывает негативное влияние на все системы и органы человеческого организма, в том числе и на сердечно-сосудистую систему.
Практически все больные, страдающие сахарным диабетом, жалуются на повышенное артериальное давление, снизить которое без помощи врача удается с большим трудом.
Гипертония и сахарный диабет
Гипертония у больных сахарным диабетом является неотъемлемой и очень опасной составляющей, которая может в несколько раз увеличивать риск развития следующих заболеваний:
- в 3-5 раз — инфаркта;
- в 3-4 раза — инсульта:
- в 10-20 раз – слепоты;
- в 20-25 раз – почечной недостаточности;
- в 20 раз – гангрены, требующей ампутации конечности.
Если показатели артериального давления превышают значения 140/90, не нужно медлить с обращением к специалисту, так как гипертония, возникающая на фоне сахарного диабета может привести к развитию необратимых последствий, зачастую не совместимых с жизнью.
Гипертония при сахарном диабете 1 типа
Основная и самая опасная причина артериальной гипертензии при сахарном диабете 1 типа заключается в наличии диабетической нефропатии у больных с данным недугом. Развитие этого осложнения наблюдается почти у 40% лиц, страдающих диабетом 1 типа. Повышение артериального давления напрямую связано с количеством белка, выделяемого с мочой.
Гипертензия, обусловленная почечной недостаточностью, развивается также вследствие слабого выведения натрия с мочой. При увеличении натрия в крови происходит накопление жидкости, необходимой для его разбавления. Ввиду увеличения объема циркулирующей крови повышается АД. Данный процесс может быть связан также с повышением концентрации глюкозы, что происходит при сахарном диабете. В результате, для снижения густоты крови в организме вырабатывается еще большее количество жидкости и объем циркулирующей крови дополнительно увеличивается и по этой причине.
Гипертония при сахарном диабете 2 типа
Одним из факторов, провоцирующих развитие сахарного диабета 2 типа, является инсулинорезистентность, т.е. снижение чувствительности тканей к действию инсулина.
Для компенсации инсулинорезистентности в крови циркулирует чрезмерное количество инсулина, что само по себе вызывает повышение артериального давления. Со временем происходит сужение просвета кровеносных сосудов, вызванное атеросклерозом, что также способствует возникновению гипертонической болезни. Параллельно у больных отмечается развитие абдоминального ожирения, а, как известно, именно из жировой ткани в кровь выделяются вещества, повышающие артериальное давление.
Гипертония при диабете: особенности
У больных сахарном диабетом наблюдается нарушение естественного суточного ритма колебаний АД. У здорового человека в утреннее и ночное время показатели артериального давления, как правило, ниже, чем в дневные часы на 10-20%. У больных сахарным диабетом снижения давления ночью не отмечается. Более того, ночные показатели давления у них могут быть даже выше, чем дневные. По мнению специалистов, данное явление обусловлено диабетической нейропатией. Повышенная концентрация сахара в крови приводит к поражению автономной нервной системы, которая отвечает за регуляцию жизнедеятельности организма. Происходит ухудшение способности сосудов к регуляции своего тонуса – сужению и расслаблению в зависимости от нагрузок.
Гипотензивные препараты при сахарном диабете
На сегодняшний день известны восемь групп гипотензивных препаратов, из них пять считаются основными, а три – дополнительными. Гипотензивная терапия при сахарном диабете представляет собой прием следующих средств:
- диуретических препаратов;
- блокаторов кальциевых каналов;
- бета-блокаторов;
- препаратов центрального действия;
- ингибиторов АПФ;
- блокаторов рецепторов ангиотензина II;
- альфа-адреноблокаторов;
- ингибитора ренина (расилеза).
Лекарственные средства, которые составляют дополнительные группы, назначаются, чаще всего, в качестве компонентов комбинированного лечения.
Безопасная гипотензивная терапия: снижение АД или контроль?
В российских рекомендациях по диагностике и лечению АГ рекомендованы 5 основных классов гипотензивных препаратов: ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецепторов ангиотензина I (БРА), антагонисты кальция, β-адреноблокаторы, диуретики. Пока нет убедительных данных, свидетельствующих о преимуществе одного класса антигипертензивных препаратов над другими [4]. Также в качестве дополнительных классов могут использоваться α-адреноблокаторы, агонисты имидазолиновых рецепторов и прямые ингибиторы ренина. При выборе антигипертензивной терапии (АГТ) необходимо в первую очередь оценить эффективность, вероятность развития побочных эффектов и преимущества лекарственного средства в определенной клинической ситуации.
Проведенный метаанализ, включивший 7 рандомизированных исследований (из них 4 крупных клинических исследования: Dutch TIA trial; PATS; HOPE; PROGRESS) и в общей сложности 15 527 пациентов, показал, что проводимая АГТ позволяет снизить риск повторного инсульта на 24%, ИМ – на 21% и сердечно-сосудистых событий – на 21% [5].
В рекомендациях рабочей группы по лечению АГ Европейского общества гипертонии (ESH) и Европейского общества кардиологов (ESC) по лечению АГ 2013 г., в седьмом отчете Совместной национальной комиссии по предупреждению, выявлению, оценке и лечению высокого артериального давления США (JNC VII) целевыми значениями АД признаны снижение САД и ДАД менее 140/90 мм рт. ст. у всех больных АГ, у пациентов с сахарным диабетом – ДАД<85 мм рт. ст. У лиц старше 80 лет рекомендуется снижать САД до
140–150 мм рт. ст. и даже до значений <140/90 мм рт. ст. при хорошей переносимости [6, 7].
В четвертом пересмотре российских рекомендаций указаны аналогичные целевые значения АД: «Профилактика, диагностика и лечение артериальной гипертензии» (РКО/ВНОК, 2010): «При лечении больных АГ величина АД должна быть менее 140/90 мм рт. ст., что является ее целевым уровнем. При хорошей переносимости назначенной терапии целесообразно снижение АД до более низких значений. У пациентов с высоким и очень высоким риском ССО необходимо снизить АД <140/90 мм рт. ст. в течение 4 нед. В дальнейшем, при условии хорошей переносимости рекомендуется снижение АД до 130–139/80–89 мм рт. ст. При плохой переносимости снижения АД рекомендуется его снижение в несколько этапов. На каждом этапе АД снижается на 10–15% от исходного уровня за 2–4 нед. с последующим периодом для адаптации пациента к более низким величинам АД. При достижении целевых уровней АД необходимо учитывать нижнюю границу снижения САД до 110–115 мм рт. ст. и ДАД до 70–75 мм рт. ст., а также следить за тем, чтобы в процессе лечения не увеличилось пульсовое АД у пожилых пациентов, что происходит главным образом за счет снижения ДАД» [4].
Развитие медикаментозной гипотензии, увеличивающей риск почечной, миокардиальной и церебральной гипоперфузии, является одной из наиболее серьезных проблем АГТ [8, 9]. Чаще всего в литературе обсуждается проблема гипотензии первой дозы при назначении иАПФ. Однако частота медикаментозной гипотензии на фоне лечения антигипертензивными препаратами достигает 10% [10].
У больных АГ гипотензия является распространенным состоянием, которому уделяется недостаточно внимания в исследованиях режимов АГТ [11]. Наиболее частыми причинами гипотонических состояний у больных АГ являются прием препаратов с выраженным эффектом вазодилатации или вызывающих уменьшение объема циркулирующей крови (ОЦК), а также спонтанная гипотензия, развивающаяся преимущественно в ночные часы и обусловленная нарушением ауторегуляции сосудистого тонуса [12]. Возникновение медикаментозных гипотонических реакций в большей степени характерно для лекарственных форм с быстрым высвобождением активного ингредиента, обладающих низкими значениями показателя Т/Р (Trough/Peak) [11].
Показатель Т/Р позволяет судить о длительности действия антигипертензивного препарата по отношению остаточной (т. е. после приема последней дозы) к пиковой (максимальное действие в момент максимальной концентрации препарата в крови) активности. При применении препаратов с низким показателем Т/Р отмечается высокая вариабельность АД, обусловленная чрезмерной гипотензией на пике действия препарата или недостаточным антигипертензивным эффектом в конце междозового интервала [13]. Уменьшение общего объема жидкости в организме и, как следствие, ОЦК может приводить к более высокой концентрации в крови гидрофильных препаратов (атенолол, лизиноприл). Выведение антигипертензивных лекарственных препаратов из организма также может замедляться в связи с уменьшением почечной фильтрации и снижением активности ферментных систем печени, что часто можно наблюдать у пожилых пациентов. Помимо этого, из-за уменьшения объема ОЦК ограничивается использование диуретических средств.
Значительное снижение АД может возникать при комбинированной терапии, когда используется несколько препаратов, которые вначале не дают быстрого антигипертензивного эффекта, максимальный эффект которых отсрочен и гипотензивная реакция возникает через несколько часов. Известно, что увеличение вариабельности АД само по себе является прогностически неблагоприятным фактором, связанным с риском развития ССО у больных АГ [14]. В то же время у лиц пожилого возраста даже на фоне приема пролонгированных препаратов может быть отмечено снижение ДАД во время бодрствования [11]. Нередко чрезмерное снижение АД наблюдается при самостоятельном приеме гипотензивных средств без контроля АД в связи с ухудшением самочувствия, которое у больных АГ не всегда связано с повышением АД [15, 16].
В ряде исследований у больных пожилого возраста или пациентов с сосудистыми заболеваниями было обнаружено парадоксальное увеличение частоты ССО, наиболее вероятно, обусловленное чрезмерным снижением АД [17]. Согласно данным Honolulu Heart Study, ортостатическая гипотензия в популяции лиц старше 70 лет регистрируется в 7% случаев, причем смертность у этой категории пациентов выше на 64%, чем в контрольной группе [18].
Неврологические осложнения гипотензивной терапии, проявляющиеся в виде снижения физической и умственной работоспособности, быстрой утомляемости, шума в ушах, головокружения, наблюдаются преимущественно у пожилых больных, особенно при наличии цереброваскулярного заболевания и значительных стенозов прецеребральных (сонных и позвоночных) и церебральных артерий. При этом могут отмечаться такие расстройства, как нарушение сна, эмоциональная лабильность, депрессивные состояния. Иногда гипоперфузионные состояния могут протекать бессимптомно и быть выявлены в виде снижения церебрального кровотока по результатам ультразвуковой допплерографии или магнитно-резонансной спектроскопии. По-видимому, именно гипоперфузионные состояния могут быть одной из причин клинически «немых» инсультов [19, 20].
Осложнения гипотензивной терапии могут быть вызваны значительным снижением АД в результате нарушения функции барорецепторов, когда его уровень опускается ниже нижней границы ауторегуляции мозгового кровообращения, что приводит к гипоперфузии головного мозга.
У лиц с нормальным АД мозговой кровоток поддерживается на постоянном уровне (около 50 мл на 100 г вещества мозга в минуту), нижняя граница ауторегуляции мозгового кровообращения составляет около 60 мм рт. ст., а верхняя – около 180 мм рт. ст., по данным среднего гемодинамического АД. У больных АГ ауторегуляция мозгового кровотока адаптируется к более высоким значениям АД, причем чем выше привычные значения АД, тем выше нижняя граница ауторегуляции мозгового кровообращения. У больных с длительной АГ нижняя граница ауторегуляции мозгового кровообращения может достигать 90–100 мм рт. ст. Таким образом, для больного АГ снижение САД до уровня 120–130 мм рт. ст., особенно при попытке быстрой «нормализации» АД, может оказаться критическим и привести к уменьшению перфузионного АД и появлению симптомов церебральной ишемии [21].
Исследование мозгового кровотока у больных с цереброваскулярной патологией показывает, что гипоперфузия мозга возникает при снижении АД в среднем на 10–20% от обычных «рабочих» значений [22].
Установлено, что повторное нарушение мозгового кровообращения зависит не только от характера инсульта – инфаркт мозга или кровоизлияние, но и от уровня поддерживаемого АД. После перенесенного кровоизлияния риск повторных мозговых осложнений был прямо пропорционален уровню ДАД, при этом наименьшая частота церебрального поражения наблюдалась при ДАД≤80 мм рт. ст. У больных, перенесших ишемический инсульт, наименьший риск повторного инсульта обнаруживался в диапазоне ДАД 80–84 мм рт. ст., а при более низком уровне АД вновь нарастал. Причем после атеротромботического инсульта наименьшая частота рецидива церебрального события отмечалась при ДАД 85–89 мм рт. ст., после лакунарного (ишемический инфаркт головного мозга) – 80–84 мм рт. ст., что было связано с ограничением возможностей ауторегуляции мозгового кровотока при поражении крупных церебральных артерий [23].
В то же время при внутримозговом кровоизлиянии рекомендуется снижать АД постепенно и только до обычных для больного уровней АД, а если они не известны, то САД – до уровня 150–160 мм рт. ст., а ДАД – до 85–90 мм рт. ст. [24].
Важнейшим фактором, имеющим несомненное влияние на определение целевого уровня АД, считают наличие гемодинамически значимого окклюзирующего атеросклеротического поражения магистральных артерий. Примерно у 20% больных, перенесших транзиторную ишемическую атаку или инсульт, отмечается выраженный стеноз или окклюзия хотя бы одной сонной артерии. Проведение у таких пациентов неадекватной АГТ может ухудшить перфузию мозга при относительно нормальных значениях АД и привести к осложнениям, включая развитие ишемического гемодинамического инсульта. Анализ результатов нескольких исследований, в которых изучалось прогностическое значение АГ и АГТ у больных со стенозами или окклюзиями сонных артерий, показал следующие результаты.
У больных, перенесших ишемический инсульт или транзиторную ишемическую атаку и имеющих значительный стеноз (сужение более 70% просвета) внутренней сонной артерии, при увеличении АД риск инсульта возрастает в меньшей степени, чем у пациентов без выраженного атеросклероза. При этом в исследовании UK-TIA у больных с клинически симптомным односторонним окклюзирующим каротидным поражением обнаружено повышение риска инсульта при снижении САД <130 мм рт. ст. При наличии двустороннего значительного стеноза сонных артерий риск развития инсульта возрастает также при снижении АД. Это обусловлено нарушением нормальной регуляции мозгового кровотока, величина которого определяется перфузионным давлением, напрямую зависящим от системного АД. У больных данной группы, получавших гипотензивную терапию, риск развития инсульта был наименьшим при значениях САД 150–169 мм рт. ст. и прогрессивно многократно увеличивался при более низких значениях. Выраженный двусторонний стеноз сонных артерий является показанием к хирургическому лечению, т. к. только после этого пациентам можно будет проводить активную гипотензивную терапию и снижать АД до уровня, безопасного для сердца, почек и других органов [25].
На основании представленных выше данных для пациентов, имеющих в анамнезе ишемические церебральные события и страдающих дисциркуляторной энцефалопатией, рекомендовано 3 основных целевых уровня САД как наиболее прогностически значимых в отношении риска повторных сосудистых мозговых осложнений:
• САД 160–150 мм рт. ст. следует считать минимально допустимым для пациентов, имеющих АГ 3-й степени либо двусторонний каротидный стеноз ≥70%;
• САД 140–135 мм рт. ст. оптимально для больных с АГ 2-й степени и односторонним каротидным стенозом ≥70%;
• САД 120 мм рт. ст. – минимально возможное для больных с АГ 1-й степени, высоким нормальным АД при отсутствии выраженного поражения магистральных артерий головы [26].
Имеются данные, что при значительном снижении АД повышается риск коронарных осложнений [27]. В исследовании INVEST, включившим 22 тыс. пациентов с АГ и ишемической болезнью сердца, ДАД ниже 90 мм рт. ст. было связано с увеличением риска ИМ по сравнению с группой, имевшей наименьший риск ИМ при ДАД 82,7 мм рт. ст. [28]. В исследовании SHEP с участием 4736 пациентов с изолированной систолической АГ было показано, что при снижении ДАД ниже 70 мм рт. ст. возрастает риск развития сердечно-сосудистых заболеваний (ССЗ), включая ИМ, и риск ССО возрастает в 2 раза при ДАД меньше 55 мм рт. ст. [29, 30].
Больные с выраженным (окклюзирующим) поражением коронарных артерий и/или гипертрофией левого желудочка имеют более высокий риск коронарных осложнений при низком ДАД, хотя данное осложнение больше характерно для пациентов с АГ 1-й и 2-й степени, у которых уровень ДАД понизился более чем на 25 мм рт. ст. от исходного значения [31, 32].
Еще одним из негативных моментов резкого снижения АД является снижение перфузии почек и, как результат, развитие почечной недостаточности. Очень важно поддержание оптимального уровня АД для пациентов с патологией почек. Для адекватной перфузии почек необходимо поддерживать САД на уровне от 80 до 180 мм рт. ст. При снижении САД ниже 80 мм рт. ст. возможны уменьшение почечной перфузии и развитие почечной недостаточности [33].
БРА и иАПФ, расширяя эфферентные артериолы клубочка, могут вызывать снижение почечного перфузионного давления и уменьшение скорости клубочковой фильтрации (СКФ). Зависимость СКФ от уровня ангиотензина II становится особенно выраженной при уменьшении ОЦК, двухстороннем стенозе почечных артерий, а также стенозе почечной артерии единственной почки [34]. Снижение фильтрации может привести к повышению уровня креатинина сыворотки крови и калия. Гиповолемия и гипотония дополнительно усугубляют уменьшение фильтрации [35].
В последние годы все большее значение придается показателю вариабельности АД, т. к. высокая вариабельность ассоциируется с повышением риска сердечно-сосудистых событий [36].
У пациентов с наибольшей вариабельностью АД вероятность развития инсульта оказалась в 6,22 раза выше по сравнению с пациентами с наименьшей вариабельностью [37–39]. Следует отметить, что в группе пациентов с АГ с повышенной вариабельностью САД частота ССО выше на 60–70% (1372 пациента, время наблюдения – до 7,5 года) [40]. В результате 14-летнего наблюдения за 956 пациентами выявлено, что в группах с умеренной и высокой вариабельностью САД по сравнению с лицами с низкой вариабельностью наблюдается увеличение риска смерти на 55 и 49% соответственно [41].
Как известно, АД снижается во время сна и быстро повышается перед пробуждением. Максимальные значения отмечаются после пробуждения и начала повседневной активности. Утренний подъем АД вызывает нагрузку на сердечно-сосудистую систему, приводя к поражениям органов-мишеней и патологическим реакциям [42].
Величина и скорость утреннего подъема АД зависят от особенностей суточного профиля АД. Причем для пациентов, страдающих эссенциальной гипертонией на ранних стадиях заболевания, характерны большая величина и скорость утреннего подъема АД, чем у здоровых лиц. А у пациентов с чрезмерным снижением АД в ночные часы, как и у пациентов с недостаточным снижением АД во время ночного сна утренний подъем характеризуется большими величиной и скоростью роста давления по сравнению с больными с нормальным циркадным ритмом [43].
По данным метаанализа 4 исследований, включивших 3468 пациентов, высокая вариабельность АД является независимым предиктором развития сердечно-сосудистых событий у пациентов с АГ даже без ССЗ в анамнезе вне зависимости от возраста и пола [44].
На основании клинико-инструментального обследования 65 больных с острым ИМ доказано существенное влияние АГ с увеличением вариабельности на течение заболевания и годичный прогноз больных. Клиническое течение острого периода ИМ у больных с высокой вариабельностью АД было более тяжелым. У больных с АГ в 2 раза чаще (20,8 и 9,8% соответственно) наблюдалось осложненное течение с развитием острой левожелудочковой недостаточности, рецидивы инфаркта возникали в 3 раза чаще (8,3 и 2,4% соответственно). Выявлено, что в течение первого года после перенесенного инфаркта повышение вариабельности АД сопряжено с увеличением риска летального исхода в 3 раза [45]. Показано, что высокая вариабельность АД в остром периоде ИМ коррелирует с ухудшением систолической функции левого желудочка [46] и является неблагоприятным прогностическим критерием течения ИМ [47].
На время утреннего подъема АД приходится максимальное число различных ССО. Так, показано, что большая часть ишемических эпизодов происходит в утренние часы, что совпадает с частотой развития ИМ и наступления внезапной смерти [48]. Наиболее часто ИМ развивается в первой половине дня [49]. В исследовании TIMI II максимальная частота развития инфарктов (34%) наблюдалась в период с 6:00 до 12:00 ч [50]. Такой же характер имеет и суточный ритм приступов стенокардии. Суточный ритм вариантной стенокардии также характеризуется пиком в утренние часы [51, 52]. Также выявлено, что существует зависимость между циркадным ритмом и ишемическим поражением головного мозга: нондипперы и овердипперы имеют достоверно больше «немых» церебральных очагов по сравнению с умеренными дипперами [53–55]. По данным метаанализа 31 исследования, в которых сообщалось о времени возникновения инсультов у 11 816 пациентов, в период 6:00–12:00 ч вероятность развития инсульта была на 79% выше, чем в другие часы. При этом в утренний период повышалась вероятность возникновения всех трех типов нарушения мозгового кровообращения (на 55% для ишемических инсультов, на 34% – для геморрагических инсультов и на 50% – для транзиторной ишемической атаки) [56]. Показано, что утренний подъем АД на 10 мм рт. ст. ассоциируется с увеличением риска развития инсульта на 22% [57].
Даже если офисное АД нормальное, в ранние утренние часы АД часто бывает повышенным. Так, проведены анализ АД методом его мониторирования в домашних условиях (исследование ACAMPA) в Испании у 290 леченых больных с АГ, а также исследование утренней АГ J-MORE (Jichi Morning-Hypertension Research) у 1027 леченых больных с АГ. Оба исследования продемонстрировали, что у 60% больных АГ, у которых лечение представляется достаточно эффективным, в утренние часы АД остается повышенным [58, 59].
Медикаментозная коррекция вариабельности АД способствует не только предупреждению ИМ, инсульта, смертельных исходов, но и объясняет различия эффективности разных антигипертензивных препаратов в отношении снижения АД. Если антигипертензивный препарат не сохраняет в полной мере свою эффективность на всем протяжении периода действия, то в результате в утренние часы АД может не контролироваться, даже если офисное АД нормальное. Длительность действия препарата более 24 ч представляется желательной, т. к. многие пациенты запаздывают с приемом очередной дозы, а то и вовсе забывают ее принять. Для эффективного действия лекарства в течение 24 ч необходимо, чтобы к концу 24-часового периода действия сохранялось не менее 50% пиковой активности действующего вещества.
Таким образом, необходимо использовать препараты с длительной продолжительностью действия для предотвращения повышения вариабельности АД в течение суток, отсутствия резких подъемов АД в утренние часы и в то же время предотвращения эпизодов резкого понижения АД. Длительный антигипертензивный эффект и высокий показатель T/P позволяют обеспечить более полную защиту органов.
Планирование желаемого уровня снижения АД у пациентов должно строиться с учетом компенсаторных возможностей церебральной, коронарной и почечной гемодинамики. Наличие цереброваскулярных заболеваний, ишемической болезни сердца и гипертрофии левого желудочка свидетельствует о снижении функционального резерва органов-мишеней и требует более тщательного контроля снижения уровня АД. При отсутствии выраженных нарушений церебральной гемодинамики допустимо снижать САД на 20% от исходных величин, а ДАД – на 15%. У пациентов с АГ целесообразно умеренное снижение АД – на 10–15% от исходного уровня за 2–4 нед. с последующим перерывом для адаптации пациента к более низким величинам АД. По мере адаптации пациента к новым (более низким) показателям АД возможно дальнейшее постепенное его снижение до оптимальных для данного больного цифр. Если переход на следующий этап вызывает ухудшение состояния пациента, целесообразно вернуться на предыдущий уровень еще на некоторое время. Cнижение АД до целевого уровня происходит в несколько этапов, число которых индивидуально и зависит как от исходной величины АД, так и от переносимости АГТ. Использование этапной схемы снижения АД с учетом индивидуальной переносимости, особенно у пациентов с высоким и очень высоким риском ССО, позволяет достичь целевого уровня АД менее 140/90 мм рт. ст., избежать эпизодов гипотонии и увеличения связанного с ней риска развития ИМ и МИ [60].
Заключение
В настоящее время эффективность рациональной АГТ убедительно доказана в отношении как профилактики развития сердечно-сосудистых событий, так и прогрессирования поражения органов-мишеней. С одной стороны, надо назначать препараты, с помощью которых достигается целевой уровень АД, с другой стороны, необходимо контролировать, чтобы снижение АД не было ниже 110–115/70–75 мм рт. ст. Постепенная и устойчивая нормализация АД приводит к снижению заболеваемости ИМ, уменьшению числа повторных инсультов и смертности от ССЗ.
Литература
- Арабидзе Г.Г., Белоусов Ю.Б., Карпов Ю.А. Артериальная гипертония. Справочное руководство по диагностике и лечению. М., 1999. 139 с.
- Гусев Е.И., Мартынов М.Ю., Ясаманова А.Н. и соавт. Этиологические факторы и факторы риска хронической сосудистой мозговой недостаточности и ишемического инсульта // Инсульт. 2001. № 1. С. 41–45.
- Chalmers J., Chapman N. Challengers for the prevention of primary and secondary stroke. The importance of lowering blood pressure and total cardiovascular risk // Blood pressure. 2001. Vol. 10. Р. 344–351.
- Диагностика и лечение артериальной гипертензии Российские рекомендации (четвертый пересмотр) // Системные гипертензии. 2010. № 3. С. 5–26.
- Guidelines for the Early Management of Adults With Ischemic Stroke. Stroke. 2007. Vol. 38. Р. 1655.
- 2013 ESH/ESC Guidelines for the management of arterial hypertension // Journal of Hypertension. 2013. Vol. 31 (7). Р. 1281–1357.
- The Seventh Report of the Joint National Committee on // NIH Publication. 2003. № 03–5233.
- Cleland J.G.F., Dargie H.J., McAlpine H. et al. Severe hypotension after first dose of enalapril in heart failure // Br. Med. J. 1985. Vol. 291. Р. 1309–1312.
- Фаучи Э., Браунвальд Ю., Иссельбахер К. Внутренние болезни по Тинсли Р. Харрисону. В 7 тт / пер. с англ. М.: Практика, 2005. Т. 1. С. 249–260.
- Ольбинская Л.И., Мартынов А.И., Хапаев Б.А. Мониторирование артериального давления в кардиологии. М.: Русский врач, 1998. 99 с.
- Ольбинская Л.И., Мартынов А.И., Хапаев Б.А. Мониторирование артериального давления в кардиологии. М., “Русский врач”, 1998, 99с.
- Heart Disease. A textbook of cardiovascular medicine/ 6th edition. Ed. by E. Braunwald, D.P. Zipes, P. Libby. W.B. Saunders Company, 2001. Р. 933.
- Чазова И.Е., Ратова Л.Г. Роль суточного мониторирования артериального давления в оценке эффективности антигипертензивной терапии (Результаты суточного мониторирования артериального давления в программе КЛИП-АККОРД) // Системные гипертензии. 2007. № 1. С. 18–26.
- Fratolla A., Parati G., Guspidi C. et al. Prognostic value of 24-hour pressure variability // J. Hypertens, 1993. Vol. 11. P. 1133–1137.
- Парфенов В.А., Горбачева Ф.Е. Церебральные осложнения гипотензивной терапии // Клиническая медицина. 1991. № 10. С. 46–48.
- Парфенов В.А., Замерград М.В. Что скрывается за диагнозом «гипертонический криз» // Неврологический журн. 1998. № 5. С. 41–43.
- Cruickhank J.M., Thorp J.M., Zacharias F.J. Benefits and potential harm of lowering high blood pressure // Lancet.1987. Vol. 1. Р. 581–583.
- Артериальная гипертензия у особых категорий больных / под ред. В.Н. Коваленко, Е.П. Свищенко. К.: Морион, 2009. С. 54.
- Pantoni L., Garcia J.H. The significance of cerebral white matter abnormalities 100 years after Binswanger’s report. A review // Stroke. 1995 Jul. Vol. 26 (7). Р. 1293–1301.
- Pantoni L., Garcia J.H. Pathogenesis of leukoaraiosis. A review // Stroke. 1997. Vol. 28. Р. 652–659.
- Ворлоу Ч.П. и соавт. Инсульт. Практическое руководство для ведения больных / пер. с англ. СПб.: Политехника, 1998.
- Гераскина Л.А. Оптимизация антигипертензивной терапии у больных дисциркуляторной энцефалопатией и остаточными явлениями нарушений мозгового кровообращения: Автореф. дис. … канд. мед. наук. М., 2000.
- Irie K., Yamaguchi T., Minematsu K., Omae T. The J-curve phenomenon in stroke recurrence // Stroke. 1993 Dec. Vol. 24 (12). Р. 1844–1849.
- Парфенов В.А. Повышение артериального давления и гипотензивная терапия при инсульте // Consilium medicum. 2004. № 1. С. 12–15.
- Rothwell P.M., Howard S.C, Spence J.D. For the Carotide Endarterectomy Trialist’s Collaboration. Relationship between blood pressure and stroke risk in patients with symptomatic carotid occlusive disease // Stroke. 2003. Vol. 34. Р. 2583–2592.
- Фонякин А.В., Гераскина Л.А., Суслина З.А. Профилактика повторного инсульта. Практические рекомендации. М., 2007. 48 с.
- Lewington S., Clarke R., Qizilbash N. et al. Age-specific relevance of usual blood pressure to vascular mortality: A meta-analysis of individual data for one million adults in 61 prospective studies // Lancet. 2002; Vol. 360. Р. 1903–1913.
- Messerli F.H., Kupfer S., Pepine C.J. J curve in hypertension and coronary artery disease /// Am J Cardiol. 2005. Vol. 95. Р. 160.
- Somes G.W., Pabor M., Sborr R.I. et al. The role of diastolic blood pressure when treating isolated systolic hypertension // Arch Intern Med. 1999. Vol. 159. Р. 2004–2009.
- SHEP Cooperative Research Group. Prevention of stroke by antihypertensivedrug treatment in older persons with isolated systolic hypertension: Final results of the Systolic Hypertension in the Elderly Program // JAMA. 1991. Vol. 265. Р. 3255–3264.
- Zanchetti A. What Blood Pressure level Should Be treated? P. 1967–1983. In. Hypertension Pathophysiology, Diagnosis and Management / Edited by J.H. Laragh and B.M. Brener. Raven Press, Ltd., New York, 1990.
- Bulpitt C.J., Palmer A.J., Fletcher A.E. et al. Optimal blood pressure control in treated hypertensive patients: Report from the Department of Health Hypertension Care Computing Project (DHCCP) // Circulation. 1994. Vol. 90. Р. 225–233.
- Reddi A.S. Essentials of renal physiology. College Book Publishers, East Hanover (NJ), 1999.
- Dzau V.J. Renal effects of angiotensinFconverting enzyme inhibition in cardiac failure // Am. J. KidFney. Dis. 1987. Vol. 10. Р. 74–80.
- Morrison G. Kidney. In Current medical diagnosis and treatment, eds Tierney L.M., McPhee S.J. and Papadakis M.A. Appleton and Lange, Stamford (CT) 1997. Р. 832.
- Mancia G., Parati G., Henning M. et al. on behalf of ELSA investigators. Relation between blood pressure variability and carotid artery damage in hypertension: baseline data from the European Lacidipine Study on Atherosclerosis (ELSA) // J Hypertens. 2001.Vol. 19. Р. 1981–1989.
- Rothwell P.M. Limitations of the usual blood-pressure hypothesis and importance of variability, instability and episodic hypertension // Lancet. 2010. Vol. 375. Issue 9718. P. 938–948.
- Rothwell P.M., Howard S.C., Dolan E., O’Brien E., Dobson J.E., Dahlöf B., Sever P.S., Poulter N.R. Prognostic significance of visit-to-visit variability, maximum systolic blood pressure, and episodic hypertension // Lancet. 2010 Mar 13. Vol. 375 (9718). Р. 895–905.
- Rothwell P.M., Howard S.C., Dolan E., O’Brien E., Dobson J.E., Dahlöf B., Poulter N.R., Sever P.S. ASCOT-BPLA and MRC Trial Investigators. // Lancet Neurol. 2010. Vol. 9 (5). P. 469–480.
- Effects of beta blockers and calcium-channel blockers on within-individual variability in blood pressure and risk of stroke // Lancet Neurol. 2010 May. Vol. 9 (5). Р. 469–480.
- Кобалава Ж.Д., Котовская Ю.В. Мониторирование артериального давления: методические аспекты и клиническое значение. М.: Сервье, 1999. С. 70.
- Muntner P., Shimbo D., Tonelli M., Reynolds K., Arnett D.K., Oparil S. The Relationship Between Visit-to-Visit Variability in Systolic Blood Pressure and All-Cause Mortality in the General Population: Findings From NHANES III, 1988 to 1994 // Hypertension. Vol. 57 (2). Р. 160–166.
- Gosse P., Lasserre R., Minifie C., Lemetayer P., Clementy J. Blood pressure surge on rising // J. Hypertens. 2004. Vol. 22. Р. 1113–1118.
- Кобалава Ж.Д., Котовская Ю.В., Моисеев В.С. Особенности утреннего подъема артериального давления у больных гипертонической болезнью с различными вариантами суточного ритма // Кардиология. 2000. № 40 (11). С. 23–26.
- Fagard R.H., Thijs L., Staessen J.A., Clement D.L., De Buyzere M.L., De Bacquer D.A. Night-day blood pressure ratio and dipping pattern as predictors of death and cardiovascular events in hypertension // J Hum Hypertens. 2009 Oct. Vol. 23 (10). Р. 645–653. Epub 2009 Feb 19.
- Целуйко В.И., Карлов С.М. Прогностическое значение показателей суточного мониторирования артериального давления в остром периоде инфаркта миокарда. Электронный ресурс https://thrombolysis.org.ua/education/articles/abp-monitoring-ami.
- Александрия Л.Г., Терещенко С.Н., Кобалава Ж.Д., Моисеев В.С. Особенности суточного профиля артериального давления у больных острым инфарктом миокарда с дисфункцией левого желудочка // Кардиология. 2000. № 1. С. 21–23.
- Сіренко Ю. М. Артеріальна гіпертензія. К.: МОРІОН, 2002. 204 с.
- Cohen M.C., Rohtla K.M., Lavery C.E., Muller J.E., Mittleman M.A. Meta-analysis of the morning excess of acute myocardial infarction and sudden cardiac death // Am J Cardiol. 1997 Jun 1. Vol. 79 (11). Р. 1512–1526.
- Willich S.N., Linderer T., Wegscheider K. et al. Increased morning incidence of myocardial infarction in the ISAM Study: absence with prior beta-adrenergic blockade. ISAM Study Group // Circulation. 1989. Vol. 80 (4). Р. 853–858.
- Tofler G.H., Muller J.E., Stone P.H. et al. Modifiers of timing and possible triggers of acute myocardial infarction in the Thrombolysis in Myocardial Infarction Phase II (TIMI II) Study Group // J Am Coll Сardiol. 1992. Vol. 20 (5). Р. 1049–1055.
- Portaluppi F., Tiseo R., Smolensky M.H., Hermida R.C., Ayala D.E., Fabbian F. Circadian rhythms and cardiovascular health // Sleep Med Rev. 2011 Jun 3.
- Tanaka A. et al. Circadian variation of plaque rupture in acute myocardial infarction // Am J Cardiol. 2004. Vol. 93. Р. 1−5.
- Kario K., Matsuo T., Kobayashi H. et al. Nocturnal fall of blood pressure and silent cerebrovascular damage in elderly hypertensive patients. Advanced silent cerebrovascular damage in extreme dippers // Hypertension. 1996. Vol. 27. Р. 130–135.
- Goldstein I.B., Bartzokis G., Hance D.B. et al. Relationship between blood pressure and subcortical lesions in healthy elderly people // Stroke. 1998. Vol. 29. Р. 765–772.
- Sierra C., de la Sierra A., Mercader J. et al. Silent cerebral white matter lesions in middle¬aged essential hypertensive patients // J Hypertens. 2002. Vol. 20. Р. 519–524.
- Elliott W.J. Circadian variation in the timing of stroke onset: a meta-analysis // Stroke. 1998 May. Vol. 29 (5). Р. 992–996.
- Kario K., Shimada K., Pickering T.G. Clinical implication of morning blood pressure surge in hypertension // J Cardiovasc Pharmacol. 2003 Dec. Vol. 42. Suppl 1. Р. 87–91.
- Redón J., Roca-Cusachs A., Mora-Maciá J. Uncontrolled early morning blood pressure in medicated patients: the ACAMPA study. Analysis of the Control of Blood Pressure using Abulatory Blood Pressure Monitoring // Blood Press Monit. 2002 Apr. Vol. 7 (2). Р. 111–116.
- Kario K., Ishikawa J., Pickering T.G., Hoshide S., Eguchi K., Morinari M., HoshideY., Kuroda T., Shimada K.Morning hypertension: the strongest independent risk factor for stroke in elderly hypertensive patients // Hypertens Res. 2006 Aug. Vol. 29 (8). Р. 581–587.
Гипотензивная терапия: общие правила
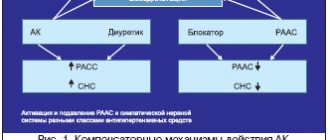
Как симптоматическая гипертония, так и гипертоническая болезнь требует коррекции с помощью препаратов, обладающих гипотензивным действием. Гипотензивная терапия может проводиться лекарственными средствами, отличающимися механизмом действия: антиадренергическими средствами, вазодилаторами, антагонистами кальция, антагонистами ангиотензина, а также диуретиками.
Получить информацию, что такое гипотензивное действие препарата, какие лекарства принимать при повышенном давлении можно не только у лечащего врача, но и у фармацевта.
Артериальная гипертензия является хроническим заболеванием, при котором необходима постоянная лекарственная поддержка, ежедневный контроль и регулярный прием назначенных медикаментов. От соблюдения этих правил зависит не только состояние здоровья, но и жизнь человека.
Несмотря на общедоступность правил терапии для снижения давления, многим больным приходится напоминать, как должна выглядеть схема лечения гипертонии:
- прием гипотензивных препаратов должен быть регулярным, независимо от самочувствия больного и уровня артериального давления. Это позволяет повысить эффективность контроля уровня АД, а также предупредить сердечно-сосудистые осложнения и поражение органов-мишеней;
- необходимо строго соблюдать дозировку и применять ту форму выпуска препарата, которую назначил лечащий врач. Самостоятельное изменение рекомендованной дозы или замена препарата может исказить гипотензивный эффект;
- даже при условии постоянного приема препаратов гипотензивного действия необходимо систематически проводить измерение артериального давления, что позволит оценить эффективность терапии, своевременно выявить те или иные изменения и скорректировать лечение;
- в случае повышения артериального давления на фоне постоянного гипотензивного лечения – развития неосложненного гипертонического криза, дополнительная доза принимаемого ранее препарата длительного действия не рекомендована. Быстро снизить АД можно с помощью короткодействующих гипотензивных средств.
Гипотензивная терапия: препараты для снижения давления
В ходе гипотензивной терапии на сегодняшний день используют несколько основных групп препаратов, способствующих снижению артериального давления:
- бета-адреноблокаторы;
- ингибиторы АПФ;
- антагонисты кальция;
- диуретики;
- блокаторы рецепторов ангиотензина II.
Все вышеперечисленные группы обладают сопоставимой эффективностью и своими особенностями, определяющими их использование в той или иной ситуации.
Бета-адреноблокаторы
Препараты данной группы обеспечивают снижение вероятности развития коронарных осложнений у больных, страдающих стенокардией, предупреждают сердечно-сосудистые катастрофы у пациентов с перенесенным инфарктом миокарда, тахиаритмией, используются у больных, имеющих хроническую сердечную недостаточность. Бета-адреноблокаторы не рекомендуется принимать пациентам с сахарным диабетом, нарушением липидного обмена и метаболическим синдромом.
Ингибиторы АПФ
Ингибиторы ангиотензинпревращающего фермента имеют выраженные гипотензивные свойства, они оказывают органопротективные эффекты: их применение обеспечивает снижение риска возникновения осложнений атеросклероза, уменьшение гипертрофии левого желудочка сердца, замедленное снижение функции почек. Ингибиторы АПФ отличаются хорошей переносимостью, отсутствием негативных воздействий на липидный обмен и уровень глюкозы.
Антагонисты кальция
Помимо гипотензивных свойств, препараты данной группы обладают антиангинальным и органопротекторным действием, способствуют снижению риска развития инсультов, атеросклеротического поражения сонных артерий и гипертрофии левого желудочка. Антагонисты кальция могут использоваться отдельно или в комбинации с другими препаратами, обладающими гипотензивными свойствами.
Диуретики
Препараты мочегонного действия, как правило, применяются на фоне приема других гипотензивных препаратов для того, чтобы усилить терапевтический эффект.
Диуретики назначают также лицам, страдающим такими патологиями, как рефрактерная гипертензия и хроническая сердечная недостаточность. Во избежание развития побочных действий, при постоянном приеме данных препаратов назначаются минимальные дозировки.
Блокаторы рецепторов ангиотензина II
Препараты этой группы, обладающие нейро- и кардиопротекторным эффектом, применяются в целях улучшения контроля показателей глюкозы в крови. Они позволяют увеличить продолжительность жизни больных, страдающих хронической сердечной недостаточностью. Гипотензивная терапия с использованием блокаторов рецепторов ангиотензина II может назначаться пациентам, перенесшим инфаркт миокарда, страдающих почечной недостаточностью, подагрой, метаболическим синдромом и сахарным диабетом.
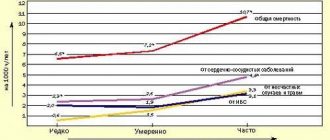
Результаты клинических исследований, в которых оценивалась частота развития определенных клинических исходов, свидетельствуют о том, что стойкое снижение уровня артериального давления (АД) приводит к статистически значимому снижению риска развития ишемической болезни сердца (ИБС) и инсульта [1, 2]. Именно адекватное снижение уровня АД считается одним из необходимых условий эффективной профилактики осложнений сердечно–сосудистых заболеваний (ССЗ). Результаты мета–анализа обсервационных исследований, включавших около 1 млн человек, показали, что снижение систолического АД всего на 2 мм рт. ст. приводит к снижению риска смерти от ИБС и инсульта на 7 и 10 % соответственно [3].
До недавнего времени считалось, что любые антигипертензивные средства, рекомендованные в качестве препаратов первого ряда, одинаково эффективны в плане снижения риска осложнений ССЗ [4, 5]. Первые сомнения в эффективности и безопасности представителей определенных классов антигипертензивных средств появились после получения данных исследования ALLHAT (Antihypertensive and Lipid–Lowering Treatment to Prevent Heart Attack Trial) [6] об увеличении на 25 % комбинированного риска развития нефатального инфаркта миокарда (ИМ) и кардиальной смерти, а также двукратном повышении риска развития сердечной недостаточности при использовании альфа–адреноблокатора доксазозина по сравнению с плацебо. Хотя результаты исследования ALLHAT указывали на одинаковое влияние тиазидного диуретика хлорталидона, антагониста кальция (АК) амлодипина и ингибитора ангиотензинпревращающего фермента (АПФ) на основной комбинированный показатель частоты осложнений ИБС, появились данные о разном влиянии тиазидных диуретиков и ингибиторов АПФ на прогрессирование бессимптомного атеросклероза сонных артерий. Так, против использования монотерапии гидрохлоротиазидом (ГХТ) свидетельствуют недавно опубликованные результаты исследования PHYLLIS (Plaque HYpertension Lipid Lowering Italian Study) [7], в которых показано, что на фоне применения ГХТ происходит статистически значимое прогрессирование атеросклероза сонных артерий, тогда как прием ингибитора АПФ не сопровождается такими изменениями.
В исследовании ALLHAT [6] гипотензивная терапия ингибитором АПФ приводила к статистически значимому снижению частоты развития новых случаев сахарного диабета (СД) по сравнению с тиазидным диуретиком (отношение рисков [ОР] при 95 %–ном доверительном интервале [ДИ] от 0,56 до 0,86).
Приведенные данные показали, что монотерапию тиазидным диуретиком не во всех случаях можно считать оптимальной тактикой гипотензивного лечения. Не удивительно, что в реальной клинической практике тиазидные диуретики применяют в качестве препаратов первого ряда не более 9 % больных [8].
Кроме того, в исследовании ALLHAT на фоне лечения тиазидным антибиотиком была отмечена высокая частота развития гипокалиемии, что требовало применения препаратов калия. В группе хлорталидона гипокалиемия (концентрация калия в плазме крови менее 3,5 мэкв/л) через 2 года отмечалась примерно у 13 % больных, а к 5 году терапии 8 % пациентов были вынуждены принимать препараты калия. Таким образом, возникают сомнения в обоснованности применения диуретиков в качестве препаратов первого ряда, по крайней мере, у части больных артериальной гипертензией (АГ).
Результаты недавно опубликованного в журнале Lancet мета–анализа свидетельствуют о значительно меньшем влиянии бета–адреноблокаторов по сравнению с другими антигипертензивными средствами на частоту развития инсульта при отсутствии преимуществ в плане профилактики ИМ и смертельных исходов [9]. Авторы мета–анализа, на основе полученных данных, высказывают сомнения в обоснованности применения бета–адреноблокаторов в качестве антигипертензивных препаратов первого ряда.
Другой недавний мета–анализ выполнялся с целью сравнить эффективность ингибиторов АПФ и блокаторов рецепторов ангиотензина II в отношении снижения риска развития инсульта, сердечной недостаточности и ИМ [10]. Методика проведения анализа позволяла сравнивать эффективность препаратов этих классов независимо от их гипотензивного действия. Было показано, что ингибиторы АПФ и блокаторы ангиотензиновых рецепторов не различаются статистически значимо по влиянию на частоту развития инсульта и сердечной недостаточности, но на фоне приема ингибиторов АПФ отмечено достоверное снижение риска развития ИМ на 9 %. Прием блокаторов рецепторов ангиотензина II сопровождался тенденцией к увеличению риска развития ИМ (на 7 %). И хотя ретроспективный анализ данных исследования CHARM [11] свидетельствует о снижении риска развития ИМ за счет применения кандесартана у больных сердечной недостаточностью, остаются сомнения в одинаковой эффективности ингибиторов АПФ и блокаторов ангиотензиновых рецепторов при профилактике ИМ.
Таким образом, представленные данные доказательной медицины позволяют предположить, что наиболее приемлемыми антигипертензивными средствами первого ряда, эффективно снижающими риск развития большинства осложнений ССЗ и положительно влияющими на течение атеросклероза, можно считать дигидропиридиновые АК и ингибиторы АПФ.
В 1990–е гг. результаты отдельных обсервационных исследований [5] стали поводом для сомнений в безопасности применения дигидропиридиновых АК. Следует отметить, что, несмотря на широкое использование препаратов этого класса, до 1997 г. отсутствовали большие контролируемые исследования по оценке их эффективности и безопасности [13]. В настоящее время общепризнано, что наиболее точно влияние терапии на частоту развития неблагоприятных клинических исходов можно оценить в ходе рандомизированных клинических испытаний, в которых выполнялось проспективное сравнение эффективности препаратов друг с другом, а в некоторых случаях с плацебо или отсутствием терапии.
Доказательные основы применения амлодипина при лечении АГ
Возможность профилактики инсульта с помощью гипотензивной терапии была доказана еще в самых ранних рандомизированных клинических исследованиях антигипертензивных средств, которые сегодня либо не применяют, либо относят к “старым” [14]. Результаты недавно выполненного мета–анализа [11], в котором сравнивалась эффективность применения антигипертензивных препаратов, относящихся к разным классам, с плацебо или отсутствием лечения, свидетельствуют о высокой эффективности применения АК для профилактики инсульта. Риск возникновения инсульта при использовании бета–адреноблокаторов, ингибиторов АПФ, диуретиков и АК снижался на 29, 31, 34 и 40 % соответственно.
Более высокая эффективность АК по сравнению с ингибиторами АПФ была подтверждена и в ходе другого мета–анализа, выполненного на основании данных 28 клинических исследований, включавших 179 122 больных [16]. При этом было показано, что в целом применение АК или ингибиторов АПФ приводит к снижению риска инсульта на 11 % по сравнению с использованием бета–адреноблокаторов и/или диуретиков либо плацебо (p = 0,005). Прием ингибиторов АПФ по сравнению с плацебо сопровождался снижением риска возникновения инсульта на 16 % (p = 0,02). В то же время применение АК по сравнению с плацебо снижало риск инсульта на 35 % (p = 0,001).
Эффективность применения амлодипина и других дигидропиридиновых АК в значительной степени определяется их гипотензивным действием. Следует отметить, что разница в уровне АД между группами лечения может обусловливать различия в эффективности между группами в нескольких клинических испытаниях [17–19] даже в тех случаях, когда преимущество одной тактики терапии по сравнению с другой первоначально объяснялось специфическим действием препарата, не зависимым от уровня АД [18, 19].
Однако эффективность амлодипина как средства профилактики ССЗ, по–видимому, определяется не только его способностью снижать АД, но и наличием дополнительных свойств. В самом крупном сравнительном клиническом исследовании антигипертензивных препаратов ALLHAT [6] амлодипин сравнивался с наиболее изученным диуретиком хлорталидоном. Несмотря на несколько более выраженное гипотензивное действие хлорталидона по сравнению с амлодипином (разница в уровне систолического АД – 0,8 мм рт. ст.), применение АК сопровождалось тенденцией к снижению риска развития инсульта (на 8 %). Эти данные могут свидетельствовать о большей эффективности АК по сравнению с тиазидными диуретиками в отношении снижения риска развития инсульта у больных АГ.
Полученные результаты представляются очень важными, поскольку в настоящее время именно снижение риска инсульта становится одной из главных целей гипотензивной терапии. В США инсульт стал третьей по частоте причиной смерти и одной из главных причин развития стойкой инвалидности. В России к концу 1990–х гг. смертность от инсульта оказалась на втором месте в структуре общей смертности, уступая лишь ИБС [20].
В последние годы несколько изменилось представление о целях лечения АГ. Это касается в первую очередь необходимости более тщательного контроля уровня АД и его нормализации у большинства больных, а во многих случаях и достижения оптимального уровня, который может быть ниже значений, признанных в настоящее время “нормальными”. Считается, что задачами эффективной гипотензивной терапии могут быть:
- снижение относительного риска развития ССЗ не менее чем на 50 % (соответствует снижению систолического АД примерно на 20 мм рт. ст.);
- достижение общепринятых целевых уровней АД (140/90 мм рт. ст. у большинства больных, 130/80 при СД и заболеваниях почек) [21].
На самом деле, оптимальная величина АД не установлена, хотя считается, что это наименьший уровень АД, при котором обеспечивается нормальное функционирование органов и систем данного организма. Для достижения такого уровня, как правило, необходимо применение более одного антигипертензивного препарата. Обычно прием одного препарата обеспечивает снижение уровня систолического АД примерно на 10 мм рт. ст., поэтому очевидно, что для его снижения на 20 мм рт. ст. требуется сочетанное применение лекарственных средств. Вот почему сегодня правильнее говорить не о преимуществах одного класса антигипертензивных препаратов перед другим, а о преимуществах определенных типов комбинированной гипотензивной терапии.
В свете этих представлений следует обратиться к недавно опубликованным результатам исследования ASCOT–BPLA (Anglo–Scandinavian Cardiac Outcomes Trial – Blood Pressure Lowering Arm) [22], в котором сравнивали эффективность профилактики осложнений ССЗ при тактике антигипертензивной терапии, основанной на применении амлодипина в сочетании с периндоприлом и атенолола в сочетании с бендрофлуметиазидом (БФТ). Оценивалось влияние указанных комбинаций на частоту развития нефатального ИМ и смертность от ИБС. В него были включены 19 257 больных в возрасте от 40 до 79 лет с нелеченой АГ (систолическое АД ≥ 160 мм рт. ст. и/или диастолическое АД ≥ 100 мм рт. ст.) или леченой АГ (систолическое АД ≥ 140 мм рт. ст. и/или диастолическое АД ≥ 90 мм рт. ст.) при наличии не менее 3 таких дополнительных факторов риска, как:
- гипертрофия левого желудочка по данным эхокардиографии или ЭКГ,
- СД типа 2;
- заболевания периферических артерий;
- ранее перенесенный инсульт или преходящее нарушение мозгового кровообращения;
- мужской пол;
- возраст ≥ 55 лет;
- микроальбуминурия или протеинурия;
- курение;
- соотношение общего холестерина и холестерина липопротеидов высокой плотности в крови ≥ 6;
- наличие в семейном анамнезе указаний на случаи преждевременного развития ИБС.
Больных рандомизировали в группы терапии, основанной на применении амлодипина с добавлением периндоприла при необходимости усиления гипотензивного эффекта (группа амлодипина; n = 9639) или атенолола с добавлением тиазидного диуретика БФТ и калия (группа атенолола; n = 9618). Начальная доза амлодипина составляла 5 мг/сут, при необходимости ее увеличивали до 10 мг/сут.
Начальная доза атенолола составляла 50 мг/сут, при необходимости ее увеличивали до 100 мг/сут. Если применение амлодипина и атенолола в таких дозах оказывалось недостаточно эффективным, к амлодипину добавляли периндоприл (4–8 мг/сут), а к атенололу – БФТ (1,25–2,5 мг/сут). Если и при этом не удавалось достигнуть желаемого эффекта, то в обеих группах к терапии добавляли доксазозин (по 4–8 мг/сут в форме гастроинтестинальной транспортной системы).
Исследование было прекращено досрочно, когда различие между группами в отношении первичной комбинированной конечной точки (нефатальный ИМ или коронарная смерть) еще не достигло статистической значимости. Непростое решение о преждевременном завершении исследования было связано с тем, что обнаружилось статистически значимое различие между группами почти по всем дополнительным показателям, включая риск развития инсульта. В группе амлодипина его частота была на 23 % ниже, чем в группе атенолола (ОР 0,77 при 95 % ДИ от 0,66 до 0,89; p = 0,0003). Таким образом, результаты исследования ASCOT– BPLA окончательно подтвердили ранее полученные данные о более высокой эффективности профилактической терапии инсульта, основанной на применении АК, по сравнению с лечением, базирующимся на использовании бета–адреноблокаторов и диуретиков.
Некоторые оппоненты исследования ASCOT–BPLA отмечают, что разница в эффективности двух тактик гипотензивной терапии могла быть в значительной степени обусловлена достижением более низкого уровня АД в группе сочетанного применения амлодипина и периндоприла по сравнению с использованием атенолола и БФТ. S. Yusuf отметил раннее появление различий в уровне АД между группами амлодипина и атенолола [23]. Однако этот эксперт соглашается с авторами исследования в том, что различием в уровне АД можно лишь отчасти объяснить разницу в частоте развития изучаемых клинических исходов. Данные многих клинических исследований показывают, что различие между группами амлодипина и атенолола в уровне систолического АД, достигавшее 2,7 мм рт. ст., могло обусловить разницу в частоте развития осложнений ИБС, равную 4–8 %, и в частоте развития инсультов, равную 11–14 %, а по данным обсервационных исследований – 8 и 11 % соответственно [24, 25]. F.H. Messerli отмечает, что для него как для врача не имеет значения, зависит ли бо’льшая эффективность одной тактики лечения по сравнению с другой от выраженности гипотензивного эффекта или от наличия дополнительных свойств применяемых препаратов [26]. По его мнению, ответ на этот вопрос представляет интерес в первую очередь для исследователей и ученых, но не для практических врачей.
Можно отметить и еще один важный результат исследования ASCOT, касающийся профилактики инсульта. Оказалось, что наиболее эффективная профилактика этого осложнения достигается при сочетанном применении АК, ингибитора АПФ и статина. По сравнению с использованием бета–адреноблокатора и диуретика сочетанное применение амлодипина, периндоприла и аторвастатина приводило к снижению относительного риска развития фатального и нефатального инсульта на 44 % [26].
Имеются данные, что по переносимости амлодипин может превосходить другие известные АК. В сравнительном исследовании комплаентности терапии амлодипином и фелодипином у пожилых больных АГ было показано, что через год лечения в группе амлодипина вероятность прекращения терапии оказалась на 21 % ниже, чем в группе фелодипина [27].
Возможные механизмы высокой эффективности амлодипина при лечении АГ
Поскольку существует взаимосвязь между повышенным уровнем АД и риском развития инсульта, один из механизмов, определяющих высокую эффективность АК при профилактике этого осложнения, может состоять в их достаточно выраженном гипотензивном действии. Большее снижение уровня АД на фоне приема АК по сравнению с другими препаратами отмечалось в нескольких рандомизированных клинических исследованиях – например, VALUE (Valsartan Antihypertensive Lon гамма–term Use Evaluation) [28] и ASCOT–BPLA [19]. Такой более выраженный гипотензивный эффект сопровождался в исследовании VALUE отчетливой тенденцией к снижению на 15 % частоты развития инсульта в группе амлодипина по сравнению с группой валсартана (p = 0,08). В исследованиях ASCOT–BPLA [19] и FEVER (Felodipine EVent Reduction) [29, 30] даже небольшая разница в уровне АД между группой АК и контрольной группой сопровождалась статистически значимым снижением риска развития инсульта.
И все–таки, почему же в исследовании ASCOT–BPLA столь небольшая разница в уровне систолического АД – 2,7 мм рт. ст. – между группами амлодипина и атенолола сопровождалась столь значительными различиями в частоте развития инсульта? Отчасти ответ на этот вопрос был получен в исследовании CAFE (Conduit Artery Function Evaluation) [31], которое планировалась как часть основного исследования ASCOT. В CAFE, включавшем более 2000 участников основного исследования ASCOT, оценивали влияние 2 тактик гипотензивной терапии на уровень центрального давления в аорте, которое определялось с помощью специальной неинвазивной методики с использованием системы Sphygmocor (AtCor Medical), одобренной FDA США.
После измерения давления в лучевой артерии компьютерная система генерировала пульсовую волну, оценка которой позволяла измерять давление в крупных артериях. При этом оказалось, что при почти одинаковом уровне АД, измеренном в плечевой артерии, центральное систолическое АД оказалось на 4,3 мм рт. ст., а центральное пульсовое давление в аорте на 3,0 мм рт. ст. ниже при тактике лечения, основанной на приеме амлодипина, по сравнению с тактикой, основанной на использовании атенолола.
Результаты исследования CAFE свидетельствуют о том, что при одинаковых результатах измерения АД на руке давление в центральных артериях может существенно различаться при использовании гипотензивных препаратов, которые по–разному влияют на так называемые отраженные волны. В частности, амлодипин за счет активного сосудорасширяющего действия эффективнее уменьшает выраженность отраженных волн по сравнению с бета–адреноблокаторами и диуретиками. На фоне применения препарата с вазодилатирующим эффектом происходит ослабление мощности отраженных волн, что сопровождается снижением центрального АД. Авторы исследования CAFE предполагают, что статистически значимое различие в клинической эффективности амлодипина и атенолола, наблюдавшееся в исследовании ASCOT, во многом можно объяснить их разным влиянием на давление в центральных артериях.
Положительное влияние длительно действующих АК на риск развития инсульта может быть отчасти обусловлено их эффектом по предупреждению повышения АД в утренние часы. Имеются убедительные данные о наличии связи между утренним повышением АД и риском развития инсульта [32]. При повышении АД в утренние часы и при его отсутствии частота развития инсульта в течение 3,5 лет составляла 19,0 и 7,3 % соответственно (p = 0,004). Утреннее повышение систолического АД на 10 мм рт. ст. сопровождается увеличением риска развития инсульта на 22–25 % [32, 33]. В сравнительном исследовании амлодипина и валсартана было показано, что применение АК позволяет статистически значимо снизить уровень систолического АД в утренние часы по сравнению с блокатором рецепторов ангиотензина II (p < 0,02) [34].
Результаты клинического исследования, включавшего 106 больных с мягкой и умеренной АГ, свидетельствуют о том, что сочетанное применение небольшой дозы амлодипина (5 мг/сут) и средней терапевтической дозы ингибитора АПФ приводит к более выраженному увеличению растяжимости артерий по сравнению с использованием максимальных терапевтических доз препаратов [35]. При применении сочетанной терапии, максимальных доз амлодипина и ингибитора АПФ растяжимость увеличивалась на 0,71 ± 0,51, 0,28 ± 0,69 и 0,39 ± 0,62 % мл/мм рт. ст. Применение комбинированной терапии приводило также к статистически более выраженному регрессу гипертрофии миокарда левого желудочка по сравнению с монотерапией каждым из препаратов (p < 0,02). Эти данные могут быть основанием для более широкого применения комбинированных препаратов, содержащих амлодипин и ингибитор АПФ.
Эффективность и безопасность применения дигидропридиновых АК для профилактики инсульта у больных СД
В 1999 г. в журнале New England Journal Medicine был опубликован обзор, в котором отмечалось, что “применение АК при СД может приводить к увеличению риска развития ССЗ” [36]. Такое мнение было основано на анализе ограниченных данных, полученных в ходе выполнения клинических исследований [37, 38]. Результаты мета–анализа рандомизированных клинических исследований, которые были опубликованы в 2004 г., полностью опровергли вышеуказанное утверждение [39]. Было показано, что применение АК у больных СД приводило к статистически значимому снижению общей смертности и частоты развития всех неблагоприятных клинических исходов, связанных с заболеванием сердца, а также инсульта по сравнению с плацебо.
У больных СД применение АК оказывало сходное со стандартной терапией влияние на риск развития ИБС и общую смертность, вызывая при этом небольшое снижение риска развития инсульта (ОР = 0,87; p = 0,08) [39]. Таким образом, применение АК у больных СД оказалось эффективным и безопасным методом профилактики большинства осложнений ССЗ и смерти от них. Однако применение АК не способствовало снижению риска развития сердечной недостаточности, особенно по сравнению со средствами, подавляющими активность ренин–ангиотензиновой системы, хотя препараты этих классов одинаково влияли на общую смертность и частоту развития инсульта или ИБС. Следует, правда, учитывать, что диагноз “сердечная недостаточность” на фоне применения АК может устанавливаться ошибочно и являться следствием небольшой задержки жидкости.
Известно также, что у больных СД монотерапия недигидропиридиновыми АК более эффективно снижает выраженность протеинурии, чем монотерапия дигидропиридиновыми препаратами этого класса. Однако при сочетанном использовании АК и ингибиторов АПФ такое различие, по мнению F.H. Messerli [26], может становиться клинически незначимым.
Таким образом, результаты недавно завершенных клинических исследований свидетельствуют о том, что амлодипин как за счет достаточно мощного гипотензивного действия, так и в связи с вероятным наличием дополнительных свойств, становится одним из основных препаратов для лечения ССЗ, поскольку его применение позволяет не только ослабить симптомы заболевания, но и снизить во многих случаях риск развития таких тяжелых осложнений ССЗ, как ИМ, инсульт и преждевременная смерть.
Доказательные основы выбора лекарственных средств для комбинированной гипотензивной терапии
Теоретическим основанием для сочетанного применения дигидропиридиновых АК и ингибиторов АПФ могут служить данные рандомизированных клинических исследований, результаты которых свидетельствуют о более высокой эффективности начальной терапии препаратами этих двух классов по сравнению с монотерапией каждым из них [40].
Обоснованность использования ингибиторов АПФ в составе комбинированных гипотензивных препаратов определяется тем обстоятельством, что их применение не только приводит к снижению АД, но и позволяет достичь других целей терапии, включая регресс гипертрофии левого желудочка [41]. Являясь важным показателем поражения органов–мишеней, масса миокарда левого желудочка считается наиболее информативным прогностическим фактором развития неблагоприятных клинических исходов у больных АГ. По данным сравнительного анализа эффективности диуретиков, АК, бета–адреноблокаторов и ингибиторов АПФ, последние вызывают наибольший регресс гипертрофии [42, 43]. Ингибиторы АПФ оказывают и нефропротективное действие [44]. Для некоторых ингибиторов АПФ, в частности для лизиноприла, доказана способность уменьшать не только выраженность гипертрофии левого желудочка, но и фиброза миокарда, что сопровождается улучшением диастолической функции сердца [45].
Сочетанное применение дигидропиридинового АК и ингибитора АПФ можно рассматривать как эффективную тактику лечения больных с изолированной систолической АГ, поскольку в этом случае обеспечивается более выраженное снижение систолического АД, чем при монотерапии этими препаратами [46]. Для окончательного суждения о перспективности сочетанного применения амлодипина и ингибитора АПФ для лечения изолированной систолической АГ в настоящее время проводится крупное клиническое исследование Avoiding Cardiovascular events through COMbination therapy in Patients LIving with Systolic Hypertension (ACCOMPLISH) [47], в которое планируется включить более 6000 больных АГ.
Возникновение периферических отеков считается частым осложнением дигидропиридиновых АК [48] и нередко становится причиной отказа от продолжения терапии. Возникновение таких отеков обусловлено выраженным расширением просвета артериол при сохранении неизменным диаметра просвета венул. При этом недостаточный отток крови из периферических тканей вызывает образование отеков. Дополнительное использование диуретиков при этих отеках может быть малоэффективным. Сочетанное применение амлодипина и ингибитора АПФ по сравнению с терапией одним АК позволяет почти в 2 раза снизить частоту развития отеков за счет венодилатирующего действия ингибиторов АПФ [48].
Доказательные основы использования лизиноприла в составе комбинированной терапии
Выбор любого препарата для лечения и профилактики ССЗ во многом зависит от наличия доказательств эффективности его применения хотя бы при одном из этих заболеваний. Данные об эффективности использования даже небольших доз лизиноприла при лечении сердечной недостаточности были получены в крупном клиническом исследовании ATLAS (Assessment of Treatment with Lisinopril And Survival) [49]. При этом была отмечена безопасность применения высоких доз лизиноприла [50], что особенно важно для больных АГ, у которых для достижения необходимого гипотензивного эффекта может потребоваться увеличение дозы ингибитора АПФ. Результаты вторичного анализа данных 3164 участников исследования ATLAS, имевших высокий риск развития осложнений ССЗ (включая больных СД), подтвердили безопасность применения высоких доз лизиноприла [51].
Еще одним обоснованием для широкого применения лизиноприла при лечении АГ, особенно у больных с метаболическим синдромом, являются данные исследования ALLHAT, свидетельствующие о том, что прием этого препарата приводил к снижению риска развития новых случаев СД на 32 % по сравнению с использованием хлорталидона (ОР 0,68 при 95 % ДИ от 0,50 до 0,80; p = 0,01). При этом лизиноприл при профилактике развития СД оказался эффективнее амлодипина, лечение которым приводило к снижению риска развития СД только на 21 % [6].
Эффективность лизиноприла при АГ была доказана в нескольких рандомизированных клинических испытаниях. По данным многоцентрового плацебо–контролируемого исследования TROPHY (Treatment in Obese Patients With Hypertension), монотерапия лизиноприлом не уступала монотерапии ГХТ по эффективности снижения АД у больных АГ на фоне ожирения [52]. Однако следует отметить, что у 57 % больных в группе лизиноприла эффективной оказалась начальная доза препарата (10 мг/сут), в то время как в группе ГХТ половине пациентов потребовалось увеличить дозу препарата до максимальной (50 мг/сут).
Высокая эффективность сочетанного применения лизиноприла и амлодипина была подтверждена в небольшом проспективном исследовании, включавшем 98 больных АГ [53]. Комбинированное применение этих препаратов приводило к выраженному снижению систолического (со 197,7 ± 18,1 до 139,9 ± 10,5 мм рт. ст.) и диастолического АД (со 107,1 ± 13,1 до 82,6 ± 5,5 мм рт. ст.). Отмечена хорошая переносимость лечения – терапия была отменена лишь у 3 больных из–за развития отеков ног и сухого кашля.
В последнее время при оценке эффективности антигипертензивных препаратов все чаще ориентируются на так называемые суррогатные критерии оценки. Результаты небольшого исследования свидетельствуют о том, что применение лизиноприла у больных пожилого возраста с систолической АГ приводило к выраженному гипотензивному эффекту, повышению скорости кровотока по мозговым сосудам и увеличению растяжимости сонных артерий, но не вызывает гипоперфузии головного мозга [54]. При этом отмечалось снижение сосудистого сопротивления без нарушения ауторегуляции мозгового кровообращения.
Результаты исследования ELVERA (Effects of amlodipine and lisinopril on Left Ventricular mass) [55], включавшего больных в возрасте 60–75 лет с впервые выявленной АГ, свидетельствуют о статистически значимом уменьшении суммарной толщины интимы и медии сонных артерии на фоне приема лизиноприла (на 0,065 мм) и амлодипина (на 0,089 мм). Эти данные указывают на антиатеросклеротическое действие препаратов.
Микроальбуминурия считается одним из основных факторов риска развития осложнений ССЗ, а ее уменьшение сопровождается снижением частоты развития неблагоприятных клинических исходов. Данные, полученные в исследовании EUCLID (EURODIAB Controlled Trial of Lisinopril in Insulin–Dependent Diabetes Mellitus) [56], указывают на эффективность применения лизиноприла для замедления прогрессирования нарушений функции почек у больных СД типа 1 при наличии микроальбуминурии. При этом терапия лизиноприлом не приводила к увеличению риска развития гипогликемии.
Таким образом, согласно современным представлениям, оптимальная тактика комбинированной гипотензивной терапии у многих больных включает сочетанное применение длительно действующего дигидропиридинового АК, например амлодипина, и одного из ингибиторов АПФ с доказанной эффективностью, к числу которых относится лизиноприл.