12 Октября 2021
2033
Федеральная сеть аптек «Омнифарм» предлагает широкий ассортимент лекарственных метаболических средств. Современные препараты для улучшения метаболизма можно заказатьв Москве и других регионах. Получить необходимые лекарства можно в ближайшей аптеке с учетом геолокации нашей сети. Она включает 20 аптек, предлагающих удобный сервис и справочную систему, работающую по всей России.
На сайте можно найти необходимые препараты для улучшения метаболизма, предназначенные для ускорения обмена веществ. Поиск можно проводить по названию, основному компоненту или производителю. Ко всем лекарственным средствам по запросу покупателя вместе с чеком предоставляется сертификат.
Виды нарушений обмена веществ, какие нужны лекарства
Среди главных факторов, вызывающих нарушения обмена веществ в организме, можно выделить недостаточную физическую активность, несбалансированное питание, гормональную предрасположенность. Также влияют на метаболизм человека разные острые и хронические болезни. Метаболики — препараты, корректирующие обмен веществ и жизненной энергии в организме, помогают ускорить метаболизм.
Виды нарушений в усвояемости и переработке элементов происходят в основных категориях:
- белкового обмена;
- углеводного;
- жирового обмена;
- витаминов и минералов;
- водно-минерального;
- кислотно-щелочного;
- гормонального баланса.
Правильный обмен веществ и комплексное похудение обеспечивают разные жиросжигающие, общеукрепляющие, иммуностимулирующие средства. Назначаемые врачом препараты для улучшения метаболизма будут отличаться в каждом из этих случаев. Они предназначены для регулирования обменных процессов, происходящих в организме.
- Восстанавливают функциональность на уровне клеток и устраняют сбои в обмене веществ.
- Приводят в нормальное состояние процессы переработки полезных компонентов, поступающих с пищей.
- Восстанавливают сложные биохимические реакции, происходящие в организме человека.
- Налаживают выработку необходимой энергии для нормальной жизнедеятельности.
Одного лекарства от всех нарушений обмена веществ в организме не существует. В медицинской практике применяются разные виды препаратов для нормализации расщепления и переработки жиров, усвоения белков, углеводов, минералов, витаминов, правильного баланса гормонов.
Современный взгляд на роль метаболической терапии в лечении заболеваний сердечно-сосудистой системы
Стенограмма лекции
Всероссийского Интернет Конгресса специалистов по Внутренним Болезням
00:00
Владимир Трофимович Ивашкин, академик РАМН, доктор медицинских наук:
– Следующее сообщение у нас. Профессор Александр Анатольевич Симаков.
«Современный взгляд на роль метаболической терапии в лечении заболеваний сердечнососудистой системы».
Пожалуйста, Александр Анатольевич.
(Демонстрация слайда).
Александр Анатольевич Симаков, профессор, доктор медицинских наук:
– Спасибо Владимир Трофимович.
(Демонстрация слайда).
Я хочу начать с того, что все мы работаем в клиниках и у всех нас есть свои пациенты. А самое главное, у всех нас есть свои студенты и аспиранты, с которыми мы работаем, из которых мы растим свою смену. Когда к нам поступает больной в клинику, молодой врач все время обращается к своему наставнику, как правило, с двумя вопросами: что в данном случае говорят клинические рекомендации об этом заболевании, и как нам лучше лечить больного.
Первый вопрос отражает приложение рандомизированных клинических исследований к реальной практике. А второй подразумевает конкретного больного с индивидуальными физическими, психическими, социальными и какими-то другими особенностями пациента. А также, самое главное, субъективное мнение специалистов. Хотя в медицине подразумевается смесь этих представлений, они, на самом деле, диаметрально противоположны друг другу.
(Демонстрация слайда).
Я бы даже назвал (вы знаете, Владимир Трофимович, Оксана Михайловна) не столько «Роль метаболической терапии», сколько «Что такое медицина вообще» с позиции взаимоотношений. Это наука, искусство или определенные правила, рекомендации.
01:22
(Демонстрация слайда).
Большинство клинических рекомендаций позволяют нам оптимизировать лечение и стандартизировать исходы. Совершенно нельзя недооценивать клиническое мнение врача. Субъективное исследование протокола и (неразборчиво, 01:40) врача способно дать иногда лучшее знание по протоколу.
Есть, хочу сказать, такой пример BARI. Оно не очень хорошо известно, это исследование, в России. Это исследование, когда через 7 лет лечения смертность больных сахарных диабетом, которым выполнялось чрескожное ангиопластическое КШ. Она включалась в различные рекомендации. При этом смертность в чрескожной ангиопластике была больше, чем в АКШ, хотя в регистре этого исследования BARI она как раз была меньше. Такая ситуация происходила с клиническими исследованиями.
Кроме того, эта приверженность к лечению является отражения взаимосвязи пациент – доктор, эффект – плацебо, предпочтением самого больного. Кстати, это очень хорошо иллюстрируется альтернативной медициной. Например, гомеопатической, где именно эти ингредиенты выступают в качестве основных факторов.
(Демонстрация слайда).
Я к чем еще раз хочу в начале. Именно клинические исследования являются основой для многих врачей и многих исследователей в качестве лечения больного. Если препарат по тем или иным соображениям не входит, например, в рекомендации или в РКИ, врачи его не назначают. Именно рекомендации, стандарты, протоколы являются основной для неназначения этого препарата.
Но хорошо известно, что система здравоохранения и клиническая практика значимо отличается в различных странах. Все это влияет на исходы рандомизированных исследований (исследования ECST). С позиции безопасности: в рандомизированных исследованиях должны учитываться только опытные специалисты (работать), а в реальной практике это происходит далеко не всегда, к сожалению.
(Демонстрация слайда).
Другой проблемой является отбор пациентов. Исследование CASE (практически классика): почти 17 тысяч больных – из них только 780 больных вошло. Это менее 5%. Как следствие строгого включения/исключения, большинство больных остается за бортом клинических исследований – полученные результаты для них не применимы.
Согласно данным национальных институтов здоровья, средняя частота исключений в РКИ 73%. Я иногда думаю, когда читаю эти исследования, где они таких больных вообще в исследование набрали. Пациенты включенные отличаются от остальных по полу, возрасту, национальности, тяжести заболевания, социальному классу и, в последующем, по особенностям исхода этого заболевания.
04:08
(Демонстрация слайда).
Особенным периодом является вводный период рандомизации, необходимый для отбора пациентов, которые удовлетворяют требованиям протокола. В случае вводного периода с активным лечением, больные с побочными эффектами и неэффективностью терапии не включаются в основную часть. Так при применении карведилола (Carvedilol) 6 – 9% по тем или иным причинам были исключены из исследования.
(Демонстрация слайда).
Иногда дальнейшее участие продолжают лишь пациенты с хорошим ответом на лечение. Все это уменьшает резкую валидность полученных результатов.
Есть такие рекомендации CONSORT. Это унифицированные требования: когда вы публикуете в биомедизданиях, обязательно указывайте все критерии исключения.
(Демонстрация слайда).
Вот такие данные я нашел в Национальной библиотеке в Вашингтоне. Национальный институт здоровья эти требования выполняет лишь в 63% случаев при опубликовании рандомизированных клинических исследований и в 19% клинических рекомендаций.
(Демонстрация слайда).
То же самое прослеживается в отношении отчетов о нежелательных явлениях или измененных лабораторных показателях, особенно если спонсором является фирма-производитель. О побочных свойствах из 192-х отчетов РКИ лишь в трети даны сведения о частоте нежелательных явлениях и изменении показателей лабораторных.
(Демонстрация слайда).
Сложности имеются и при использовании в качестве лечения суррогатных и комбинированных точек. В реальной клинической практике не всегда применимы результаты, которые в РКИ получаются.
05:40
(Демонстрация слайда).
Суррогатные точки не считаются корректной конечной точкой. Только такие жесткие, как например смертность, частота инфаркта, инсульта, можно рассматривать с позиции значимости. А для пациента как раз могут быть интересны другие показатели. Для них интересны качество жизни, эмоциональный комфорт, общий тонус, когнитивные функции. Может быть, он и проживет не так много, как по другим исследованиям, но именно качество жизни для него чрезвычайно важно. Например, у больного с развитием деменции не является продолжительность жизни адекватным эффектом для пациента.
(Демонстрация слайда).
По всем выше перечисленным причинам данные из реальной практики (полученные в регистрах) часто более применимы в повседневной работе. Известно, что РКИ не учитывает формирование терапевтической связи врач – больной, предпочтений своего пациента. В них также нельзя исключить непредумышленной ошибки, например, при корректировке факторов.
(Демонстрация слайда).
Не смотря на то, что рандомизированные клинические исследования являются основной для определения эффективности лечения, мы должны всегда помнить о низкой внешней валидности полученных данных. Это происходит в рекомендациях, где происходит прямое экстраполирование данных РКИ на широкую популяцию. Если более 70% были исключены в процессе отбора, то полученные результаты нельзя использовать без коррекции на индивидуальные особенности пациента. Причем наилучшая стратегия требует модификации клинических рекомендаций.
(Демонстрация слайда).
Надо заметить, что термин «доказательная медицина» в последнее время значительно трансформировался. Если вы посмотрите первоначальное определение Sacket, «доказательная медицина» – это сознательное, точное, разумное использование наиболее доказанных методов для принятия решения о стратегии лечения больного.
(Демонстрация слайда).
Даже если молодой специалист спросит своего опытного коллегу, что говорят рекомендации, он всегда будет делать скидку на конкретного пациента. Все это делает возможным сделать такой вывод: медицина – это не простое следование рекомендациям.
Свет как физическая структура может (в зависимости от необходимости, методики) быть описан с двух позиций: корпускулярной и волновой. Это хороший пример комплементарности.
07:53
(Демонстрация слайда).
Под термином «комплементарность» понимается вообще в науке, в искусстве понятие двух противоположностей, связанных между собой. Романтизм в годы Возрождения появился вследствие неприятия научного рационализма не только в литературе, но и в науке.
(Демонстрация слайда).
В широком понимании это свелось к единству и борьбе двух противоположностей: день и ночь, рационализм и иррационализм, общее и индивидуальное.
(Демонстрация слайда).
Медицину мы часто относим к естественным наукам, однако каждый пациент обладает своими уникальными характеристиками. Комплементарный подход в медицине подразумевает индивидуальный подход к страдающему человеку. С этой точки зрения, медицина является не только наукой, но и искусством. С этой точки зрения, мы совершенно логично должны использовать не только те препараты, которые входят в рекомендации, учитывая их достаточно большое количество недостатков, но и конкретного больного.
С этой позиции я хотел бы продолжить тему того, чем мы 20 лет занимаемся в своей клинике – это так называемая метаболическая терапия. Если мы посмотрим рекомендации европейцев – они там присутствуют, в 2006-м году стабильная стенокардия, модулятор энергии присутствует, но только при стабильной стенокардии.
Когда говоришь о цитопротекторах, очень многие говорят: «В рекомендациях их нет, и применять их мы не будем». Мешанина у врачей в голове: что такое цитопротектор и метаболические препараты. Часто говорят: «Что-то в сердечной мышце такое происходит. Что там происходит – понять невозможно».
09:25
(Демонстрация слайда).
Я следующий слайд так и обозначил: цитопротекторы – это недооцененные возможности. Да, только при стабильной стенокардии модулятор энергии рекомендуется в европейских рекомендациях. Но когда я готовил лекцию, я все-таки пытался понять, что мы относим к цитопротекторам. Три позиции должны им соответствовать: клеточный метаболизм, ионный гомеостаз и влиять на структуру и функцию мембран клеток.
Если у препарата есть доказанный экспериментальный клинический эффект, его можно относить к цитопротекторам. Все остальное за пределами этого понятия. Я для себя как врач знаю только три таких препарата: это ранолазин, который был удален с рынка за счет влияния какого-то (неразборчиво, 10:04), триметазидин (Trimetazidine) и тот препарат, с которым мы более 20-ти лет работаем – фосфогенный креатин или «Неотон».
(Демонстрация слайда).
Эта продукция энергии, указанная в верхней части, в норме. Она вырабатывается за счет глюкозы и свободных жирных кислот. Бета-окисление, 60 – 80% дает АТФ, но много кислорода требует. Глюкоза. Если недостаток кислорода, то на уровне первого акта все заканчивается, и происходит изменение ph клетки.
(Демонстрация слайда).
Фосфогенный креатин – это препарат, который очень долго изучался. Надо отметить, что именно российские ученые (академик Сакс, профессор Рудай, Шахов) в Москве и разработали в свое время этот препарат. Он, к сожалению, от нас ушел в Италию, но скоро, насколько я понимаю, патент вернется к нам. Это препарат, который удовлетворяет всем трем позициям: он на клеточную мембрану влияет, он изменяет энергетический пул и изменяет ph клетки в плане убирания ацидоза.
(Демонстрация слайда).
Это четыре слайда, они говорят о том, как воздействует фосфогенный креатин или «Неотон» по выработки энергии.
(Демонстрация слайда).
Подробно не буду останавливаться – это больше биохимические. Это реакция Лохмана.
(Демонстрация слайда).
Это схема креативного пути. На таком красивом слайде показано, куда источник быстрой энергии (к каким точкам) прилагается. Здесь словами мы изложили это. Цитоплазматическая мембрана. Митохондрии заряжаются. На действие ионов и миофибриллы. Вот куда требуется энергия кардиомиоцита на сокращение.
11:45
(Демонстрация слайда).
Здесь разложено потребление энергии кардиомиоцитами: 80% на сокращение, на возбудимость 10 – 15% и 5 – 10% на прохождение АТФ каналов.
(Демонстрация слайда).
При сердечной недостаточности, особенно при длительном течении, при ХСН в частности, нарушается процесс переноса и утилизации АТФ в кардиомиоцитах. Снижается уровень фосфогенного креатинина на 70% уже на ранних стадиях. Хроническое течение сердечной недостаточности приводит к истощению энергетических ресурсов.
(Демонстрация слайда).
Вот такие показатели по Нью-Йоркской классификации. Неслучайно хроническую сердечную недостаточность (ХСН) считают эпидемией, от нее больше, чем от онкологии, умирает больных. Лечение этой ситуации является актуальной темой.
(Демонстрация слайда).
Вот соотношение фосфокреатина у больных с ХСН в течение трех лет показал, что при сохранении ресурсов увеличивается выживаемость этих больных.
(Демонстрация слайда).
Механизмы необратимого повреждения кардиомиоцитов изложены на этом слайде. Это продукция метаболизма, это изменение структурной мембраны, разрушение клеточной мембраны и массированный вход туда различных кальциев.
(Демонстрация слайда).
Все это приводит к необратимому понижению клеток.
(Демонстрация слайда).
Механизм защитного действия многогранен.
(Демонстрация слайда).
Он включает эти четыре позиции, мембраны защищает, чем-то напоминает антиагрегационный препарат – агрегацию дает внутрь клетки и ингибирует нуклеотиды, которые дают выработку энергии.
13:20
(Демонстрация слайда).
Этот препарат отражается на всех трех звеньях, о которых мы сказали:
— клеточная мембрана (вот она здесь изложена);
(Демонстрация слайда).
— стабилизация происходит при взаимодействии зарядов молекулы-цвиттериона;
(Демонстрация слайда).
— фосфолипаза задействована.
(Демонстрация слайда).
Клинические проявления у больных с инфарктом миокарда: нарушение ритма сердца уменьшается именно за счет мембраны клетки. Он не является антиритмическим препаратом, но, стабилизируя мембрану, он не дает возникать аритмии.
(Демонстрация слайда).
Сократительные функции сердца в эксперименте и в клинике (Грациоли проводил исследование в 1992-м году, и оно полностью удовлетворило доказательную медицину).
(Демонстрация слайда).
Добавление «Неотона» или экзогенных фосфокреатинов к сердечной недостаточности уменьшало ее класс по Нью-Йоркской классификации.
(Демонстрация слайда).
Желудочковая аритмия сердечной недостаточности по этой же причине.
(Демонстрация слайда).
Вот отдельные группы, которые мы много изучали – это острые формы, метаболические препараты, цитопротекторы. Это инфаркт миокарда в частности.
(Демонстрация слайда).
Туда, куда добавлялись к кардиоционной смене фосфогенный креатин («Неотон»), и размеры инфаркта миокарда уменьшались, и его масса (есть соответствующие расчеты по грамм-эквиваленту).
(Демонстрация слайда).
Динамика тропонинов быстрее происходила, время нормализации других кардиоспецифических ферментов при использовании «Неотона» в разных схемах. Причем это дозозависимый препарат.
(Демонстрация слайда).
По той же самой причине происходило уменьшение желудочковых тахикардий. Вот почему очень хороший эффект, Владимир Трофимович, у нас получался при постреперфузионных аритмиях. У меня вышло почти 15 кандидатских и докторских диссертаций, где в качестве основного препарата мы использовали фосфогенный креатин или «Неотон».
В заключении я хочу сказать, что если в европейские рекомендации модулятор энергии входит только при хронических формах, при стабильной стенокардии, то по нашим исследованиям они должны использоваться и в острых формах ишемической болезни. При инфаркте миокарда, нестабильной стенокардии, при проведении тромболизиса. Есть очень интересные работы у кардиохирургов об использовании этого препарата в качестве плегических растворов.
Вот то, что я хотел сказать за то время, которое вы мне отвели. Спасибо большое за внимание.
Владимир Ивашкин: Спасибо большое.
15:45
Препараты при нарушении жирового обмена веществ
Нарушение липидного метаболизма происходит вследствие сбоев в усвоении и расщеплении липидов (жиров) с образованием накопления и появления лишнего веса либо активной переработки и истощения. Это напрямую отражается на заболеваемости человека и возникновения тяжелых патологий органов ЖКТ, сосудов. Лекарственные препараты для улучшения метаболизма жиров включают разные средства:
- Ферменты;
- Метаболики;
- Антиоксиданты;
- Фибраты;
- Статины (снижающие холестерин);
- Комбинированные корректоры метаболизма.
Витамины при нарушенном липидном обмене веществ включают Рыбий жир, Никотиновую кислоту, витамин Е (ретинола ацетат или пальмитат).
Метаболический синдром — симптомы и лечение
Лечение метаболического синдрома следует разделить на немедикаментозное и медикаментозное.
Немедикаментозное лечение синдрома Reaven — это ведение здорового образа жизни, отказ от курения и злоупотребления алкоголем, оптимальная двигательная активность[14], рациональное питание, а также разумное использование природных и преформированных физических лечебных факторов (массаж, подводный душ-массаж, гипокситерапия и гиперкапния, водолечение, талассотерапия, бальнео- и термотерапия, внутренний прём минеральных вод, общие магнитотерапевтические воздействия)[15], психотерапевтических методик и обучающих программ.[13]
Медикаментозное лечение метаболического синдрома, в зависимости от наличия тех или иных его компонентов, может включать гиполипидемические, антигипертензивные препараты, медикаменты для снижения инсулинорезистентности, постпрандиальной гипергликемии и веса.
Основными препаратами, которые используют при лечении артериальной гипертензии у больных синдромом Reaven и сахарным диабетом, являются ингибиторы ангиотензинпревращающего фермента, сартаны и агонисты имидазолиновых рецепторов. Однако для достижения целевого уровня артериального давления часто необходимо сочетание различных классов медикаментов, таких как пролонгированных блокаторов медленных кальциевых каналов, высокоселективных бета-адреноблокаторов и тиазидоподобных диуретиков (индапамид) в сочетании с медикаментами первой линии.[10]
Для коррекции нарушений липидного обмена при метаболическом синдроме первоначально используются статины, возможно их сочетание с эзетролом и фибратами. Основной механизм действия статинов — снижение внутриклеточного синтеза ОХ за счёт обратимого блокирования фермента 3-гидрокси-3-метилглютарил-кофермент А редуктазы. Оно ведёт к увеличению количества рецепторов к ХС-ЛПНП на поверхности гепатоцита и снижению концентрации ХС-ЛПНП в крови. Помимо этого, статины имеют плейотропные эффекты, такие как антитромбогенный, противовоспалительный, улучшение функции эндотелия, что приводит к стабилизации атеросклеротической бляшки. Современные статины способны вместе со снижением ХС-ЛПНП до 55% уменьшать триглицериды до 30% и повышать ХС-ЛПВП до 12%. В то же время, ключевое достоинство статинотерапии — снижение сердечно-сосудистых осложнений и общей смертности[1]. Эффективней всего использовать аторвастатин (10-80 мг/сут) или розувастатин (5-40 мг/сут).[11]
При неэффективности монотерапии статинами целесообразно присоединение эзетрола в дозе 10 мг/сут, который препятствует всасыванию ОХ в кишечнике и может усиливать снижение ХС-ЛПНП на 15-20%.
Фибраты — ещё один класс липидснижающих препаратов. Они расщепляют богатые триглицеридами жировые частицы, снижают синтез свободных жирных кислот и повышают ХС-ЛПВП путём увеличения распада ЛНП. Это приводит к значительному уменьшению триглицеридов (до 50%), ХС-ЛПНП (до 20%) и увеличению ХС-ЛПВП (до 30%). Фибраты также имеют плейотропные эффекты: снижают концентрацию мочевой кислоты, фибриногена и улучшают инсулиночувствительность, однако их положительное влияние на прогноз пациентов не доказано. Наиболее эффективный и безопасный препарат этой группы — фенофибрат 145 мг/сут.
Для снижения инсулинорезистентности препаратом выбора является метформин, который обладает доказанным положительным эффектом на тканевую инсулинорезистентность через усиление поглощения глюкозы тканями-мишенями. Метформин уменьшает скорость всасывания углеводов в тонкой кишке, оказывает периферическое анорексигенное действие, уменьшает продукцию глюкозы печенью, улучшает транспорт глюкозы внутри клеток. Положительное воздействие метформина (1500-3000 мг/сутки) на конечные точки обусловлено снижением инсулинорезистентности, системными метаболическими эффектами (снижение веса, липидных нарушений, факторов свёртываемости крови и т.д.).[9]
Для снижения постпрандиальной гипергликемии используют акарбозу, которая обратимо блокирует глюкоамилазы, сахарозы и мальтазы в верхнем отделе тонкой кишки. В итоге непереваренные углеводы достигают нижние отделы кишечника, и абсорбция углеводов пролонгируется. Вместе с тем, у акарбозы выявлены дополнительные эффекты. В исследовании STOP-NIDDM (2002 год) у больных метаболическим синдромом, принимающих акарбозу дозировкой 300 мг/сут, продемонстрировано снижение развития сахарного диабета на 36%, новых случаев артериальной гипертензии на 34% и суммарного показателя сердечно-сосудистых событий на 46%[6].
При наличии у пациента с синдромом Reaven сахарного диабета второго типа могут применяться современные классы сахароснижающих препаратов, такие как аналог глюкагоноподобного пептида-1, ингибитор дипептидилпептидазы-4 и ингибитор натрийзависимого переносчика глюкозы второго типа. Представитель последнего класса эмпаглифлозин (Джардинс) в исследовании EMPA-REG OUTCOME (2016 год) снизил сердечно-сосудистую смертность у больных сахарным диабетом второго типа на 36%.
Медикаментозная коррекция морбидного ожирения показана, если немедикаментозное лечение не приводит к снижению массы тела более чем на 5% от исходного. Препараты для лечения ожирения делятся на аноретики центрального действия (сибутрамин), и средства, воздействующие на желудочно-кишечный тракт, например орлистат (Ксеникал).
Препарат для снижения аппетита сибутрамин в меньшей степени воздействует на дофаминовые и холинергические процессы, но уменьшает потребление жиров и углеводов, что приводит к похудению и улучшает жировой и углеводный метаболизм. Артериальное давление и частота сердечных сокращений при этом повышается только на 5%.
Орлистат является ингибитором желудочной и панкреатической липаз, вследствие чего треть пищевых триглицеридов не всасывается и снижается их концентрация в крови, что приводит к уменьшению калоража пищи и веса. Кроме того, снижается артериальное давление, уровень глюкозы и инсулинорезистентности.
В медицинской практике лечение метаболического синдрома зависит от наличия и выраженности его компонентов. В таблице ниже показана тактика подбора терапии при вариантах синдрома Reaven, которые встречаются наиболее часто.
| АО+АГ+НТГ (СД) Умеренный ССР | АО+АГ+ДЛ Высокий ССР | АО+АГ+НТГ (СД)+ДЛ Высокий и очень высокий ССР | ||
| Д/ФН+АГП+ГГП | Д/ФН+АГП+ГЛП | Д/ФН+АГП+ГГП+ГЛП | ||
| Примечание ССР – сердечно-сосудистый риск; АГ – артериальная гипертензия; АО – абдоминальное ожирение; ДЛ – дислипидемия; НТГ – нарушение толерантности к глюкозе; СД – сахарный диабет; Д/ФН – диета/физическая нагрузка; АГП – антигипертензивный препарат; ГГП – гипогликемический препарат; ГЛП – гиполипидемический препарат. | ||||
Обмен витаминов, микро- и макроэлементов
Фармакологические препараты, способствующие улучшению метаболизма витаминов и минералов, назначаются в случае:
- недостатка этих элементов в организме;
- излишнего поступления с пищей;
- сбоев в расщеплении и усвояемости;
- дисбаланса жизненно важных систем.
В результате гиповитаминоза или гипервитаминоза, дефицита микро- и макроэлементов возникает огромнейший спектр тяжелых патологий. Нарушение баланса этих компонентов вызывает болезни, отображается на состоянии волос, кожи, ногтей, напрямую влияет на внешний вид человека.
Так, например, дефицит йода приводит к развитию и прогрессированию заболевания щитовидной железы, дисбалансу тиреоидных гормонов. На фоне гормонального сбоя происходит изменение веса. Также опасен избыток этого микроэлемента в организме, он может вызвать сбои в эндокринной системе. Поэтому препараты рекомендуется применять по назначению врача.
Огромный выбор поливитаминных комплексов с самыми редкими витаминами и микроэлементами позволяет пройти полноценный курс лечения и восстановить утраченный баланс.
Исключительная коррекция метаболизма минералов проводится препаратами, содержащими железо, медь, цинк, фосфор, кальций, хром и других. Богатый на железо Феррум-ЛЕК позволяет восполнить этим полезным элементом свой организм. Этот комплекс назначается при железодефицитных анемиях, беременности.
Подробное описание исследования
Метаболический профиль — комплексное лабораторное исследование, которое позволяет оценить скорость обмена веществ (метаболизма) и выявить нарушения в данном процессе, которые могут стать причиной ожирения, нарушения репродуктивной функции, заболеваний сердечно-сосудистой системы и многих других патологических состояний.
В данный комплекс лабораторных исследований входит определение следующих показателей: Тиреотропный гормон (ТТГ) — гормон, вырабатываемый гипофизом (железа, которая синтезирует гормоны и находится в основании черепа). ТТГ участвует в регуляции синтеза гормонов щитовидной железы (тироксин, тетрайодтиронин (Т4) и трийодтиронин (Т3)), стимулируя выработку Т4 и Т3.
По уровню ТТГ в сыворотке крови судят о наличии гипертиреоза — гиперпродукции гормонов щитовидной железы, — когда концентрация ТТГ ниже нормы, и гипотиреоза (дефицит гормонов щитовидной железы), когда уровень ТТГ повышен. Данные патологические состояния характеризуются нормальными уровнями Т3 и Т4.
Т3 и Т4, находящиеся в крови, практически полностью связываются белком. Небольшая часть гормонов остается несвязанной (свободной) и представляет собой биологически активную форму.
Если щитовидная железа вырабатывает чрезмерное количество Т4, то у человека могут наблюдаться симптомы гипертиреоза: повышенная нервная возбудимость, учащенное сердцебиение, потливость.
Если щитовидная железа вырабатывает недостаточное количество Т4, это состояние характеризуется наличием симптомов, связанных с гипотиреозом: отечностью лица, шелушением кожи, запорами, нарушением менструального цикла.
И гипертиреоз, и гипотиреоз также могут быть связаны с раком щитовидной железы или чрезмерным/недостаточным синтезом ТТГ. Дифференциальная диагностика данных состояний может быть выполнена с помощью измерения уровня свободного Т4.
Кортизол (гидрокортизон) — глюкокортикоидный гормон коры надпочечников, который участвует в регуляции обмена жиров, белков и углеводов в организме. Продукция кортизола зависит от функциональной активности надпочечников и состояния гипофиза.
В плазме крови кортизол представлен свободной, то есть биологически активной формой (около 5 % всего вырабатываемого кортизола) и соединениями с белками плазмы (преимущественно транскортином и альбуминами), а также в виде метаболитов.
Секреция кортизола у здорового человека составляет 15–30 мг и в норме имеет выраженный суточный ритм. Самая высокая концентрация отмечается рано утром, затем уровень гормона постепенно снижается в течение дня и достигает минимума около полуночи. Эта закономерность может измениться, если у человека есть ряд заболеваний, связанных с подавлением или усилением синтеза гормона.
Сочетание клинических симптомов, которые отмечаются при хроническом повышении уровня кортизола, называют синдромом Кушинга. Характерные клинические симптомы включают:
- Лунообразное лицо;
- Центральный тип ожирения;
- Тонкие конечности;
- Багровые стрии (растяжки) на животе;
- Плохое заживление ран.
В высоких концентрациях кортизол увеличивает всасывание натрия и выведение калия, что способствует задержке жидкости и возникновению отеков, развитию артериальной гипертензии и аритмии (нарушению частоты сердечных сокращений).
Избыток гормона может провоцировать развитие неврозов, вплоть до бредовых расстройств и тяжелой клинической депрессии.
Инсулин вырабатывается поджелудочной железой, основная его задача — транспорт глюкозы из крови внутрь клеток организма. Таким образом он участвует в регуляции энергетического обмена.
В поджелудочной железе есть специализированные клетки (бета-клетки), в которых биологически неактивный препроинсулин под действием стимулирующих факторов (повышение концентрации глюкозы в крови) в результате цепи реакций превращается в биологически-активный гормон инсулин, который высвобождается в кровоток.
Если нарушена работа поджелудочной железы и инсулин не производится в достаточном количестве или же возникает невосприимчивость клеток к инсулину (инсулинорезистентность), то глюкоза не поступает в клетку и не перерабатывается. Глюкоза накапливается в сыворотке крови, что опасно нарушением нормального обмена веществ и может приводить к развитию сахарного диабета, поражению органов и систем.
C-пептид — фрагмент молекулы проинсулина, который образуется в процессе биосинтеза инсулина. Когда инсулин выделяется в кровоток, также высвобождается равное количество свободного C-пептида.
Примерно 50 % образовавшегося инсулина сохраняется в печени, имея время полужизни в крови не более 4 минут. С-пептид из кровотока печенью не удаляется и его содержание в крови соответствует продукции в поджелудочной железе. Поэтому об инсулинсекретирующей способности В-клеток поджелудочной железы можно косвенно судить по уровню С-пептида.
Белок лептин — пептидный гормон, который участвует в регуляции энергетического обмена, сигнализируя о насыщении в ответ на поступление пищи. Гормон в большей степени вырабатывается клетками жировой ткани (адипоцитами), меньшая часть секретируется плацентой, скелетной мускулатурой и слизистой желудка.
Биологическое действие лептина осуществляется через специфические рецепторы в гипоталамусе. Когда лептин взаимодействует со своим рецептором, активируется синтез биологически-активных веществ, которые подавляют аппетит. Также останавливается образование стимулирующих аппетит веществ. По мере того как концентрация лептина в крови увеличивается, чувство голода постепенно проходит.
Избыток лептина в крови в редких случаях может быть связан с генетическими дефектами. Но чаще всего человек перестает улавливать «сигналы насыщения» из-за:
- Невосприимчивости к действию лептина, вызванного дефектами рецепторов лептина;
- Избыточного синтеза ингибиторов лептина;
- Нарушений транспорта лептина.
Переизбыток лептина провоцирует избыточное накопление жировой ткани в организме, из-за этого значительно увеличивается секреция инсулина, провоцируя гиперинсулинемию.
В норме лептин увеличивает потребление инсулина тканями организма и снижает его продукцию. Избыток инсулина, вызванный гиперсекрецией лептина, уже не поглощается мышцами и клетками печени, а количество инсулиновых рецепторов в тканях уменьшается, развивается инсулинорезистентность, т.е. невосприимчивость клеток к инсулину. Данное состояние увеличивает риск развития сахарного диабета второго типа.
Глюкоза — основной источник энергии для всех клеток организма. Глюкоза постоянно необходима клеткам, поэтому в норме в сыворотке крови должен поддерживаться относительно постоянный ее уровень.
Глюкоза образуется в процессе переваривания пищи, содержащей углеводы. Как правило, уровень глюкозы в сыворотке крови незначительно увеличивается сразу после приема пищи. В ответ на это поджелудочная железа вырабатывает гормон-инсулин, который необходим для переноса глюкозы к клеткам и тканям, где она используется для получения энергии. По мере того, как глюкоза утилизируется с помощью инсулина ее уровень в крови постепенно снижается, что останавливает выработку инсулина поджелудочной железой.
Если работа этой системы (глюкоза-инсулин) нарушается, глюкоза остается в крови и не может быть утилизирована клетками. Наиболее распространенное заболевание, связанное с нарушением утилизации глюкозы и выработкой инсулина – сахарный диабет.
Значительные изменения уровня глюкозы в сыворотке крови провоцируют опасные для жизни состояния, вызывая нарушения в работе органов, повреждение мозга и другие тяжелые последствия.
Индекс атерогенности — показатель, который позволяет оценить риск развития заболеваний сердца и сосудов. Для расчета показателя используют определение 2-х параметров: уровень общего холестерина и уровень липопротеинов высокой плотности.
Холестерин — это жироподобное вещество, которое необходимо для нормальной работы организма. Он входит в состав клеточных мембран, используется для синтеза некоторых гормонов, из него продуцируются желчные кислоты, необходимые для всасывания в кишечнике питательных веществ из пищи.
Небольшое количество холестерина циркулирует в крови в виде сложных частиц, называемых липопротеинами. Каждая частица содержит комбинацию белка, холестерина, триглицерида и фосфолипидов. Данные комплексы классифицируются по их плотности на:
- Липопротеины высокой плотности (ЛПВП);
- Липопротеины низкой плотности (ЛПНП);
- Липопротеины очень низкой плотности (ЛПОНП).
ЛПВП помогают удалять избыток холестерина из кровеносных сосудов (за это они получили название «хороший» холестерин), а ЛПНП и ЛПОНП, наоборот, задерживают его в тканях и органах.
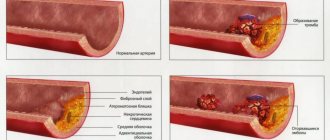
Избыток холестерина откладывается в виде бляшек на стенках кровеносных сосудов. Бляшки, постепенно увеличиваясь в размерах, приводят к сужению просвета сосудов или к их полной закупорке. Это увеличивает риск развития заболеваний сердечно-сосудистой системы и осложнений данных заболеваний.
Липопротеины низкой плотности (ЛПНП) и очень низкой плотности (ЛПОНП) — основные переносчики жиров (триглицеридов) в организме. Данные классы липопротеинов также называют «плохим холестерином», потому что при увеличении уровня ЛПОНП и ЛПНП повышается риск развития атеросклероза (отложение жировых «бляшек» на стенках сосудов) и других заболеваний сердечно-сосудистой системы.
Исследования, входящие в данный комплекс, позволяют оценить основные виды обмена (углеводный, белковый, жировой), а также обмен гормонов и других биологически-активных веществ, что позволяет выявить нарушения в данных процессах. В норме обмен веществ в организме человека сбалансирован и обеспечивает нормальное функционирование всех систем и органов.
Подробное описание исследований, референсные значения представлены на страницах с описаниями отдельных исследований.
Нарушения белкового обмена
Недостаточное поступление белка и аминокислот и нарушение метаболизма приводит к истощению организма, ослаблению иммунитета, снижению транспортной функции по доставке питательных веществ. Этот дефицит вызывает белково-энергетическую недостаточность, которая устраняется разными препаратами:
- анаболиками;
- аминокислотами;
- витаминами и минералами;
- иммуномодуляторами;
- общетонизирующими составами.
В случае недостаточности эндокринной регуляции назначаются адаптогены, общетонизирующие средства. Глубокое истощение и дисфункции, возникающие вследствие отсутствия в пище белка, устраняют препараты для улучшения метаболизма для парентерального и энтерального введения, соответственно уколом в вену и через зонд.
Использованная литература
- El-Farhan, N., Rees, D., Evans, C. Measuring cortisol in serum, urine and saliva — are our assays good enough? Annals of clinical biochemistry, 2021. — Vol. 54(3). — P. 308-322.
- Клиническая лабораторная диагностика: учебник / под ред. В.В. Долгова, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования». — М.: ФГБОУ ДПО РМАНПО, 2021. — 668 с.
- Бобрик, М.И. Взаимное влияние тиреоидного и углеводного обмена. Парадигмы и парадоксы. МЭЖ, 2015. — № 3(67).
- Глобальные практические рекомендации Всемирной гастроэнтерологической организации: ожирение, 2015.
Нарушения обмена углеводов
Сахарный диабет, панкреатит, артериальная гипертензия и иные заболевания возникают на фоне нарушений обмена углеводов. Организм не в состоянии самостоятельно перерабатывать основные источники энергетических ресурсов, таких как:
- глюкоза;
- фруктоза;
- галактоза;
- гликоген.
Медикаментозная терапия включает препараты для улучшения метаболизма в зависимости от вида наступившего сбоя в организме. С этой целью применяются ферменты, антиферменты, гипогликемические средства, лекарства, регулирующие обмен мочевой кислоты и другие. Врач назначает Кокарбоксилазу, АТФ, Витрум Кардио Омега-3, поливитаминные комплексы.
Метаболические лекарственные средства в кардиологической практике
В последнее время возрос интерес к метаболическому направлению в лечении стабильных форм ИБС. Метаболически действующие препараты потенциально могут сохранить жизнеспособность миокарда (гибернирующий миокард) до проведения операции по восстановлению коронарного кровотока. Метаболическая терапия направлена на улучшение эффективности утилизации кислорода миокардом в условиях ишемии. Нормализация энергетического метаболизма в кардиомиоцитах является важным и перспективным подходом к лечению больных ИБС.
Возможные пути цитопротекции:
- торможение окисления свободных жирных кислот (триметазидин, ранолазин);
- усиление поступления глюкозы в миокард (раствор глюкоза-натрий-инсулин);
- стимуляция окисления глюкозы (L-Карнитин);
- восполнение запасов макроэргов (фосфокреатин);
- улучшение трансмиокардиального транспорта NAD+/NADH (аминокислоты);
- открытие К+-АТФ-каналов (Никорандил).
Из известных в настоящее время миокардиальных цитопротекторов наиболее изученным препаратом с доказанными антиангинальным и антиишемическим действиями является триметазидин, реализующий свое действие на клеточном уровне и воздействующий непосредственно на ишемизированные кардиомиоциты. Высокая эффективность триметазидина в лечении ИБС объясняется его прямым цитопротекторным антиишемическим действием. Триметазидин, с одной стороны, перестраивает энергетический метаболизм, повышая его эффективность, с другой — уменьшает образование свободных радикалов, блокируя окисление жирных кислот [10, 13].
Механизм действия триметазидина связан:
- с ингибированием 3-кетоацил-КоА-тиолазы, приводящим к снижению бета-окисления жирных кислот и стимуляции окисления глюкозы;
- оптимизацией функции миокарда в условиях ишемии за счет снижения продукции протонов и ограничения внутриклеточного накопления Na+ и Ca2+;
- ускорением обновления мембранных фосфолипидов и защитой мембран от повреждающего действия длинноцепочечных ацильных производных.
Указанные процессы помогают сохранить в кардиомиоцитах необходимый уровень АТФ, снизить внутриклеточный ацидоз и избыточное накопление ионов кальция.
Таким образом, противоишемическое действие триметазидина осуществляется на уровне миокардиальной клетки за счет изменения метаболических превращений, что позволяет клетке повысить эффективность использования кислорода в условиях его сниженной доставки и таким образом сохранить функции кардиомиоцита.
Триметазидин на российском фармацевтическом рынке представлен такими препаратами, как «Предуктал» (Франция), «Триметазид» (Польша), «Триметазидин», «Римекор» (Россия).
В многочисленных исследованиях убедительно продемонстрирована высокая антиангинальная и антиишемическая эффективность триметазидина у больных ИБС как при монотерапии, так и в комбинации с другими лекарственными средствами [14, 17, 18]. Препарат не менее эффективен в лечении стабильной стенокардии, чем бета-адреноблокаторы или антагонисты кальция, однако наибольшую эффективность он проявляет в сочетании с основными гемодинамическими антиангинальными препаратами. К преимуществам триметазидина относится отсутствие гемодинамических эффектов, что позволяет назначать препарат независимо от уровня артериального давления, особенностей сердечного ритма и сократительной функции миокарда.
Триметазидин может быть назначен на любом этапе лечения стенокардии в составе комбинированной антиангинальной терапии для усиления эффективности бета-адреноблокаторов, антагонистов кальция и нитратов у следующих категорий больных:
- с впервые выявленной стенокардией напряжения;
- у которых не удается достичь терапевтического эффекта гемодинамическими антиангинальными препаратами;
- у лиц пожилого возраста;
- с дисфункцией левого желудочка;
- с ХСН;
- с сахарным диабетом;
- с синдромом слабости синусового узла;
- у которых традиционные антиангинальные препараты вызывают побочные эффекты;
- у лиц с выраженными побочными эффектами на фоне лечения антиангинальными препаратами.
Триметазидин позволяет уменьшить дозу препаратов, оказывающих побочные действия, улучшая общую переносимость лечения.
Важными моментами являются отсутствие противопоказаний, лекарственной несовместимости, а также его хорошая переносимость. Нежелательные реакции возникают очень редко и всегда слабо выражены. Это позволяет применять препарат лицам пожилого возраста, при наличии сахарного диабета и других сопутствующих заболеваний.
Данных о влиянии триметазидина на отдаленные исходы и сердечно-сосудистую смертность у больных ИБС пока нет, поэтому целесообразность его назначения в отсутствие стенокардии или эпизодов безболевой ишемии миокарда не установлена.
Нормализация энергетического метаболизма в кардиомиоцитах является важным и перспективным подходом к лечению больных ХСН. Метаболическая терапия у таких больных должна быть нацелена на улучшение эффективности утилизации кислорода миокардом в условиях ишемии. Однако работ, посвященных изучению особенностей действия триметазидина у больных ХСН, крайне мало [7, 11, 16].
В связи с этим на кафедре клинической фармакологии и фармакотерапии ФППОВ ММА им. И. М. Сеченова было проведено исследование с целью определить пределы и возможности триметазидина в комплексной терапии больных ХСН, осложнившей течение ИБС.
В исследование было включено 82 больных ХСН II–III функциональных классов по NYHA, осложнившей течение ИБС. В их числе было мужчин — 67, женщин — 15, средний возраст составил 62,2 ± 7,3 года. Перед включением в исследование у всех пациентов была достигнута стабилизация состояния на фоне терапии сердечными гликозидами, диуретиками, бета-адреноблокаторами в индивидуально подобранных дозах. Все больные были распределены в две группы: в первую (основную) группу вошли 40 больных, которым к комплексной терапии был добавлен триметазидин в дозе 60 мг/сут и ИАПФ эналаприл в дозе 5–10 мг/сут; вторую (контрольную) группу составили 42 больных, которым к комплексной терапии был добавлен только эналаприл без триметазидина. Между группами не было достоверных различий по возрасту, полу, давности заболевания, ФК ХСН. Длительность наблюдения составила 16 нед.
Клиническую эффективность терапии оценивали по динамике функционального класса ХСН. Всем больным проводилось холтеровское мониторирование ЭКГ с оценкой среднесуточной частоты сердечных сокращений (ЧСС), общего количества эпизодов депрессии сегмента ST, максимальной величины депрессии сегмента ST. Тренды сегмента ST расценивались как ишемические при его горизонтальном снижении не менее чем на 1 мм относительно точки J продолжительностью 1 мин и более. Антиишемический эффект считали достоверным, если количество эпизодов ишемии миокарда уменьшалось на 3 и более и/или суммарная депрессия сегмента ST сокращалась на 50% и более. Также оценивался характер нарушений ритма сердца: количество изолированных желудочковых экстрасистол (ЖЭ), парных ЖЭ, наджелудочковых экстрасистол (НЖЭ), эпизодов неустойчивой желудочковой тахикардии (ЖТ), пробежек наджелудочковой тахикардии (НЖТ). Критериями антиаритмического эффекта считали уменьшение изолированных ЖЭ на 50%, парных ЖЭ — на 90% при полном устранении эпизодов ЖТ.
Для оценки толерантности к физической нагрузке больным проводился тредмил-тест. Критериями положительной пробы являлись типичный приступ стенокардии и/или стойкая горизонтальная депрессия сегмента ST на 1 мм и более. При анализе результатов тредмил-теста оценивались максимальная мощность выполненной нагрузки и общая продолжительность нагрузки.
С целью оценки состояния внутрисердечной гемодинамики пациентам проводилось эхокардиографическое исследование с оценкой следующих морфофункциональных параметров сердца: размер левого предсердия (ЛП), см; конечно-диастолический размер (КДР)Я, см; конечно-систолический размер (КСР), см; фракция выброса (ФВ) левого желудочка, %.
Клинические и инструментальные исследования проводили до и через 16 недель непрерывной терапии.
Статистический анализ полученных данных проводили с использованием стандартных методов статистики, включая вычисление непарного критерия t Стьюдента. Все данные представлены в виде средних стандартных отклонений (М ± m).
Анализ динамики ФК ХСН показал, что через 16 недель лечения у 28% больных первой группы и у 26% больных второй группы было достигнуто улучшение клинического состояния и переход в более низкий ФК ХСН. Количество больных III ФК уменьшилось в первой группе с 50 до 27,5%, во второй — с 64,3 до 30,9%. Количество больных II ФК увеличилось до 67,5 и 66,7% соответственно. На фоне лечения в обеих группах появились больные I ФК: 5% — в первой группе и 2,4% — во второй. В целом ФК ХСН снизился на 11% (р < 0,05) и 10% (р < 0,05) соответственно (
).
По данным холтеровского мониторирования ЭКГ исходно у больных, включенных в исследование, были получены следующие данные: НЖЭ зарегистрированы у всех больных в обеих группах; у 9 больных первой группы и у 7 больных второй группы были зарегистрированы пробежки НЖТ. У всех больных регистрировались изолированные ЖЭ, в том числе потенциально опасные для жизни ЖЭ высоких градаций: парные ЖЭ и эпизоды неустойчивой ЖТ.
Через 16 недель лечения в первой группе количество парных ЖЭ уменьшилось на 57,6% (р < 0,05), во второй — на 28,8% (р < 0,05), количество эпизодов неустойчивой ЖТ — на 58,3% (р < 0,05) и 36,8% (р < 0,05) соответственно, количество изолированных ЖЭ — на 23,6% (р > 0,05) и 6,9% (р > 0,05) соответственно, количество НЖЭ — на 26,4% (р 0,05) и 10,8% (р > 0,05) соответственно.
Ни у одного больного, получавшего терапию триметазидином, не было зарегистрировано вновь появившихся парных ЖЭ или эпизодов неустойчивой ЖТ.
По данным холтеровского мониторирования ЭКГ отмечено и достоверное уменьшение суточного количества эпизодов депрессии сегмента SТ в первой группе на 55,5% (р < 0,05), во второй — на 23,3% (р < 0,05).
Улучшение клинического состояния больных сопровождалось улучшением морфофункциональных параметров сердца, более выраженным у больных первой группы, получавших триметазидин. Через 16 недель непрерывного лечения отмечено уменьшение КДР в первой группе на 4,7% (р < 0,05), во второй — на 2,1% (р < 0,05); КСР — на 7,5% (р < 0,05) и 4,8% (р < 0,05) соответственно; ФВ возросла в первой группе на 13,7% (р < 0,05), во второй группе — на 10,4% (р < 0,05).
Результаты тредмил-теста дают объективное подтверждение высокой антиангинальной и антиишемической активности триметазидина: максимальная мощность нагрузки у больных первой группы возросла на 12,3% (р < 0,05), у больных второй группы — на 6,7% (р < 0,05), общая продолжительность нагрузки возросла на 16,8% (р < 0,05) и на 8,2% (р < 0,05) соответственно.
Таким образом, четкое представление о патофизиологических механизмах повреждения миокардиальных клеток в условиях ишемии и гипоксии, в основе которых лежат метаболические нарушения, обусловливают необходимость включения антиоксидантов и антигипоксантов в комплексную терапию стабильных форм ИБС.
Нормализация энергетического метаболизма в кардиомиоцитах также является чрезвычайно важным и перспективным подходом к лечению больных ИБС, осложнившейся развитием хронической сердечной недостаточности. Добавление к традиционной терапии больных ХСН метаболического препарата триметазидина позволяет добиться более выраженной динамики клинических проявлений заболевания и более выраженного улучшения морфофункциональных параметров сердца. Наряду с антиангинальными и антиишемическими эффектами, триметазидин оказывает также положительное влияние на сократительную функцию миокарда левого желудочка и снижает эктопическую активность сердца за счет уменьшения электрической нестабильности ишемизированного миокарда.
Для получения доказательств положительного влияния метаболических средств на конечные точки, частоту сердечно-сосудистых событий, смертность и прогноз заболевания у больных ИБС необходимо их дальнейшее изучение в рамках крупномасштабных рандомизированных исследований.
По вопросам литературы обращайтесь в редакцию.
Т. Е. Морозова, доктор медицинских наук, профессор ММА им. И. М. Сеченова, Москва
Другие виды нарушений обмена веществ
Появление сбоев метаболизма в мышцах провоцирует развитие тяжелых нервно-мышечных болезней. Это приводит к нарушению деятельности сердца и сосудов. В этих случаях применяются антиоксиданты, кардиопротекторы, ферменты, антиферменты и другие препараты.
Нарушение водного и минерального баланса приводит к появлению отеков, заболеваний почек, скачкам давления, образованию излишка жидкости в тканях и других патологических процессов. Назначаются антиоксиданты, регуляторы кислотно-щелочного состояния (КЩС).
В каждом случае рекомендуется индивидуальная схема:
- Назначения и приема лекарств.
- Специальной диеты.
- Кардинальное изменение образа жизни.
- Коррекция физических нагрузок.
- Режима сна для улучшения работы мозга.
В современной неврологии широко применяется метаболическая терапия, в частности препараты с цитопротективным эффектом. Важной областью ее применения является лечение дисциркуляторной энцефалопатии (ДЭ), так как препараты, влияющие на гемодинамические параметры, эффективны для профилактики инсульта, но не защищают нейроглиальный комплекс от метаболических изменений, составляющих основу прогрессирования патологического процесса. В частности, атеросклероз приводит к гипоперфузии и развитию дисбаланса между доставкой кислорода к нейронам и потребностью в нем — формируется ишемия, изменяющая клеточный метаболизм. В основе дисфункции нейронов и клинических проявлений заболевания лежат ацидоз, локальное воспаление и пероксидация, нарушение ионного равновесия, уменьшение синтеза АТФ [3, 11, 14].
Одним из важных факторов развития тканевой гипоксии при ДЭ выступают расстройства микроциркуляции [10, 20, 21]. Повышенная вязкость крови является фактором риска развития ДЭ, транзиторных ишемических атак, предшествует инсультам [1, 6]. Существуют различные формы синдрома повышенной вязкости крови: гемоконцентрация, увеличение адгезии клеток, повышение агрегации тромбоцитов и снижение деформируемости эритроцитов, которые ведут к фибринообразованию и тромбозу [13]. Коррекция реологических свойств крови — важный элемент комплексного лечения больных с сосудистой патологией.
Выделяют три основных направления метаболической терапии в неврологии — профилактика некроза и апоптоза нейронов; оптимизация процессов образования и расхода энергии; нормализация баланса между интенсивностью свободнорадикального окисления и антиоксидантной защитой. Для этого в клинической практике назначаются антигипоксанты, оптимизирующие функции митохондрий, активирующие цикл Кребса, предотвращающие разобщение окисления и фосфорилирования [16, 18].
Спектр препаратов, способных эффективно влиять на реологические свойства крови, ограничен. С этой целью используются растворы альбумина, однако значительное число побочных эффектов ограничивает их применение [12]. Широко назначаются плазмозамещающие растворы, препараты декстрана, производные желатина, гидроксиэтилкрахмала, полиэтиленгликоля. Они оказывают нормоволемический эффект за счет поступления интерстициальной жидкости в сосудистое русло, а также антитромботическое действие [2, 15], но требуют осторожности при назначении пациентам с сердечной и дыхательной недостаточностью.
Учитывая вышеизложенное, средствами выбора для коррекции гемореологических расстройств должны являться препараты, более безопасные и эффективные. Интерес представляет оригинальный препарат, созданный на основе многоатомных спиртов, — реосорбилакт, 1 л которого содержит сорбитол — 60,0 г, натрия лактат — 19,0 г, натрия хлорид — 6,0 г, кальция хлорид — 0,1 г, калия хлорид — 0,3 г, магния хлорид — 0,2 г, воду для инъекций — до 1 л; осмолярность 900 мОсм/л; энергетическая ценность — 240 ккал/л; рН 6,0-7,6. Реосорбилакт обладает полифункциональным действием, нормализуя несколько видов нарушения гомеостаза: благодаря гиперосмолярности реосорбилакт вызывает поступление жидкости из межклеточного пространства в сосудистое русло, улучшая микроциркуляцию и перфузию тканей; сорбитол, частично метаболизируясь до фруктозы, способствует нормализации углеводного и энергетического обмена (при этом сорбитол, в отличие от глюкозы, метаболизируется без участия инсулина), что особенно благоприятно сказывается на улучшении функционального состояния нейроглии и гепатоцитов, в которых восстанавливается депо гликогена; сорбитол стимулирует окисление жирных кислот по некетогенному пути метаболизма и облегчает включение кетоновых тел в цикл Кребса; сорбитол повышает моторику кишечника за счет прямого действия на нервно-рецепторный аппарат кишечной стенки и усиление синтеза и секреции вилликинина, холецистокинина и витаминов группы В; натрия лактат способствует коррекции кислотно-основного равновесия плазмы, лактат-анион восстанавливает и стимулирует функции клеток ретикуло-эндотелиальной системы печени и почек. Эти свойства позволяют применять реосорбилакт для коррекции водно-электролитного, кислотно-щелочного и энергетического баланса, улучшения реологических свойств крови.
Цель работы — изучение возможности применения реосорбилакта в качестве средства метаболической терапии в неврологической практике.
Материал и методы
Проведено открытое клиническое исследование эффективности препарата реосорбилакт в составе комплексной терапии пациентов с ДЭ и диабетической полинейропатией (ДПН). В исследовании приняли участие 89 пациентов в возрасте от 42 до 70 лет (средний — 54,2±5,8 года).
Критериями включения пациентов в исследование были верифицированный диагноз ДЭ I-II стадии или ДПН, а также наличие информированного согласия пациента. Критериями исключения являлись алкалоз, индивидуальная непереносимость компонентов препарата, язвенная болезнь желудка, геморрагический колит, тяжелые заболевания печени, рефрактерная артериальная гипертензия и сердечная недостаточность в стадии декомпенсации.
Первую группу составили 45 больных, 25 мужчин и 20 женщин, с ДЭ, которые были рандомизированы в две подгруппы, сопоставимые по полу, возрасту и индексу массы тела. В лечении 20 пациентов подгруппы Iа использовали ноотропные, сосудистые, витаминные препараты. Комплексная терапия 25 больных подгруппы Iб, кроме того, включала введение реосорбилакта по 200-400 мл в сутки (из расчета 3 мл/кг) внутривенно капельно со скоростью 80 капель в минуту через день в течение 20 дней.
Во вторую группу вошли 44 пациента, 24 мужчины и 20 женщин, с ДПН, которые также были разделены на 2 сопоставимые подгруппы IIа и IIб по 22 больных в каждой. Комплексное лечение больных обеих подгрупп включало витаминные препараты, тиоктовую кислоту.
В подгруппе IIб, кроме того, применяли парентеральное введение реосорбилакта по приведенной выше схеме.
Исследование включало скрининговый период, период активного лечения, этап наблюдения и анализа результатов. На этапе скрининга определяли соответствие пациента критериям включения/исключения. После 20-дневного курса лечения больные оставались под наблюдением в течение еще 10 дней. Общая длительность исследования составила 30 дней.
Первичной конечной точкой исследования в обеих группах больных было улучшение качества жизни пациентов через 1 мес от начала лечения, оцениваемое по шкале SF-36. Всем пациентам 1-й группы до лечения и на 30-е сутки наблюдения, помимо неврологического осмотра [8], проводилось исследование когнитивных функций с использованием батареи тестов лобной дисфункции (FAB), краткой шкалы оценки психических функций (MMSE), а также изучались параметры кислотно-основного равновесия в венозной крови (рН и избыток оснований — ВЕ). До начала исследования и по его завершении осуществлялось ультразвуковое дуплексное сканирование (УЗДС) магистральных артерий головы на аппарате SONOLINE Elegra (Германия, СПЕКТРОМЕД) с использованием линейного датчика 7 МГц. Исследование включало определение толщины комплекса интима-медия (КИМ) сонных артерий в стандартных точках; диаметров общих (ОСА) и внутренних (ВСА) сонных артерий; степени стеноза по критерию ECST [11]. Скоростные и спектральные параметры кровотока определялись в ОСА, ВСА и позвоночных артериях (ПА) на экстракраниальном уровне. Оценивались пиковая систолическая и конечная диастолическая скорости кровотока, усредненная по времени пиковая и объемная скорость кровотока (Vvol) в каждом сосуде отдельно; также оценивали суммарную объемную скорость кровотока в ОСА (σVvol ОСА) и ПА (σVvol ПА), суммарную объемную скорость мозгового кровотока (σVvol МК).
Во 2-й группе помимо оценки качества жизни по SF-36, уровня тревоги (опросник HARS), интенсивности боли (опросник NRS) и параметров кислотно-основного состояния в венозной крови (рН и ВЕ) до лечения и на 30-е сутки исследования анализировали концентрацию глюкозы в капиллярной крови и проводили электронейромиографию (ЭНМГ) большеберцового и малоберцового нервов с помощью диагностического комплекса Nicolet Viking-IV (CША). Исследовались скорость проведения импульса по двигательным волокнам (СПИ эфф), скорость проведения импульса по чувствительным волокнам (СПИ афф), амплитуда М-ответа, латентный период вызванного потенциала. Выраженность побочных эффектов лечения оценивали с помощью шкалы оценки побочного действия UKU [17].
Статистический анализ полученных данных проводили с помощью программы Statistica 6.0 в соответствии с рекомендациями по обработке результатов медико-биологических исследований [9]. Выбор методик осуществлялся с учетом принципов системного анализа и моделирования динамических исследований. Заключение о статистической значимости давалось при уровне вероятности ошибочного заключения р
<0,05.
Результаты
В начальном периоде исследования у большинства пациентов c ДЭ преобладал астено-невротический синдром, в неврологическом статусе наблюдались рассеянная неврологическая симптоматика, латерализованный пирамидно-мозжечковый дефицит и легкие когнитивные расстройства (табл. 1)
.
Анализ состояния кислотно-основного состояния крови у данной категории больных выявил дефицит оснований (ВЕ) при нормальном значении рН, что свидетельствовало о негрубом ацидозе, вероятно, развившемся из-за недостаточности энергетического обеспечения тканей при их хронической гипоперфузии. Пациенты с ДЭ отмечали снижение показателей качества жизни (по шкале SF-36) в физической и психологической сферах, что соответствовало характеру предъявляемых жалоб.
Через 30 дней наблюдения у пациентов с ДЭ в подгруппе Iа наблюдалась лишь тенденция к улучшению показателей исследуемых параметров при отсутствии статистически значимых изменений. Улучшение качества их жизни к концу исследования наблюдалось преимущественно за счет психологического компонента. У больных подгруппы Iб были выявлены достоверные изменения по ряду исследуемых параметров по сравнению с аналогичными показателями в подгруппе Iа и исходными данными. Так, по результатам анализа УЗДС наблюдалось значительное (р
<0,05) улучшение суммарной объемной скорости кровотока во всех исследуемых системах (ОСА, ПА, МК), что свидетельствовало об увеличении перфузии головного мозга. Кроме того, отмечалось достоверное уменьшение выраженности ацидоза крови за счет значимого восстановления дефицита оснований (до –2,0±1,7 ммоль/л,
р
<0,05), не сопровождающегося выраженным изменением показателя рН крови. Достоверных различий в изменении средних показателей шкал MMSE и FAB по сравнению с исходными значениями зафиксировано не было. Пациенты данной подгруппы отметили значительное улучшение качества жизни к концу лечения (
р
<0,05) как за счет физического, так и психологического компонентов.
На этапе скрининга подавляющее большинство пациентов с ДПН предъявляли жалобы на онемение, парестезии в стопах, усиливающиеся в ночное время. В неврологическом статусе доминировал полиневритический синдром с поражением нижних конечностей, сопровождавшийся умеренно выраженным болевым синдромом (по данным шкалы NRS). Исследование периферической крови выявило легкую гипергликемию и метаболический ацидоз (по результатам исследования ВЕ) при нормальном показателе рН. ЭНМГ нервов нижних конечностей позволила установить значимое снижение СПИ по сенсорным и моторным нервным волокнам, снижение амплитуды М-ответа и увеличение его латентности.
По истечении 30 сут после начала лечения у пациентов подгруппы IIа, получавших общепринятую комплексную терапию ДПН, наблюдалось значимое (р
<0,05) снижение уровня гипергликемии, что сопровождалось уменьшением выраженности дефицита оснований крови (увеличение ВЕ до –3,52±1,2 ммоль/л,
р
<0,05) и тенденцией к нормализации исследуемых ЭНМГ-показателей. Достоверно значимого изменения степени выраженности болевого синдрома и уровня кислотности крови зафиксировано не было. Тем не менее подавляющее большинство пациентов к моменту окончания наблюдения отметили существенное улучшение качества жизни по сравнению с исходным его уровнем, главным образом, за счет психологического компонента (
р
<0,05). Позитивные изменения были связаны с уменьшением гипергликемии вследствие более тщательного контроля концентрации глюкозы в крови и повышения комплаентности к медикаментозному лечению как сахарного диабета, так и ДПН.
В подгруппе IIб к моменту окончания исследования отмечалось достоверное (р
<0,05) улучшение всех исследуемых показателей за исключением рН крови, который практически не изменился по сравнению с исходным значением. Значимое снижение уровня глюкозы в плазме крови сопровождалось уменьшением выраженности боли по данным шкалы NRS до степени легкого алгического синдрома (3,6±1,8 балла,
р
<0,05), увеличением значения ВЕ до –1,7±1,3 (
р
<0,05), что свидетельствовало о купировании метаболического ацидоза крови. По данным ЭНМГ нервов нижних конечностей у пациентов подгруппы IIб через 30 сут от начала терапии наблюдались признаки значимого улучшения невральной проводимости (повышение значений СПИ эфф и СПИ афф) и нервно-мышечной передачи (увеличение амплитуды М-ответа и уменьшение его латентности)
(табл. 2)
.
Пациенты отметили, что лечение существенно улучшило их физическое, психологическое состояние и качество жизни в целом (р
<0,05). За период наблюдения значимых побочных эффектов во всех исследуемых группах зарегистрировано не было, что свидетельствует о хорошей переносимости препаратов и отсутствии их отрицательного взаимодействия.
Обсуждение
Оценка метаболического эффекта реосорбилакта при ДЭ и ДПН обусловлена общностью патогенеза (нарушение микроциркуляции) этих заболеваний (ацидоз, оксидативный стресс, снижение активности митохондрий и др.). Установленная эффективность реосорбилакта в составе комплексной терапии больных с ДЭ и ДПН обусловлена метаболическим действием препарата. В частности, в ходе исследования выявлена способность реосорбилакта устранять метаболический ацидоз — наблюдалось достоверное уменьшение выраженности ацидоза крови за счет значимого восстановления ВЕ без выраженных изменений рН крови.
Показано, что присутствие сорбитола в седалищном нерве и спинном мозге [5] снижает расход витаминов в нервной системе и способствует более экономичному их использованию. Сорбитол не только снижает внутричерепное давление, но и улучшает кровообращение в головном мозге [19]. Это позволяет рекомендовать его применение при отеке мозга, субдуральной гематоме, инсульте [4, 7].
Анализ эффективности терапии больных ДПН показал, что использование реосорбилакта позволило уменьшить выраженность боли, улучшить невральную проводимость и нервно-мышечную передачу. Данное обстоятельство подчеркивает целесообразность системной терапии при ДПН. Лечение с применением реосорбилакта существенно улучшило показатели физического, психологического состояния и качества жизни больных. Таким образом, реосорбилакт обладает рядом терапевтических свойств, определяющих целесообразность его применения при различных неврологических заболеваниях.
Изменения веса при нарушении метаболизма
Важное условие в лечении ожирения — установление самих причин заболевания и лишнего веса. Перед похудением вначале устраняют нарушения метаболизма. Эти два явления тесно взаимосвязаны между собой, в этом случае лучше обратиться за консультацией к врачу.
Пациенту назначаются лабораторные исследования крови, мочи, других анализов и на основании результатов рекомендуется корригирующая терапия.
- Препараты при нарушении обмена липопротеинов с добавлением лекарств, влияющих на аппетит, а также энтеросорбентов.
- Специальные комплексы для восполнения дефицита витаминов, микро- и макроэлементов в виде таблеток, драже и растворов.
Современные монопрепараты и комплексные медикаменты позволяют поддерживать свой организм в идеальной форме и предупредить появление сбоев и дефицитных состояний.
Журнал «Артериальная гипертензия» 6 (26) 2012
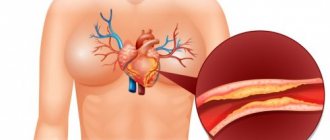
Болезни системы кровообращения до настоящего времени остаются основной причиной смерти населения развитых стран мира и Украины в том числе. Несмотря на то, что в США, Великобритании и Канаде болезни сердца и сосудов также являются главной причиной смерти, смертность от этих заболеваний в Украине в 2–4 раза выше, чем в других странах мира. Ежегодно в Украине от сердечнососудистых заболеваний (ССЗ) умирает около 400 тысяч человек. Эти болезни становятся причиной 66,3 % смертей в нашей стране. И если в странах Западной Европы и Северной Америки наблюдается ежегодное снижение смертности и инвалидизации от ССЗ, то в нашей стране до 2008 года наблюдался их отчетливый рост, и только в последние годы наметилась тенденция к снижению. Несмотря на успехи, достигнутые в лечении ССЗ, только в 2011–2012 годах от инфарктов, инсультов и других сердечнососудистых заболеваний умерло около миллиона жителей Украины [10, 11, 13].
По данным ряда авторов, в структуре смертности от ССЗ ведущее место занимают ишемическая болезнь сердца (ИБС) и мозговой инсульт, которые, как правило, развиваются на фоне артериальной гипертензии (АГ), поскольку высокое артериальное давление (АД) повышает риск смерти от ИБС в 3 раза, а от инсульта — в 6 раз. Несмотря на появление современных антиангинальных и гипотензивных средств, постоянное совершенствование их фармакокинетики и фармакодинамики, эффективность традиционных препаратов остается недостаточной даже при адекватной регулярной терапии. Поэтому проблема повышения эффективности лечения хронических болезней сердечнососудистой системы, и прежде всего ИБС и АГ, остается весьма актуальной [21, 23].
Современная стратегия оказания помощи больным ИБС и АГ, вопервых, предусматривает назначение препаратов, действие которых направлено на улучшение прогноза у данной категории больных (антитромбоцитарные и гиполипидемические препараты, ингибиторы ангиотензинпревращающего фермента и бетаадреноблокаторы). Вовторых, не менее важным аспектом в лечении пациентов со стенокардией является улучшение качества их жизни, что достигается применением антиангинальных средств, таких как нитраты, антагонисты кальция, бетаадреноблокаторы и ингибиторы Ifканалов синусового узла [6]. Учитывая тот факт, что в основе формирования морфофункциональных изменений миокарда и сосудистого русла лежит нарушение внутриклеточного энергетического обмена, обусловленное его гипоксией вследствие нарушения коронарного кровотока, использование препаратов гемодинамического действия (бетаадреноблокаторов, антагонистов кальция, нитратов) должно в полной мере обеспечивать оптимизацию соотношения между потребностями сердечной мышцы в кислороде и его доставкой. Однако, как показывают результаты ряда исследований, данные препараты не всегда эффективно контролируют симптомы заболевания даже при использовании их в рациональных комбинациях [15, 20]. Вероятно, это связано с тем, что возможности терапии ограничены условиями функционирования миокарда при ишемии, наличием других адаптационных и дезадаптационных процессов, оказывающих существенное влияние на кардиомиоциты и миокард в целом [31]. Кроме того, традиционный гемодинамический подход к лечению больных со стабильной стенокардией зачастую не удовлетворяет ни врача, ни самих больных: более 60 % пациентов с ИБС оценивают качество своей жизни как неудовлетворительное или плохое, а у половины больных как минимум дважды в неделю возникают приступы стенокардии покоя [1, 9].
Поэтому в настоящее время назрела необходимость использования принципиально новых путей в лечении ССЗ в связи с пониманием сущности нарушений, происходящих в метаболизме кардиомиоцита при гипоксии, формированием новых представлений о патогенезе ИБС, появлением новых адаптационных ишемических синдромов (оглушенность, гибернация и прекондиционирование миокарда). Одним из направлений медикаментозного воздействия на ишемизированный миокард стало применение миокардиальных цитопротекторов — средств, которые успешно устраняют нарушения клеточного метаболизма, ионного гомеостаза и функций мембран кардиомиоцитов, предупреждая тем самым развитие необратимых процессов в миокарде. В современной литературе под термином «миокардиальные цитопротекторы» подразумевают препараты различных химических классов, действие которых не связано с гемодинамическим эффектом, а опосредуется путем оптимизации процессов образования и расхода энергии, коррекции функции дыхательной цепи, нормализации баланса между интенсивностью свободнорадикального окисления и антиоксидантной защитой, а также непосредственного влияния на кардиомиоциты, что в конечном итоге способствует их выживаемости в условиях ишемии и препятствует формированию «метаболического ремоделирования миокарда» (термин предложен М. van Bilsen и соавт. в 2004 году для обозначения патологических изменений, опосредованных избытком активации жирных кислот в кардиомиоците) [43].
История возникновения метаболических препаратов, используемых для лечения ИБС, начинается с появления глюкозоинсулинокалиевой смеси, которую впервые исследовали D. SodiPallaris с соавт. в 1962 году и доказали ее положительное влияние на раннюю выживаемость пациентов с острым инфарктом миокарда [41]. В дальнейших исследованиях было продемонстрировано снижение высвобождения адипоцитами свободных жирных кислот (СЖК) при применении глюкозоинсулинокалиевой смеси, что приводило к уменьшению их концентрации в зоне ишемизированного миокарда. В 70–80е годы ХХ в. стали широко внедряться в практику такие препараты, как инозин, АТФ. Однако их применение не оказывало значимого влияния на улучшение состояния больных ни с ИБС, ни с АГ. Назрела необходимость поиска других подходов к метаболической терапии ИБС и АГ. Полученные в последующих исследованиях данные позволили сделать вывод о том, что значительная активация окисления глюкозы может быть достигнута путем блокады окисления СЖК [19, 26, 35].
Сегодня терапия метаболическими препаратами с полным правом заняла свое место в схемах лечения ССЗ и вошла в международные рекомендации по лечению ИБС. Однако необходимо заметить, что в данном случае речь идет не о замене гемодинамического подхода метаболическим, а о взаимодополняющем сочетании двух эффектов, в основе которых лежат разные механизмы действия препаратов [12, 16].
Каким требованиям должна отвечать современная метаболическая терапия в кардиологии? Вопервых, препараты с метаболической активностью должны иметь доказательную базу в отношении противоишемической эффективности по данным клинической картины, электрокардиографии (ЭКГ), параметров нагрузочных тестов, 24часового мониторирования ЭКГ и, что особо важно, весомые аргументы в пользу ограничения размеров некроза при инфаркте миокарда, доказанные в эксперименте и в клинике. Вовторых, они должны характеризоваться отсутствием гемодинамического действия — влияния на частоту сердечных сокращений, сократимость миокарда, артериальное давление и другие параметры. И наконец, идеальный кардиометаболический препарат должен улучшать отдаленный прогноз заболевания, обладать хорошей переносимостью и минимальным количеством побочных эффектов.
В современных экспериментальных исследованиях прямой кардиопротекторный механизм действия установлен почти у 2000 молекул. Однако в реальной клинической практике в настоящее время используются лишь некоторые препараты с метаболическими свойствами. В группу кардиометаболических протекторов включают лекарственные вещества, способные, с одной стороны, позитивно влиять на клеточный метаболизм, ионный гомеостаз, структуру и функцию мембран клеток, а с другой — препятствовать развитию их повреждения и реперфузии. Единой классификации кардиоцитопротекторов не существует. Одной из последних, представленных в медицинской литературе, является классификация, предложенная В.П. Михиным (2011), построенная на основании локализации фармакологического эффекта препарата [14].
Классификация кардиоцитопротекторов по локализации фармакологического эффекта
1. Внутримитохондриальные цитопротекторы:
1.1. Торможение окисления жирных кислот:
— подавление бетаокисления жирных кислот (триметазидин);
— подавление транспорта жирных кислот в митохондрии (Милдронат);
1.2. Прямая стимуляция окисления глюкозы (сукцинат 2этил6метил3оксипиридина);
1.3. Стимуляция цитохромной цепи (коэнзим Q10).
2. Транспорт энергетического субстрата в митохондрии (фосфокреатин, глюкозоинсулиновая смесь, янтарная кислота).
3. Стимуляция анаэробного гликолиза (тиатриазолин) — мало разработана и малоэффективна.
4. Антиоксиданты и митохондриальные цитопротекторы, обладающие антиоксидантными свойствами.
Наиболее физиологично подавляют окисление жирных кислот pFOXингибиторы (парциальные ингибиторы окисления жирных кислот). Одним из наиболее широко используемых в кардиологической практике метаболических препаратов является триметазидин, в основе действия которого лежит блокада bокисления свободных жирных кислот в митохондриях в условиях ишемии, в результате чего происходит угнетение синтеза АТФ из свободных жирных кислот. Поэтому главным источником энергии для синтеза АТФ становится глюкоза, на окисление которой до углекислого газа и воды требуется на 30 % меньше кислорода (из расчета на одну молекулу АТФ), чем для окисления жирных кислот, что в итоге приводит к значительной экономии кислорода для синтеза АТФ внутри митохондрий [3, 36]. На сегодняшний день в целом ряде исследований показано положительное влияние триметазидина на патологический каскад нарушений, развивающихся при ишемии миокарда. Так, применение триметазидина препятствует истощению источников энергии (в частности, гликогена) в сердечной мышце, снижает содержание ионов натрия и кальция в кардиомиоцитах [33, 37, 38]. Триметазидин уменьшает пассивную проницаемость мембран и повышает их устойчивость к гипоксическим и механическим повреждениям. Под влиянием препарата происходит уменьшение высвобождения ферментов повреждения кардиомиоцитов, таких как креатинфосфокиназа и лактатдегидрогеназа [27, 30].
Другим представителем этой группы является Милдронат, который в отличие от триметазидина снижает скорость биосинтеза карнитина из его предшественника — гаммабутиробетаина. Это приводит к замедлению карнитинопосредованного транспорта длинноцепочечных жирных кислот через мембраны митохондрий без воздействия на метаболизм короткоцепочечных жирных кислот. При этом включается альтернативная система производства энергии — окисление глюкозы, которая более эффективно использует кислород для синтеза АТФ. Преимущество Милдроната заключается в том, что при его приеме в митохондриях не возрастает концентрация недоокисленных промежуточных продуктов метаболизма жирных кислот, которые, в свою очередь, могут служить источником образования токсических липопероксидов в результате активации свободнорадикальных процессов при ишемии и реперфузии миокарда. Кроме того, накопление гаммабутиробетаина стимулирует биосинтез оксида азота, что приводит к нормализации функционального состояния эндотелия, снижению агрегации тромбоцитов и в конечном итоге — к нормализации сосудистого тонуса. Однако нельзя исключить и другой механизм повышения образования оксида азота на фоне применения Милдроната — уменьшение интенсивности его инактивации свободными радикалами [7, 18, 28]. В ряде научных исследований было показано, что применение Милдроната у пациентов со стабильной стенокардией снижало частоту приступов стенокардии и среднесуточное потребление короткодействующих нитратов, в то же время отмечалось повышение толерантности к физической нагрузке [8]. Терапевтический и защитный эффекты Милдроната реализуются благодаря его воздействию на метаболические звенья энергетической цепи, что обеспечивает полноценное функционирование клетки в условиях ишемии. Достижение этих эффектов осуществляется путем снижения интенсивности окисления жирных кислот в условиях ишемии (экономия энергии), активации гликолиза для производства энергии, фармакологической тренировки (прекондиционирование), индукции биосинтеза оксида азота, снижения сопротивления периферических сосудов [17].
Таким образом, Милдронат благодаря уникальным особенностям своего механизма действия является препаратом выбора среди других кардиометаболических средств для лечения больных с хроническими формами ИБС, хронической сердечной недостаточностью ишемического генеза, а также для коррекции метаболических нарушений со стороны органовмишеней при АГ [29, 32, 39, 40]. Позиционируя механизм действия Милдроната на клинику, можно выделить несколько важных моментов: вопервых, назначение препарата уже при начальных проявлениях ИБС позволяет осуществлять защиту миокарда от ишемии и предотвращать усугубление кардиальной патологии, так как метаболические нарушения в миокарде начинаются гораздо раньше, чем развивается клиническая картина стенокардии. Вовторых, добавление Милдроната к стандартной антиангинальной терапии приводит к достоверному уменьшению количества приступов стенокардии, снижению суточной потребности в нитроглицерине, увеличению толерантности к физическим нагрузкам, снижению функционального класса и в конечном итоге — к улучшению качества жизни пациентов. Втретьих, при острой ишемии миокарда применение Милдроната ведет к ограничению зоны некроза на 30 %, при остром инфаркте миокарда — к уменьшению метаболических изменений, а при реперфузии — к восстановлению функции сердца и снижению частоты фибрилляции желудочков.
Эффективность и безопасность оригинального препарата Милдронат при ИБС и АГ доказана в многочисленных клинических исследованиях, отвечающих требованиям доказательной медицины. Так, сравнительная оценка эффективности Милдроната у больных ИБС со стабильной стенокардией показала, что добавление Милдроната к традиционной терапии хронической ИБС, включавшей аспирин, статины, селективные бетаадреноблокаторы и пролонгированные нитраты (пациенты получали его не менее чем за 4 месяца до включения в исследование и продолжали получать в неизменных суточных дозах в процессе наблюдения), позволило достоверно снизить частоту приступов стенокардии и сократить потребность в нитратах короткого действия [22, 25]. В то же время в отдельных работах четко прослеживалось уменьшение частоты ангинозных приступов и увеличения потребности в сублингвальных нитратах на фоне приема Милдроната (оценивались дозы Милдроната 500 мг/сут и 1000 мг/сут) [2]. В другом открытом контролируемом исследовании изучали влияние Милдроната на окислительные процессы и эндотелиальную функцию у пожилых пациентов с ИБС. На фоне приема базисных препаратов в сочетании с Милдронатом (500 мг в сутки) в течение 12 недель отмечалось снижение исходного уровня продуктов перекисного окисления липидов в среднем на 33 % и повышение устойчивости липопротеинов низкой плотности к окислению на 26 %. Кроме того, у пациентов наблюдалось повышение уровня метаболитов оксида азота в крови (в среднем в 1,4 раза) по сравнению с показателями до приема препарата.
Особый интерес представляют результаты международного многоцентрового рандомизированного двойного слепого плацебоконтролируемого клинического исследования MILSS II, в котором было продемонстрировано, что прием Милдроната при лечении стабильной стенокардии в комбинации со стандартной терапией приводит к существенному улучшению состояния больного и повышению качества жизни пациента. Целью исследования явилась оценка эффективности и безопасности терапии Милдронатом в дозе 1000 мг в сутки на фоне стандартной терапии у пациентов со стабильной стенокардией. Результаты исследования показали, что в группе пациентов, принимавших Милдронат, продолжительность выполнения функциональной нагрузки (ФН) увеличилась на 10 %, тогда как в группе плацебо — лишь на 2,4 %. Через 12 месяцев лечения разница в продолжительности выполнения ФН между группами составила 13 % в пользу группы пациентов, принимавших Милдронат (р = 0,009). Следует отметить, что в группе плацебо продолжительность ФН к 12му месяцу терапии была на 2,1 % ниже по сравнению с показателем на 6м месяце лечения. До начала терапии среднее время возникновения депрессии сегмента ST на 1 мм и более в группе пациентов, принимавших Милдронат, составило 425,63 ± 160,97 с, в то время как в группе плацебо — 398,98 ± 145,75 с (различия между группами статистически недостоверны, p = 0,185). Через 12 месяцев лечения этот показатель в группе активной терапии увеличился до 483,83 ± 193,99 с, в то время как в группе плацебо — до 425,98 ± 159,12 с (p = 0,01). Полученные результаты позволили заключить, что 12месячная терапия милдронатом увеличивала продолжительность выполнения ФН до появления депрессии сегмента ST на 1 мм на 13,6 % по сравнению с исходными показателями. Разница в показателях между исследуемыми группами на 12м месяце лечения составила 13,9 % в пользу группы Милдроната. Таким образом, результаты исследования MILSS II продемонстрировали, что добавление Милдроната к стандартной терапии ИБС повышает толерантность пациентов к ФН, увеличивает уровень максимальной достигнутой ФН, продолжительность выполнения ФН до возникновения приступа стенокардии и депрессии сегмента ST, а также улучшает качество жизни больных [5].
Особое место в изучении эффективности кардиопротекторов при ИБС отводится их применению при коронарной ангиопластике. Проведение чрескожных коронарных вмешательств (ЧКВ) и коронарного шунтирования (КШ) сопряжено с развитием осложнений со стороны сердечнососудистой системы, которые включают в себя дисфункцию миокарда с развитием «оглушенного миокарда» с нарушением локальной сократимости миокарда левого желудочка, нарушения гемодинамики и появление различных аритмий [34]. Согласно современным представлениям, ишемические и реперфузионные изменения миокарда, в том числе и при проведении коронарной реваскуляризации, развиваются в результате нарушения метаболизма кардиомиоцитов [42]. Эффективность применения Милдроната для коррекции вышеописанных патологических изменений была подтверждена результатами клинического исследования, проведенного на базе ГОУ ВПО «Российский государственный медицинский университета», в котором участвовали 149 пациентов со стабильной стенокардией II–III ФК в возрасте от 41 до 75 лет. Всем больным проводилось коронарное шунтирование в условиях искусственного кровообращения или чрескожное коронарное вмешательство. Пациентам первой группы за 10–15 дней до предполагаемой реваскуляризации к лекарственной терапии (нитраты, бетаадреноблокаторы, дезагреганты, ингибиторы АПФ, антиаритмики) был добавлен Милдронат в течение трех дней, затем — два раза в неделю. Вторая группа (контрольная) не получала метаболические препараты. На 2–3й день после КШ на фоне применения Милдроната было обнаружено снижение на 15 % индекса нарушения локальной сегментарной сократимости левого желудочка (ИНЛС), в то время как в группе сравнения значение ИНЛС уменьшилось лишь на 3,5 %. До выполнения баллонной ангиопластики в результате предоперационного применения Милдроната ИНЛС сократился на 14 %, в группе сравнения — на 2,5 %. После выполнения баллонной ангиопластики в основной группе ИНЛС снизился на 19,5 % от исходного, а в группе сравнения — на 12 %. Включение в предоперационную подготовку Милдроната позволило сразу после ангиопластики увеличить фракцию выброса левого желудочка на 12 %, в то время как достоверного изменения фракции выброса левого желудочка в контрольной группе зарегистрировано не было. Данное исследование подтвердило способность Милдроната уменьшать степень гибернации миокарда при хронической ишемии. Использование Милдроната при коронарной ангиопластике в составе предоперационной и послеоперационной терапии ускоряло восстановление сократительной функции миокарда на фоне улучшения коронарного кровотока и таким образом повышало эффективность реваскуляризации [4].
Что касается применения кардиопротекторов при АГ, то следует отметить, что в последние годы опубликован ряд работ, в которых представлены позитивные результаты данной группы препаратов. Интерес к такого рода исследованиям обусловлен полиорганностью поражения органовмишеней при артериальной гипертензии, ведущую роль в патогенезе которых играют нарушение энергетического внутриклеточного обмена и активация свободнорадикальных процессов. В клиническом исследовании, посвященном сравнительной оценке эффективности кардиопротекторов у больных с АГ, пациентам первой группы назначался Милдронат в дополнение к гипотензивному препарату эналаприлу, пациентам второй — добавляли триметазидин, а в третьей (контрольной) до окончания исследования проводилась монотерапия эналаприлом. Через 6 месяцев приема препаратов у всех больных произошло снижение уровня липопероксидов в крови, причем в группе Милдроната уровень диеновых конъюгат снизился более существенно (на 31 %), чем в группах сравнения (около 20 %). На этом фоне отмечалось увеличение степени эндотелийзависимой возодилатации при проведении манжеточной пробы, однако у лиц, принимавших Милдронат, уровень эндотелийзависимой вазодилатации был достоверно выше. В дополнение к вышеперечисленным эффектам применение Милдроната на фоне эналаприла усиливало ангиопротектекцию (толщина комплекса интимамедиа в группе Милдроната сократилась на 16,2 %, а в группах триметазидина и эналаприла — на 9,7 и 9,5 % соответственно). И наконец, у больных с АГ комбинация Милдроната с эналаприлом усиливала гипотензивный эффект последнего, ускоряла достижение целевого уровня АД, способствовала нормализации суточного профиля АД в большем числе случаев, чем монотерапия ингибитором ангиотензинпревращающего фермента [24].
Таким образом, применение Милдроната в составе комплексной терапии с базисными антигипертензивными препаратами позволяет использовать его в качестве средства для вторичной профилактики АГ, прогрессирования поражения органовмишеней и развития ассоциированных заболеваний.
Итак, подводя итог вышесказанному, можно сделать вывод, что современные кардиоцитопротекторы является новым получившим доказательную базу направлением в лечении сердечнососудистых заболеваний. В связи с непродолжительным временем их изучения отсутствует серьезная доказательная база их влияния на выживаемость и смертность у больных с ССЗ. Однако полученные к настоящему времени клинические данные о повышении эффективности лечения пациентов с ишемической болезнью сердца и артериальной гипертензией свидетельствуют о перспективности их применения в комбинированной терапии больных с сердечнососудистой патологией.