Под данным термином понимается малоинвазивная процедура, проводимая как самостоятельная либо дополняющая оперативную манипуляцию. Широко применяется в онкологии.
По ходу процедуры врач делает прокол, чтобы ввести в проблемную катетер в интересующую его артерию.
В результате вмешательства сосуд, подпитывающий новообразование кровью, блокируется частицами, кровоток перекрывающими. Их называют эмболами.
Методика применима для лечения различных патологий. В наше время она активно применяется в онкологии.
Этому причиной несколько ее характеристик – эффективность, малоинвазивность.
Проведение
Манипуляцию проводят в операционной, которая специально оборудована под нее.
Как правило, манипуляцию проводят с использованием местного анестетика. Но бывают случаи применения наркоза.
Пациент должен принять пищу не более чем за 5-6 часов до проведения вмешательства.
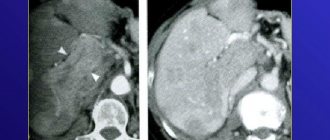
Перед вмешательством необходимо провести ангиографию. Для этого в кровеносные сосуды вводят специальное вещество. Это необходимо для получения более четкой цифровой картинки и последующей записи.
Кроме того, данная технология позволяет доктору точнее понять локацию и анатомию артерий. Благодаря новой технологии, он обнаруживает проблемные сосуды, питающие кровью патогенный очаг.
Гистероскопия с РДВ
Проникновение в сосуд, как правило, осуществляют через артерию, находящуюся в бедре. Сначала хирургом выполняется обработка кожи антисептиком, а затем выполняется сама процедура.
Когда цель достигнута, и катетер достиг проблемного ссуда, через него в сосуд вводят эмболы. Их задача – перекрытие просвета.
2.Как проводится операция?
Сосудистая система человека представляет собой густую сеть, которая охватывает весь организм, вплоть до самых периферических его участков. По этим питательным «трубопроводам» медицина научилась подводить к страдающим органам миниатюрный инструментарий – катетеры, стенты, спирали, окклюдеры и проч. В диаметре такие инструменты обычно не превышают полутора-двух миллиметров. Их вводят в доступный сосуд через прокол, и затем продвигают уже внутри сосудистой системы до нужной области. Выполняется эта манипуляция под контролем соответствующей рентгено-телевизионной аппаратуры
. Этот современный способ контроля стал возможен благодаря инновационным технологиям, позволившим получить объемную картинку внутренности сосуда с помощью обработки цифрового изображения. Для получения такой подробной картинки, позволяющей исследовать изображение в мельчайших деталях, необходимы минимальные дозы рентгеновского облучения. Таким образом,
оперирующий хирург полностью контролирует ход операции
, точно манипулируя эндоваскулярным инструментарием и направляя его в заданное место установки.
Посетите нашу страницу Нейрохирургия
Как действует в онкологии
Есть ряд онкозаболеваний, где эмболизация кровеносных сосудов хорошо применима:
- Автономное лечение – рак печени, почек, легких и т.д.;
- Комплекс «эмболизация-хирургия» – рак печени, почек, легких, позвоночника, матки, простаты и т.д.;
- Остановка кровотечений, вызванных опухолевым очагом.
Методика находит широкое использование при лечении болезней не онкологических:
- Аневризмы;
- Миома матки;
- Аденома простаты;
- Варикоцеле;
- Сосудистые мальформации различной локализации.
При каких онкозаболеваниях показана сосудистая эмболизация?
Эмболизацию с использованием микросфер и одновременным применением препаратов для химиотерапии назначают при:
- первичном раке печени;
- печеночных метастазах опухолей нервной системы, желез внутренней секреции и прямой кишки;
- опухолях желчного пузыря и желчевыводящих протоков;
- раке молочной железы;
- опухолях легких;
- почечном раке;
- раке головки поджелудочной железы;
- опухолях костных структур головы и шеи.
Безопасность
Целью данной методики применительно к онкологии является прекращение кровяного притока к проблемной зоне, а также сохранение нормального кровообращения в соседних здоровых тканях.
Современные техника и технологии, где применяют новейшие микрокатетеры, гарантируют точность и безопасность выполнения процедуры.
Точность повышается посредством ангиографии. Благодаря последней, хирург имеет возможность детально изучить сеть сосудов, выявить те сосуды, которые опухоль питают, чтобы затем применить данную методику.
Перед процедурой пациент проходит УЗИ и некоторые другие исследования.
4.Эндоваскулярная эмболизация опухоли
Всем хорошо известно, что жизнедеятельность опухоли происходит за счет сосудов, доставляющих ей питание. Если же эти сосуды перекрыть, опухоль лишается жизнеобеспечения. Именно на это направлена процедура закрытия просветов сосудов, подходящих к опухоли, называемая эмболизацией
. В большинстве случаев она дает возможность больному обойтись без хирургического вмешательства. Удаление новообразования происходит естественным путём.
Кроме того, метод эндоваскулярной эмболизации успешно применяют для перекрытия кровоточащего сосуда, предупреждая тем самым риск развития кровотечения и снижая вероятность возможных негативных для пациента последствий.
Проводятся эндоваскулярные процедуры под местной анестезией
, и буквально через несколько дней пациент может покинуть лечебное учреждение.
Виды церебральных мальформаций венозно-артериального русла
Патологические образования принято различать по топографо-анатомическому признаку, гемодинамической активности, размерам. Первый параметр характеризует место расположения мальформации в головном мозге, отсюда происходят их названия:
- поверхностные АВМ – сосредоточены в коре больших полушарий мозга (на поверхности мозга) и прилежащих структурах белого вещества;
- глубинные АВМ – локализуются в глубине мозговых извилин, базальных ганглиях, внутри желудочков, в структурах ствола ГМ.
По гемодинамической активности выделяют мальформации:
- активные – к ним причисляют смешанного вида АВМ ГМ (самая частая разновидность, при которой обнаруживается частичная деструкция капилляров) и фистулезного типа (артерия прямо переходит в вену, капиллярная сеть полностью разрушена);
- неактивные – капиллярные (телеангиоэктазии), венозные, артериовенозные кавернозные.
Поражение также оценивается по размерам, учитывается диаметр только клубка мальформации. При диагностике размеров используют следующие наименования АВМ:
- микромальформации – менее 10 мм;
- малые – от 10 мм до 20 мм;
- средние – 20-40 мм
- большие – 40-60 мм
- гигантские – более 6 см в диаметре.
Для предупреждения тяжелой геморрагии и связанных с ней необратимых осложнений крайне важно выявить и устранить очаг в ближайшее время, до разрыва. Почему? Объяснение куда более убедительное – при разрывах слишком большой процент людей погибает (до 75% пациентов) от обширного кровоизлияния, несопоставимого с жизнью.
Необходимо понимать, что сосуды АВМ слишком подвержены прорывам, так как они серьезно истощены на почве ненормального строения и нарушенного тока крови. Одновременно с этим, крупные порочные образования сдавливают и повреждают окружающие мозговые ткани, что несет дополнительную угрозу состоятельности функций ЦНС. Поэтому, если диагноз подтвержден клинически, оттягивать с лечением ни в коем случае нельзя.
Обсуждение
Аденозин является природным эндогенным пуриновым нуклеозидом, состоящим из молекулы аденина, присоединенной к рибозо-сахарному фрагменту (рибофуранозе) через бета-N9-гликозидную связь (6-амино-9-b-D-рибофуранозил-9-H-пурин) [3]. Аденозин снижает частоту сердечных сокращений и продлевает проводимость через синоатриальный и атриовентрикулярный узлы [4]. Вводимый в виде внутривенного болюса аденозин может вызывать преходящую асистолию с сопутствующей остановкой кровотока [5]. Он имеет короткий период полураспада (менее 10 с), что связано с быстрым обратным захватом эритроцитами и эндотелиальными клетками сосудов и ферментативным разрушением. Влияние на частоту сердечных сокращений развивается в течение 10—20 с после введения, продолжительность асистолии достигает плато от 40 до 60 с при дозе 1 мг на 1 кг массы тела. Относительный период гипотонии составляет 1 мин после асистолии [6]. В нашей серии период асистолии был несколько короче и находился в промежутке 10—20 с, после чего во всех случаях происходило полное восстановление параметров гемодинамики до исходного уровня.
Нам не удалось найти публикации, посвященные применению неадгезивных эмболизатов на фоне кардиального ареста в лечении АВМ у взрослых пациентов, однако первые сообщения о применении этой методики в сосудистой нейрохирургии появились уже в 80-х годах XX века [7—9] и посвящены открытой хирургии церебральных аневризм. В последние годы появились сообщения об использовании кардиоплегии в открытой хирургии церебральных АВМ. По мнению авторов, данная опция являлась чрезвычайно полезной в случае интраоперационного разрыва АВМ для облегчения поиска источника кровотечения [10]. Параллельно появились публикации, посвященные внутрисосудистой эмболизации АВМ на фоне кардиоплегии, однако основным применяемым эмболизирующим агентом является адгезивный клей [11—13]. Описание сочетания кардиоплегии с введением неадгезивного эмболизата нам удалось найти только в одной публикации, посвященной лечению АВМ вены Галена у детей [14], в которой авторы сообщают о безопасности и надежности применения этого метода в детском возрасте, хотя был проанализирован только один случай. Отдельно следует отметить факт отсутствия в нашей серии явлений тахифилаксии при повторном применении аденозина, что соответствует данным других авторов [5, 8].
Статистика заболеваемости и последствий патологии
Артериовенозная мальформация в структуре всех патологий с объемными образованиями в тканях головного мозга в среднем составляет 2,7%. В общей статистике острых нетравматических геморрагий в субарахноидальное пространство, 8,5%-9% случаев кровоизлияний происходят по причине мальформаций. Инсультов головного мозга – 1%.
Встречаемость заболевания происходит со следующей средней частотой в год: 4 случая на 100 тыс. населения. Некоторые зарубежные авторы указывают другую цифру – 15-18 случаев. Несмотря на врожденную природу развития, клинически проявляется только у 20%-30% детей. Причем возрастной пик обнаружения АВМ ГМ у детей приходится на младенчество (≈13,5%) и возраст 8-9 лет (столько же %). Считается, что у ребенка с таким диагностированным сосудистым нарушением риски разрыва гораздо выше.
Видео ангиографии:
По статистике, мальформации проявляют себя по большей мере в возрасте 30-40 лет, поэтому диагностируются чаще у людей именно этой возрастной группы. Заболевание обычно протекает скрыто в течение десятков лет, чем и объясняется такая тенденция его определения далеко не в детские годы. Половой закономерности в развитии церебральных АВМ у мужского и женского пола пациентов не обнаружено.
При наличии мальформации ГМ вероятность разрыва составляет от 2% до 5% в год, с каждым последующим годом риски увеличиваются. Если кровоизлияние уже состоялось, риск его повторного рецидива существенно возрастает, вплоть до 18%.
Летальные исходы из-за внутричерепного кровоизлияния, которое часто является первым проявлением болезни (в 55%-75% случаев), случаются у 10%-25% пациентов. Смертность вследствие разрыва, согласно исследованиям, больший процент имеет у детей (23%-25%), чем у взрослых людей (10%-15%). Инвалидизация от последствий заболевания отмечается у 30%-50% больных. Примерно к 10%-20% пациентов возвращается полноценное или приближенное к норме качество жизни. Причина такой грозной тенденции заключается в поздней диагностике, несвоевременном получении квалифицированной медицинской помощи.
Подготовка к лечению
- Не ешьте и не пейте ничего после полуночи до процедуры.
- Тем не менее можно принимать обычные лекарства. Если вы страдаете диабетом и принимаете инсулин, вам следует поговорить с врачом, так как может потребоваться корректировка обычной дозы инсулина.
- Вы должны сообщить своему врачу обо всех лекарствах, которые вы принимаете, включая травяные добавки. А также если у вас есть какие-либо аллергии, особенно к местным обезболивающим препаратам, общей анестезии или контрастным материалам, содержащим йод.
- Врач может посоветовать прекратить прием аспирина, нестероидных противовоспалительных препаратов или разбавителей крови в течение определенного периода времени перед процедурой.
Что такое эмболизация
Основной целью эмболизации является исключение патологически измененных сосудов из общей системы кровообращения. Для этого на проблемных участках перекрывают ток крови. Выполняется манипуляция способом введения специальных склерозирующих препаратов или мелкодиспенсерных наполнителей.
Само название процедуры полностью описывает суть процесса. В переводе с греческого «эмбол» означает «пробка». Патологически измененный участок сосуда буквально перекрывают. После этого организм самостоятельно формирует другие пути для нормального кровотока.
В чем же суть метода эмболизации маточных артерий?
В процессе эмболизации маточных артерий через тонкий (не более 1,5 мм) катетер в маточные артерии вводят специальные шарики — эмболы. Эмболы выполнены из специального медицинского полимера и имеют строго определенный размер. Они избирательно закрывают просвет артерий, питающих все миоматозные узлы в матке.
Эмболы в небольшом количестве могут попадать и в мелкие артерии, кровоснабжающие матку, но это не влияет на степень ее кровоснабжения, поскольку доля попавших туда эмболов минимальна, а разветвленная сеть сосудов позволяет быстро восстановить кровоснабжение здоровой части матки. Восстановления кровоснабжения в миоматозных узлах не происходит из-за отсутствия коллатеральной сети.
✅ Размер эмболов, применяемых для ЭМА, обычно варьирует в пределах 500–900 микрон.
✅ Врач выбирает необходимый размер в зависимости от типа эмбола и особенностей сосудистой сети миомы.
✅ Материал, из которого изготовлены эмболы, абсолютно биологически инертен и никак не взаимодействует с организмом.
Попав в сосуды, питающие миоматозные узлы, эмболы там и остаются. Они оказываются заключенными внутри скопления волокон фибрина и тромботических масс, образующихся в закупоренном сосуде. В процессе замещения узла соединительной тканью эмболы либо разрушаются, либо оказываются заключенными в массе соединительной ткани.
Уже через 5 минут после ЭМА сосудов миомы как таковых не остается — они полностью закрываются эмболами, фибрином и тромботическими массами. Эмболы никуда не могут «сдвинуться», «улететь» или «попасть». Напомним, что речь идет о сосудах диаметром не более 1 мм.
Эмболы, попадающие в сосуды, кровоснабжающие матку, могут через некоторое время выходить в процессе менструации, небольшая часть со временем также разрушается. Фактически с эмболами происходит все то же самое, что происходит с нитками, которыми хирурги шьют ткани во время операции.
Варикоцеле причины
Варикоцеле не вызывает болей, и лишь изредка может проявляться ноющими или тянущими ощущениями в яичке. В этом и заключается коварство этого заболевания, потому что убедить пациента, у которого ничего не болит, лечь под нож бывает непросто (хотя сегодня это, конечно, скорее не нож, а микрохирургический инструмент). А оперироваться необходимо, потому что из-за варикозного расширения вен семенного канатика возникает застой крови в яичке, страдает его кровоснабжение и повышается локальная температура. Все эти факторы, действуя исподволь и незаметно, приводят к нарушению процесса образования и созревания сперматозоидов, а в далеко зашедших случаях — к уменьшению размеров и атрофии яичка. Чем раньше провести лечение варикоцеле, тем больше шансов предотвратить негативные последствия для организма мужчины.
У пациентов с варикоцеле нередко обнаруживаются патологические изменения в спермограмме. Наиболее часто встречается олигозооспермия (уменьшение концентрации сперматозоидов менее 15 млн в мл), астенозооспермия (снижение концентрации прогрессивно подвижных сперматозоидов до 32% и менее), тератозооспермия (большое количество патологических форм сперматозоидов, превышающее 96%). Для варикоцеле характерно повреждение и фрагментация ДНК сперматозоидов.
Несколькими исследованиями последних лет подтверждена взаимосвязь между варикоцеле и снижением уровня тестостерона, эректильной дисфункцией. Так, в 2011 г. группа индийских ученых во главе с Сатиа Срини (Sathya Srini V.) опубликовала результаты лечения 200 пациентов с гипогонадизмом и эректильной дисфункцией в сочетании с варикоцеле. Часть этих пациентов получала гормоно-заместительную терапию, другая часть подверглась хирургическому лечению варикоцеле. У 78 % пациентов, подвергшихся операции по устранению варикоцеле, достигнута нормализация уровня тестостерона с улучшением эректильной функции. Схожие результаты были продемонстрированы польским урологом Д. Падуч. В его исследовании бесплодных мужчин с варикоцеле и гипогонадизмом, у 76% после хирургического лечения варикоцеле достигнута нормализация тестостерона и улучшение половой функции.
Материалы, используемые для этой процедуры:
- Рентгенографический стол, одна или две рентгеновских трубки и телевизионного монитора для наблюдения за ходом процедуры и ее руководства.
- Катетер, который представляет собой длинную тонкую пластиковую трубку.
- Эмболический агент, который подбирается в зависимости от размера кровеносного сосуда: Желатиновый губчатый материал, который разрезают на мелкие кусочки и вводят в артерию, в период от нескольких дней до двух недель материал растворяется. Такой агент используется для контроля кровотечения до тех пор, пока причина не может быть идентифицирована и исправлена.
- Пропитанные желатином акриловые полимерные сферы, которые вводятся в кровоток для блокирования небольших сосудов. Эти агенты используются для непрерывного блокирования или закрытия сосудов.
- Для блокирования больших сосудов используются металлические катушки различного размера из нержавеющей стали или платины.
- Жидкие склерозирующие агенты, используемые для разрушения кровеносных сосудов.
- Жидкий клей.
Ощущения во время и после процедуры ЭМА
К телу будут прикреплены электроды для контроля за сердечной деятельностью и регистрацией каждого сокращения сердца на компьютер. Ощущается укол, когда игла вводится в бедренную артерию для внутривенной инфузии.
После проведения легкой седатации наступает расслабленность и сонное состояние, можно бодрствовать или спать, в зависимости от желания.
Во время вставления катетера чувствуется небольшое давление, но не боль. При введении контраста ощущается жар в паху и иногда металлический привкус во рту.
После процедуры ЭМА в течение 24–48 часов возможно появление болевого синдрома в нижней части живота, иногда ощущение судорог в области таза. Самые интенсивные боли и судороги отмечаются в первые сутки после выполнения ЭМА и быстро уменьшаются в течение следующих нескольких дней. При нахождении в клинике назначается адекватное обезболивание.
Возвращение к своей обычной деятельности происходит в течение 7-10 дней после ЭМА.
После проведения ЭМА возможен пропуск одного или двух менструальных циклов или в очень редких случаях и при обширных миомах возможно полное прекращение менструации. Полное исчезновение симптомов, как правило, занимает от двух до трех недель, и в течение месяца миома будет сокращаться и смягчаться. По прошествии шести месяцев процесс заканчивается, клиническая картина и самочувствие стабилизируются.
Реабилитация
Восстановление не отнимет много времени. Первые сутки после эмболизации пациент находится в стационаре. Рекомендуется давящая повязка и полный покой. Если доступ осуществлялся через бедренную артерию, нельзя двигать конечностью, в которой сделан прокол. По истечении 24 часов, если состояние пациента нормальное, его выписывают домой.
В первые дни после эмболизации рекомендовано избегать физических нагрузок и перегрева. В дальнейшем после консультации с врачом можно вернуться к привычному ритму жизни.
Какое оборудование используется при проведении ЭМА
При проведении ЭМА в нашей клинике используется ангиографический комплекс Philips Allura CV20 (производства Германии, 2014 года выпуска), одноразовые катетеры и проводники (пр-ва США), а также эмболы на выбор пациента производства России, США или Японии.
Ангиографический комплекс состоит из прозрачного рентгенологического стола, и С–образной рентгеновской трубки, генерирующей сверхмалые дозы облучения и обеспечивающие максимальную визуализацию кровеносных артерий, в том числе капиллярного порядка. Высокая разрешающая способность ангиографического комплекса исключает возможность врачебной ошибки и минимизирует возможные теоритические осложнения. Весь ход операции и диагностики фиксируется в компьютере и может быть записан на индивидуальный магнитный носитель (CD–диск или флэш–карту) пациента.
Все используемые во время процедуры ЭМА инструменты и расходные материалы имеют Регистрационные Удостоверения Росздравнадзора и разрешение к обороту на территории Российской Федерации.
Материал и методы
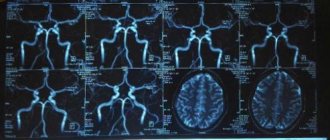
В отделении хирургии сосудов головного мозга Российского научно-исследовательского нейрохирургического института имени профессора А.Л. Поленова — филиала ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России в 2018 г. прооперировано 13 пациентов с церебральными АВМ путем эмболизации неадгезивными эмболизатами на фоне аденозин-индуцированной кардиоплегии. Оценку необходимости выполнения кардиоплегии проводили на дооперационном этапе по данным спиральной компьютерной томографии и магнитно-резонансной томографии сосудов, а также по данным предоперационной селективной ангиографии. Особое внимание обращали на наличие высокоскоростных артериовенозных фистул (АВ-фистул), представляющих собой расширенный афферентный сосуд, напрямую впадающий в расширенную вену или венозную лакуну. Следует обратить внимание на то, что подобных фистул в структуре даже одной АВМ может быть несколько. Заполнение дренажных вен в ранней артериальной фазе также считали признаком наличия высокопотоковой АВ-фистулы. Мужчин было 9, женщин — 4. Средний возраст составил 36,2 года (21—58). Распределение АВМ по шкале Spetzler—Martin (SM) представлено в табл. 1.
Таблица 1. Распределение пациентов по шкале Spetzler—Martin
Примечание. SM — шкала Spetzler—Martin.
АВМ располагалась в лобной доле у 1 пациента, в теменной — у 2, в затылочной — у 3; занимала более одной доли в 5 случаях. Субтенториальные АВМ установлены у 2 пациентов. Сочетание АВМ с церебральными аневризмами выявлено у 5 больных, при этом в нашей серии все аневризмы располагались в бассейнах, не заинтересованных в кровоснабжении АВМ. Геморрагический тип течения отмечен у 3 пациентов, эпилептический — у 5, другие варианты течения — у 5. Все пациенты до операции осмотрены кардиологом, всем рутинно выполнены электрокардиография и эхокардиография, по показаниям применялись стресс-тесты. Абсолютными противопоказаниями к проведению данного метода считали наличие атриовентрикулярной блокады II и III степени, нестабильной стенокардии. Для эмболизации использовали DMSO-совместимые микрокатетеры Sonic (BALT EXTRUSION SAS, Франция) и неадгезивные эмболизаты ONYX (EV3 International Inc., США и SQUID Embo Flüssigkeiten AG, Швейцария).
Клиническое наблюдение
Больная К., 33 года, обратилась за медицинской помощью в Университетскую хирургическую клинику им. В.С. Савельева 12.09.17 с жалобами на боли в нижних отделах живота, тяжесть в гипогастральной области, усиливающиеся после физической нагрузки, боли после полового акта. Указанные симптомы возникли 4 года назад, после третьих родов. Выраженность тазовой боли по визуально-аналоговой шкале (ВАШ) оценивалась в 8 баллов. Индекс массы тела (ИМТ) больной составлял 18,5 кг/м2. Пациентка неоднократно была обследована амбулаторно гинекологом, хирургом, невропатологом, при этом заболеваний внутренних половых органов, мочевыделительной и костно-суставной системы, толстого кишечника не было выявлено.
По данным ультразвукового исследования (УЗИ) органов малого таза были обнаружены расширенные вены матки и придатков. Местный статус: единичные телеангиоэктазии на обеих голенях. Варикозных вен на промежности, ягодицах, нижних конечностях нет. Отека нижних конечностей нет. В ходе дообследования при ультразвуковом ангиосканировании (УЗАС) вен таза были зарегистрированы расширение и клапанная недостаточность левой гонадной, параметральных и маточных вен. Диаметр левой овариальной вены составлял 7 мм, параметральных вен — 10 мм, маточных вен — 6 мм. Продолжительность рефлюкса крови по указанным сосудам превышала 2 с.
При оварикографии и тазовой флебографии было зафиксировано расширение левой гонадной вены до 7 мм с рефлюксом контрастного препарата в гроздьевидное венозное сплетение и его «перетоком» по аркуатным венам на противоположную сторону (слева направо). Случай расценен как варикозная болезнь таза, СТВП. Правосторонним трансфеморальным бедренным доступом пациентке была выполнена эмболизация левой овариальной вены 4 металлическими спиралями 0,035″ MReye (Cook Medical, США) с вплетенными длинными коллагеновыми волокнами размером 8×10 см (рис. 1).
Рис. 1. Оварикограммы больной К. а — левая гонадная вена до эмболизации; б — рефлюкс контрастного вещества в левые параметральные вены с «перетоком» на противоположную сторону; в — левая гонадная вена со спиралями в ней, рефлюкса контрастного вещества дистальнее окклюзии вены нет. Указано стрелками.
Периоперацонный период протекал без осложнений. На 3-и сутки после операции больная отметила уменьшение ВТБ по ВАШ с 8 до 5 баллов. Пациентка была выписана на амбулаторное лечение, ей был рекомендован прием диосминсодержащего веноактивного препарата.
Через 1 мес после эмболизации у пациентки началось усиление болевых ощущений в левой подвздошно-паховой области (до 8 баллов по ВАШ) с иррадиацией в левую нижнюю конечность. По данным повторного УЗАС вен таза признаков тромбоза внутритазовых вен, забрюшинной гематомы в зоне эмболизации левой гонадной вены не выявили (рис. 2).
Рис. 2. Ультразвуковые ангиосканограммы больной К. через 1 мес после эндоваскулярной эмболизации левой гонадной вены. а — спираль в просвете гонадной вены (1); кровоток краниальнее места окклюзии сосуда (2). Жидкостных образований в проекции гонадной вены нет; б — спирали в просвете гонадной вены (3), кровоток в зоне эмболизации не визуализируется. Указано стрелками.
Учитывая возможность развития постэмболизационного синдрома, больной было рекомендовано продолжить венотоническую терапию, принимать диклофенак в дозе 75 мг 2 раза в день в течение 5 сут. На фоне лечения боли несколько уменьшились (до 6 баллов по ВАШ), однако после прекращения приема диклофенака вновь усилились до первоначального уровня (8 баллов).
Дальнейшая консервативная терапия эффекта не имела, боли в левой подвздошно-паховой области сохранялись. В анализах крови и мочи патологических изменений не определялось. Больная была осмотрена гинекологом, урологом, неврологом, ей были выполнены УЗИ органов малого таза, мочевыделительной системы — какой-либо патологии не было обнаружено. На протяжении 2 мес повторные ультразвуковые (выполняли 4 раза) и флебографические (1 раз) исследования указывали на отсутствие рефлюкса крови по левой и правой гонадным венам, депонирования контрастного вещества в параметральных и маточных венах. По данным компьютерной томографии с контрастным усилением экстравазации контрастного вещества, миграции спиралей либо дисклокации витков спиралей за пределы гонадной вены не было зарегистрировано. Было высказано предположение, что болевой синдром обусловлен протрузией металлической спирали сквозь стенку левой гонадной вены, механическим контактом ее витков с левым бедренно-половым нервом. Было принято решение удалить левую овариальную вену со спиралями ретроперитонеальным эндоскопическим способом. Во время операции у больной было отмечено скудное количество забрюшинной жировой клетчатки. После мобилизации левой яичниковой вены выявили протрузию 2 витков спирали в средней трети сосуда, перфорацию концевой части одной из спиралей, проекционно совпадающих с расположением левого бедренно-полового нерва (рис. 3).
Рис. 3. Этапы операции ретроперитонеальной эндоскопической резекции левой гонадной вены (ЛГВ) с находящимися в ней спиралями. а — спираль в просвете ЛГВ; б — концевой участок спирали, перфорирующий вену; в — клипирование сосуда; г — удаленный участок вены со спиралями. Указано стрелками.
Вена была удалена вместе со спиралями на протяжении 12 см. В послеоперационном периоде осложнений не наблюдалось. Выраженность послеоперационной боли в 1-е сутки составила 4 балла по ВАШ. Больная была выписана из стационара на 2-е сутки после хирургического вмешательства. При осмотре через 1 мес болевые ощущения в левой подвздошно-паховой области значительно уменьшились — до 2 баллов по ВАШ. Дальнейшее наблюдение за больной в течение года свидетельствовало о полном купировании болевого синдрома.
Каковы преимущества сосудистой эмболизации?
- Малая инвазивность процедуры – она не требует наложения швов и не оставляет после себя крупных послеоперационных шрамов.
- Минимальный риск инфекционных осложнений.
- Часто нет необходимости использовать общую анестезию, которая всегда становится серьезной нагрузкой для ослабленного организма онкобольного.
- Минимальное время восстановления после вмешательства.
- Высокая эффективность в сравнении с традиционной системной химиотерапией.
- Сохранение целостности и функциональной активности органов и тканей.