Терапевт-участковый
Бурнацкая
Светлана Николаевна
Стаж 33 года
Врач-терапевт участковый, профпатолог. Член Российского научного медицинского общества терапевтов
Записаться на прием
Агранулоцитоз – это тяжелое патологическое состояние. При нем отмечается критическое снижение в крови гранулоцитов. Гранулоциты являются важной фракцией лейкоцитарного ряда (нейтрофилы, эозинофилы и базофилы). При этом концентрация базофилов и эозинофилов в крови в состоянии нормы имеет небольшой процент, поэтому изменение их количества не оказывает значительного влияния. Так, можно утверждать, что именно снижение концентрации нейтрофилов ведет к развитию агранулоцитоза крови. Отсюда и второе название патологии – нейтропения.
Специалисты поднимают вопрос о агранулоцитозе у пациента при снижении лейкоцитов в крови ниже 1×109/л и гранулоцитов ниже 0,75×109/л. Поскольку лейкоциты и грануцолиты выполняют защитную функцию от болезнетворных микроорганизмов, то уменьшение их концентрации снижает способность организма сопротивляться инфекциям и вирусам. Развитие агранулоцитоза практически всегда сопровождается развитием различных инфекционных процессов, это могут быть язвенные стоматиты или ангины, пневмонии, геморрагических проявления и т.д.
В зависимости от концентрации гранулоцитов определяется и тяжесть патологии периферической крови. Чем меньше их концентрация, тем тяжелей степень всего выделяют три степени: легкая, средняя и тяжелая. При тяжелой степени показатель концентрации гранулоцитов ниже 0,4×109/л.
У женщин агранулоцитоз встречается чаще. У мужчин данное заболевание диагностируется в среднем в 2-3 раза реже. В большинстве случаев проявление патологии встречается в возраст после 40 лет.
Симптоматика и признаки
Поскольку патология имеет несколько форм, то и симптомы агранулоцитоза разных типов отличаются. Для иммунного типа характерен острый агранулоцитоз со следующей симптоматикой:
- резкая слабость и потливость;
- температура тела до 39-40°С;
- бледность;
- появление инфекционных стоматитов;
- воспаление глотки и миндалин;
- воспаление десен;
- боль в горле и спазм жевательной мускулатуры.
Миелотоксический и аутоиммунный типы прогрессируют постепенно и также постепенно у них возникают симптомы:
- геморрагические симптомы в виде носового кровотечения, кровотечения десен и пр.;
- наличие крови в моче;
- возникновения синяков, гематом;
- боли в животе и вздутие, диарея, если поражен кишечник;
- возможное появление болей в грудной клетке при дыхании.
Строение
Лимфоциты
Различают крупные (от 10 до 18 мкм), средние (от 6,5 до 10 мкм) и малые (от 4,5 до 6,5 мкм) формы. В крови человека циркулируют преимущественно мелкие лимфоциты, размер которых не превышает в диаметре 7-10 мкм. Крупные лимфоциты находятся в крови только у новорожденных. У взрослых людей крупные клетки локализуются в органах (печени, легких, почках) и играют роль натуральных киллеров.
Строение их таково, что большую часть клетки занимает темное ядро бобовидной или округлой формы. Лимфоцит содержит небольшое количество светло-синей цитоплазмы, в которой находятся лизосомы (органоиды, включающие ферменты). Цитоплазма обычно видна как ободок вокруг ядра. Лимфоциты нередко выглядят как фиолетовые шарики из-за того, что цитоплазма как будто сливается с ядром.
Моноциты
Это самые большие белые клетки, их размер в диаметре – от 12 до 20 мкм. Красновато-фиолетовое ядро может иметь разные формы: бобовидную, в виде подковы, бабочки, гриба и др. Оно занимает равную с цитоплазмой или большую часть клетки.
Цитоплазма светло-голубая или дымчатая, около ядра светлее, на периферии окрашена более интенсивно. В ней содержатся очень мелкие лизосомы, которые обычно расположены ближе к ядру. В цитоплазме могут находиться вакуоли, везикулы, гранулы пигментов, фагоцитированные клетки.
Причины возникновения
Возникновение агранулоцитоза может иметь разные причины, в зависимости от которых осуществляется классификация патологии.
Виды недуга
Миелотоксический агранулоцитоз – результат оказания воздействия различных неблагоприятных факторов на красный костный мозг. Под их воздействием наступает глубокая депрессия ответственного за выработку гранулоцитов кроветворного отростка. Под неблагоприятными факторами следует понимать внутренние заболевания организма и внешние неблагоприятные воздействия. Примеры внешнего воздействия: отравление веществами и ядами, подавляющими кроветворение (ртуть, мышьяк, бензол и др.), радиоактивное облучение, прием миелотоксических препаратов. Среди болезней, которые наиболее часто становятся причиной агранулоцитоза, специалисты выделяют острый лейкоз, саркому и метастаз в красный костный мозг, хронический миелолейкоз.
Иммунный агранулоцитоз – характеризуется разрушением гранулоцитов в крови вследствие возникновения в организме патологических иммунных реакций. Данный вид дополнительно делится на следующие формы агранулоцитоза.
- Аутоимунный – возникает в большинстве случаев на фоне заболеваний соединительной ткани. К ним относят, например, ревматоидный артрит или системную красную волчанку.
- Гаптеновый агранулоцитоз или лекарственный – развивается при участии в иммунных реакциях гаптенов. Гаптены сами по себе являются безвредными веществами, но при определенных ситуациях и реакциях могут стать причиной разрушения гранулоцитов. В роли гаптенов чаще всего выступают лекарственные препараты, которые пациент принимает в рамках терапии различных заболеваний. Отсюда и второе название патологии – «лекарственный».
- Генуинный – данный вид устанавливается пациенту в тех случаях, когда диагностика не выявила причин снижения гранулоцитов в токах крови.
Агранулоциты: их характеристика, свойства и участие в иммунном ответе
Говоря об учёных XIX – начала XX веков, я неизменно поражаюсь тому, насколько обширны были области их исследовательских интересов и притязаний. Тем не менее каждый из великих мира сего имел определённые заслуги, благодаря которым человечество особенно выиграло и шагнуло вперёд в понимании тех или иных законов природы. И вот, когда речь заходит о великом русском физиологе (иммунологе, биологе, эмбриологе и далее по списку) Илье Мечникове, я каждый раз невольно представляю его себе воином на коне, ведущим за собой армию макрофагов, ибо именно этот человек первым осознал роль данных клеток, присущих всем организмам от эхинодермы до позвоночных. Позднее, в 1960-х годах, уже ван Фурт и Кон определили систему мононуклеарных фагоцитов как общность агранулярных миелоидных клеток, которые, как нам теперь известно, играют важнейшую роль в обновлении тканей, поддержании гомеостаза и стимуляции и регуляции как врождённого, так и приобретённого иммунитета. Вообще в систему мононуклеарных фагоцитов входят клетки трёх типов: полностью дифференцированные макрофаги и дендритные клетки (которые, в свою очередь, тоже подразделяются на множество субпопуляций), а также моноциты.
Под, собственно, моноцитами понимают циркулирующие клетки крови, составляющие около 10% всех лейкоцитов периферической крови человека. В кровеносное русло моноциты поступают из костного мозга, где и развиваются из общей для агранулоцитов и гранулоцитов миелоидной клетки-предшественницы. Не в последнюю очередь по причине непродолжительности пребывания моноцитов в циркулирующей крови (около 3-х суток у человека) данная среда считается резервуаром миелоидных предшественников, обеспечивающих постоянное обновление пула тканевых макрофагов и, в частности, короткоживущих дендритных клеток.
Рис. 1. Система мононуклеарных фагоцитов.
Развивающиеся макрофаги обнаруживаются в уже желточном мешке, что определяется как по морфологическим характеристикам, так и согласно экспрессии макрофагальных маркеров (например, FMS, CD11b, рецептор маннозы). Позднее, когда запускается гемопоэз в печени плода, она становится основным источником макрофагов, которые напоминают те, что наблюдаются во взрослом организме, однако количество макрофагов, заселяющих органы эмбриона, превышает таковое у взрослого человека. Моноциты могут играть роль предшественников, которые, дифференцируясь, пополняют пул тканевых макрофагов, но все же большая их часть образуется в ходе локальной пролиферации предшественников, чем в результате рекрутинга моноцитов из периферической крови.Моноциты выходят из костного мозга в кровеносное русло, имея фенотип Ly6C+, и изменяются впоследствии, давая начало еще одному фенотипически отличающемуся подтипу (Ly6C-).
Изначально моноциты, циркулирующие с кровью, пытались классифицировать, основываясь на клеточной морфологии и их удельной плотности. Однако данные характеристики довольно разнородны и не обладают должной специфичностью, поэтому различать моноциты исключительно по гистологическим признакам весьма затруднительно. Первые мысли о том, что, вероятно, моноциты могут быть подразделены на подтипы, которым присущи различные физиологические признаки, закрались тогда, когда были выявлены две первые субпопуляции моноцитов, отличающихся как по морфологии, так и по дифференциальной экспрессии антигенных маркеров – CD14 и CD16. Клетки с фенотипом CD14hi CD16 относят к классическим моноцитам, поскольку высокий уровень экспрессии CD14 и экспрессия CD16 были характерны для впервые описанных моноцитов. Второй основной подтип моноцитов характеризуется, помимо экспрессии CD14 и CD16 (обозначаются как CD14+ CD16+), повышенным уровнем молекул главного комплекса гистосовместимости II класса и CD32 (также известен как FcγRII), в связи с чем было высказано предположение, что данные клетки похожи на зрелые тканевые макрофаги. Помимо различий в степени экспрессии основных антигенных маркеров, оба вышеописанных подтипа моноцитов проявляют различия относительно экспрессии хемокиновых рецепторов (например, моноциты CD14hi CD16 экспрессируют С-С рецептор хемокина 5 (CCR5), тогда как для CD14+ CD16+ характерна экспрессия CCR2). Тем не менее при культивировании обоих подтипов моноцитов в присутствии GM-CSF и IL-4 и те, и другие дифференцируются до дендритных клеток. А в экспериментах in vitro с использованием модели трансэндотелиальной миграции мононуклеарные клетки, изолированные из периферической крови при инкубации с монослоем эндотелиальных клеток пупочной вены человека на коллагеновой матрице, мигрировали, минуя эндотелиальный барьер, и дифференцировались в макрофаги, которые оставались в субэндотелиальном матриксе либо превращались в дендритные клетки, мигрирующие обратно сквозь слой эндотелиоцитов.
Моноциты крови берут свои истоки в костном мозге, образуясь из гемопоэтических стволовых клеток путём последовательного коммитирования и дифференцировки предшественников. Первейшими клетками, с которых начинается путь дифференцировки до моноцитов, являются общая миелоидная клетка-предшественница и гранулоцитарно-макрофагальный предшественник. Кроме того, в 2006 году были описаны специфические клоногенные предшественники, обнаруженные в костном мозге, которые, в отличие от гранулоцитарно-макрофагальных предшественников, не дают начало гранулоцитарному, лимфоидному, эритроидному или мегакариоцитарному росткам, а обеспечивают прирост лишь нескольких подвидов макрофагов и резидентных дендритных клеток. Сообразно тому, каким клеткам дают начало такие предшественники, они и были названы предшественниками макрофагальных и дендритных клеток (MDP), всё просто. Микроокружение костного мозга потенцирует MDP к дифференцировке в моноциты, которые впоследствии выходят в кровь.
С точки зрения эволюции, система приобретённого иммунитета млекопитающих представляет собой венец всевозможных иммунных реакций с позиции её сложности и молекулярной специфичности. В отличие от клеток, относящихся к системе врождённого иммунитета и распознающих типичные мотивы, ассоциированные с широким спектром патогенов, за счёт рецепторов, кодируемых множественными зародышевыми генами, клетки системы приобретённого иммунитета могут быть обеспечены практически неиссякаемым разнообразием антиген-распознающих рецепторов, что происходит благодаря одному из механизмов соматической рекомбинации (V(D)J-рекомбинация), который, кроме прочего, является основой существования иммунологической памяти у клеток за счёт дифференцировки, распространения и поддержания персистенции долгоживущих антиген-специфических лимфоцитов. Являясь прямыми эффекторами системы иммунитета и реализуя цитотоксические свойства, а также продуцируя антитела, лимфоциты в то же время выполняют и роль ключевого регулятора иммунного ответа, усиливая или ослабляя его, оказывая влияние на различные типы клеток по механизму положительной или отрицательной обратной связи.
Разберём чуть подробнее механизм рекомбинации, благодаря которому становится возможным разнообразие антиген-распознающих рецепторов у лимфоцитов. V(D)J-рекомбинация служит основой разнообразия В-клеточных рецепторов вследствие того, что в формирующихся В-клетках гены, кодирующие тяжёлые и лёгкие цепи иммуноглобулинов, составляются из нескольких различных генных сегментов. Развитие В-лимфоцитов начинается в печени у плода с дифференцировки плюрипотентных гемопоэтических стволовых клеток (ГСК) и происходит впоследствии в костном мозге.
ГСК дифференцируются до прогениторных В-клеток, которые при помощи фактора транскрипции Pax5 достигают стадии зрелых В-клеток и приобретают поверхностный маркер c-kit, а также CD19, характерный для всех стадий дифференцировки В-лимфоцитов, кроме плазматических клеток. Именно на стадии прогениторных В-клеток осуществляется соматическая рекомбинация ДНК в локусе тяжёлой цепи иммуноглобулинов (IgH-локус), что заключается в образовании функционального VDJ-экзона, состоящего из V- (variable), D- (diversity) и J- (joining) сегментов. Данный экзон кодирует V-регион тяжёлой цепи иммуноглобулина и образует совместно с V-регионом лёгкой цепи антигенсвязывающий участок мембраносвязанных В-клеточных рецепторов. V(D)J-рекомбинация в IgH-локусе протекает в 2 этапа, для чего данный участок ДНК прежде претерпевает модификационные преобразования хроматина и только потом становится доступным для изменений: сначала на этапе ранних прогениторных клеток в обоих аллелях путём негомологичной рекомбинации объединяются D и JH-сегменты, а затем, уже в поздних прогениторах В-клеток, становится доступным для взаимодействия VH-сегмент, расположенный сразу после вышеупомянутых участков, и при сокращении локуса VH-сегмент присоединяется к уже реаранжированным сегментам D и J. Безусловно, сложный процесс V(D)J-рекомбинации требует участия многочисленных ферментов, среди которых стоит назвать RAG1 и RAG2 (Recombination-activating Genes 1 and 2), специфичные для лимфоцитов, а также присущие всем клеткам ферменты и системы репарации двойных разрывов ДНК, такие как Ku70, Ku80, XRCC4, ДНК-лигаза IV, ДНК-зависимые протеинкиназы (DNA-PK), Artemis.
RAG распознают специфические рекомбинационные сигнальные последовательности (RSS – recombination signal sequences), окружающие сегменты генов иммуноглобулинов, и инициируют V(D)J-рекомбинацию, разрывая обе цепочки ДНК между сегментами генов Ig и находящимися по соседству от них RSS. Свободные 3’-OH концы сегментов связываются с комплементарными цепями, образуя шпилечные структуры (их называют кодирующими соединениями, Coding Joint), а RSS соединяются своими свободными концами и формируют сигнальные соединения – Signal Joint. Получившиеся шпилечные структуры снова раскрываются с помощью эндонуклеазы Artemis за счёт разрыва одной из цепей, а после процессинга экзонуклеолитические свойства Artemis и полимераз обеспечивают соединение генных сегментов друг с другом с формированием тупых концов ДНК. Важно обратить внимание на тот момент, что шпилечные структуры не должны раскрываться в тех же самых местах (на уровне тех же оснований), где изначально произошло их объединение, а потому лежащая между ними нуклеотидная последовательность может быть отзеркалена, в результате чего образуются палиндромные нуклеотиды (Р-нуклеотиды).
Разнообразие возможных сочетаний сегментов (помимо рекомбинаторного разнообразия) увеличивается как раз за счёт Р-нуклеотидов, а также за счёт случайным образом добавляемых терминальной дезоксинуклеотидилтрансферазой нешаблонных нуклеотидов. Чтобы обеспечить непосредственно рекомбинацию V и D / D и J сегментов, RSS задействованных в рекомбинации участков различаются. Между относительно консервативными гепта- и нонамерными последовательностями (CACAGTG и ACAAAAACC соответственно), встречающимися во всех RSS, располагаются спейсерные последовательности, которые у RSS сегментов V и J составляют 23 пары оснований, а в пределах RSS, ограничивающих с двух сторон сегмент D, спейсеры охватывают 12 пар оснований. Таким образом, за счёт наличия спейсеров предотвращается прямое взаимодействие между сегментами V и J в IgH-локусе, поскольку V(D)J-рекомбинация осуществляется по большому счёту почти исключительно между RSS со спейсерами различной длины (правило 12/23).
После перестройки сегментов гена, ответственных за структуру тяжёлой цепи иммуноглобулина, происходит непосредственно её синтез. Получившиеся тяжёлые цепи связываются с суррогатными лёгкими цепями, состоящими из белков VpreB и λ-подобного белка, и сигнальными молекулами Igα и Igβ, формируя вместе рецепторный комплекс пре-В. Данный комплекс перемещается на поверхность клетки, где он способен воспринимать и проводить сигналы, способствующие дифференцировке клеток в ранние пре-В-лимфоциты и их клональной экспансии. Кроме того, сигналы, проводимые посредством пре-В комплекса, ингибируют рекомбинацию в IgH-локусе.
Рис. 2. RAG-опосредованные перестройки генных сегментов.
Иногда же V(D)J-рекомбинация не обходится без ошибок и бывает так, что происходит смещение рамки считывания вследствие дополнительно встроенных Р- или N-нуклеотидов или, наоборот, из-за их выпадения. В таких случаях получившийся VDJ-экзон оказывается нефункционален, и рекомбинация продолжается во втором аллеле гена. Если и вторая перестройка не удаётся, то в таком про-В-лимфоците не осуществляется проведения сигналов, позволяющих клетке жить и продолжать дифференцировку, и запускается её апоптоз.
Но вернёмся к нормальным клеткам, для которых рекомбинация в IgH-локусе завершилась образованием продуктивного VDJ-экзона и синтезом способной к связыванию тяжёлой цепи. Экспрессия рецепторного комплекса пре-В неизменно означает для такой клетки переход к стадии раннего прекурсора В-лимфоцитов, что сопровождается потерей клеткой маркера c-kit и прекращением экспрессии терминальной дезоксинуклеотидилтрансферазы. Кроме того, активность RAG1 и RAG2 временно прекращается. Вместо этого ранние пре-В-лимфоциты экспрессируют CD25 и вступают в непродолжительную пролиферационную фазу, охватывающую 4-6 циклов клеточного деления, цель которой состоит в увеличении количества пре-В-лимфоцитов, обладающих функционально активными IgH-цепями, способными формировать комплексы с IgL-цепями. Подобная селективная клональная экспансия пре-В-клеток вносит существенный вклад в расширение спектра Ig, поскольку каждая новая клеточка-предшественница будущего В-лимфоцита имеет свою собственную, не похожую на другие L-цепь, а следовательно, приобретает и Ig-рецептор с новой, характерной только данной клетке специфичностью.
Если быть совсем точным, то клональная экспансия ранних прекурсоров ведёт к их дифференцировке в мелкие покоящиеся пре-В-лимфоциты, в которых по аналогии с перестановками в IgH-локусе передислоцируются κ- и λ-локусы лёгких цепей иммуноглобулинов; после перестройки гена IgL синтезируется IgL-цепь, которая, объединяясь с IgH-цепью, становится частью В-клеточного рецептора, необходимого для перехода клетки на стадию незрелого В-лимфоцита. После того, как полный В-клеточный рецептор экспрессируется на поверхности клетки, незрелые В-лимфоциты подвергаются негативной селекции, в ходе которой их рецепторы проходят проверку на аутоагрессию. Выявленные клетки с аутоагрессивными свойствами могут быть апоптотически уничтожены, а могут и избавиться от аутореактивных рецепторов, будучи вовлечёнными в процесс вторичной перестройки Ig-локусов их рецепторов.
Итак, ткани и органы лимфатической системы, находясь в тесной взаимосвязи между собой, обеспечивают организму защиту от чужеродных агентов. Говоря непосредственно о системе приобретённого иммунитета, первое, о чём стоит упомянуть, это антигенпрезентирующие клетки, которые мигрируют из очага инфекции в ближайшие регионарные лимфоузлы, где презентируют микробные антигены интактным Т-клеткам. Сталкиваясь с «распознанным» антигенпрезентирующими клетками антигеном, интактные Т-клетки начинают активно делиться, в результате чего в течение нескольких дней происходит дифференцировка как эффекторных Т-лимфоцитов, которые направляются в очаг инфекции и занимаются элиминацией чужеродных агентов, так и Т-клеток памяти, которые, персистируя в кровеносном русле, готовы поддержать иммунный ответ на вторичную инфекцию.
Собственно, поэтому лимфоциты, как правило, рассматривают как клетки, характерные для лимфоидных органов и циркулирующие в крови, однако, не стоит забывать, что существуют также резидентные типы лимфоцитов, присутствующие в нелимфоидных тканях (особенно это касается кожи и слизистых оболочек). К специализированным резидентным тканевым лимфоцитам относятся лимфоидные клетки врождённого иммунного ответа (innate lymphoid cells; ILC), тканевые Т-клетки памяти (tissue-resident memory T cells; TRM), а также особые типы Т-лимфоцитов, такие как инвариантные естественные киллеры (iNKT), инвариантные Т-лимфоциты, ассоциированные со слизистыми (MAIT-клетки), γδ T-клетки и интраэпителиальные лимфоциты (IEL) CD8aa+.
Рис. 3. Тканевые и циркулирующие лимфоциты и их функции.
Чтобы яснее представлять себе роль тканерезидентных лимфоцитов, обратимся к тому, чем же эти клетки отличны от тех, что циркулируют с током крови. Первое, что стоит упомянуть – это их способность к самообновлению вне зависимости от циркулирующих прекурсоров. Значительная часть пула тканевых лимфоцитов концентрируется в барьерных тканях. Также важным свойством данных клеток является широкий спектр микробных антигенов и сигналов от других клеток организма, которые они способны распознавать и воспринимать, получая тем самым информацию о воспалении, развитии инфекционного процесса и повреждении тканей.
Активация тканевых лимфоцитов осуществляется при помощи полуинвариантных антигенных рецепторов, NK-активирующих рецепторов и рецепторов аларминов и цитокинов. Полуинвариантные рецепторы, присущие iNKT-клеткам, напоминают паттерн-распознающие рецепторы и узнают гликолипиды, обладающие α-аномерной гликозидной связью, кои нередко характерны для патогенных бактерий и могут непосредственно запускать сигнальные внутриклеточные реакции после связывания с данными рецепторами. Тем не менее даже в отсутствие мощных микробных антигенов Т-лимфоциты могут быть активированы низкоаффинными эндогенными лигандами, конкурентно стимулируемыми цитокинами, как правило, IL-12 и IL-18. Это наталкивает на размышления о том, что активация iNKT не обязательно сопровождает инфекционные процессы, а может быть вызвана также в ответ на метаболический стресс, характеризующийся нарушением синтеза и обмена гликолипидов.
Для некоторых субпопуляций интраэпителиальных лимфоцитов также характерна реакция на эндогенные лиганды, сопряжённые с нарушением обменных процессов в тканях. И наконец, заключительной особенностью тканерезидентных лимфоцитов является их способность к быстрой реакции на активирующие сигналы, что выражается в массированной секреции антимикробных факторов (цитокинов, цитолитических молекул, факторов роста). Не меньшее значение имеет и экспрессия тканевыми лимфоцитами некоторых транскрипционных факторов, например, PLZF. В экспериментах на мышах у тех особей, у которых наблюдался дефицит экспрессии PLZF, было отмечено резкое снижение количества iNKT и MAIT-клеток, а имеющиеся клетки проявляли нарушения функций и локализации.
Рис. 4. Усиление иммунного ответа тканерезидентными лимфоцитами.
(А) Гельминтозная инфекция становится причиной высвобождения из погибающих эпителиоцитов IL-33 и IL-25 из хемочувствительных волосковых клеток. Данные цитокины побуждают лимфоидные клетки врожденного иммунного ответа (ILC2) к секреции IL-13, вызывающего гиперплазию бокаловидных и волосковых клеток. (В) Активированные презентированным антигеном CD8+ TRM вырабатывают гамма-интерферон, который приводит клетки ткани в «состояние боевой готовности» и привлекает циркулирующие клетки памяти. (С) NKT продуцируют цитокины и, будучи предварительно активированы клетками Купфера, сами активируют CD40L, которые, в свою очередь, презентируют CD1d-связанные гликолипиды, встречающиеся в составе бактериальных патогенов.
Рис. 5. Обобщенное представление об эффекторных функциях тканерезидентных лимфоцитов.
На этом завершим наш небольшой обзор агранулоцитов. Их сложные взаимоотношения и многогранный вклад в развитие иммунных реакций, разумеется, все еще вызывают у вас немало вопросов, на которые, надеюсь, вы тут же отправитесь искать ответы.
Источники:
- Xiying Fan, Alexander Y. Rudensky Hallmarks of Tissue-Resident Lymphocytes, Cell, 2016
- Siamon Gordon, Philip R. Taylor Monocyte and macrophage heterogeneity, Nature Reviews Immunology, 2005
- Simon Yona, Steffen Jung Monocytes: subsets, origins, fates and functions, Current opinion in hematology, 2010
- Bassing, C. H., W. Swat, et al. The mechanism and regulation of chromosomal V(D)J recombination, Cell, 2002
Факторы риска
В группу риска в первую очередь попадают пациенты, которые часто подвергаются тяжелым инфекциям, а также необычным, редким инфекциям. Еще одна группа риска – больные, которые в рамках лечения других заболеваний получают препараты или терапию (например, лучевую терапию), которые могут стать причиной развития агранулоцитоза. Пациенты в группе риска должны особенно внимательно относиться к своему самочувствию и обращать внимание на тревожные «звоночки». Для подтверждения диагноза требуется точная лабораторная диагностика.
Причины агранулоцитоза
- Ионизирующая радиация и лучевая терапия, химические вещества (бензол), инсектициды.
- Лекарственные средства могут вызвать агранулоцитоз в результате прямого угнетения кроветворения (цитостатики, вальпроевая кислота, карбамазепин, бета-лактамные антибиотики), либо действуя как гаптены (препараты золота, антитиреоидные препараты и пр.).
- Аутоиммунные заболевания (например, красная волчанка, аутоиммунныйтиреоидит).
- Вирусные инфекции (вызванные вирусом Эпстайна – Барр,цитомегаловирус, желтая лихорадка,вирусные гепатиты) обычно сопровождаются умеренной нейтропенией, однако в некоторых случаях может развиться агранулоцитоз.
- Тяжелые генерализованные инфекции (как бактериальные, так и вирусные).
- Исхудание.
- Генетические нарушения.
Диагностика у пациентов агранулоцитоза
Если пациент в группе риска или появляется соответствующая симптоматика без других видимых причин, проводится диагностика агранулоцитоза следующими методами.
- Анализ крови общий – самый первый и главный анализ, позволяющий определить концентрацию гранулоцитов и лейкоцитов в кровотоке.
- Анализ на антитела – назначается с целью выявления аутоиммунного агранулоцитоза, позволяет определить антинейтрофильные антитела.
- Миелограмма – позволяет определить уменьшение миелокариоцитов и другие показатели состояния периферической крови.
По необходимости при диагностике агранулоцитоза назначаются и другие методы исследования, чтобы определить степень поражения органов и систем, вызванных данной патологией. В частности, могут быть назначены:
- рентгенографии легких;
- обращение к стоматологу;
- биохимический анализ крови;
- исследования на стерильность крови;
- консультирование отоларинголога.
Лечение
При установлении диагноза и верификации типа патологии лечение должно начаться незамедлительно. В большинстве случаев требуется госпитализация пациента в отделение гематологии. Это необходимо для создания асептических условий. В палате-изоляторе по графику проводится кварцевание, также ограничивается посещение пациента. Такие меры необходимы, чтобы предупредить возникновение дополнительных инфекционных осложнений.
Специалист назначает пациенту комплексное лечение агранулоцитоза, и начинается оно с устранения факторов, под воздействием которых началось развитие данного патологического состояния. Комплекс мероприятий по лечению агранулоцитоза включает:
- устранение негативных факторов воздействия, в том числе отказ от приема миелотоксических препаратов, различных химических веществ и т.д.
- лечение и профилактику инфекционных заболеваний;
- усиленный уход за полостью рта;
- стероидную терапия;
- введение иммуноглобулина (внутривенно);
- переливание лейкоцитарной массы;
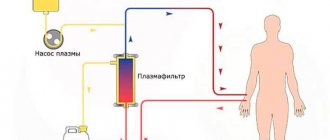
- плазмаферез и др.
Набор лечебных мероприятий зависит от типа заболевания, его степени, а также степени других присутствующих в организме патологий. В каждом случае комплекс лечения назначается индивидуально.