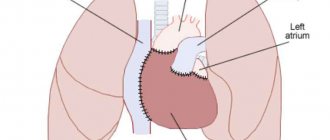
Что такое рентгенография сердца?
Рентген сердца является достаточно старым методом исследования и в определенной степени уступает некоторым современным диагностических процедурам. Однако и по сегодняшний день рентгенография является достаточно информативной. Она позволяет быстро и точно узнать, в каком состоянии находятся камеры сердца и магистральные сосуды. Также можно получить данные о сократительной способности органа. Болезни сердца могут выявляться и без рентгенографии, она часто назначается как дополнение. Прохождение рентгена сердца возможно как в государственных, так и частных клиниках. Этот диагностический метод является очень распространенным.
Рентгеноанатомия
Если понадобилось сделать снимок, стоит узнать рентгеноанатомию крупных сосудов и сердца. Рентгеноанатомия этого органа состоит из его тени, легочной артерии, аорты, а также полой вены. 2/3 перечисленных структур находятся левее средней линии грудной клетки, лишь 1/3 выступает в правую часть. В рентгеноанатомию грудной клетки входят легкие, бронхи и трахея.
Можно выделить несколько разновидностей расположения тени сердца, в зависимости от ее угла и конституции пациента. А именно:
- вертикальное – угол составляет более 45 градусов;
- косое – угол составляет 45 градусов;
- горизонтальное – угол меньше 45 градусов.
Как показывает рентгенография сердца, горизонтальное расположение обычно присуще женщинам, а вертикальное – людям высокого роста.
Острый коронарный синдром у детей.
Г.Э. Сухарева, Н.В. Лагунова, Н.Н. Руденко, А.К. Куркевич, И.Г. Лебедь, И.Н. Имнадзе, Л.И. Устенко, Г.Д. Левченко, И.Б. Зюкова, С.П. Булатова.
- Крымский государственный медицинский университет им. С.И. Георгиевского;
- Республиканская детская клиническая больница;
- Республиканский диагностический центр, г. Симферополь
- Научно-практический Центр детской кардиологии и кардиохирургии МОЗ Украины, г. Киев.
Многие педиатры и кардиологи считают, что острый коронарный синдром (ОКС) в детском возрасте относится к казуистическим случаям. Если у взрослых основная причина инфаркта миокарда (ИМ) – атеросклеротическое поражение венечных артерий (ВА), то причиной развития ОКС у детей является врожденная или приобретенная патология ВА [1, 3, 6–8, 13, 14]. Учитывая редкую встречаемость, трудность диагностики и отсутствие настороженности практических врачей по отношению к патологии ВА у детей с развитием ОКС, мы хотим привести собственные наблюдения и привлечь внимание практических врачей к рассматриваемой проблеме.
Среди причин развития ОКС у детей наибольшую распространенность имеют врожденные аномалии и приобретенная патология (коронариты) ВА.
Наиболее частой врожденной патологией ВА является аномалия Бланда–Уайта–Гарленда – аномальное отхождение левой венечной артерии от легочной артерии (АОЛВА от ЛА), которая составляет от 0,5 % в детской популяции [1, 3, 4, 8].
Выделяют два основных типа порока: инфантильный, или детский и взрослый [1, 6, 8].
Наличие области ишемии, снабжаемой аномальным сосудом (если анастомозы между левой и правой ВА отсутствуют), обуславливает развитие обширного ИМ с быстро прогрессирующей недостаточностью кровообращения и смертью больного. Однако обычно имеются коллатерали. При инфантильном типе такое кровоснабжение оказывается явно недостаточным, и тяжелая ишемия миокарда развивается через 6–8 нед после рождения.
Второй тип – взрослый. Он характеризуется хорошо развитыми межкоронарными анастомозами и выявляется в дошкольном или зрелом возрасте. При этом типе кровоснабжение миокарда определяется степенью развития анастомозов. В типичных случаях имеется умеренная ишемия миокарда левого желудочка (ЛЖ) вследствие синдрома «обкрадывания».
У большинства больных симптомы заболевания появляются в первые 3 мес жизни, реже – во втором полугодии. Первыми признаками являются нарушение общего состояния, вялость, бледность кожных покровов, повышенная потливость, рвота, срыгивания, одышка, тахикардия, обмороки, кашель. У половины больных отмечаются приступы внезапного беспокойства с усилением одышки, бледности, часто во время или после кормления. В это время выражение лица ребенка страдальческое, появляются гримасы, как при сильной боли, он пронзительно кричит, пульс становится нитевидным. Иногда наступает внезапная смерть. Иногда первыми симптомами при данной патологии могут быть повышение температуры, одышка и диарея, возможно связанные с рефлекторным характером нарушений желудочно-кишечного тракта. Значительно реже ИМ протекает без болевого синдрома. У некоторых детей возможно развитие кардиогенного шока (холодная кожа серо-бледного цвета, покрытая липким потом, олигоанурия, нитевидный пульс, уменьшение пульсового артериального давления (АД) менее 20– 30 мм рт. ст., снижение систолического АД). Многие дети отстают в физическом развитии. У них рано формируется левосторонний сердечный горб. Верхушечный толчок разлитой, ослабленный, смещен в 6-е, 7-е межреберье. Границы сердца смещены влево. Тоны чаще приглушены, причиной систолического шума недостаточности митрального клапана (МК) может быть хроническая ишемия или инфаркт папиллярных мышц, дилатация полости ЛЖ. Иногда выслушивается трехчленный ритм. При рентгенологическом исследовании определяется кардиомегалия. Она может достичь такой степени, что на рентгенограмме обнаруживается затемнение всей левой половины грудной клетки [1, 8, 13].
На ЭКГ наблюдаемых нами детей определялся характерный паттерн порока, описанный в литературе [1, 8]:
- патологический зубец Q в отведениях I, AVL (max в AVL);
- провал зубцов R в отведениях V3-V4 (морфология комплекса становится rS,QS,Qr), свидетельствующий о перенесенном ИМ;
- инверсия зубца T в отведениях I, AVL и левых грудных. Патологическое отклонение электрической оси сердца (ЭОС) влево из-за блокады передней левой ветви пучка Гиса.
Под нашим наблюдением в отделении кардиоревматологии Республиканской детской клинической больницы (РДКБ) г. Симферополя находились двое детей с синдромом Бланда–Уайта–Гарленда. Одно из первых в Украине описаний ИМ у ребенка с этой аномалией было сделано нами в 1999 г. [13]. В данном сообщении хотим привести еще одно собственное наблюдение развития ОКС у ребенка с АОЛВА от ЛА.
Ребенок М., 12 мес, в течение последних трех месяцев лечился у участкового педиатра по поводу острого обструктивного бронхита. В возрасте 3 мес появились кашель, одышка, тахикардия, по поводу чего родители обратились к детскому кардиоревматологу г. Ялты. Им было рекомендовано углубленное стационарное обследование, от которого родители отказались. Состояние ухудшилось 27.03.2003 г. – усилились одышка, кашель, тахикардия. Ребенок был госпитализирован в Ялтинскую детскую больницу, где при рентгенографии органов грудной клетки была обнаружена кардиомегалия. С подозрением на врожденный порок сердца больной был переведен в реанимационное отделение РДКБ.
Из анамнеза жизни и болезни известно, что ребенок от 7-й беременности, 2-х срочных родов. Беременность и роды протекали без патологии. Родился с массой 3400 г, рост – 51 см, 8 баллов по шкале Апгар. Закричал сразу, к груди приложен в роддоме. Привит по возрасту. Период новорожденности протекал без особенностей. Аллергоанамнез не отягощен. Матери 37 лет, здорова. Отцу – 50 лет, здоров. Наследственность не отягощена.
При поступлении в стационар состояние ребенка тяжелое за счет сердечной недостаточности. Менингеальные симптомы отрицательные. Ребенок беспокоен. Кожные покровы бледные с землистым оттенком, цианоз носогубного треугольника. Стонущее дыхание. Отечность лица, век. Одышка смешанного характера с втяжением податливых мест грудной клетки. Частота дыхательных движений (ЧДД) – 60 в 1 мин. Над легкими перкуторно – ясный легочный звук, аускультативно – жесткое дыхание, влажные хрипы с двух сторон. Область сердца не изменена. Верхушечный толчок пальпируется в 4-м межреберье, ослаблен. Границы относительной сердечной тупости расширены в поперечнике: правая – 1,5 см кнаружи от правого края грудины; верхняя – верхний край II ребра; левая – по передней подмышечной линии. Тоны сердца ослаблены, тахикардия. Частота сокращений сердца (ЧСС) – 170 в 1 мин при беспокойстве. АД – 90/45 мм рт. ст. Живот умеренно вздут, безболезненный. Печень +4,5 см из-под края реберной дуги, край эластичный, безболезненный. Селезенка не пальпируется. Диурез снижен. Стул регулярный, кашицеобразный. Общеклиническое обследование при поступлении без особенностей; по данным общего анализа крови в динамике – анемия I степени (Hb – 100 г/л).
Эхокардиография: расширение всех полостей сердца с выраженной дилатацией левых отделов сердца. Умеренная относительная митральная и трикуспидальная недостаточность. Дефекты перегородок не лоцируются. Общая сократимость снижена (фракция выброса (ФВ) – 45 %). Общая гипокинезия. Кровоток в брюшной аорте пульсирующий. Умеренная легочная гипертензия.
На рентгенограмме грудной полости кардиомегалия (кардиоторакальный индекс (КТИ) – 75 %). Консультация невропатолога: гипоксическая энцефалопатия, синдром гипервозбудимости.
Получал терапию: антибактериальную, инотропную (добутамин), кардиометаболическую (неотон), мочегонные препараты (фуросемид), обезболивающие препараты (аналгин, промедол), нитроглицерин (0,5 мкгЧкг-1Чмин-1). На фоне проводимой терапии состояние ребенка стабилизировалось, и он был направлен для определения дальнейшей тактики ведения в НПМЦ детской кардиологии и кардиохирургии с диагнозом: аномалия Бланда–Уайта–Гарленда. Фиброэластоз эндомиокарда. Недостаточность кровообращения (НК) IIБ. Ребенку были проведены зондирование полостей сердца, коронарография, которые подтвердили диагноз – АОЛВА от ЛА. Проведена операция аортокоронарного шунтирования.
В наблюдениях Л.А. Бокерия и соавторов [4], представивших результаты хирургического лечения 91 пациента с АОЛВА от ЛА, спектр хирургических вмешательств при данной патологии был многообразен: прямая имплантация аномально отходящей ВА в аорту была проведена у 53,8 % больных, в 10,9 % был создан аорто-легочный тоннель (операция Takeuchi). Операция простой перевязки аномально отходящей левой ВА осуществлена в 15,4 % случаев, транспульмональное ушивание устья левой ВА – в 5,5 % случаев, аортокоронарное шунтирование – в 11 %. Ю.М. Белозеров и соавторы считают, что оперативное лечение не достаточно эффективно у детей до 2 лет из-за неадекватного количества межкоронарных анастомозов. Если больные переживают критический период жизни (1–2 года) при медикаментозном лечении, то затем их состояние стабилизируется. Дети старше 2 лет хорошо переносят перевязку левой ВА. Прогноз порока без операции в большинстве случаев неблагоприятный. Почти 2/3 больных без лечения умирают на 1-м году жизни, 12–15 % доживают до старшего возраста, из них в дальнейшем половина умирает внезапно после физической нагрузки или психической травмы [1, 8].
К приобретенным поражениям ВА относятся острые и хронические коронариты. Истинная распространенность коронаритов в связи со сложностью диагностики неизвестна, в большинстве случаев этот диагноз ставят при аутопсии. Коронариты встречаются при различных инфекционных заболеваниях, ревматических и неревматических кардитах, инфекционном эндокардите, системной красной волчанке, системных (первичных) васкулитах (гигантоклеточный (височный артериит), артериит Такаясу; узелковый полиартериит (классический), болезнь Кавасаки; гранулематоз Вегенера, синдром Черджа–Стросса, микроскопический полиангиит, пурпура Шенлейна–Геноха и др.) [15], опухолях сердца (вторичные васкулиты).
Клиническая картина коронарита однотипна независимо от этиологического фактора и проявляется развитием ОКС вплоть до ИМ.
Болезнь Такаясу (Takayasu) – неспецифический аортоартериит (НАА), болезнь отсутствия пульса – относится к группе системных васкулитов и представляет собой хронический гранулематозный артериит с преимущественным поражением аорты и ее основных ветвей [9, 11, 12, 15]. Поражения ВА встречаются у 10–25 % больных с НАА и считаются потенциально фатальным осложнением. Как правило, коронарит сочетается с поражением других артерий, однако возможно и изолированное поражение ВА. Вовлечение в процесс ВА характеризуется клиническими признаками ОКС.
Учитывая редкую встречаемость и трудность диагностики болезни Такаясу и болезни Кавасаки, мы хотим продемонстрировать собственные наблюдения развития ОКС при данной патологии. Приводим наше наблюдение развития ОКС при болезни Такаясу у девочки 12 лет.
Больная В., 12 лет, поступила в отделение кардиоревматологии РДКБ г. Симферополя с жалобами на слабость, утомляемость, головокружение, одышку в покое, усиливающуюся при физической нагрузке, сердцебиение, ощущение перебоев ритма сердца, выраженные кардиалгии. Из анамнеза болезни известно, что считает себя больной на протяжении 1,5 года, когда после перенесенного гриппа появились вышеперечисленные жалобы, однако в стационаре не обследовалась и не лечилась. Ухудшение состояния в последние 3 мес, родители обратились к кардиоревматологу, после консультации которого больная с подозрением на неревматический кардит была госпитализирована в ЦРБ, получала терапию миокардита, однако эффекта не было. Была переведена в отделение кардиоревматологии РДКБ для дальнейшего обследования и лечения. При поступлении состояние ребенка тяжелое. Вялая, бледная. Отмечается пастозность лица и верхней части туловища, выраженная сосудистая сеть на передней поверхности грудной клетки, видимая пульсация сосудов шеи. Пульс 140 в 1 мин, слабого наполнения, асимметричный. Отсутствует пульс на левой лучевой артерии. На остальных сосудах пульсация определяется. Границы относительной сердечной тупости расширены влево: левая граница – по передней подмышечной линии. Аускультативно: тоны сердца аритмичны, фиксируются единичные экстрасистолы. Выслушивается грубый систолический шум с максимумом во втором межреберье справа от грудины и в точке Боткина. Выслушивается систолический шум на сосудах шеи. Определяется асимметрия АД на конечностях: АД на левой руке – 90/50 мм рт. ст.; АД на правой руке – 110/60 мм рт. ст. Пульсация на бедренной артерии сохранена. АД на ногах – 130/80 мм рт. ст. Над легкими перкуторно – ясный легочный звук, аускультативно – везикулярное дыхание, хрипов нет. Одышка, ЧДД 28–30 в 1 мин. Живот мягкий, доступен пальпации, печень +2 см из-под края реберной дуги.
Общеклинические анализы: анемия I степени, умеренный лейкоцитоз с палочкоядерным сдвигом, стойко повышено СОЭ (до 60 мм/ч), отмечается повышение острофазовых показателей. На ЭКГ – синусовая тахикардия, единичная суправентрикулярная экстрасистолия, ST-T изменения в V1-V4. На рентгенограмме грудной клетки отмечено изменение конфигурации сердечной тени, увеличение ЛЖ, гиперволемия, расширение тени сосудистого пучка.
При эхокардиографии – выраженная митральная регургитация. Расширение восходящей дуги аорты до 4,7 см, в грудном отделе – до 3,7 см. Аортальный клапан уплотнен, диаметр кольца аортального клапана – 2,2; восход. – 4,0. Легочная гипертензия – 50 мм рт. ст. ФВ – 56 %. Компьютерная томография грудной полости – аневризма восходящей аорты.
При допплеровском исследовании сосудов дуги аорты выявлено: сонографические изменения характерны для неспецифического аортоартериита (болезнь Такаясу) с преимущественным поражением общих сонных артерий (ОСА) с обеих сторон, плечеголовного ствола, первого сегмента подключичной артерии слева, синдром позвоночно-подключичного обкрадывания справа. Стенозы наиболее выражены: в подключичной артерии слева (стеноз около 50 % по диаметру). В устье и на протяжении ОСА слева диаметр уменьшен в 3 раза. Интима-медиа сосуда неравномерно утолщена, нарушена дифференциация на слои за счет стенозов, наблюдается гемодинамически значимая ассиметрия в ОСА и подключичных артериях с редукцией кровотока слева. Компенсаторная дилатация позвоночной артерии слева. Кровоток в почечной артерии справа изменен, диаметр артерии до 2 мм (приобретенная гипоплазия). Заключение: болезнь Такаясу с преимущественным поражением ОСА с обеих сторон и подключичной слева.
На основании вышеизложенного был обоснован клинический диагноз: болезнь Такаясу (неспецифический аортоартериит), осложненный аневризмой восходящей аорты, развитие митрально-аортальной недостаточности. Острый коронарный синдром. НК ІІА.
В связи с ухудшением состояния больная была направлена в НИИССХ им. Н.М. Амосова АМН Украины, где у нее развился инфаркт папиллярной мышцы с отрывом створки МК, что потребовало протезирования МК (МИКС-25). В препарате МК обнаружена миксоматозная дегенерация с поверхностной пролиферацией. Произведена ревизия аортального клапана и наложен бандаж восходящей аорты. При патологогистологическом исследовании в препарате, полученном из стенки аорты, были изменения, характерные для НАА (болезнь Такаясу). В настоящий момент девочка находится под наблюдением кардиоревматолога, самочувствие ее удовлетворительное. Получает глюкокортикоиды в поддерживающей дозе в комбинации с метотрексатом, антиагрегационную терапию.
Болезнь Кавасаки (слизисто-кожно-лимфоузловой синдром) – системный васкулит с преимущественным поражением ВА. Чаще встречается в раннем детском возрасте [2, 5, 8, 10, 16, 17]. Поражение сердца может быть по типу миокардита (в острой стадии), коронарита с развитием множественных, иногда гигантских аневризм (на 6–8-й неделе), стенозов и окклюзий ВА, способных привести к развитию ОКС даже в отдаленные сроки от начала заболевания, что иллюстрирует наше наблюдение.
Ребенок М., 3 года 7 мес, поступил в отделение кардиоревматологии РДКБ 29.05.2006 г. с жалобами на слабость, одышку при физической нагрузке. Из анамнеза жизни и болезни известно, что ребенок болен на протяжении года, когда в июне 2005 г. впервые были отмечены эпизоды подъема температуры до фебрильных цифр, плохо поддающиеся антипиретической терапии и резистентные к антибиотикам, высыпания на теле, расцененные как аллергическая реакция, артралгии. Был госпитализирован в ЦРБ с диагнозом: ОРВИ, тяжелое течение, гипертермический синдром. Атопический дерматит. Острый пиелонефрит. Экссудативный перикардит. По данным общего анализа крови отмечено ускоренное СОЭ до 64 мм/ч, лейкоцитоз до 14,4ґ1012/л с палочкоядерным сдвигом до 17 %; высокая серологическая активность – СРП +++, АСЛ-О – отр., по данным общего анализа мочи – лейкоцитурия. По данным эхокардиографии – признаки перикардита.
Проводилась антибактериальная терапия, терапия глюкокортикостероидами, на фоне которой отмечена некоторая положительная динамика, и ребенок был выписан по месту жительства с рекомендацией повторного осмотра через месяц и консультации в РДКБ. Однако родители ребенка на протяжении всего года к врачам не обращались.
В отделении был выполнен общий анализ крови: выраженный лейкоцитоз до 30,2ґ1012/л, палочкоядерный сдвиг до 17 %, СРП++++, ускорение СОЭ до 61 мм/ч, ЦИК 283 ЕД, АСЛ-О – отр. дважды, повышение уровня трансаминаз. Была проведена SIPS-пункция: по данным миелограммы данных, свидетельствующих об остром лейкозе, нет. Проведена компьютерная томография: органической патологии не выявлено. При рентгенологическом исследовании органов грудной полости: сердце расширено в поперечнике, КТИ – 78 %. При анализе серии электрокардиограмм в динамике, начиная с июня 2005 г., обращает внимание явная недооценка врачами электрокардиографических изменений и отрицательная динамика, выражающаяся в нарастании провала зубца R в V1-V4, элевация ST выше изоэлектрической линии с отрицательным зубцом T в грудных отведениях.
На ЭКГ 1.08.2005 г. зарегистрирован синусовый ритм с ЧСС 94–120 в 1 мин. ЭОС не отклонена. Регистрируются изменения в виде дугообразного подъема над изолинией сегмента RS-T в отведениях V2-V3 (резко выраженная элевация +9–15 мм); в I, AVL, V4-V5 – умеренно выраженная элевация. Комплекс QRS представлен в отведениях I–qR; AVL–qr; V4-V5–Rs; V2-V3–rs.
На последующих ЭКГ, начиная с 12.08.2005 г. по июнь 2006 г. – отсутствие динамики графических изменений в виде QS V1-V5 с глубоким инвертированным Т в V1-V6, умеренно выраженной элевацией ST; в отведениях I, AVL регистрируется комплекс qR. Данные изменения характерны для перенесенного трансмурального ИМ передней стенки левого желудочка и передне-перегородочной области. «Застывшая кривая» ЭКГ может свидетельствовать об аневризме.
Отмечалась также отрицательная динамика эхокардиографического исследования: нарастала дилатация ЛЖ, прогрессивно снижалась сократительная способность миокарда (конечнодиастолический объем (КДО) – 83 мл, конечнодиастолический индекс (КДИ) – 126 мл/м2, ФВ (по Симпсону) – 28 %, сократимость резко снижена, дискинезия передне-верхушечной зоны с образованием аневризмы. Визуализируется патология левой ВА: расширенный ствол с дилатацией до 7 мм в месте бифуркации.
Ребенок был направлен в НПМЦ детской кардиологии и кардиохирургии МОЗ Украины, где после обследования был выставлен диагноз: Болезнь Кавасаки. Множественные аневризмы ВА. Постинфарктный (2005) кардиосклероз. Аневризма передне-верхушечной зоны левого желудочка.
Ребенку было проведено хирургическое вмешательство: аневризма ЛЖ (по передней, боковой и задней стенке) вскрыта разрезом длиною 7 см, произведена резекция аневризмы 6ґ1,5 см. Проведена эндовентрикулопластика. Произведено маммарно-коронарное шунтирование (наложен шунт: LIMA — LAD). В отдаленном послеоперационном периоде (через год после операции) ребенок чувствует себя хорошо, жалоб не предъявляет. При эхокардиографии: остается расширенной полость ЛЖ (КДО – 73 мл, КСО – 43 мл, КДИ – 96 мл/м2, ФВ – 59 %). Правая ВА – до 6 мм. Сохраняется акинезия верхушечных (переднего, бокового) сегментов. Гипокинезия перегородочных сегментов.
Таким образом, ОКС у детей встречается чаще, чем диагностируется. Настороженность практических врачей и своевременная диагностика данной патологии позволят улучшить прогноз заболевания, снизить риск летального исхода и уменьшить инвалидизацию.
Литература
- Белозеров Ю.М. Инфаркт миокарда у детей // Рос. вестник перинатологии и педиатрии. – 1996. – № 3. – С. 36-40.
- Белозеров Ю.М. Болезнь Кавасаки // Рос. вестник перинатологии и педиатрии. – 1995. – № 3. – С. 41-47.
- Беришвили И.И., Вахромеева М.Н., Кацитадзе З.Д. Аномальное отхождение левой коронарной артерии от легочной артерии // Архив патологии. – 1998. – № 2. – С. 35-39.
- Бокерия Л.А., Шаталов К.В.. Подзолков В.П., Арнаутова И.В. Хирургическое лечение синдрома аномального отхождения левой коронарной артерии от легочной артерии // Материалы второй Всероссийской конференции «Актуальные вопросы кардиологии раннего детского возраста». – М., 2006. – С. 48.
- Брегель Л.В., Субботин В.М., Белозеров Ю.М., Толстикова Т.В. Особенности миокардита при болезни Кавасаки // Тезисы Всероссийского Конгресса «Детская кардиология 2002». – М.: Медпрактика, 2002. – С. 88.
- Волосовец А.П., Кривопустов С.П. Инсульт головного мозга и инфаркт миокарда у детей: современный взгляд на проблему // Здоровье ребенка. – 2006. – № 2. – С. 63-69.
- Кубышкин В.Ф., Филин П.И., Ушаков А.В. и др. Острый коронарный синдром. Руководство для врачей и интернов. – К.: СПД Коляда О.П., 2004. – 40 с.
- Леонтьева И.В., Царегородцева Л.В., Белозеров Ю.М и др. Инфаркт миокарда у детей: возможные причины, современные подходы к диагностике // Педиатрия. – 2001. – № 1. – С. 32-37.
- Лекции по кардиологии / Под ред. Л.А. Бокерия, Е.З. Голуховой. – М.: Издательство НЦССХ им. А.Н. Бакулева РАМН, 2001. – С. 167-171.
- Лыскина Г.А. Клиническая картина, лечение и прогноз слизисто-кожного-лимфонодулярного синдрома (Кавасаки) // Рос. вестник перинатологии и педиатрии. – 2007. – № 2. – С. 31-35.
- Марушко Т.В., Тодуров Б.М. Особенности течения и диагностики болезни Такаясу у детей // Современная педиатрия. – 2003. – № 1. – С. 89-92.
- Мурзина О.Ю., Ковалев И.А., Варваренко В.И. и др. Случай неспецифического аортоартериита у ребенка 3 лет // Материалы пятого Российского конгресса «Современные технологии в педиатрии и детской хирургии». – М.: Оверлей, 2006. – С. 176-177.
- Сухарева Г.Э., Трофимишин В.В., Левченко Г.Д. Инфаркт миокарда у детей // Таврический медико-биологический вестник. – 1999. – № 1-2. – С. 58-61.
- Шарыкин А.С. Врожденные пороки сердца. Руководство для педиатров, кардиологов, неонатологов. – М.: Теремок, 2005. – С. 289-294.
- Шуба Н.М. Системные васкулиты // Доктор. – 2002. – № 1. – С.42-47.
- Benseler S.M., McCrindle B.W., Silverman E.D. et al. Infections and Kawasaki disease: implications for coronary artery outcome // Pediatrics. – 2005. – 116:6:760-766.
- Tanaka H., Narisawa T., Hirano J. et al. Coronary artery bypass grafting for coronary aneurysms due to Kawasaki disease // Ann. Thorac Cardiovasc Surg. – 2001. – Vol. 7. – P. 307-310.
Укркардіо
Что может выявить рентген?
Рентгенограмма сердца позволит получить большое количество информации относительно положения, размеров и состояния органа и его структур. На основании этих данных врач сможет сделать заключение о наличии патологий и выявить причину ухудшения самочувствия пациента.
Размеры сердца
Рентгенографию сердца необходимо пройти для того, чтобы узнать, в норме ли размеры органа. Именно они являются очень важными при определении патологий. Выявляют размер не по тем ширине и длине, которые видны на рентгеновском снимке, а по кардиоторакальному индексу. Для этого нужно померить ширину грудной клетки на уровне четвертого ребра, а также узнать ширину сердца в этой же области. Если клетка шире органа в два раза, индекс будет составлять 50%. Если выше, значит сердечная мышца увеличена. Гипертрофия миокарда может указывать на ишемию или же гипертоническую болезнь. Расширение камер может быть связано с кардиомиопатией или сердечной недостаточностью.
Состояние магистральных сосудов
Задумываясь о том, что показывает рентген сердца, стоит узнать, что станет известно состояние магистральных сосудов. Доктор сможет узнать, есть ли в аорте бляшки, отложения солей кальция, а также любые уплотнения. Можно будет также определить заболевание, которое характеризуется скоплением жидкости в околосердечной сумке. Оно иначе называется «перикардитом». Если жидкость скапливается медленно, орган становится похожим на мешок, если же быстро – на шар. Если состояние усугубляется отложениями солей кальция, врач установит констриктивный перикардит.
Какие симптомы нельзя игнорировать
На увеличенное сердце у ребенка могут указывать следующие симптомы:
- учащенный сердечный ритм;
- бледность или синюшность кожных покровов;
- учащенное дыхание;
- синева носогубного треугольника;
- слабый аппетит.
Так как сердечный ритм у детей всегда по значению больше, чем у взрослых, то нельзя однозначно сказать, часто ли бьется сердце у вашего малыша или нет. Определить это может только доктор. Но если пульс больше 160 ударов в минуту, то это явно нехороший сигнал.
Дыхание при кардиомегалии не просто учащенное, но и поверхностное, неравномерное по вдохам и выдохам.
Бледность кожных покровов возникает в результате нарушения кровообращения из-за слабой работы сердечной мышцы и самого органа.
Особенности проведения процедуры у детей
Иногда рентген сердца может проводиться у детей. Назначается детям такой тип исследования очень редко, поскольку до 15 лет процедура противопоказана. Однако она может потребоваться для выявления пороков сердца, а также при планировании оперативных вмешательств или для оценки эффективности выбранного метода лечения. Также рентген может понадобиться для выявления опухолевых процессов.
Если речь о совсем маленьком ребенке, рентгенограмму сердца будут делать с использованием специального приспособления. Представляет собой подставку, на которую укладывают ребенка и закрепляют его туловище, голову и конечности при помощи ремней. Это обеспечит полную неподвижность пациента в то время, когда врач будет делать снимок. Процедура займет не более пары секунд, а дискомфорт возможен только от ремней, при помощи которых осуществляется фиксация. Если речь о более взрослых детях, они могут проходить процедуру даже без взрослых.
Причины
Причины увеличенного сердца у ребенка зависят от типа кардиомегалии. Она может быть первичной или вторичной. Вторичное течение болезни происходит из-за:
- тяжелых токсических поражений;
- перенесенных инфекционных заболеваний, спровоцировавших различные осложнения на сердце;
- дыхательной недостаточности легких;
- острых вирусных инфекций.
Если мы говорим о первичном типе увеличенного сердца у ребенка, то причины его возникновения до сих пор до конца не изучены.
Подготовка и проведение диагностики
Готовиться понадобится только в том случае, если необходимо пройти рентгенографию сердца с контрастированием. Она предполагает сдачу анализов для определения наличия аллергии на контраст, а также посещение кабинета натощак, что позволит избежать тошноты.
Чтобы приступить к процедуре, необходимо убрать всю бижутерию или аксессуары из металла, которые могут сказаться на качестве снимка. Процедура выполняется в 4 разных проекциях:
- передняя;
- боковая левая;
- косая левая (под углом 45 градусов);
- правая.
Благодаря этому, описание и заключение рентгена сердца будут максимально точными. Врач рассмотрит все плоскости органа и отметит наличие патологических процессов.
Противопоказания
Нельзя назвать такое исследование полностью безопасным. В связи с этим существует ряд ситуаций, в которых такая диагностика не производится, а подбирается более щадящий метод. Нередко вместо рентгена могут назначаться УЗИ
или МРТ, а также иные исследования.
Беременным женщинам
Перед тем как узнать, что такое рентген сердца, что показывает такая процедура, женщине стоит быть абсолютно уверенной в отсутствии беременности. Такое положение является абсолютным противопоказанием к процедуре, поскольку существует риск того, что рентгеновское излучение окажет неблагоприятное воздействие на организм и будущей мамы, и малыша. Не рекомендуется проходить диагностику также кормящим мамам. Однако в некоторых ситуациях врач может назначать такую процедуру, если ее польза значительно выше вероятных рисков. Поэтому лучше всего довериться доктору.